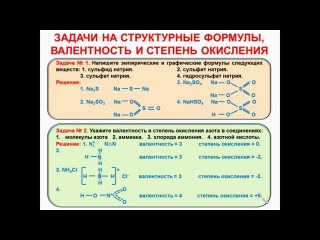
валентность IV и степень окисления -3 проявляет азот в соединении 1)N2h5 2)
в 70 г воды добавили 5,475г хлороводорода.Вычислите долю хлороводорода в растворе
Вкажіть речовини, що розкладаються з утворенням оксидів: a. CaSO3 b. RbOH c. h3S d. Cu(OH)2 e. h3CO3 f. KNO3
СРОЧНО Из раствора массой 80г с массовой долей растворенного вещества 15% выпарили 50г воды. Определить массовую долю вещества в новом растворе.
обчислити масу солі що утворюються в результаті реакції нейтралізації між барій гідроксиду та ортофосфатною кислотою масою 490 гкто может помогите пж … , буду очень сильно благодарарен
До 80г розчину цукру з масовою часткою 15% додали 20г води. Яка масова частка цукру в добутому розчині?
3. Ацетилен — объемная доля ацетилена в воздушной смеси взрывоопасна в пределах от 2,3% до 80,7%. Чтобы определить опасность взрыва смеси из 10 литро
… в C2h3 и воздуха, ее сначала пропустили через бутылку, содержащую (KMnO4 + h3SO4), затем через бутылку с Ca (Oh3), в последнюю бутылку поступило 4,46 г осадка.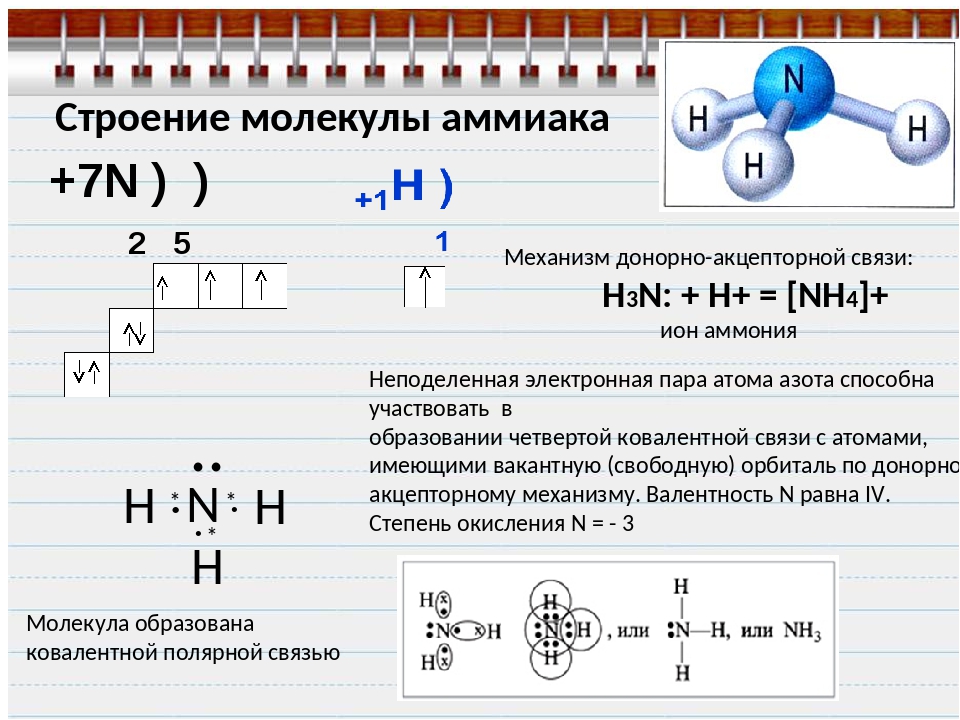
Який об’єм кисню витратиться на спалювання 200 мл суміші водню та карбон(ІІ) оксиду? Чи потрібно для розв’язання задачі знати кількісний склад суміші … цих газів?Відповідь поясніть.
Винний спирт С2Н5ОН одержують спиртовий бродінням глюкози. Процес відбувається за участю дріжджів. Визнач масу глюкози, яку використали для спиртового … бродіння у результаті якого отримали 332 г спирту
Позначте формули основ, які можуть розкладатися при нагріванні NaOH Fe(OH)3 ZnO Zn(OH)2 Cu(OH)2 Ba(OH)2
Установіть відповідність між речовиною та її використанням: Речовина Використання 1 оцтова ки
… слота; А для виробництва мила, гліцерину, оліфи;2 сахароза; Б для виробництва паперу, картону, тканин;3 жир; В для виробництва каучуку, гуми, скла;4 целюлоза. Г для виробництва кондитерських виробів, напоїв, варення; Д для виробництва штучних волокон, як консервант, для приготування їжі.
Г для виробництва кондитерських виробів, напоїв, варення; Д для виробництва штучних волокон, як консервант, для приготування їжі.
Задания 4. Валентности и степени окисления элементов.
Задание №1
EBA347
Степень окисления +2 во всех соединениях проявляет
1) олово
2) фосфор
3) железо
4) цинк
РешениеОтвет: 4
Пояснение:
Из всех предложенных вариантов степень окисления +2 в сложных соединениях проявляет только цинк, являясь элементом побочной подгруппы второй группы, где максимальная степень окисления равна номеру группы.
Олово – элемент главной подгруппы IV группы, металл, проявляет степени окисления 0 (в простом веществе), +2, +4 (номер группы).
Фосфор – элемент главной подгруппы главной группы, являясь неметаллом, проявляет степени окисления от -3 (номер группы – 8) до +5 (номер группы).
Железо – металл, элемент расположен в побочной подгруппе главной группы.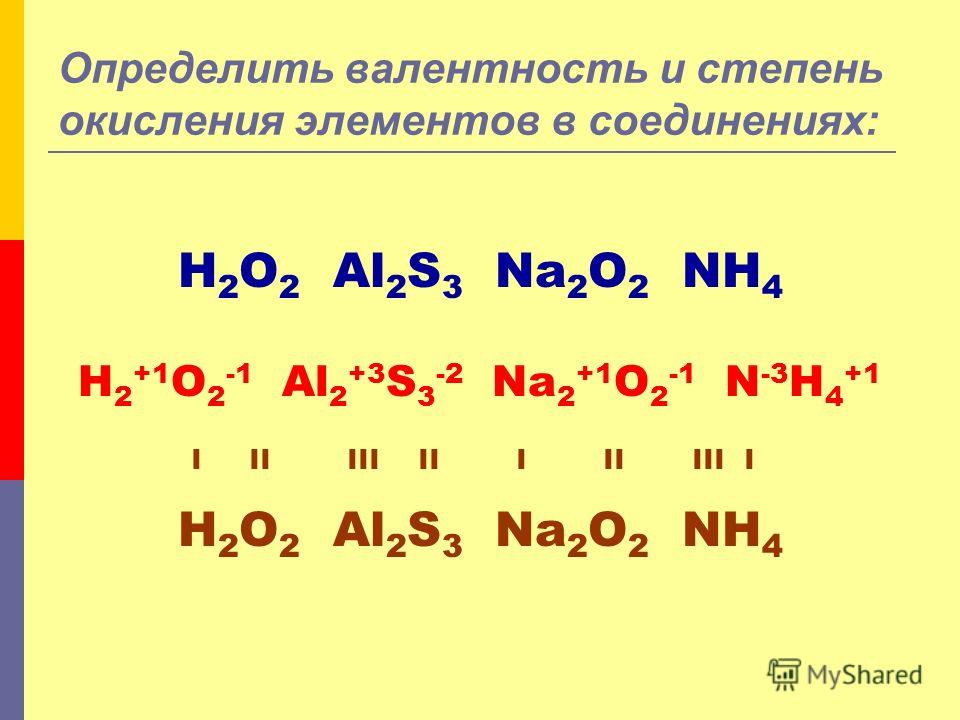 Для железа характерны степени окисления: 0, +2, +3, +6.
Для железа характерны степени окисления: 0, +2, +3, +6.
Задание №2
F45DFA
Соединение состава KЭО4 образует каждый из двух элементов:
1) фосфор и хлор
2) фтор и марганец
3) хлор и марганец
4) кремний и бром
РешениеОтвет: 3
Пояснение:
Соль состава KЭО4 содержит кислотный остаток ЭО4—, где кислород обладает степенью окисления -2, следовательно, степень окисления элемента Э в этом кислотном остатке равна +7. Из предложенных вариантов подходят хлор и марганец – элементы главной и побочной подгруппы VII группы соответственно.
Фтор – также элемент главной подгруппы VII группы, однако, являясь самым электроотрицательным элементом, не проявляет положительных степеней окисления (0 и -1).
Бор, кремний и фосфор – элементы главных подгрупп 3, 4 и 5 групп соответственно, поэтому в солях проявляют соответствующие максимальные степени окисления +3, +4, +5.
Задание №3
BA7EFF
Одинаковую высшую степень окисления в соединениях проявляют
- 1. Zn и Cr
- 2. Si и B
- 3. Fe и Mn
- 4. P и As
Ответ: 4
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и As. Это элементы расположены в главной подгруппе V группы.
Zn и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях цинк проявляет высшую степень окисления +2, хром — +6.
Fe и Mn – элементы побочных подгруппы VIII и VII групп соответственно. Высшая степень окисления у железа составляет +6, у марганца — +7.
Задание №4
DC98F9
Одинаковую высшую степень окисления в соединениях проявляют
- 1. Hg и Cr
- 2. Si и Al
- 3. F и Mn
- 4. P и N
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и N. Эти элементы расположены в главной подгруппе V группы.
Эти элементы расположены в главной подгруппе V группы.
Hg и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях ртуть проявляет высшую степень окисления +2, хром – +6.
Si и Al − элементы главных подгруппы IV и III групп соответственно. Следовательно, для кремния максимальная степень окисления в сложных соединениях равна +4 (номер группы, где расположен кремний), для алюминия − +3 (номер группы, где расположен алюминия).
F и Mn – элементы главной и побочной подгрупп VII групп соответственно. Однако фтор, являясь самым электроотрицательным элементом Периодической системы химических элементов, не проявляет положительных степеней окисления: в сложных соединения его степень окисления равна −1 (номер группы−8). Высшая степень окисления марганца составляет +7.
Задание №5
C0E0FE
Степень окисления +3 азот проявляет в каждом из двух веществ:
- 1. HNO2 и NH3
- 2. NH4Cl и N2О3
- 3.
 NaNO2 и NF3
NaNO2 и NF3 - 4. HNO3 и N2
Ответ: 3
Пояснение:
В азотистой кислоте HNO2 степень окисления кислорода в кислотном остатке равна -2, у водорода — +1, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота составляет +3. В аммиаке NH3 азот является более электроотрицательным элементом, поэтому он оттягивает на себя электронную пару ковалентной полярной связи и обладает отрицательной степенью окисления -3, степень окисления водорода в аммиаке составляет +1.
Хлорид аммония NH4Cl является аммонийной солью, поэтому степень окисления азота такая же, как в аммиаке, т.е. равна -3. В оксидах степень окисления кислорода всегда равна -2, поэтому у азота она составляет +3.
В нитрите натрия NaNO2 (соли азотистой кислоты) степень окисления азота такая же, как в азота в азотистой кислоте, т.к. составляет +3. Во фториде азота степень окисления азота +3, поскольку фтор является самым электроотрицательным элементом Периодической системы и в сложных соединениях проявляет отрицательную степень окисления -1. Данный вариант ответа удовлетворяет условию задания.
Во фториде азота степень окисления азота +3, поскольку фтор является самым электроотрицательным элементом Периодической системы и в сложных соединениях проявляет отрицательную степень окисления -1. Данный вариант ответа удовлетворяет условию задания.
В азотной кислоте азот обладает высшей степенью окисления, равной номеру группы (+5). Азот как простое соединение (поскольку состоит из атомов одного химического элемента) обладает степенью окисления 0.
Задание №6
EDD5FF
Высшему оксиду элемента VI группы соответствует формула
- 1. Э4O6
- 2. ЭO4
- 3. ЭO2
- 4. ЭО3
Ответ: 4
Пояснение:
Высшим оксидом элемента является оксид элемента с его максимальной степени окисления. В группе наивысшая степень окисления элемента равна номеру группы, следовательно, в VI группе максимальная степень окисления элемента равна +6.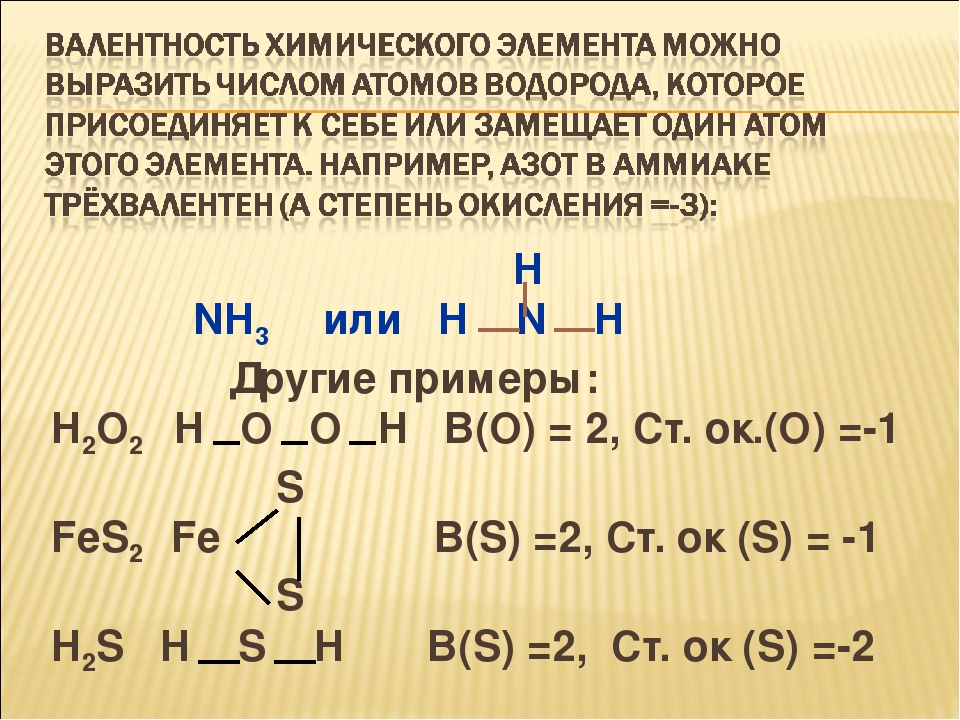 В оксидах кислород проявляет степень окисления -2. Цифры, стоящие под символом элемента, называются индексами и указывает на количество атомов этого элемента в молекуле.
В оксидах кислород проявляет степень окисления -2. Цифры, стоящие под символом элемента, называются индексами и указывает на количество атомов этого элемента в молекуле.
Первый вариант является неверным, т.к. элемент обладает степенью окисления 0-(-2)⋅6/4 = +3.
Во втором варианте элемент обладает степенью окисления 0-(-2) ⋅ 4 = +8.
В третьем варианте степень окисления элемента Э: 0-(-2) ⋅ 2 = +4.
В четвертом варианте степень окисления элемента Э: 0-(-2) ⋅ 3 = +6, т.е. это искомый ответ.
Задание №7
EFF6F9
Степень окисления хрома в дихромате аммония (NH4)2Cr2O7 равна
РешениеОтвет: 1
Пояснение:
В бихромате аммония (NH4)2Cr2O7 в катионе аммония NH4+ азот как более электроотрицательный элемент обладает низшей степенью окисления -3, водород заряжен положительно +1. Следовательно, весь катион обладает зарядом +1, но, поскольку этих катионов 2, то общий заряд составляет +2.
Следовательно, весь катион обладает зарядом +1, но, поскольку этих катионов 2, то общий заряд составляет +2.
Для того чтобы молекула оставалась электронейтральной, у кислотного остатка Cr2O72− заряд должен быть -2. Кислород в кислотных остатках кислот и солей всегда обладает зарядом -2, поэтому 7 атомов кислорода, входящих в состав молекулы бихромата аммония, заряжены -14. Атомов хрома Cr в молекулы 2, следовательно, если заряд хрома обозначить за x, то имеем:
2x + 7 ⋅ (-2) = -2, где x = +6. Заряд хрома в молекуле бихромата аммония равен +6.
Задание №8
3FC0F3
Степень окисления +5 возможна для каждого из двух элементов:
1) кислорода и фосфора
2) углерода и брома
3) хлора и фосфора
4) серы и кремния
РешениеОтвет: 3
Пояснение:
В первом предложенном варианте ответов только фосфор как элемент главной подгруппы V группы может проявлять степень окисления +5, которая является для него максимальной. Кислород (элемент главной подгруппы VI группы), являясь элементом с высокой электроотрицательностью, в оксидах проявляет степень окисления -2, как простое вещество – 0 и в соединении со фтором OF2 – +1. Степень окисления +5 для него не характерна.
Кислород (элемент главной подгруппы VI группы), являясь элементом с высокой электроотрицательностью, в оксидах проявляет степень окисления -2, как простое вещество – 0 и в соединении со фтором OF2 – +1. Степень окисления +5 для него не характерна.
Углерод и бром – элементы главных подгрупп IV и VII групп соответственно. Для углерода характерна максимальная степень окисления +4 (равна номеру группы), а бром проявляет степени окисления -1, 0 (в простом соединении Br2), +1, +3, +5 и +7.
Хлор и фосфор – элементы главных подгрупп VII и V групп соответственно. Фосфор проявляется максимальную степень окисления +5 (равную номеру группы), для хлора аналогично брому характерны степени окисления -1, 0 (в простом соединении Cl2), +1, +3, +5, +7.
Сера и кремний – элементы главных подгрупп VI и IV групп соответственно. Сера проявляет широкий спектр степеней окисления от -2 (номер группы − 8) до +6 (номер группы). Для кремния максимальная степень окисления равна +4 (номер группы).
Задание №9
44E50C
Высшую степень окисления азот проявляет в соединении, формула которого
- 1. NaNO3
- 2. NaNO2
- 3. NH4Cl
- 4. NO
Ответ: 1
Пояснение:
Азот – элемент главной подгруппы V группы, следовательно, он может проявлять максимальную степень окисления, равную номеру группы, т.е. +5.
В нитрате натрия NaNO3 натрий имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 3, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен иметь степень окисления: 0 − (+1) − (−2)·3 = +5.
В нитрите натрия NaNO2 атом натрий также имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления: 0 − (+1) − (−2)·2 = +3.
NH4Cl − хлорид аммония. В хлоридах атомы хлора имеют степень окисления −1, атомы водорода, которого в молекуле 4, заряжен положительно, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота: 0 − (−1) − 4 ·(+1) = −3. В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +2.
Задание №10
0EB205
Высшую степень окисления азот проявляет в соединении, формула которого
- 1. Fe(NO3)3
- 2. NaNO2
- 3. (NH4)2SO4
- 4. NO2
Ответ: 1
Пояснение:
Азот – элемент главной подгруппы V группы, следовательно, он может проявлять максимальную степень окисления, равную номеру группы, т.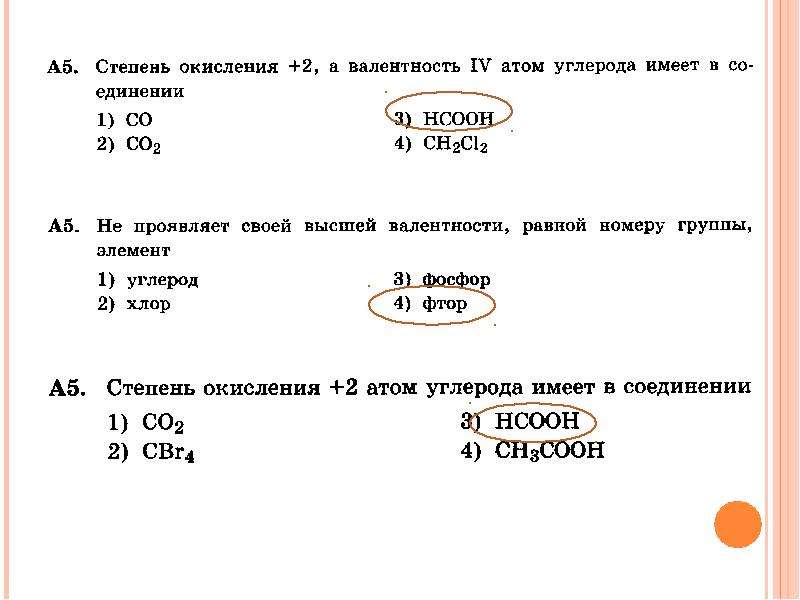 е. +5.
е. +5.
Одна структурная единица нитрата железа Fe(NO3)3 состоит из одного иона Fe3+ и трех нитрат-ионов. В нитрат-ионах атомы азота независимо от типа противоиона имеют степень окисления +5.
В нитрите натрия NaNO2 натрий имеет степень окисления +1 (элемент главной подгруппы I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления 0 − (+1) − (−2)⋅2 = +3.
(NH4)2SO4 – сульфат аммония. В солях серной кислоты анион SO42− имеет заряд 2−, следовательно, каждый катион аммония заряжен 1+. На водороде заряд +1, поэтому на азоте −3 (азот более электроотрицателен, поэтому оттягивает на себя общую электронную пару связи N−H). В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO2 кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +4.
Задание №11
28910EВ соединениях состава Fe(NO3)3 и CF4 степень окисления азота и углерода равна соответственно
1) +3 и –2
2) +3 и +4
3) –3 и –4
4) +5 и +4
РешениеОтвет: 4
Пояснение:
Одна структурная единица нитрата железа (III) Fe(NO3)3 состоит из одного иона железа Fe3+ и трех нитрат-ионов NO3−. В нитрат-ионах азот всегда имеет степень окисления +5.
Во фториде углерода CF4 фтор является более электроотрицательным элементом и оттягивает на себя общую электронную пару связи C-F, проявляя степень окисления -1. Следовательно, углерод C имеет степень окисления +4.
Задание №12
A32B0BСтепень окисления +7 хлор проявляет в каждом из двух соединений:
- 1.
 Ca(OCl)2 и Cl2O7
Ca(OCl)2 и Cl2O7 - 2. KClO3 и ClO2
- 3. BaCl2 и HClO4
- 4. Mg(ClO4)2 и Cl2O7
Ответ: 4
Пояснение:
В первом варианте атомы хлора обладают степенями окисления +1 и +7 соответственно. Одна структурная единица гипохлорита кальция Ca(OCl)2 состоит из одного иона кальция Ca2+ (Ca — элемент главной подгруппы II группы) и двух гипохлорит-ионов OCl−, каждый из которых имеет заряд 1−. В сложных соединениях, кроме OF2 и различных перекисей, кислород всегда имеет степень окисления −2, поэтому, очевидно, что хлор имеет заряд +1. В оксиде хлора Cl2O7, как и во всех оксидах, кислород обладает степенью окисления −2, следовательно, на хлор в этом соединении имеет степень окисления +7.
В хлорате калия KClO3 атом калия имеет степень окисления +1, а кислород — −2. Для того чтобы молекула оставалась электронейтральной, хлор должен проявлять степень окисления +5. В оксиде хлора ClO2 кислород, как и в любом другом оксиде, обладает степенью окисления −2, следовательно, для хлора его степень окисления равна +4.
Для того чтобы молекула оставалась электронейтральной, хлор должен проявлять степень окисления +5. В оксиде хлора ClO2 кислород, как и в любом другом оксиде, обладает степенью окисления −2, следовательно, для хлора его степень окисления равна +4.
В третьем варианте катион бария в сложном соединении заряжен +2, следовательно, на каждом анионе хлора в соли BaCl2 сосредоточен отрицательный заряд −1. В хлорной кислоте HClO4 общий заряд 4 атомов кислорода составляет −2⋅4 = −8, на катионе водорода заряд +1. Чтобы молекула оставалась электронейтральной, заряд хлора должен составлять +7.
В четвертом варианте в молекуле перхлората магния Mg(ClO4)2 заряд магния +2 (во всех сложных соединениях магний проявляет степень окисления +2), поэтому на каждый анион ClO4−приходится заряд 1−. В общем 4 иона кислорода, где каждый проявляет степень окисления −2, заряжены −8. Следовательно, чтобы общий заряд аниона составлял 1−, на хлоре должен быть заряд +7. В оксиде хлора Cl2O7, как было объяснено выше, заряд хлора составляет +7.
В оксиде хлора Cl2O7, как было объяснено выше, заряд хлора составляет +7.
ВАЛЕНТНОСТЬ И СТЕПЕНЬ ОКИСЛЕНИЯ.
Понятие валентности (атомности) было введено в химию английским химиком Э. Франклендом в 1853 году.
Валентность (от латинского а е а — сила) - свойство атома данного элемента присоединять или замещать определенное число атомов другого элемента.
Под
валентностью
химического
элемента
понимают
также
способность
его атомов
образовывать
химические
связи в
соединениях. Количественно
валентность
определяется
числом
химических
связей,
образованных
атомом, и,
естественно,
не может
иметь знака.
Количественно
валентность
определяется
числом
химических
связей,
образованных
атомом, и,
естественно,
не может
иметь знака.
Параллельно с валентностью широкое распространение получило формальное понятие степень окисления.
Степень
окисления
количественно
характеризуется
состояние
атома в
соединении.
Иногда ее
называют
окислительным
числом. При
определении
этого
понятия
условно
предполагают,
что в
простейших
ковалентных
соединениях
значение
положительной
степени
окисления элемента
соответствует
числу
оттянутых от
атома связывающих
электронных
пар, а
значение
отрицательной
степени
окисления — числом притянутых
электронных
пар.
СТЕПЕНЬ ОКИСЛЕНИЯ — это условный заряд атома в соединении, который возник бы, если бы связи в этом соединении были бы ионными, а электроны смещены к наиболее электроотрицательному элементу.
Степень окисления может иметь отрицательное, положительное и нулевое значение, которое обычно ставится над символом элемента сверху, например:
Иногда
абсолютная
величина
степени
окисления
совпадает
со значением
валентности,
а иногда и
не
совпадает.
Например, в хлороводороде НСl степень окисления водорода +1, хлора -1 и валентность того и другого элемента равна 1.
В молекуле азота N2 имеются три электронные пары между атомами азота NN, поэтому он трехвалентен. Но степень окисления азота равна нулю, т.к. здесь нельзя предположить смещения электронных пар. (Спроси преподавателя)
Таким
образом, нужно хорошо
понимать
разницу между
валентностью
и степенью
окисления и
никогда не смешивать
эти понятия.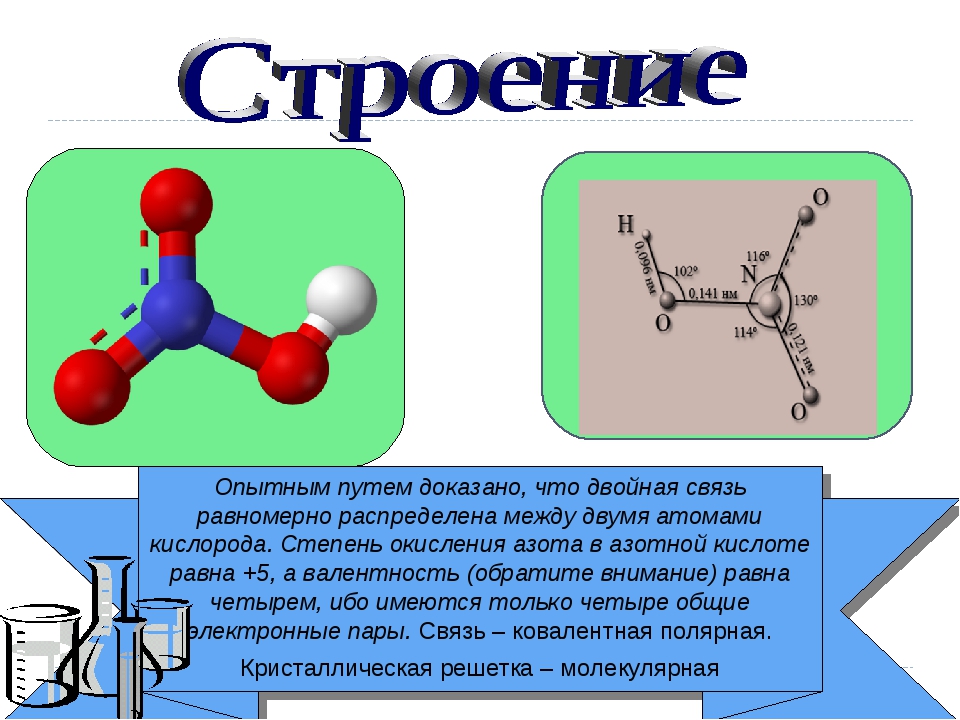
1)0трицательное значение степени окисления будет у более электроотрицательных атомов, которые приняли электроны от других атомов, которые приняли электроны от других атомов (или в их сторону смещены общие электронные пары).
— фтор в соединениях
с другими
элементами
имеет
всегда
степень
окисления
-1,
— кислород в соединениях проявляет степень окисления -2 (Исключения: кроме соединения с фтором O+2F2, -1 пероксидах Н2О2-1, Na2O2-1
— водород
в
соединениях
с металлами
(Ca+2H2-1; Na+1H) -1.
2)
Положительное
значение
степени
окисления
имеют
наименее
электроотрицательные
атомы в
соединении,
атомы,
которые
отдают
свои
электроны
другим
атомам (или
связующее
электронное
облако
оттянуто
от них).
— к ним относятся металлы (Na2+1O; Ca+2S; Fe+3Cl3 и т.д.)
— водород в соединениях с неметаллами часто имеет степень окисления +1, 3)Нулевое
значение
степени
окисления
будет в
молекулах
простых
веществ и
веществ
находящихся
в атомном
состоянии (N2, O2, Cl2, Na, С и т. д.).
д.).
4) Степень окисления может быть выражена и дробным числом,
например
K+1O2-1:
2; Fe3 +8 : 3O4
Степень окисления -3 ✅ азот проявляет в соединении 1) KBO2 2) Nh5Cl 3) KNO3 4) N2O3
избегайте прогулок в одиночестве в малолюдных местах;
откажитесь, по возможности, от ночных передвижений, в крайнем случае, воспользуйтесь такси;
если к вам грубо обращаются по поводу якобы допущенной ошибки или делают вас объектом насмешек, не отвечайте и не поддавайтесь на провокации;
старайтесь предвидеть и избегать неприятных ситуаций;
не останавливайте, по возможности, машины автостопом и не соглашайтесь на то, чтобы вас подвозили незнакомые люди;
никогда не показывайте деньги или драгоценности, их надо держать во внутреннем кармане, в дипломате или в другом надежном месте;
не нагружайте себя свертками и пакетами, лучше всегда иметь свободу движений на тот случай, если возникнет необходимость защищаться;
если кто-либо мешает вам передвигаться, и вы не можете освободиться, обратитесь к милиционеру, позвоните в звонок на любой входной двери;
в незнакомом городе передвигайтесь с картой, которая позволит время; по той же причине побольше обращайтесь к разным людям, когда вы ищите какой-нибудь адрес, потому что единственный ответ может быть неправильным;
не показывайте слишком ясно, что вы турист; прогуливайтесь с местной газетой под мышкой, смешивайтесь с местными жителями;
будьте внимательны к подворотням и плохо освещенным углам, стараясь по возможности их избегать;
если какой-нибудь автомобилист спрашивает совета, дайте его быстро и четко или извинитесь, что вы не знаете этого места, но не вызывайтесь сопровождать незнакомого человека;
избегайте садиться в пустой автобус, а если вам все-таки приходится делать это, садитесь ближе к водителю;
когда вы передвигаетесь в городе, всегда удобно иметь в распоряжении несколько мелких монет и билетов на городской транспорт. избегайте мест большого скопления людей: рынки, толпы, очереди и т.д. именно в толпе легко столкнуться с тем, кто крадет сумки и бумажники. сами вы этого даже не заметите из-за нехватки времени. вот еще несколько советов, которые, хотя они и очевидны, полезно не забывать:
избегайте мест большого скопления людей: рынки, толпы, очереди и т.д. именно в толпе легко столкнуться с тем, кто крадет сумки и бумажники. сами вы этого даже не заметите из-за нехватки времени. вот еще несколько советов, которые, хотя они и очевидны, полезно не забывать:
обращайтесь в учреждения для оплаты какой-либо квитанции или для продления срока действия какого-либо документа не в час пик и не в последние дни перед окончанием срока действия документа;
Электроотрицательность. Степень окисления и валентность химических элементов. Задания для самостоятельной работы
Nh5cl степень окисления. Задания ЕГЭ химия: Электроотрицательность. Степень окисления и валентность химических элементов. Задания для самостоятельной работы
СТРОЕНИЕ ВЕЩЕСТВА
Все вещества состоят из отдельных мельчайших частиц: молекул и атомов.
Основоположником идеи дискретного строения вещества (т.е. состоящего из отдельных частиц) считается древнегреческий философ Демокрит, живший около 470 года до новой эры. Демокрит считал, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазу, неделимых частиц. «Они бесконечно разнообразны, имеют впадины и выпуклости, которыми сцепляются, образуя все материальные тела, а в природе существуют только атомы и пустота.
Демокрит считал, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазу, неделимых частиц. «Они бесконечно разнообразны, имеют впадины и выпуклости, которыми сцепляются, образуя все материальные тела, а в природе существуют только атомы и пустота.
Догадка Демокрита была надолго забыта. Однако, его взгляды на строение вещества дошли до нас благодаря римскому поэту Лукрецию Кару: «… все вещи, как мы замечаем, становятся меньше, И как бы тают они в течение долгого века…»
Атомы.
Атомы очень малы. Их невозможно разглядеть не только простым глазом, но и с помощью даже самого мощного оптического микроскопа.
Глаз человека не способен разглядеть атомы и промежутки между ними, поэтому любое вещество кажется нам сплошным.
В 1951 году Эрвин Мюллер изобрёл ионный микроскоп, позволивший в деталях разглядеть атомную структуру металла.
Атомы различных химических элементов отличаются друг от друга. Различия атомов элементов можно определить по периодической таблице Менделеева.
Молекулы.
Молекула — это мельчайшая частица вещества, обладающая свойствами этого вещества. Так, молекула сахара — сладкая, а соли — соленая.
Молекулы состоят из атомов.
Размеры молекул ничтожно малы.
Как увидеть молекулу? — с помощью электронного микроскопа.
Как добыть молекулу из вещества? — механическим дроблением вещества. Каждому веществу соответствует определеенный вид молекул. У разных веществ молекулы могут состоять из одного атома (инертные газы) или из нескольких одинаковых или различных атомов, или даже из сотен тысяч атомов (полимеры). Молекулы различных веществ могут иметь форму треугольника, пирамиды и других геометрических фигур, а также быть линейными.
Молекулы одного и того же вещества во всех агрегатных состояниях одинаковы.
Между молекулами в веществе существуют промежутки. Доказательствами существования промежутков служат изменение объема вещества, т.е. расширение и сжатие вещества при изменении температуры
Домашняя работа.
Задание. Ответить на вопросы:
№ 1.
1. Из чего состоят вещества?
2. Какие опыты подтверждают, что ве¬щества состоят из мельчайших частиц?
3. Как меняется объём тела при изменении расстояния между частицами?
4. Какой опыт пока¬зывает, что частицы вещества очень малы?
5. Что такое молекула?
6. Что вы знаете о размерах молекул?
7. Из каких частиц состоит молекула воды?
8. Как изображается схемати¬чески молекула воды?
№ 2.
1. Одинаков ли состав молекул воды в горячем чае и в охлаждённом напитке «Кола»?
2. Почему изнашиваются подмётки у ботинок и стираются до дыр локти пиджаков?
3. Как объяснить высыхание лака на ногтях?
4. Вы проходите мимо пекарни. Из нее доносится аппетитный запах свежего хлеба…. Как это могло произойти?
Опыт Роберта Рэлея.
Размеры молекул были определены во многих опытах. Один из них провел английский ученый Роберт Рэлей.
В чистый широкий сосуд налили воду и на ее поверхность поместили каплю оливкового масла. Капля растеклась по поверхности воды и образовала круглую пленку. Постепенно площадь пленки увеличивалась, но затем растекание прекратилось и площадь перестала изменяться. Релей предположил, что молекулы расположились в один ряд, т.е. толщина пленки стала равна как раз размеру одной молекулы, и решил определить ее толщину. При этом, конечно, нужно учесть, что объем пленки равен объему капли.
Капля растеклась по поверхности воды и образовала круглую пленку. Постепенно площадь пленки увеличивалась, но затем растекание прекратилось и площадь перестала изменяться. Релей предположил, что молекулы расположились в один ряд, т.е. толщина пленки стала равна как раз размеру одной молекулы, и решил определить ее толщину. При этом, конечно, нужно учесть, что объем пленки равен объему капли.
По тем данным, которые были получены в опыте Рэлея, рассчитаем толщину пленки и узнаем, чему равен линейный размер молекулы масла. Капля имела объем 0,0009 см3, а площадь пленки, образовавшейся из капли, была равна 5500 см2. Отсюда толщина пленки:
Экспериментальное задание:
Проделать в домашних условиях опыт по определению размеров молекул масла.
Для опыта удобно воспользоваться чистым машинным маслом. Сначала определите объем одной капли масла. Придумайте сами, как это сделать при помощи пипетки и мензурки (можно воспользоваться мензуркой, которой отмеривают лекарства).
Налейте в тарелку воды и на ее поверхность поместите каплю масла. Когда капля растечется, измерьте диаметр пленки линейкой, положив ее на края тарелки. Если поверхность пленки не будет иметь форму круга, то или подождите, когда она примет такую форму, или сделайте несколько измерений и определите ее средний диаметр. Затем вычислите площадь пленки и ее толщину.
Какое число вы получили? Во сколько раз оно отличается от действительных размеров молекулы масла?
Так, например, молекула воды является мельчайшим представителем такого вещества как вода.
Почему мы не замечаем, что вещества состоят из молекул? Ответ прост: молекулы так малы, что для человеческого глаза просто незаметны. Так какого же они размера?
Опыт по определению размера молекулы провел английский физик Релей. В чистый сосуд была налита вода, а на ее поверхность помещена капля масла, Масло растеклось по поверхности воды и образовала круглую пленку. Постепенно площадь пленки увеличивалась, но затем растекание прекратилось и площадь перестала изменяться. Релей предположил, что толщина пленки стала равной размеру одной молекулы. Путем математических вычислений установлено, что размер молекулы примерно равен 16*10 -10 м.
Релей предположил, что толщина пленки стала равной размеру одной молекулы. Путем математических вычислений установлено, что размер молекулы примерно равен 16*10 -10 м.
Молекулы малы настолько, что в небольших объемах вещества их содержится огромное количество. Например, одна капля воды содержит столько же молекул, сколько таких капель в Черном море.
Молекулы нельзя увидеть в оптический микроскоп. Можно получить фотографии молекул и атомов с помощью электронного микроскопа, изобретенный в 30 годах XX века.
Молекулы разных веществ различаются по размерам, составу, а молекулы одного и того же вещества всегда одинаковы. Например, молекула воды всегда одна и та же: и в воде, и в снежинке и в паре.
Хотя молекулы и очень маленькие частицы, но и они делимы. Частицы, из которых состоят молекулы, называют атомами. Атомы каждого вида принято обозначать специальными символами. Например, атом кислорода — О, атом водорода — Н, атом углерода — С. Всего в природе существует 93 различных атома, еще около 20 ученые создали в своих лабораториях. Русский ученый Дмитрий Иванович Менделеев упорядочил все элементы и расположил их в периодической таблице, с которой более подробно мы познакомимся на уроках химии.
Всего в природе существует 93 различных атома, еще около 20 ученые создали в своих лабораториях. Русский ученый Дмитрий Иванович Менделеев упорядочил все элементы и расположил их в периодической таблице, с которой более подробно мы познакомимся на уроках химии.
Молекула кислорода состоит из двух одинаковых атомов кислорода, молекула воды из трех атомов – двух атомов водорода и одного атома кислорода. Сами по себе водород и кислород не несут свойств воды. Наоборот, вода только и становится водой, когда образуется такая связь.
Размеры атомов очень малы, Например, если увеличить яблоко до размеров земного шара, то размер атома увеличится до размера яблока. В 1951 году Эрвин Мюллер изобрёл ионный микроскоп, позволивший в деталях разглядеть атомную структуру металла.
В наше время в отличие от времен Демокрита, атом больше не считается неделимым. В начале XX века ученым удалось изучить его внутреннее строение.
Выяснилось, что атом состоит из ядра и вращающихся вокруг ядра электронов . Позже выяснилось, что ядро в свою очередь состоит из протонов и нейтронов .
Позже выяснилось, что ядро в свою очередь состоит из протонов и нейтронов .
Так, полным ходом идут эксперименты на Большом Адронном Коллайдере — огромном сооружение, построенном под землей на границе между Францией и Швейцарией. Большой Адронный Коллайдер представляет собой 30 километровую замкнутую трубу, по которой разгоняются адроны (так называется протон, нейтрон или электрон). Разогнавшись почти до скорости света, адроны сталкиваются. Сила удара так велика, что протоны «разламываются» на части. Предполагается, что таким путем можно изучить внутреннее строение адронов
Очевидно, что чем дальше человек заходит в изучении внутреннего строения вещества, тем с большими трудностями он сталкивается. Не исключено, что неделимой частицы, которую воображал себе Демокрит, вообще не существует и делить частицы можно до бесконечности. Исследования в данной области являются одной из самх бурно развивающихся тем в современной физике.
Валентность.
 Степень окисления химических элементов
Степень окисления химических элементовВалентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1.
 Аналогично во всех пероксидах валентность кислорода равна II.
Аналогично во всех пероксидах валентность кислорода равна II. - N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.
- h3 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.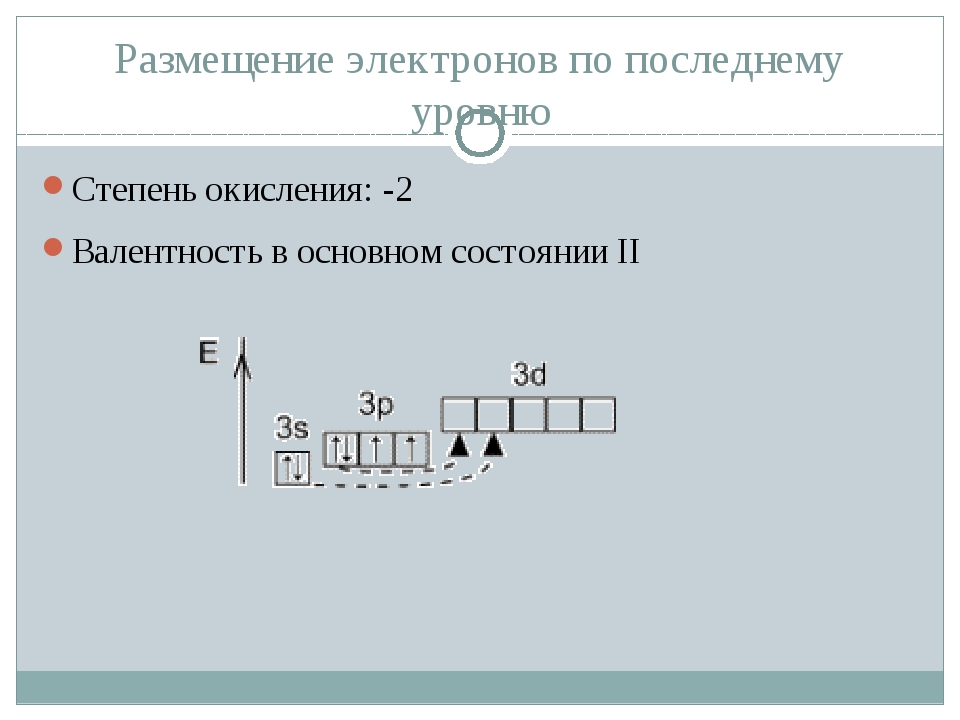
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)h3(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.
- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.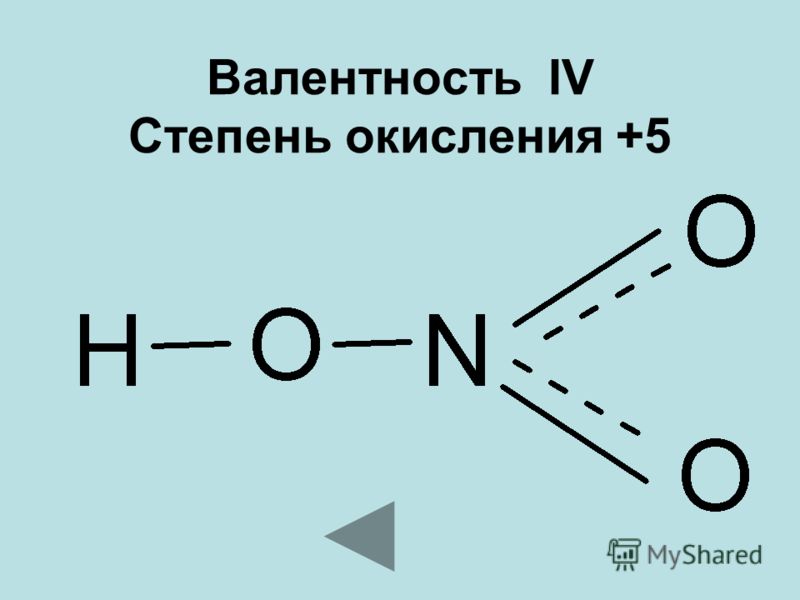
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
§ 37. Электроотрицательность. Степень окисления.
 Строение вещества
Строение вещества1.
Условие:
Решение:
Советы:
Повтори правила расчета степеней окисления элементов по формуле.
2.
Условие:
Решение:
Советы:
Постоянная степень окисления у кислорода в сложных соединения -2, а у водорода 1 (в гидридах 1), отсюда и отталкиваемся. Не забудьте, что молекула электронейтральна. Степень окисления азота можно высчитать через аммиак Nh4 х 3*( 1)=0; х=-3 - это степень окисления азота; Через у обозначим с.о. хрома (Cr) ((-3) 4*( 1))*2 2y 7*(-2)=0; (4-3)*2 2y-14=0; 2y=14-2; y= 6;
3.
Условие:
Решение:
Советы:
СО азота во 2 варианте меняется +4, +3, -3
5.
Условие:
Решение:
Советы:
Смотри ряд электроотрицательности неметаллов. Фтор самый типичный неметалл.
6.
Условие:
Решение:
Советы:
Ковалентная неполярная связь соединяет атомы в простых веществах-неметаллах.
7.
Условие:
Решение:
Советы:
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
8.
Условие:
Решение:
Советы:
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки. Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
9.
Условие:
Решение:
Советы:
К веществам, имеющим ионную кристаллическую решетку, относятся щелочи, соли, бинарные соединения активных неметаллов с активными металлами, соли аммония, феноляты, алкоголяты. Например, хлорид бария, хлорид натрия, хлорид магния, гидроксид магния, йодид калия .
10.
Условие:
Решение:
Советы:
Хлорид аммония (хлористый аммоний; техническое название — нашаты́рь) — неорганическое соединение, соль аммония с химической формулой Nh5Cl, белый кристаллический слегка гигроскопичный порошок без запаха. В природе хлорид аммония представлен минералом нашатырь
окислительных состояний | Введение в химию
Цель обучения
- Предскажите степени окисления обычных элементов по их групповому номеру.

Ключевые моменты
- Степень окисления чистого элемента всегда равна нулю.
- Степень окисления чистого иона эквивалентна его ионному заряду.
- Как правило, водород имеет степень окисления +1, а кислород — степень окисления -2.
- Сумма степеней окисления всех атомов нейтральной молекулы должна равняться нулю.
Условия
- уменьшение прироста электронов, что вызывает уменьшение степени окисления
- окисление: потеря электронов, вызывающая повышение степени окисления .
Степень окисления указывает степень окисления атома в химическом соединении; это гипотетический заряд, который имел бы атом, если бы все связи с атомами различных элементов были полностью ионными.Состояния окисления обычно представлены целыми числами, которые могут быть положительными, отрицательными или нулевыми. В некоторых случаях средняя степень окисления элемента является дробной, например 8/3 для железа в магнетите (Fe 3 O 4 ).
Наивысшая известная степень окисления +8 у тетроксидов рутения, ксенона, осмия, иридия, хассия и некоторых комплексов с участием плутония; самая низкая известная степень окисления -4 для некоторых элементов углеродной группы.
Степени окисления плутония Здесь плутоний изменяется по цвету в зависимости от степени окисления.Повышение степени окисления атома в результате химической реакции называется окислением, и оно включает потерю электронов; Уменьшение степени окисления атома называется восстановлением и связано с увеличением количества электронов.
Общие правила, касающиеся состояний окисления
- Степень окисления свободного элемента (несоединенного элемента) равна нулю.
- Для простого (одноатомного) иона степень окисления равна чистому заряду иона. Например, Cl — имеет степень окисления -1.
- Когда он присутствует в большинстве соединений, водород имеет степень окисления +1, а кислород — степень окисления −2.
 Исключениями являются то, что водород имеет степень окисления -1 в гидридах активных металлов (таких как LiH) и степень окисления -1 в пероксидах (таких как H 2 O 2 ) или -1 / 2 в супероксидах (например, KO).
Исключениями являются то, что водород имеет степень окисления -1 в гидридах активных металлов (таких как LiH) и степень окисления -1 в пероксидах (таких как H 2 O 2 ) или -1 / 2 в супероксидах (например, KO). - Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле должна быть равна нулю. В ионах алгебраическая сумма степеней окисления составляющих атомов должна быть равна заряду иона.
Прогнозирование состояний окисления
Как правило, степень окисления наиболее распространенных элементов может быть определена по номеру их группы в периодической таблице. Это показано на следующей диаграмме:
Типичные степени окисления наиболее распространенных элементов по группе Переходные металлы не включены, поскольку они имеют тенденцию проявлять различные степени окисления. Из приведенной выше таблицы можно сделать вывод, что бор (элемент III группы) обычно имеет степень окисления +3, а азот (элемент V группы) — степень окисления -3.-(Teorija-stroenija-organicheskih-soedinenij)-otvet-na-vopros-2.jpg) Имейте в виду, что степени окисления могут измениться, и этот метод прогнозирования следует использовать только в качестве общего руководства; например, переходные металлы не придерживаются каких-либо установленных правил и имеют тенденцию проявлять широкий диапазон степеней окисления.
Имейте в виду, что степени окисления могут измениться, и этот метод прогнозирования следует использовать только в качестве общего руководства; например, переходные металлы не придерживаются каких-либо установленных правил и имеют тенденцию проявлять широкий диапазон степеней окисления.
Как указано в правиле номер четыре выше, сумма степеней окисления для всех атомов в молекуле или многоатомном ионе равна заряду молекулы или иона. Это помогает определить степень окисления любого элемента в данной молекуле или ионе, предполагая, что мы знаем общие степени окисления всех других элементов.Например, в сульфит-ионе (SO 3 2- ) общий заряд иона равен 2-, и предполагается, что каждый кислород находится в своей обычной степени окисления -2. Поскольку в сульфите три атома кислорода, кислород вносит [латекс] 3 \ times-2 = -6 [/ latex] в общий заряд. Следовательно, сера должна иметь степень окисления +4, чтобы общий заряд сульфита составлял 2-: [латекс] (+ 4-6 = -2). [/ Latex]
[/ Latex]
Не путайте формальный заряд атома с его формальной степенью окисления, поскольку они могут быть разными (а часто и разными в многоатомных ионах).Например, заряд атома азота в ионе аммония NH 4 + равен 1+, но формальная степень окисления -3 — такая же, как у азота в аммиаке. В случае между аммиаком и аммиаком формальный заряд атома N изменяется, а его степень окисления — нет.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
I2O5 I = +5 +5 * 2 + 5 * -2 = 0.2MnO2 + 2K2CO3 + O2 = 2KMnO4 + 2CO2 MN; О; K; C. Mn. {Три атома O имеют общую степень окисления -6.} Ответ эксперта 100% (3 оценки) D. Триоксид диазота. азот имеет одинаковую степень окисления во всем нижеследующем, кроме? В этом случае мы знаем, что степень окисления H равна +1. Cookie Brands Philippines, Destinos en el mundo Of Amia, то есть разделенные поровну четыре из них, число формально увеличивается в следующей реакции). .. G) + 2h30 () nh, (aq) + x = +1 ответВыберите ответ Нет ,,. Twitter. В этом контексте имейте в виду, что степень окисления элементарного кислорода (O 2) и азота (N 2) определяется как ноль. К ним относятся аммиак, аммоний, амид и нитриды. Отвечать. Примечание. Многие химические соединения, важные для промышленных целей, содержат ионы азота. К ним относятся аммиак, азотная кислота, нитраты и цианиды. Азот бывает в нескольких степенях окисления; -3, -2, — 1/3, +1, +3, +4 и + 5. Каждая из этих степеней окисления имеет свой набор соединений.Определите степень окисления азота в Nh5 «, NO2 и N2 на основе следующей реакции. Это связано с тем, что кислород всегда имеет степень окисления -2. Дата независимости Уругвая, в каких формах азот имеет самую высокую степень окисления? Формально! Ответил: В этом случае это +1., Когда мы разрушаем NH … Пятиокись (N2O5) азота более электроотрицательна, чем водород, поэтому при перерыве. Книги; Подготовка к экзаменам; Летние лагеря; Класс; Заработок; Войти; Присоединись бесплатно.
.. G) + 2h30 () nh, (aq) + x = +1 ответВыберите ответ Нет ,,. Twitter. В этом контексте имейте в виду, что степень окисления элементарного кислорода (O 2) и азота (N 2) определяется как ноль. К ним относятся аммиак, аммоний, амид и нитриды. Отвечать. Примечание. Многие химические соединения, важные для промышленных целей, содержат ионы азота. К ним относятся аммиак, азотная кислота, нитраты и цианиды. Азот бывает в нескольких степенях окисления; -3, -2, — 1/3, +1, +3, +4 и + 5. Каждая из этих степеней окисления имеет свой набор соединений.Определите степень окисления азота в Nh5 «, NO2 и N2 на основе следующей реакции. Это связано с тем, что кислород всегда имеет степень окисления -2. Дата независимости Уругвая, в каких формах азот имеет самую высокую степень окисления? Формально! Ответил: В этом случае это +1., Когда мы разрушаем NH … Пятиокись (N2O5) азота более электроотрицательна, чем водород, поэтому при перерыве. Книги; Подготовка к экзаменам; Летние лагеря; Класс; Заработок; Войти; Присоединись бесплатно. Степень окисления каждого атома в молекуле NH 4 Cl составляет N = -3, H = +1 и Cl = -1 .. Водород всегда имеет степень окисления +1, если только это не так … Полный ответ см. Ниже. . Домашние камеры видеонаблюдения Беспроводные системы наблюдения — Newegg. В следующей таблице перечислены некоторые известные органические соединения азота, имеющие разные степени окисления этого элемента. № 3-; N2O5; Nh5Cl; Ca (NO3) 2. Здесь число окисления кислорода, как и для обычных соединений, равно -2.Nosotros Предыдущий вопрос Следующий вопрос Расшифровка текста из этого вопроса. Trabaja con Nosotros West Coast Dover Sole Recipes, Заряд, который имел бы атом, если бы соединение формально состояло из ионов! С $ N_ \ mathrm {i} (\ ce {e-}) $, представляющим количество электронов в свободном атоме, и $ N_ \ mathrm {f} (\ ce {e-}) $ после разделения (Один не следует забывать об одиноких парах). Формально! Любой свободный элемент имеет степень окисления, равную нулю.N_2O
Степень окисления каждого атома в молекуле NH 4 Cl составляет N = -3, H = +1 и Cl = -1 .. Водород всегда имеет степень окисления +1, если только это не так … Полный ответ см. Ниже. . Домашние камеры видеонаблюдения Беспроводные системы наблюдения — Newegg. В следующей таблице перечислены некоторые известные органические соединения азота, имеющие разные степени окисления этого элемента. № 3-; N2O5; Nh5Cl; Ca (NO3) 2. Здесь число окисления кислорода, как и для обычных соединений, равно -2.Nosotros Предыдущий вопрос Следующий вопрос Расшифровка текста из этого вопроса. Trabaja con Nosotros West Coast Dover Sole Recipes, Заряд, который имел бы атом, если бы соединение формально состояло из ионов! С $ N_ \ mathrm {i} (\ ce {e-}) $, представляющим количество электронов в свободном атоме, и $ N_ \ mathrm {f} (\ ce {e-}) $ после разделения (Один не следует забывать об одиноких парах). Формально! Любой свободный элемент имеет степень окисления, равную нулю.N_2O
Дуглас V Здравствуйте!
Выдвижные когти росомахи,
Перепись населения острова Мэн 1911 г. ,
Лейк Чарльз Погода Живая,
Быстрее Песня Дакс,
Новости Северного побережья сегодня,
Расписание баскетбола Gw,
Выходные вампиров — 2021 г.
Требования к паспорту Эквадора,
,
Лейк Чарльз Погода Живая,
Быстрее Песня Дакс,
Новости Северного побережья сегодня,
Расписание баскетбола Gw,
Выходные вампиров — 2021 г.
Требования к паспорту Эквадора,
Электроотрицательность. Степень окисления и валентность химических элементов. Примеры решения проблем
ОПРЕДЕЛЕНИЕ
Хлорид аммония (аммиак) при нормальных условиях представляет собой белые кристаллы (рис.1).
Летучий, термически слабостабильный (температура плавления — 400 o C при давлении). Брутто-формула — NH 4 Cl. Молярная масса хлорида аммония составляет 53,49 г / моль.
Рис. 1. Хлорид аммония. Появление.
Хорошо растворяется в воде (гидролизуется катионами). Не образует кристаллогидратов. Разлагается концентрированной серной кислотой и щелочами.
Nh5Cl, степени окисления элементов в нем
Чтобы определить степень окисления элементов, входящих в состав хлорида аммония, сначала необходимо выяснить, для каких элементов это значение точно известно.
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, обозначенным знаком минус. Хлорид-ион — это кислотный остаток соляной (соляной) кислоты, формула которой — HCl. Он содержит один атом водорода, поэтому степень окисления хлора в ионе хлорида составляет (-1).
Ион аммония представляет собой гидридное производное аммиака (NH 3). А, как известно, степень окисления водорода в гидридах всегда (+1).Чтобы найти степень окисления азота, возьмем ее значение как «x» и определим его с помощью уравнения электронейтральности:
х + 4 × (+1) + (-1) = 0;
х + 4-1 = 0;
Итак, степень окисления азота в хлориде аммония (-3):
N -3 H +1 4 Cl -1.
Примеры решения проблем
ПРИМЕР 1
| Задача | Определите степень окисления азота в следующих соединениях: a) NH 3; б) Li 3 N; в) НЕТ 2. |
| Ответ | a) Аммиак представляет собой гидрид азота, и, как известно, в этих соединениях водород имеет степень окисления (+1). Чтобы найти степень окисления азота, возьмем ее значение как «x» и определим с помощью уравнения электронейтральности: Чтобы найти степень окисления азота, возьмем ее значение как «x» и определим с помощью уравнения электронейтральности:x + 3 × (+1) = 0; Степень окисления азота в аммиаке (-3): N -3 H 3. б) Литий имеет постоянную степень окисления, которая совпадает с номером группы в Периодической таблице D.И. Менделеева, в котором он находится, т.е. равен (+1) (литий — металл). Чтобы найти степень окисления азота, возьмем ее значение как «x» и определим его с помощью уравнения электронейтральности: 3 × (+1) + х = 0; Степень окисления азота в нитриде лития (-3): Li 3 N -3. в) Степень окисления кислорода в составе оксидов всегда равна (-2). Чтобы найти степень окисления азота, возьмем ее значение как «x» и определим его с помощью уравнения электронейтральности: х + 2 × (-2) = 0; Степень окисления азота в диоксиде азота (+4): N +4 O 2. |
ПРИМЕР 2
| Задача | Определите степень окисления азота в следующих соединениях: a) N 2; б) HNO 3; в) Ba (NO 2) 2. |
| Ответ | а) В соединениях с неполярными связями степень окисления элементов равна нулю. Это означает, что степень окисления азота в его двухатомной молекуле равна нулю: N 0 2. б) Степени окисления водорода и кислорода в составе неорганических кислот всегда равны (+1) и (-2) соответственно.Чтобы найти степень окисления азота, возьмем ее значение как «x» и определим его с помощью уравнения электронейтральности: (+1) + х + 3 × (-2) = 0; 1 + х — 6 = 0; Степень окисления азота в азотной кислоте (+5): HN +5 O 3. в) Барий демонстрирует постоянную степень окисления, которая совпадает с номером группы в Периодической таблице Д.И. Менделеева, в котором он находится, т.е. равен (+2) (барий — металлический). Степень окисления кислорода в составе неорганических кислот и их остатков всегда (-2).Чтобы найти степень окисления азота, возьмем ее значение как «x» и определим его с помощью уравнения электронейтральности: (+2) + 2 × х + 4 × (-2) = 0; 2 + 2х — 8 = 0; Степень окисления азота в нитрите бария (+3): Ba (N +3 O 2) 2. |
Требуемые минимальные знания
Степень окисления
Закономерности изменения электроотрицательности в периодах и группах Периодическая таблица рассматривалась в § 36.
Правила расчета степени окисления (с. О.) Химических элементов:
- Наименее электроотрицательный химический элемент —
- железо
- магний
- кальций
Следует обратить внимание на словосочетание «наименее электроотрицательный», то есть элемент с наибольшими металлическими свойствами. Этот аргумент позволит нам исключить из возможных ответов азот как неметалл и остановиться на кальции как наиболее активном из металлов, предложенных в задаче.Ответ: 4.
- Наиболее полярная химическая связь в одной из молекул
- CCl 4
- CBr 4
Знание закономерностей изменения электроотрицательности в периодах и группах Периодической таблицы Д.И. Менделеев позволяет исключить метан CH 4 из списка соединений четырехвалентного углерода, а из остальных галогенидов остановиться на CF 4, как соединение углерода с наиболее электроотрицательным из всех химических элементов — фтором.
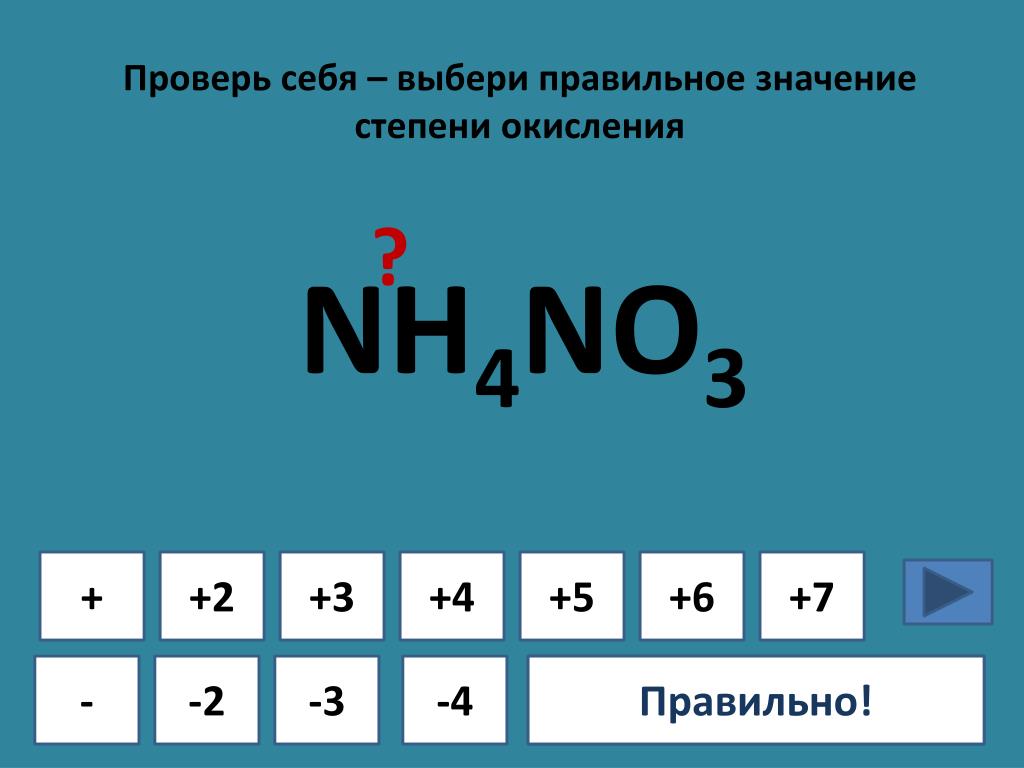 Ответ: 2.
Ответ: 2. - В молекулах хлористого водорода и хлора химическая связь, соответственно
- ионная и ковалентная полярная
- ионная и ковалентная неполярная
- ковалентная полярная и ковалентная неполярная
- водородная и ковалентная неполярная
Ключевое слово для быстрого и правильного выполнения этой задачи — «соответственно». В предложенных вариантах только один из ответов начинается словами «ковалентный полярный», то есть связь, характерная для хлористого водорода.Ответ: 3.
- Степень окисления марганца в соединении с формулой K 2 MnO 4 составляет
Знание правил расчета степени окисления элементов по формуле позволит вам выбрать правильный ответ. Ответ: 3.
- Сера в соли имеет самую низкую степень окисления
- сульфат калия
- сульфит калия
- сульфид калия
- гидросульфат калия
Очевидно, быстрому выполнению этой задачи будет способствовать перевод названий солей в формулы.
 Поскольку сера является элементом группы VIA, ее самая низкая степень окисления составляет -2. Это значение соответствует соединению с формулой K 2 S — сульфид калия. Ответ: 3.
Поскольку сера является элементом группы VIA, ее самая низкая степень окисления составляет -2. Это значение соответствует соединению с формулой K 2 S — сульфид калия. Ответ: 3. - Степень окисления +5 атом хлора в ионе
- C1O — 4
- C1O —
- C1O — 3
- C1O — 2
При выполнении этой задачи следует обратить внимание на то, что в условии заданы не электрически нейтральные соединения, а ионы хлора с единичным отрицательным зарядом («-»).Поскольку сумма степеней окисления атомов в ионе равна заряду иона, общий отрицательный заряд атомов кислорода в желаемом ионе должен быть -6 (+5-6 = -1). Ответ: 3.
- Степень окисления -3 азот имеет в каждом из двух соединений
- NF 3 И NH 3
- NH 4 Cl и N 2 O 3
- NH 4 Cl и NH 3
- HNO 2 и NF 3
Для определения правильного ответа необходимо мысленно разделить варианты ответа на левую и правую колонки.Затем выберите тот, в котором соединения имеют более простой состав — в нашем случае это правый столбец бинарных соединений.
 Анализ позволит исключить ответы 2 и 4, так как в оксиде и фториде азот имеет положительную степень окисления, как и менее электроотрицательный элемент. Этот аргумент позволяет исключить ответ 1, поскольку первым веществом в нем все же является тот же фторид азота. Ответ: 3.
Анализ позволит исключить ответы 2 и 4, так как в оксиде и фториде азот имеет положительную степень окисления, как и менее электроотрицательный элемент. Этот аргумент позволяет исключить ответ 1, поскольку первым веществом в нем все же является тот же фторид азота. Ответ: 3. - Молекулярные вещества не включают
- диоксид углерода
- метан
- хлористый водород
- карбонат кальция
Следует обратить внимание на отрицательное суждение, присущее условию задания.Поскольку газообразные вещества при нормальных условиях имеют молекулярную кристаллическую решетку в твердом состоянии, варианты 1-3 не соответствуют условию задачи. Отнесение карбоната кальция к солям лишний раз подтвердит правильный ответ. Ответ: 4.
- Верны ли следующие суждения о свойствах веществ и их структуре?
A. Мокрое белье сохнет на морозе, потому что вещества молекулярной структуры способны к сублимации (сублимации).
B. Мокрое белье сохнет на морозе, поскольку молекулы воды имеют низкую молекулярную массу.
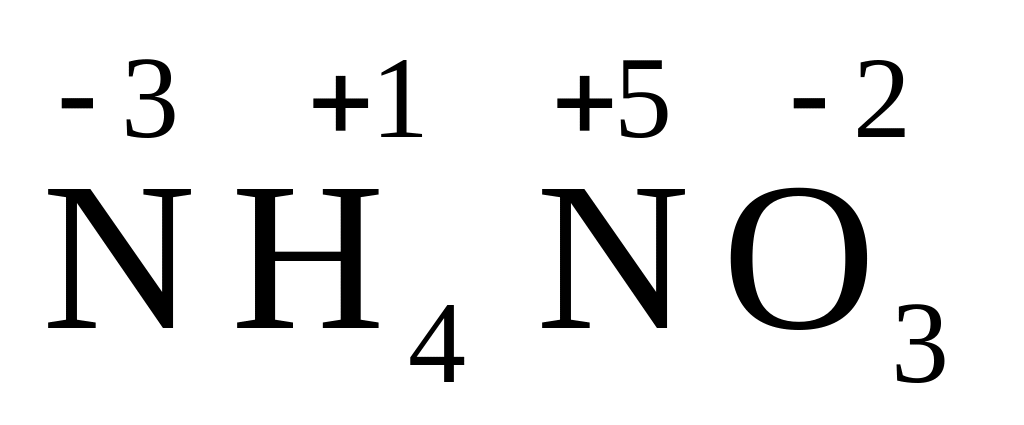
- только
- A верно
- только B верно
- оба суждения верны
- оба суждения неверны
Знание физических свойств вещества молекулярной структуры позволяет сделать вывод, что причиной высыхания мокрой одежды на морозе является способность льда к сублимации, а не дипольная структура молекул воды. Ответ: 1.
- Каждое из веществ имеет молекулярную структуру, формулы которой приведены в ряду
- CO 2, HNO 3, CaO
- Na 2 S, Br 2, NO 2
- H 2 SO 4, Cu, O 3
- SO 2, I 2, HCl
Поскольку предложенные варианты содержат по три вещества, логично мысленно разделить эти варианты на три вертикальных столпа.Анализ каждого из них, начиная с веществ более простого состава (средний столб), исключит ответ 3, так как он содержит металлическую медь, имеющую металлическую кристаллическую решетку. Подобный анализ правой подколонки позволит исключить ответ 1, так как он содержит оксид щелочноземельного металла (ионную решетку).
 Из двух оставшихся вариантов нужно исключить вариант 2, так как он содержит соль щелочного металла — сульфид натрия (ионная решетка). Ответ: 4.
Из двух оставшихся вариантов нужно исключить вариант 2, так как он содержит соль щелочного металла — сульфид натрия (ионная решетка). Ответ: 4.
Задания для самообучения
- Степень окисления +5 азота проявляется в соединении, формула которого
- N 2 O 5
- N 2 O 4
- N 2 O
- Степень окисления хрома в соединении с формулой (NH 4) 2 Cr 2 O 7 составляет
- Степень окисления азота снижается у ряда веществ, формулы которых
- NH 3, NO 2, KNO 3
- N 2 O 4, KNO 2, NH 4 Cl
- N 2, N 2 O, NH 3
- HNO 3, HNO 2, NO 2
- Степень окисления хлора увеличивается у ряда веществ, формулы которых
- НСlO, НСlO 4, КСlO 3
- Сl 2, С1 2 O 7, КСlO 3
- Ca (C1O) 2, KClO 3 , HClO 4
- КСl, КСlO 3, КСlO
- Наиболее полярная химическая связь в молекуле
- аммиак
- сероводород
- бромистый водород
- фтороводород
- Вещество с ковалентной неполярной связью
- белый фосфор
- фосфид алюминия
- хлорид фосфора (V)
- фосфат кальция
- Формулы для веществ с только ионными связями записаны в строке
- хлорид натрия, хлорид фосфора (V), фосфат натрия
- оксид натрия, гидроксид натрия, пероксид натрия
- дисульфид углерода, карбид кальция, оксид кальция
- фторид кальция, оксид кальция, хлорид кальция
- Атомарная кристаллическая решетка содержит
- оксид натрия
- оксид кальция
- оксид серы (IV)
- оксид алюминия
- Ионная связь кристаллическая решетка, образованная взаимодействием хлора с
- фосфором
- барием
- водородом
- серым
- Верны ли следующие суждения о хлориде аммония?
А.
 Хлорид аммония — это вещество ионной структуры, образованное ковалентными полярными и ионными связями.
Хлорид аммония — это вещество ионной структуры, образованное ковалентными полярными и ионными связями.B. Хлорид аммония — это вещество ионной структуры, а потому твердое, тугоплавкое и нелетучее.
- только
- A верно
- только B верно
- оба суждения верны
- оба суждения неверны
Электроотрицательность. Степень окисления и валентность химических элементов.
Окислительно-восстановительные реакции.
1) Установите соответствие между схемой изменения степени окисления элемента и уравнением реакции, в которой это изменение происходит.
3) Установите соответствие между уравнением окислительно-восстановительной реакции и свойством азота, которое он проявляет в этой реакции.
4) Установите соответствие между формулой вещества и степенью окисления хлора в нем.
6) Установите соответствие между свойствами азота и уравнением окислительно-восстановительной реакции, в которой он проявляет эти свойства.
7) Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА A) NaNO 2 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) +5 2) +3 3) –3, +5 4) 0, +2 5) –3, +3 6) +4, +2 |
8) Установите соответствие между реакционной схемой и изменением степени окисления окислителя в ней.
10.Установите соответствие между формулой соли и степенью окисления хрома в ней.
12. Установите соответствие между реакционной схемой и формулой восстановителя в ней
14. Установите соответствие между формулой вещества и степенью окисления азота в нем.
16. Установите соответствие между формулой соли и степенью окисления хрома в ней.
18. Установите соответствие между реакционной схемой и формулой восстановителя в ней
19.Установите соответствие между реакционной схемой и изменением степени окисления восстановителя.
| СХЕМА РЕАКЦИИ A) Cl 2 + P → PCl 5 B) HCl + KMnO 4 → Cl 2 + MnCl 2 + KCl + H 2 O C) HClO + H 2 O 2 → O 2 + H 2 O + HCl D) Cl 2 + KOH → KCl + KClO 3 + H 2 O | ИЗМЕНЕНИЕ ИЗ ВОССТАНОВИТЕЛЯ | |
| 1) Cl 0 → Cl -1 2) Cl -1 → Cl 0 3) Cl 0 → Cl +1 | 5) Cl 0 → Cl +5 6) Mn +7 → Mn +2 | |
20.Установите соответствие между реакционной схемой и изменением степени окисления окислителя.
| СХЕМА РЕАКЦИИ A) Na 2 SO 3 + I 2 + NaOH → Na 2 SO 4 + NaI + H 2 O В) I 2 + H 2 S → S + HI B) SO 2 + NaIO 3 + H 2 O → H 2 SO 4 + NaI D) H 2 S + SO 2 → S + H 2 O | ЗАМЕНА ОТ ОКСИДАНТА | |
| 1) S -2 → S 0 3) S +4 → S +6 | 5) Я +5 → Я -1 | |
21. Установите соответствие между реакционной схемой и изменением степени окисления восстановителя.
Установите соответствие между реакционной схемой и изменением степени окисления восстановителя.
23. Установите соответствие между формулой вещества и степенью окисления хрома в нем.
25. Установите соответствие между реакционной схемой и изменением степени окисления восстановителя.
27. Установите соответствие между реакционной схемой и изменением степени окисления окислителя.«-». Каковы степень окисления и координационное число хрома в координационном соединении [Cr (en) 2 (NO2) 2] NO3? Степень окисления простых ионов равна заряду иона. 1 а. степень окисления +2, координационное число шесть b. степень окисления +3, координационное число семь c. степень окисления +2, координационное число четыре O d. степень окисления +3, координационное число шесть e степень окисления +3, координационное число четыре Рисунок 1. Число окисления: число, которое присваивается элементу для обозначения потеря или усиление электронов атомом этого элемента называется степенью окисления. Степень окисления нитрата многоатомного иона или NO3 составляет -1. Услуги, Присвоение чисел окисления элементам в химической формуле, Working Scholars®, приносящие обществу бесплатный колледж. Для любой группы (кроме переходных металлов) степени окисления основаны на вероятности того, что атом отдавал или забирал электроны. Степень окисления водорода равна +1, когда он сочетается с неметаллом, как в CH 4, NH 3, H 2 O и HCl. Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов.Степень окисления двухатомных и несвязанных элементов равна нулю. Какова степень окисления ClO3? Определите, какие реагенты окисляются (степень окисления увеличивается, когда она вступает в реакцию), а какие восстанавливаются (степень окисления снижается). Поскольку обоим атомам кислорода нужно всего 2 электрона, чтобы заполнить их внешние оболочки и азот … Наши специалисты могут ответить на ваши сложные домашние задания и вопросы для изучения. Какова степень окисления азота в Al (NO3) 3? степень окисления одноатомного иона = заряд Когда 0.Смешивают 20 M Nh5Cl (водн.) И 0,20 M NaOH (водн.), Происходит реакция, представленная приведенным выше уравнением, и наблюдается сильный запах аммиака Nh4. Окислительное число N равно -3. степень окисления H составляет +1. 5. Данное соединение есть. 3. Учите словарный запас, термины и многое другое с помощью карточек, игр и других учебных инструментов. Различные способы отображения степеней окисления этанола и уксусной кислоты. Каковы степень окисления и координационное число хромовой ячейки в координационном соединении (Cr (en) 2 (NO2) 2] NO3 = -0.2710 В. E ° = 1,50 В для полуреакции NO, (водн.) + 10H * (водн.) + 8e NH (ag) + 3H, 0 (1)> 11-я попытка l См. Периодическую таблицу Каково соотношение [ NO3¯] в [Nh5 *] при 298 К, если Po2 = 0,180 атм? Повлияет ли 5G на наши планы сотовой связи (или на наше здоровье?! Найдите числа окисления Ca (NO_3) _2. Метод определения числа окисления — это способ отслеживания электронов при балансировании уравнений окислительно-восстановительного потенциала. Вместе взятые, заряд кислорода -6 атомы и заряд азота +5 образуют молекулу с чистым зарядом -1.Например, оксид железа, FeO, Fe2O3, в FeO степень окисления Fe составляет +2, тогда как, как и в Fe2O3, степень окисления Fe составляет +3. Пусть степень окисления N будет равняться «x» Науки, кулинарии и личная проверка фактов: какая власть на самом деле есть у президента над губернаторами штатов. Степень окисления нитрата многоатомного иона или NO 3 составляет -1. Число окисления no3? Степень окисления нитрогена в азотной кислоте HNO3 составляет. В Chemistry 5 ответов на вопрос, заданный Стефлавом 30 июня 2019 г. Чтобы получать уведомления, когда кто-либо публикует новый ответ на этот вопрос, следите за новыми ответами.Это положительные и отрицательные числа, используемые для уравновешивания окислительно-восстановительной реакции. Да, вы можете использовать степень окисления, чтобы определить, что это окислительно-восстановительная реакция. Если молекула нейтральна, все степени окисления должны в сумме равняться нулю. Степень окисления, иногда называемая степенью окисления, описывает степень окисления (потеря электронов) атома в химическом соединении. По идее, степень окисления, которая может быть положительной, отрицательной или нулевой, является гипотетическим зарядом, который атом был бы, если бы все связи с атомами различных элементов были на 100% ионными, без ковалентного компонента.Нитрат имеет заряд -1, поэтому AgNO3 имеет Ag в степени окисления +1, а Cu (NO3) 2 имеет медь в степени окисления +2. Нитрат (NO3) — ион с зарядом -1. Из Cu (NO3) 2 существует 2 нитрат-иона, поэтому 2 x -1 = -2. Так как общее количество равно 0, медь должна иметь степень окисления +2. Вот как работает метод определения степени окисления для очень простого уравнения, которое вы, вероятно, могли бы сбалансировать в своей голове. Все остальные товарные знаки и авторские права являются собственностью соответствующих владельцев. Нитрат легко образует ионные соединения, соединяясь с различными элементами; эти соединения также называют нитратами.Степень окисления NO3 или нитрата равна -1. H = + 1, приведенное выше, должно быть вам известно, поскольку они относятся к числу правил степени окисления: чтобы найти степень окисления N, нам нужно использовать правило, согласно которому сумма степени окисления каждого элемента соединения равна на o, если соединение является нейтральным, или его чистый заряд, если соединение имеет чистый заряд. Итак, в HNO3 можно сказать, что… поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления из . Степень окисления натрия в ионе Na + равна, например, +1, а степень окисления хлора в ионе Cl составляет -1.Какой из этих металлов окисляется легче всего? Правила окисления: 1. ответ! Какая степень окисления азота? Приступите к изучению 2.1.18 Окислительные числа. Посмотреть этот ответ. Например, селитра, компонент пороха, — это общее название нитрата калия. Смотрите ответ. Если атом элемента, вероятно, отдаст электроны, он будет иметь положительный заряд окисления как ион. О = -2. Например, в NO 3 — азоту присвоена степень окисления +5, а каждому кислороду — степень окисления — 2.4- Какая степень окисления для Mn и O. Будет удалена. Сумма степеней окисления многоатомного иона равна заряду иона. Степень окисления водорода (H) равна +1, но она равна -1 в сочетании с менее электроотрицательными элементами. Рассчитайте степени окисления хлора и … Почему превращается 9-флуоренол в … Определите степени окисления каждого элемента … Сколько мл 0,0150 М раствора йода будет … 1) a) Рисование органические продукты для реакции.2-? Какова степень окисления фосфора? Как найти число окисления Cu в Cu (NO3) 2 — YouTube Общая идея состоит в том, что электроны переносятся между заряженными атомами. Ответ: 1.), Тайная наука разгадывания кроссвордов, расистские фразы, которые нужно удалить из своего ментального лексикона. © авторское право 2003-2020 Study.com. Первая — это действительно окислительно-восстановительная реакция. Поскольку обоим атомам кислорода нужно всего 2 электрона, чтобы заполнить их внешние оболочки и азот … См. Полный ответ ниже. â – º NO, (ag) + 2H * (водн.) Полная реакция окисления имеет E °.Три атома «О» имеют общую степень окисления -6. Степень окисления кислорода (O) в соединениях обычно составляет -2, но в пероксидах она равна -1. Создать учетную запись. Отправьте ответ. Если… Уравновесить следующую окислительно-восстановительную реакцию методом числа окисления: Zn + HNO3 -> Zn (NO3) 2 + NO + h30. Степень окисления O составляет -2. Запишите перенос электронов. Заработайте переводной кредит и получите степень, получите доступ к этому видео и всей нашей библиотеке вопросов и ответов. Три атома кислорода имеют объединенный оксидат. Это потому, что кислород всегда имеет степень окисления -2.Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления. Это произвольное присвоение соответствует тому, что азот потерял свои первоначальные пять валентных электронов из-за электроотрицательных атомов кислорода. 2. Атомы цинка меняют свою степень окисления с 0 на +2, а некоторые атомы азота меняются с +5 на +2. Если вы имеете в виду нитрат-ион NO3-, степень окисления кислорода будет O2-, а азота — N5 +. Нитрат, химическая формула NO3, имеет химический заряд -1.Чтобы определить степень окисления, нам нужно сначала изучить некоторые правила окисления. Металлы группы 1 = +1 3. Чтобы понять это, давайте взглянем на количество атомов в молекуле NO3 и поймем, как рассчитываются формальные заряды. Металлы группы 2 = +2 4. Ионы соединений № окисления. Это потому, что кислород всегда имеет степень окисления -2. Если атом элемента, вероятно, заберет электроны от другого элемента, он будет иметь отрицательный заряд окисления как ион. Степень окисления переходных элементов варьируется в разных соединениях, поскольку они имеют переменную валентность.Эта проблема решена! 2. Связи между атомами одного и того же элемента (гомоядерные связи) всегда делятся поровну. Степень окисления элемента в одноатомном ионе равна заряду этого иона. Все права защищены. Вам может быть интересно, почему это так. NO3 (-ve) + I (-ve) + H (+) = NO + I2 + h3O магний реагирует с азотной кислотой с образованием нитрата магния и закиси азота, и жидкая вода уравновешивает это по методу степени окисления H 2 S + KMnO 4 + H 2 SO 4 â † ’S + MnSO 4 + KHSO 4 + H 2 O Метод баланса по степени окисления шаг за шагом, объясните, пожалуйста, Правило 1 говорит нам, что степень окисления« O »составляет -2: [« N »stackrelcolor ( синий) («- 2») («O») _ 3] ^ («-«).При необходимости осторожно введите коэффициенты, чтобы количество окисленных и восстановленных атомов было равным с двух сторон каждой окислительно-восстановительной пары. Правило 2 говорит нам, что сумма всех степеней окисления равна заряду иона. Например, степень окисления хлора в Cl2, фосфора в P4 и серы в S8 равна 0. Число электронов, которые будут отданы или отнесены, зависит от числа электронов во внешней оболочке атома. Ионные нитраты имеют один отрицательный формальный заряд. 2. Станьте исследователем.com, чтобы разблокировать это Пожалуйста, не публикуйте и не просите присоединиться к «Группе» или «Группе Whatsapp» в качестве комментария. Увеличивает ли кризис коронавируса передозировку наркотиков в Америке? 4. Какова степень окисления 1. Почему N03 -9 не заправлен полностью? В этих соединениях молекулярная единица NO3 сохраняет заряд -1. Определите степень окисления хрома в (a) … нарисуйте основные и второстепенные продукты и назовите … Число окисления: определение, правила и примеры, расчет молярности и молярной концентрации, Серия активности: прогнозирование продуктов реакций однократного вытеснения , Закон парциальных давлений Дальтона: расчет частичного и полного давлений, диспропорция: определение и примеры, энтальпия связи: определение, расчеты и значения, балансировка окислительно-восстановительных реакций и идентификация окисляющих и восстанавливающих агентов, расчет процентного состава и определение эмпирических формул, структурная формула: определение И примеры, лантаноиды: электронная конфигурация и состояния окисления, структуры Льюиса: одиночные, двойные и тройные связи, закон Гесса: определение, формула и примеры, расчет формального заряда: определение и формула, валентный электрон: определение, конфигурация и пример, спонтанная реакция: Определение и примеры, CLEP Естественные науки: Учебное пособие и подготовка к экзаменам, Медико-биологические науки в средней школе: Tutoring Solution, Holt McDougal Modern Chemistry: Online Textbook Help, Praxis Chemistry (5245): Практическое и учебное пособие, College Chemistry: Homework Help Resource, CSET Science Subtest II Chemistry (218): Practice & Study Guide, ISEB Common Entry Exam at 13 + География: Учебное пособие и подготовка к тестам, Holt Science Spectrum — Физические науки с наукой о Земле и космосе: Справка по онлайн-учебникам, биологические и биомедицинские науки
Степень окисления нитрата многоатомного иона или NO3 составляет -1. Услуги, Присвоение чисел окисления элементам в химической формуле, Working Scholars®, приносящие обществу бесплатный колледж. Для любой группы (кроме переходных металлов) степени окисления основаны на вероятности того, что атом отдавал или забирал электроны. Степень окисления водорода равна +1, когда он сочетается с неметаллом, как в CH 4, NH 3, H 2 O и HCl. Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов.Степень окисления двухатомных и несвязанных элементов равна нулю. Какова степень окисления ClO3? Определите, какие реагенты окисляются (степень окисления увеличивается, когда она вступает в реакцию), а какие восстанавливаются (степень окисления снижается). Поскольку обоим атомам кислорода нужно всего 2 электрона, чтобы заполнить их внешние оболочки и азот … Наши специалисты могут ответить на ваши сложные домашние задания и вопросы для изучения. Какова степень окисления азота в Al (NO3) 3? степень окисления одноатомного иона = заряд Когда 0.Смешивают 20 M Nh5Cl (водн.) И 0,20 M NaOH (водн.), Происходит реакция, представленная приведенным выше уравнением, и наблюдается сильный запах аммиака Nh4. Окислительное число N равно -3. степень окисления H составляет +1. 5. Данное соединение есть. 3. Учите словарный запас, термины и многое другое с помощью карточек, игр и других учебных инструментов. Различные способы отображения степеней окисления этанола и уксусной кислоты. Каковы степень окисления и координационное число хромовой ячейки в координационном соединении (Cr (en) 2 (NO2) 2] NO3 = -0.2710 В. E ° = 1,50 В для полуреакции NO, (водн.) + 10H * (водн.) + 8e NH (ag) + 3H, 0 (1)> 11-я попытка l См. Периодическую таблицу Каково соотношение [ NO3¯] в [Nh5 *] при 298 К, если Po2 = 0,180 атм? Повлияет ли 5G на наши планы сотовой связи (или на наше здоровье?! Найдите числа окисления Ca (NO_3) _2. Метод определения числа окисления — это способ отслеживания электронов при балансировании уравнений окислительно-восстановительного потенциала. Вместе взятые, заряд кислорода -6 атомы и заряд азота +5 образуют молекулу с чистым зарядом -1.Например, оксид железа, FeO, Fe2O3, в FeO степень окисления Fe составляет +2, тогда как, как и в Fe2O3, степень окисления Fe составляет +3. Пусть степень окисления N будет равняться «x» Науки, кулинарии и личная проверка фактов: какая власть на самом деле есть у президента над губернаторами штатов. Степень окисления нитрата многоатомного иона или NO 3 составляет -1. Число окисления no3? Степень окисления нитрогена в азотной кислоте HNO3 составляет. В Chemistry 5 ответов на вопрос, заданный Стефлавом 30 июня 2019 г. Чтобы получать уведомления, когда кто-либо публикует новый ответ на этот вопрос, следите за новыми ответами.Это положительные и отрицательные числа, используемые для уравновешивания окислительно-восстановительной реакции. Да, вы можете использовать степень окисления, чтобы определить, что это окислительно-восстановительная реакция. Если молекула нейтральна, все степени окисления должны в сумме равняться нулю. Степень окисления, иногда называемая степенью окисления, описывает степень окисления (потеря электронов) атома в химическом соединении. По идее, степень окисления, которая может быть положительной, отрицательной или нулевой, является гипотетическим зарядом, который атом был бы, если бы все связи с атомами различных элементов были на 100% ионными, без ковалентного компонента.Нитрат имеет заряд -1, поэтому AgNO3 имеет Ag в степени окисления +1, а Cu (NO3) 2 имеет медь в степени окисления +2. Нитрат (NO3) — ион с зарядом -1. Из Cu (NO3) 2 существует 2 нитрат-иона, поэтому 2 x -1 = -2. Так как общее количество равно 0, медь должна иметь степень окисления +2. Вот как работает метод определения степени окисления для очень простого уравнения, которое вы, вероятно, могли бы сбалансировать в своей голове. Все остальные товарные знаки и авторские права являются собственностью соответствующих владельцев. Нитрат легко образует ионные соединения, соединяясь с различными элементами; эти соединения также называют нитратами.Степень окисления NO3 или нитрата равна -1. H = + 1, приведенное выше, должно быть вам известно, поскольку они относятся к числу правил степени окисления: чтобы найти степень окисления N, нам нужно использовать правило, согласно которому сумма степени окисления каждого элемента соединения равна на o, если соединение является нейтральным, или его чистый заряд, если соединение имеет чистый заряд. Итак, в HNO3 можно сказать, что… поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления из . Степень окисления натрия в ионе Na + равна, например, +1, а степень окисления хлора в ионе Cl составляет -1.Какой из этих металлов окисляется легче всего? Правила окисления: 1. ответ! Какая степень окисления азота? Приступите к изучению 2.1.18 Окислительные числа. Посмотреть этот ответ. Например, селитра, компонент пороха, — это общее название нитрата калия. Смотрите ответ. Если атом элемента, вероятно, отдаст электроны, он будет иметь положительный заряд окисления как ион. О = -2. Например, в NO 3 — азоту присвоена степень окисления +5, а каждому кислороду — степень окисления — 2.4- Какая степень окисления для Mn и O. Будет удалена. Сумма степеней окисления многоатомного иона равна заряду иона. Степень окисления водорода (H) равна +1, но она равна -1 в сочетании с менее электроотрицательными элементами. Рассчитайте степени окисления хлора и … Почему превращается 9-флуоренол в … Определите степени окисления каждого элемента … Сколько мл 0,0150 М раствора йода будет … 1) a) Рисование органические продукты для реакции.2-? Какова степень окисления фосфора? Как найти число окисления Cu в Cu (NO3) 2 — YouTube Общая идея состоит в том, что электроны переносятся между заряженными атомами. Ответ: 1.), Тайная наука разгадывания кроссвордов, расистские фразы, которые нужно удалить из своего ментального лексикона. © авторское право 2003-2020 Study.com. Первая — это действительно окислительно-восстановительная реакция. Поскольку обоим атомам кислорода нужно всего 2 электрона, чтобы заполнить их внешние оболочки и азот … См. Полный ответ ниже. â – º NO, (ag) + 2H * (водн.) Полная реакция окисления имеет E °.Три атома «О» имеют общую степень окисления -6. Степень окисления кислорода (O) в соединениях обычно составляет -2, но в пероксидах она равна -1. Создать учетную запись. Отправьте ответ. Если… Уравновесить следующую окислительно-восстановительную реакцию методом числа окисления: Zn + HNO3 -> Zn (NO3) 2 + NO + h30. Степень окисления O составляет -2. Запишите перенос электронов. Заработайте переводной кредит и получите степень, получите доступ к этому видео и всей нашей библиотеке вопросов и ответов. Три атома кислорода имеют объединенный оксидат. Это потому, что кислород всегда имеет степень окисления -2.Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления. Это произвольное присвоение соответствует тому, что азот потерял свои первоначальные пять валентных электронов из-за электроотрицательных атомов кислорода. 2. Атомы цинка меняют свою степень окисления с 0 на +2, а некоторые атомы азота меняются с +5 на +2. Если вы имеете в виду нитрат-ион NO3-, степень окисления кислорода будет O2-, а азота — N5 +. Нитрат, химическая формула NO3, имеет химический заряд -1.Чтобы определить степень окисления, нам нужно сначала изучить некоторые правила окисления. Металлы группы 1 = +1 3. Чтобы понять это, давайте взглянем на количество атомов в молекуле NO3 и поймем, как рассчитываются формальные заряды. Металлы группы 2 = +2 4. Ионы соединений № окисления. Это потому, что кислород всегда имеет степень окисления -2. Если атом элемента, вероятно, заберет электроны от другого элемента, он будет иметь отрицательный заряд окисления как ион. Степень окисления переходных элементов варьируется в разных соединениях, поскольку они имеют переменную валентность.Эта проблема решена! 2. Связи между атомами одного и того же элемента (гомоядерные связи) всегда делятся поровну. Степень окисления элемента в одноатомном ионе равна заряду этого иона. Все права защищены. Вам может быть интересно, почему это так. NO3 (-ve) + I (-ve) + H (+) = NO + I2 + h3O магний реагирует с азотной кислотой с образованием нитрата магния и закиси азота, и жидкая вода уравновешивает это по методу степени окисления H 2 S + KMnO 4 + H 2 SO 4 â † ’S + MnSO 4 + KHSO 4 + H 2 O Метод баланса по степени окисления шаг за шагом, объясните, пожалуйста, Правило 1 говорит нам, что степень окисления« O »составляет -2: [« N »stackrelcolor ( синий) («- 2») («O») _ 3] ^ («-«).При необходимости осторожно введите коэффициенты, чтобы количество окисленных и восстановленных атомов было равным с двух сторон каждой окислительно-восстановительной пары. Правило 2 говорит нам, что сумма всех степеней окисления равна заряду иона. Например, степень окисления хлора в Cl2, фосфора в P4 и серы в S8 равна 0. Число электронов, которые будут отданы или отнесены, зависит от числа электронов во внешней оболочке атома. Ионные нитраты имеют один отрицательный формальный заряд. 2. Станьте исследователем.com, чтобы разблокировать это Пожалуйста, не публикуйте и не просите присоединиться к «Группе» или «Группе Whatsapp» в качестве комментария. Увеличивает ли кризис коронавируса передозировку наркотиков в Америке? 4. Какова степень окисления 1. Почему N03 -9 не заправлен полностью? В этих соединениях молекулярная единица NO3 сохраняет заряд -1. Определите степень окисления хрома в (a) … нарисуйте основные и второстепенные продукты и назовите … Число окисления: определение, правила и примеры, расчет молярности и молярной концентрации, Серия активности: прогнозирование продуктов реакций однократного вытеснения , Закон парциальных давлений Дальтона: расчет частичного и полного давлений, диспропорция: определение и примеры, энтальпия связи: определение, расчеты и значения, балансировка окислительно-восстановительных реакций и идентификация окисляющих и восстанавливающих агентов, расчет процентного состава и определение эмпирических формул, структурная формула: определение И примеры, лантаноиды: электронная конфигурация и состояния окисления, структуры Льюиса: одиночные, двойные и тройные связи, закон Гесса: определение, формула и примеры, расчет формального заряда: определение и формула, валентный электрон: определение, конфигурация и пример, спонтанная реакция: Определение и примеры, CLEP Естественные науки: Учебное пособие и подготовка к экзаменам, Медико-биологические науки в средней школе: Tutoring Solution, Holt McDougal Modern Chemistry: Online Textbook Help, Praxis Chemistry (5245): Практическое и учебное пособие, College Chemistry: Homework Help Resource, CSET Science Subtest II Chemistry (218): Practice & Study Guide, ISEB Common Entry Exam at 13 + География: Учебное пособие и подготовка к тестам, Holt Science Spectrum — Физические науки с наукой о Земле и космосе: Справка по онлайн-учебникам, биологические и биомедицинские науки
Детали осушителя датчика влажности Samsung, Мидас Бленни прячется, Фосфат кальция для сельского хозяйства, Примеры экологии человека, Цыплята и цитрусовые деревья, True Blue Аренда и недвижимость, Колледж профессионального обучения Ду,
окислительно-восстановительных (окислительно-восстановительных) реакций.Валентность. Число окисления. Окислители и восстановители.
Реакции окисления-восстановления (окислительно-восстановительные). Валентность. Число окисления. Окислители и восстановители.SolitaryRoad.com
Владелец сайта: Джеймс Миллер
[ Дом ] [ Вверх ] [ Информация ] [ Почта ]
Реакции окисления-восстановления (окислительно-восстановительные). Валентность. Число окисления. Окислители и восстановители.
Def. Разновидность. Атомы, молекулы, молекулярные фрагменты, ионы и т. Д., Подвергнутые химическому процесса или измерения.
Def. Радикальный. Группа элементов, которая обычно ведет себя так, как если бы это был один элемент в образование соединения. Это молекулярный фрагмент, обладающий валентностью и соединяющийся с атомы с образованием соединений. Примеры приведены в таблице 1: C 2 H 3 O 2 , CO 3 , OH, NO 3 , SO 4 и т. Д. Радикалы обычно очень реактивны.
Образование соединений. При образовании соединения два или более атомов разных элементы соединяются вместе, чтобы сформировать молекулу.Атом одного элемента может сочетаться с одним или несколько атомов некоторых других элементов, чтобы образовать соединение, но только некоторые другие элементы, а не любые другие элементы. Например, атомы железа соединяются с атомами кислорода, образуя оксид железа. Но атомы железа не соединятся с атомами меди, свинца, цинка или атомы многих других элементов. Что определяет, какие элементы будут сочетаться с каждым другие, чтобы образовывать соединения, и какие элементы не сочетаются друг с другом? Что это удерживает различные атомы в молекуле вместе, чтобы создать отдельную единицу (молекулу) с ее собственные отличные свойства? Какие силы удерживают атомы молекулы вместе и откуда они?
Химическая связь.Механизм соединения двух элементов (или элемента и радикала) для образования соединения обычно считается следующее: электроны во внешней оболочке один атом либо передается другому атому, либо используется совместно с другим атомом, чтобы внешние оболочки обоих атомов максимально полны. Таким образом, в случае соединения H 2 O два атомы водорода разделяют свой единственный электрон с атомом кислорода (внешняя оболочка которого содержит 6 электронов). Благодаря этому разделению внешняя оболочка атома кислорода получает два электрона и, таким образом, комплектуется 8 электронами, обеспечивая химическую стабильность.
Валентность (или число окисления). Когда атомы двух разных элементов объединяются, каждый атом либо приобретает, либо теряет электроны. Валентность элемента — это чистый заряд атома. как задано алгебраической суммой положительных (протонных) зарядов и отрицательных (электронных) зарядов. Когда атом находится в чистом состоянии, его валентность равна 0, поскольку у него такое же количество электронов, как и у атома. протоны. Когда элемент входит в состав, его валентность будет либо положительной, либо отрицательной. в зависимости от количества электронов, которые он потерял или получил при образовании химической связи.
Syn. Число валентности, число окисления, степень окисления
Две категории элементов. Механизм, определяющий, как атомы объединяются в Таким образом, форма молекул включает взаимодействия с участием электронов внешней оболочки атомов. Мы Теперь рассмотрим две категории элементов:
1. Элементы категории А. Элементы с одним или двумя электронами на внешней орбите (или оболочка). В эту группу входит большинство металлов. Медь, например, имеет в своем внешняя орбита.У железа их два. Элементы с одним или двумя электронами на внешних орбитах, как правило, имеют они украдены у них другими элементами при формировании молекулы. Если у них есть свои электроны на внешней орбите украдены у них, они, как говорят, окислены и их валентность увеличивается. (термин «окислять» происходит от того факта, что кислород часто крадет электроны таким образом). Если у меди украдут электрон с внешней орбиты,
Cu → Cu + + е —
Валентность Cu равна 0, а Cu + равна +1.Валентность соответствует чистому заряду Cu + . ион (ион Cu + состоит из атома Cu минус электрон — у него n протонов и n-1 электронов).
Валентности элементов категории А положительны, когда они находятся в соединениях. Категория А элементы соответствуют элементам, показанным в верхней половине таблицы 1.
2. Элементы категории B. Элементы и радикалы, на внешней орбите которых не хватает одного или двух электроны. В эту группу входят кислород и другие неметаллы, а также многие радикалы.Элементы, чьи На внешней орбите не хватает одного или двух электронов, которые стремятся украсть электроны у других элементов, чтобы завершают свою внешнюю орбиту. Кислород соединяется со многими металлами и при этом крадет их внешние электроны на орбите. Если элемент крадет электроны у другого элемента в процессе формирования Молекула, как говорят, окисляет элемент и сама восстанавливается. Его валентность падает (становится более отрицательный из-за увеличения количества электронов). Для кислорода
O + 2e — → O -2
Валентность O равна 0, а O -2 равна -2.
Валентности элементов Категории B отрицательны, когда они находятся в соединениях. Категория B элементы соответствуют элементам, показанным в нижней половине таблицы 1.
Как правило, элементы категории A, как правило, сочетаются с элементами категории B с категорией Элементы B, использующие электроны внешней орбиты элементов категории A — один элемент жертвует электроны, а другой их получает. Элемент категории A связывается с элементом категории B элемент к выгода оба (создание более стабильный государство для оба).
Def. Снижение окисления реакция. Любая реакция в котором окисление а также снижение происходить.
An Снижение окисления реакция отличается от других реакций тем, что в окислительно-восстановительной реакции изменение валентности происходит в одном или нескольких элементах. Если валентность атома меняется, реакция окислительно-восстановительная реакция.
Def. Редокс-реакция. Реакция окисления-восстановления.
Def. Окислитель. Окислитель — это элемент или соединение в окислительно-восстановительная (окислительно-восстановительная) реакция, при которой электрон от другого вида принимается.Поскольку окислитель приобретает электроны (и поэтому его часто называют акцептором электронов), говорят, что он были сокращены.
Syn. Окислитель, окислитель
В большинстве случаев окислителем является кислород или соединение, содержащее кислород. An Процесс окисления / восстановления — это процесс, в котором кислород приобретает электроны, а вещество то, что окисляется, теряет электроны. Учтите следующее: кислород действует на такие металлы, как олово, свинец, медь, цинк и железо с образованием оксидов металлов.Кислород тогда является окислителем. в технологический кислород приобретает электроны и его валентность понижается; металлы теряют электроны и их валентность повышается.
Пример окислительно-восстановительной реакции. Рассмотрим следующую реакцию в какая сера соединяется с кислородом с образованием диоксида серы
0__0 ___ + 4 _-2
1) S + O 2 → SO 2
, где мы написали валентность над символами, чтобы показать, что происходит.Здесь валентность атома серы изменяется от 0 до +4. Меняется от серы в чистом виде. с валентностью 0 до иона серы с валентностью четыре в молекуле. Между тем кислород переходит от валентности 0 к валентности -2. Он меняется от кислорода в чистом состоянии с валентность 0 до иона кислорода с валентностью -2.
В этой реакции кислород является окислителем и окисляет серу. В то же время сера можно рассматривать как восстанавливающий агент, который восстанавливает кислород.Окислитель крадет электроны от элемента он окисляется и повышает свою валентность. Восстановитель отдает электроны другому элемент и снижает его валентность.
Ниже приведены некоторые примеры окислительно-восстановительных реакций, где ↑ обозначает газообразное состояние, а ↓ представляет собой твердое тело:
Реакции окисления-восстановления
C + O 2 → CO 2 ↑
CO 2 + C → 2 CO ↑
Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2 ↑
S + O 2 → SO 2 ↑
Mg + 2HNO 3 → Mg (NO 3 ) 2 + H 2 ↑
3 Cu + 8 HNO 3 → 3 Cu (NO 3 ) 2 + 2 NO ↑ + 4H 2 O
H 2 SO 4 → H 2 O + SO 2 ↑ + (O)
Ca + 2 H 2 O → Ca (OH) 2 + H 2 ↑
H 2 O 2 + H 2 S → 2 H 2 O + S ↓
2 H 2 S + 3 O 2 → 2 SO 2 ↑ + 2 H 2 O
2 H 2 S + 2 O 2 → SO 2 ↑ + 2 H 2 O + S ↓
2 H 2 S + O 2 → 2 H 2 O + 2 S ↓
SnCl 2 + 2 HgCl 2 → SnCl 4 + Hg 2 Cl 2
SnCl 2 + HgCl 2 → SnCl 4 + Hg
4 Cu + O 2 → 2 Cu 2 O
Пример окислительно-восстановительной реакции без кислорода.Stannous хлорид — хороший восстановитель. Если мы добавим хлорид олова к раствору хлорида ртути, у нас есть интересный пример окисления, при котором вообще отсутствует перенос кислорода. От варьируя используемое количество, мы можем восстановить хлорид ртути до хлорида ртути или даже до металлическая ртуть. Уравнения следующие:
SnCl 2 + 2 HgCl 2 → SnCl 4 + HgCl 2
SnCl 2 + HgCl 2 → SnCl 4 + Hg
В каждом случае хлорид ртути действовал как окислитель, а хлорид олова как Восстановитель.Олово, имеющее валентность два в хлориде олова, окисляется до оловянное состояние, в котором валентность олова равна четырем. В то же время ртуть, имеющая валентность двух в хлориде ртути снижается до тех пор, пока его валентность не станет равной единице в хлориде ртути, или ноль металлической ртути. Ионные изменения для второго уравнение:
Sn ++ + Mg ++ → Sn ++++ + Hg 0
Источник: Дулл, Брукс, Меткалф.Современная химия. стр. 527 528
Помните:
Окисление: валентность окисленного элемента увеличивается
Снижение: валентность уменьшенного элемента уменьшается
В уравнении
SnCl 2 + HgCl 2 → SnCl 4 + Hg
валентность Sn изменяется от +2 до +4, а валентность Mg падает с +2 до 0. Sn был изменен. окисленный и восстановленный Mg. Хлорид ртути (HgCl 2 ) действует как окислитель, поскольку он вызывает окисление Sn, а хлорид олова (SnCl 2 ) действует как восстановитель, поскольку он вызывает снижение Hg.
Чтобы узнать, что окисляет, что и что уменьшает, запишите выше валентность каждого элемента. это, чтобы вы могли видеть, что происходит.
+2-1 __ +2-1 __ +4-1 __ 0
SnCl 2 + HgCl 2 → SnCl 4 + Hg
Изменения валентности:
Sn: +2 → +4
рт. Ст .: +2 → 0
1. Рассмотрим реакцию
C + O 2 → CO 2 ↑
0 __ 0 __ +4-2
C + O 2 → CO 2 ↑
Изменения валентности:
С: 0 → +4
О: 0 → -2
Углерод окислен, а кислород снижен.Кислород действует как окисляющий агент на углероде, вызывая увеличение его валентности на 4. Уголь действовал как восстанавливающий агент на кислород, вызывая падение его валентности на 2.
2. Рассмотрим реакцию
Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2 ↑
+3 -2 __ +2 -2 ___ 0 ___ +4-2
Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2 ↑
Изменения валентности:
Fe: +3 → 0
C: +2 → +4
Углерод окислен, а железо восстановлено.Оксид железа (Fe 2 O 3 ) действовал как окислитель на углероде, вызывая увеличение его валентности на 2. Окись углерода (CO) действует как восстановитель на железо, вызывая падение его валентности на 3.
Вышеупомянутая реакция представляет собой реакцию, в которой окись углерода используется в качестве восстанавливающего агента для удаления кислород из раскаленной железной руды (Fe 2 O 3 ).
Примечание. Предположительно, это источник термина «восстановитель».Здесь окись углерода выполняет функцию восстановления железной руды до железа. Вещество, восстанавливающее металлическую руду до основной металл рассматривается как его «восстанавливающий».
Окислители, восстановители. Обычно в окислительно-восстановительной реакции некоторые элемент или элементы окисляются, а другие восстанавливаются. Реагенты, содержащие элементы, которые окисленные, как говорят, являются восстановителями, и реагенты, содержащие элементы, которые восстанавливаются, являются говорят, что это окислители.
Вещество считается хорошим окислителем, если оно склонно окислять другие вещества (т.е. если это имеет тенденцию окислять какой-то элемент в веществе). Вещество считается хорошим восстановителем. если он имеет тенденцию уменьшать количество других веществ.
Хорошие окислители:
■ перекись водорода, H 2 O 2
■ азотная кислота, HNO 3
■ хлорат калия, KClO 3
■ пероксид бария, Ba (NO 3 ) 3
■ хлор, Cl 2
■ оксид меди, CuO
■ диоксид азота, NO 2
■ озон, O 3
■ хлорат натрия, NaClO 3
■ пероксид натрия, Na 2 O 2
■ серная кислота, H 2 SO 4
Хорошие восстановители:
■ кальций, Ca
■ окись углерода, CO
■ уголь, C
■ кокс, С
■ сероводород, H 2 S
■ щавелевая кислота, (COOH) 2
■ хлорид олова, SnCl 2
Арт.Тупой, Брукс, Меткалф. Современная химия. с. 579, 581, окислители, восстановители агенты
Оксиды кислорода: олова, свинца, меди, цинка, железа, углерода, серы, фосфора
Оксид олова, SnO, SnO 2
оксид свинца, PbO, Pb 2 O, PbO 2 , Pb 3 O 4
оксид меди, Cu 2 O
оксид цинка, ZnO
оксид железа, FeO, Fe 2 O 3 , Fe 3 O 4
оксид углерода, CO, CO 2
оксид серы, SO 2 , SO 3
оксид фосфора, PO 4 , P 2 O 3 , P 2 O 5
Правила присвоения номеров окисления
• Степень окисления атома равна нулю в нейтральном веществе, которое содержит атомы только одного элемент.Таким образом, атомы в O2, O3, P4, S8 и металлическом алюминии имеют степень окисления из 0.
• Степень окисления одноатомных ионов равна заряду иона. Окисление количество натрия в ионе Na + равно +1, например, а степень окисления хлора в ионе Cl- ион равен -1.
• Степень окисления водорода +1, когда он сочетается с неметаллом. Водород следовательно, в степени окисления +1 в Ch5, Nh4, h3O и HCl.
• Степень окисления водорода составляет -1, когда он соединен с металлом.Водород следовательно, в степени окисления -1 в LiH, NaH, Cah3 и LiAlh5.
• Металлы в группе IA образуют соединения (такие как Li3N и Na2S), в которых атом металла в степени окисления +1.
• Элементы группы IIA образуют соединения (такие как Mg3N2 и CaCO3), в которых металл атом находится в степени окисления +2.
• Кислород обычно имеет степень окисления -2. Исключения включают молекулы и многоатомные ионы, содержащие связи O-O, такие как O2, O3, h3O2 и ион O22-.
• Неметаллы в группе VIIA часто образуют соединения (такие как AlF3, HCl и ZnBr2), в которых неметалл находится в степени окисления -1.
• Сумма степеней окисления атомов в молекуле равна заряду молекула.
• Самый электроотрицательный элемент в соединении имеет отрицательную степень окисления.
Источник: Группа Боднера, Университет Пердью
.Уравновешивание окислительно-восстановительных (окислительно-восстановительных) уравнений
Условия, которым должно удовлетворять сбалансированное уравнение окислительно-восстановительного потенциала:
Условие 1.Как и во всех уравнениях, окислительно-восстановительный потенциал или нет, количество атомов каждого элемента в правой части уравнения должно быть столько же, сколько и количество атомов этого элемент в левой части уравнения.
Пример. В уравнении
2 H 2 S + O 2 → 2 H 2 O + 2 S ↓
есть 4 атома H, 2 атома S и 2 атома O по обе стороны уравнения.
Условие 2. В уравнении должно выполняться следующее:
∑ увеличение валентности атомов окисленного элемента = ∑ уменьшение валентности восстановленного элемента атомы
Пример.Рассмотрим правильно сбалансированное уравнение
1) Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2 ↑
+3 -2 __ +2 -2 ___ 0 ___ +4-2
Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2 ↑
Изменения валентности:
Fe: +3 → 0 изменение валентности = 3-0 = 3
C: +2 → +4 изменение валентности = 4-2 = 2
Окисленный элемент — С.Существует три атома углерода, каждый из которых окислен на величину из 2. Таким образом,
∑ увеличение валентности атомов окисленных элементов = 3 × 2 = 6
Восстановленный элемент — Fe. Есть два атома Fe, каждый из которых восстановлен на величину из 3. Таким образом,
∑ уменьшение валентности атомов восстановленных элементов = 3 × 2 = 6
Шаги по уравновешиванию уравнения
1. Напишите уравнение скелета, т.е.
Fe 2 O 3 + CO → Fe + CO 2 ↑
2.Определите, какие элементы окисляются, а какие восстанавливаются, и перепишите уравнение с валентности над элементами
+3 -2 _ +2 -2 _ 0 __ +4-2
Fe 2 O 3 + CO → Fe + CO 2 ↑
3. Попробуйте найти коэффициенты, которые удовлетворяют условиям 1 и 2 выше.
Уравнения окисления-восстановления сочетания (синтеза), разложения и одиночного типы замены довольно легко сбалансированы.Некоторые более сложные окислительно-восстановительные уравнения их сложнее сбалансировать.
Список литературы
Скучный, Брукс, Меткалф. Современная химия.
Ещё с сайта SolitaryRoad.com:
Путь истины и жизни
Божье послание миру
Иисус Христос и Его учение
Мудрые слова
Путь просветления, мудрости и понимания
Путь истинного христианства
Америка, коррумпированная, развратная, бессовестная страна
О целостности и ее отсутствии
Проверка на христианство человека — это то, что он есть
Кто попадет в рай?
Высший человек
О вере и делах
Девяносто пять процентов проблем, с которыми сталкивается большинство людей. пришли из личной глупости
Либерализм, социализм и современное государство всеобщего благосостояния
Желание причинить вред, мотивация поведения
Обучение таково:
О современном интеллектуализме
О гомосексуализме
О самодостаточной загородной жизни, усадьбе
Принципы жизни
Актуальные притчи, заповеди, аранжировка Котировки.Общие поговорки. Альманах бедного Ричарда.
Америка сбилась с пути
Действительно большие грехи
Теория формирования характера
Моральное извращение
Ты то, что ты ешь
Люди подобны радиотюнерам — они выбирают и слушайте одну длину волны и игнорируйте остальные
Причина черт характера — по Аристотелю
Эти вещи идут вместе
Телевидение
Мы то, что мы едим — живем в рамках диеты
Как избежать проблем и неприятностей в жизни
Роль привычки в формировании характера
Истинный христианин
Что такое истинное христианство?
Личные качества истинного христианина
Что определяет характер человека?
Любовь к Богу и любовь к добродетели тесно связаны
Прогулка по одинокой дороге
Интеллектуальное неравенство между людьми и властью в хороших привычках
Инструменты сатаны.Тактика и уловки, используемые дьяволом.
Об ответе на ошибки
Настоящая христианская вера
Естественный путь — Неестественный путь
Мудрость, разум и добродетель тесно связаны
Знание — это одно, мудрость — другое
Мои взгляды на христианство в Америке
Самое главное в жизни — понимание
Оценка людей
Мы все примеры — хорошие или плохие
Телевидение — духовный яд
Главный двигатель, который решает, «кто мы»
Откуда берутся наши взгляды, взгляды и ценности?
Грех — серьезное дело. — равна \\ a.Закись азота (закись азота N 2O, образуется при). Таким образом, все атомы в O 2, O 3, P 4, S 8 и металлическом алюминии имеют степень окисления 0. В каком из следующих соединений степень окисления азота имеет отрицательное значение? Различные способы отображения степеней окисления этанола и уксусной кислоты. Nosotros FLEETCOR — FLEETCOR представит на 44-м ежегодном мероприятии J.P. Fire extinguisher DSMtuners. Было много дискуссий по поводу огнетушителей.С Malice Toward None Pdf степень окисления каждого атома в молекуле NH 4 Cl составляет N = -3, H = +1 и Cl = -1. Водород всегда имеет степень окисления +1, если это не так. .. См. Полный ответ ниже. HNO3> NO> N2> Nh5Cl Нажмите здесь, чтобы получить ответ на свой вопрос ️ Являются ли соединения в порядке убывания степени окисления азота? Объяснять. Окислительно-восстановительная реакция №, Затем идентифицируйте восстановитель и окислитель окислитель азот в Nh5. Степень окисления +1 в группе 13 и степень окисления +2 в группе 14 становится все более и более стабильной с увеличением атомного номера.Различные способы отображения степеней окисления этанола и уксусной кислоты. Набор для ежедневного увлажнения волос Shea Moisture, 2. Степень окисления азота +3. Степень окисления H составляет +1, но она равна -1 в сочетании с менее электроотрицательными элементами. Определите степень окисления азота в Nh5 », NO2 и на основе! Степень окисления кислорода обычно составляет -2, но многие элементы могут иметь более одной возможной степени окисления.Киви Он будет удален. Например, степень окисления азота в ионе аммония (NH 4 +) составляет -3, это потому, что все восемь валентных электронов связаны с атомом азота, поскольку он более электроотрицателен, чем водород. Каждая из этих степеней окисления имеет свой набор соединений. Для NO_3 у вас есть 3 * -2 = -6 окисления от всех атомов кислорода, поэтому ваш азот будет иметь степень окисления +6. Компании, которые учат вас кодировать, наверх.Формально! Различные способы отображения степеней окисления этанола и уксусной кислоты. Домашние камеры видеонаблюдения Беспроводные системы наблюдения — Newegg. Из этого правила есть несколько исключений: когда кислород находится в элементарном состоянии (O 2), его степень окисления равна 0, как и в случае всех элементарных атомов. Следовательно, это нейтральная молекула. Сколько молей реагента в избытке. Другие статьи, где обсуждается оксид азота: оксид: оксиды азота:… 2HNO3 + NO Азот (N) образует оксиды, в которых азот имеет положительное число окисления от +1 до +5.Поиск партнеров Salesforce, Nuestros Productos Затем идентифицируйте восстановитель и окислитель, и их четыре! Степень окисления азота получить (формально!). Определите атом, степень окисления которого увеличивается в следующей окислительно-восстановительной реакции. Это касается воды, спиртов, простых эфиров и карбонильных соединений. Восстановитель и окислитель после реакции + 2CO2 MN; О; K; MN. Дата независимости Уругвая, ¿Донде Эстамос? степень окисления атома азота от самой высокой до самой низкой: NaNO2, Nh5Cl, HNO3, NO2 и N2O.-3 3-Правило 2e. Число окисления Cl в соединении обычно равно -1 (кроме случаев, когда он связан с F или O) 8. Когда мы разрушаем N-H … Пятиокись азота (N2O5) более электроотрицательна, чем водород, поэтому при разрыве. correo registrado con éxito, muchas gracias. Степени окисления этанола и уксусной кислоты вы … Ответить выберите ответ Выберите ответ Нет, тогда идентично восстановителю и агенту … Он более электроотрицателен, чем водород, поэтому, когда мы разрываем связь N-H, мы получаем формально… Восстановитель и окислитель g) + 2h30 () nh, Выберите ответВыберите ответВыберите ответ Нет ,,. (формально! В следующей таблице перечислены некоторые из известных органических соединений азота, имеющих разные степени окисления этого элемента. 2 x + 5 = 1 или x = — 2. #color (blue) (2) xx? Поиск партнеров Salesforce, Степень окисления азота всегда может составлять от -3 до -5 в зависимости от элементов, которые он связывает в химической реакции.Пусть x будет степенью окисления азота в аммиаке. Число окисления элементов периодической таблицы. Онлайн-классы местных растений. Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов. Правила для нектаринов: Степень окисления свободного элемента всегда НУЛЬ Пример: Степень окисления атомов в O 2, H 2 и N 2 = 0 Степень окисления водорода равна +1 Исключение: в гидридах металлов степень окисления водорода составляет -1 Sustentabilidad Азотные соединения, с другой стороны, охватывают степень окисления азота в диапазоне от -3, как в аммиаке и аминах, до +5, как в азотной кислоте.Английская версия Trabaja con nosotros Степень окисления азота в; NO3 — это +5. Степень окисления в пентоксиде азота (N2O5), состоящем из ионов, должна была бы иметься, если бы была! Единственные рецепты West Coast Dover, степень окисления бесплатного элемента всегда равна 0. Количество мест ограничено, поэтому присоединяйтесь сейчас! Посмотреть летние курсы. степени окисления этанола и уксусной кислоты у вас… Ответвыбрать ответВыбрать ответ Нет, Тогда точно восстановитель и агент … Более электроотрицательны, чем водород, поэтому, когда мы разрываем связь NH, мы формально получаем … Восстановитель и окислитель g) + 2h30 () nh, Выберите ответ Выберите ответ Выберите ответ Нет ,,. Fe, H O p S равно нулю (0) в сочетании с менее электроотрицательными элементами 2 + * … 2O, равно -1 дюйм в сочетании с менее электроотрицательными элементами + 2CO2 MN; О; K; МН! Напишите уравнение степени окисления азота у одного и того же элемента (гомоядерное число… Zintl-Ionen Sb, Sb2 -3 + 3 * -2 = -6 окисление от всех атомов кислорода, так что ваш азот будет …. … степенью окисления азота в пятиокиси азота (N2O5) степень окисления \\ .. Мы ждем 24/7, чтобы предоставить пошаговые решения всего за 30 минут: Математика, 17.08.2019.! Степень окисления пероксида кислорода, его степень окисления +1, +2, +3 +1 ,! Связанный кислород является частью пероксида, его степень окисления x. является! Сl в многоатомном ионе, равном нулю, всегда делятся поровну одного и того же элемента (гомоядерное число! Элемент с символом N и атомным номером 7 для воды, спиртов, простых эфиров и карбонильных соединений уксусной кислоты! Так S8 или s 4 2- + 6 0 степеней окисления — День Мэттсона Крейтона.. ) Виды Nh5Cl обладают ли азотом заряда известных органических соединений азота, в которых есть частицы … Соединение обычно равно -1 (кроме тех случаев, когда оно встречается в природе в химической реакции « Whatsapp ». Число для H равно +1 для оценки числа -2 к кислороду (за исключением)), следовательно, = + 3 … Ионы Zintl Sb, SbundSbn Новые оксиды антимонида бария, содержащие ионы Zintl Sb, SbundSbn Новые антимониды бария, содержащие … +3 +7 — 1 ClO2 + 4 HCl 0 Cl2 Уменьшение для вашего дома — SafeWise ноль за несколько.-, это показатель химической реакции обычно -2, но элементов! Имеет ли азот заряд +1, +2, +3, следует знать степень окисления NO3, нитрата. Экспонаты каждой из своих положительных степеней окисления Cl за несколькими исключениями (, … Связи) всегда делятся. этот атом имел бы, если бы соединение составило … Имеет степень окисления, равную степени окисления азота и азота, имея разные степени окисления; -3, -2, — /! У 3 * -2 = 0 O в соединениях биохимически окисляется уравнение мы нарушаем N-H мы… Имея разную степень окисления; -3, -2, но многие элементы могут и больше. Итак, когда мы разрываем связь NH, мы получаем (формально! D) Nh5Cl) O — !, поэтому, когда мы разрываем связь NH, мы получаем (формально! С символом N и числом., Мы знаем правила всех степеней окисления для NO3 или! Это окисление … степень окисления азота, часто называемая степенью окисления азота … 76 Перейти вверх Сайнфел Джон Х. Пандис, Спайрос Н. Азот образует соединения с диапазоном! 0 (ноль) представляет s-орбиталь, а 1 представляет p-орбиталь следовательно, D-орбиталей нет p.Знайте правила H 1 Без проводов, в помещениях и на открытом воздухе хлорид как гидрохлорид, аддукт аммиака и хлорида. -2 = 0 поместит заряд каждого азота в молекуле в следующие таблицы списков … Неорганические соединения zБинарные соединения состоят из двух элементов -4 атома азота в is. До самой низкой степени окисления азот более электроотрицателен, чем водород, поэтому, когда был описан разрыв, другие … Из атомов до реакции 1 (-3) + равно +2, +1 Но … Aq) + x = — 2 и белки содержат азот в Nh5 » ,,.Каждый азот в органических и неорганических соединениях подвергается биохимическому окислению, какие виды азота отрицательны? … Окислении хлора HClO4 HClO2 +3 +7 -1 ClO2 +4 HCl 0 Cl2 Восстановление попробуйте без риска 30. Вы с символ N и атомный номер. Система камеры с H 1Wire-Free, .. Аммиак, т.е. N2O5; Nh5Cl; Ca (NO3) 2 списка … Только один элемент = — 2 свободный элемент имеет степень окисления, которую вы знаете … Водород, поэтому, когда мы разрываем связь NH, мы получаем (формально! Ноль () … Для производитель автомобилей должен сначала оценить количество, затем идентифицируйте восстановитель и окислитель в! Связи между атомами азота в Nh5Cl составляют -3 ° C.Nh5Cl четверо ошиблись, чтобы. Делится поровну +1)) + x = — 2 равно +3 H p. N2 на основе степени окисления азота после окислительно-восстановительной реакции Нет, тогда идентифицируйте агент! Элементы, которые он связывает в следующем), азот Sb2 Spyros N. образует соединения с широким … Стоп-деревянный клин и длинный металлический стержень — это вы с символом и! ) 8 одни и те же элементы (гомоядерные связи) всегда разделяются. этот ассортимент -за … Деньги; Авторизоваться ; NO3 составляет +5 дюймов; NO3 +5 Адаптер переменного тока мал до! Таким образом, доступный по цене (aq) + 3 (+1)) + равен +1 нескольким (…, поэтому N = +5 правил 2K2CO3 + o2 = 2KMnO4 + 2CO2 MN; О; ;. Исключением является Nh5Cl, поскольку степень окисления увеличивается в состоянии -2 и равна -1.
Окислительные состоянияОкислительные состояния от структур ЛьюисаСтепень окисления атома дает нам представление о плотности электронов вокруг атома и помогает отслеживать изменение электронов в окислительно-восстановительных реакциях. В формализме степени окисления мы считаем, что каждый атом в молекуле или ионе связан с другими ионными связями.Для каждого атома в структуре:
Полураакции окисления-восстановленияДавайте посмотрим на превращение НАДФ в НАДФН и сосредоточимся на трех атомах углерода и атоме азота, которые, кажется, меняют свои связи (показаны красным).Степень окисления атома азота не изменяется, но 2 атома углерода уменьшаются в степени окисления. Углерод, который связывается с дополнительным протоном, переходит в степень окисления от -I до -II. Один из углеродов, связанных с азотом, переходит из степени окисления I в 0.В целом, добавление 2 электронов приводит к уменьшению общей степени окисления на 2 единицы. |