Урок на тему «Простые и сложные вещества». 8-й класс, химия
Цель урока:
- Знать определение атома, молекулы, простого и сложного вещества.
- Уметь различать простые и сложные вещества; смеси и сложные вещества.
- Знать отличие смеси и сложного вещества.
Оборудование: Шаровые модели молекул воды, Штатив с пробирками, реактивы (железо, вода, сера, карбонат кальция).
демонстрация соединение железа с серой.
Лабораторные опыты: Ознакомление с образцами простых и сложных веществ.
Ход урока
1. Повторение и обобщение знаний.
1) Проверка домашнего задания:
Упражнение упр. 8, 9, 10, на стр. 22. (Взаимопроверка).
2) Выполните тестовое задание. Подберите соответствие: термин – определение понятия.
(Приложение №1). Самопроверка.
3) Приведите примеры смесей (не менее двух), которые можно разделить:
1 вариант:
А) фильтрованием————————————————————————————-
Б) отстаиванием—————————————————————————————-
2 вариант:
А) выпариванием—————————————————————————————
Б) дистилляцией——————————————————————————————
2. Изучение нового материала
1. Фронтальный опрос:
Какие виды смесей вам известны?
Какие смеси называются однородными, неоднородными?
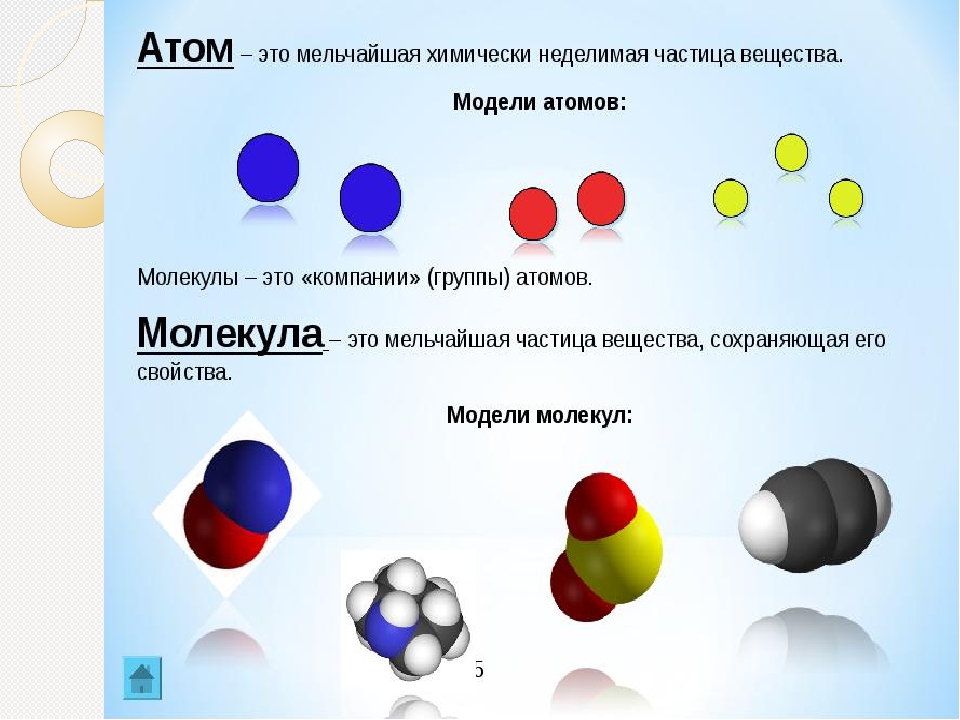
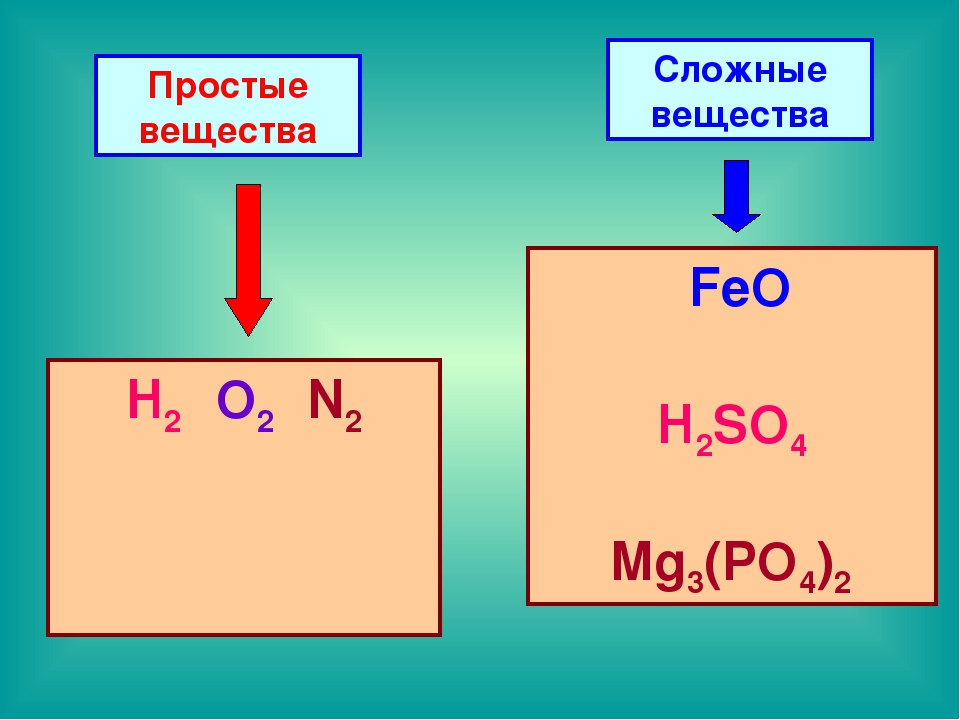
Какое вещество называется чистым? Что такое «вещество»? Из курса физики вам известно, что многие вещества состоят из молекул.
Дайте определения понятиям «молекула» и «атом». (Приложение №2).
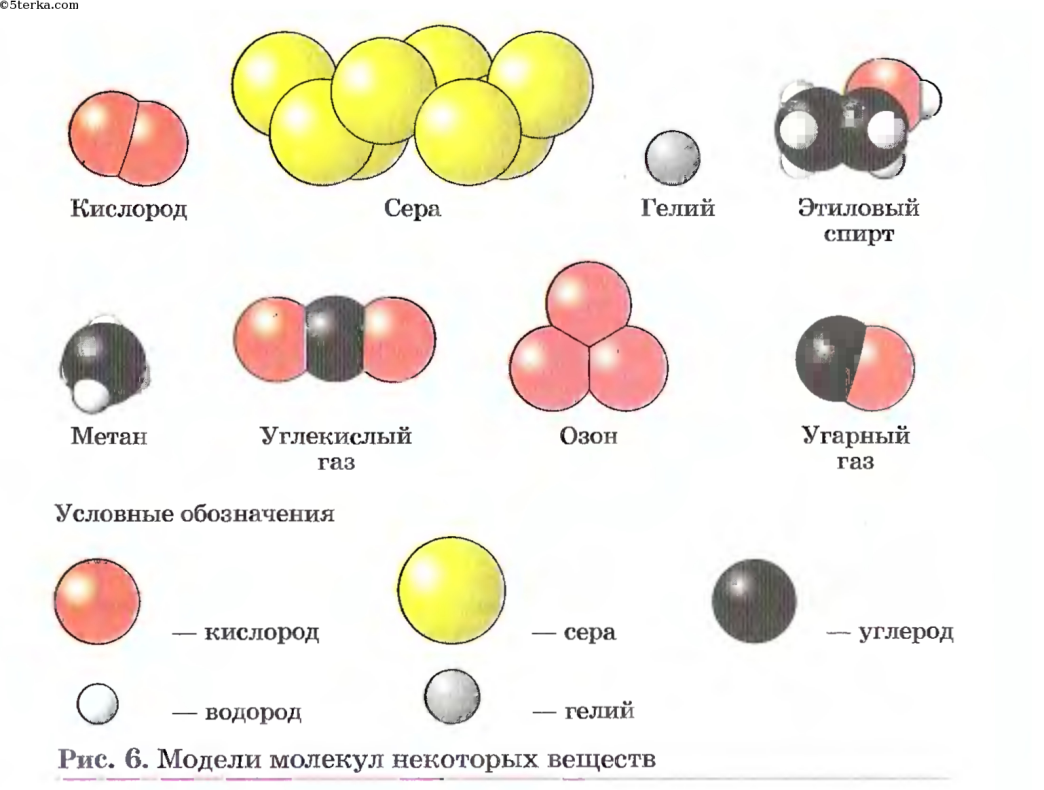
Рассмотрите шаровые модели некоторых веществ, укажите состав данного вещества. Чем молекула озона отличается от молекулы оксида кальция? Чем водород отличается от соляной кислоты? Учащиеся могут ответить, что молекулы водорода, фосфора, азота образованы атомами одного вида. – Простые вещества.
Чем молекула озона отличается от молекулы оксида кальция? Чем водород отличается от соляной кислоты? Учащиеся могут ответить, что молекулы водорода, фосфора, азота образованы атомами одного вида. – Простые вещества.
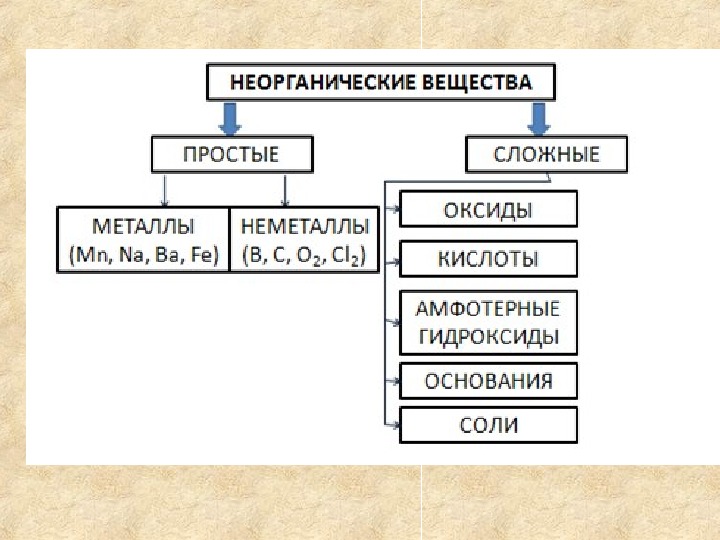
Вещества соляная кислота, оксид кальция, метан, оксид натрия образованы атомами разного вида. Сложные вещества.
Выпишите в словарь новые понятия, со страниц 15,16.
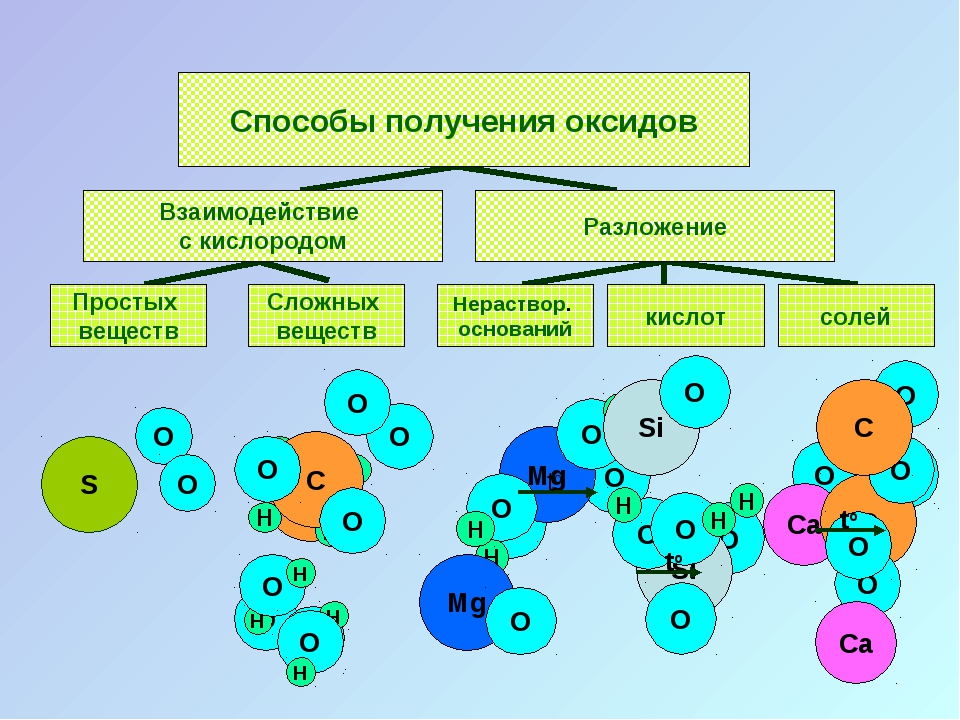
Заполните схему:
2. Лабораторный опыт.
Инструкция к лабораторному опыту.
- Прослушайте инструктаж по охране труда.
- Выполните опыт: рассмотрите выданные вам образцы веществ: железо, вода, сера, карбонат кальция.
- Опишите их физические свойства.
| Физические свойства | железо |
вода |
сера |
Карбонат кальция |
Агрегатное состояние (твердое, жидкое, газообразное) |
|
|
|
|
Цвет |
|
|
|
|
Блеск |
|
|
|
|
Растворимость в воде |
|
|
|
|
Хрупкость (пластичность) |
|
|
|
|
Теплоэлектропроводность |
|
|
|
|
Температура кипения, температура плавления. |
|
|
|
|
Простое (сложное) вещество |
|
|
|
|
Вывод к работе: о физических свойствах веществ, о составе простых и сложных веществах.
3. Чем смесь отличается от сложного вещества.
Напомнив, как готовиться смесь железа и серы, учитель отмечает, что сера — простое вещество, молекулы ее состоят из одинаковых атомов одного вида, железо тоже простое вещество, состоящее из одинаковых атомов другого вида. Можно ли назвать то, что получилось при перемешивании порошков, сложным веществом? Разделим смесь при помощи магнита. После обсуждения делаем вывод, что смесь можно разделить физическими способами и получить чистые вещества, из которых она состояла.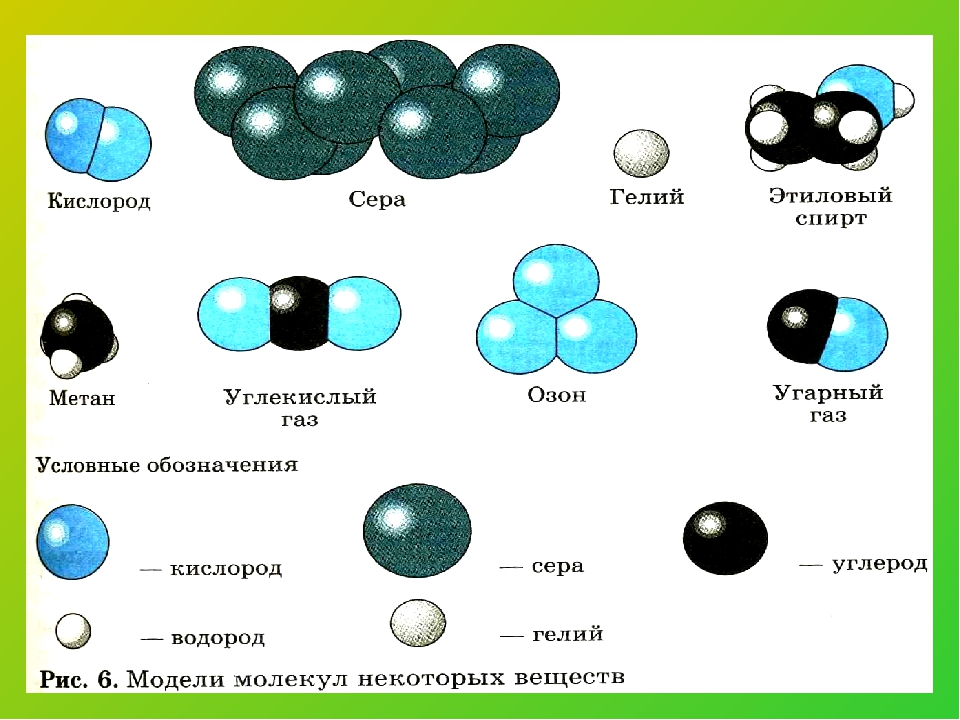
Таблица №1. Сравнение смесей и сложных веществ.
Смесь |
Сложное вещество |
1. Вещества сохраняют свои свойства. |
1. Свойства исходных веществ не сохраняются. |
2. Вещества можно разделить физическими методами. |
2. Сложное вещество нельзя разделить физическими методами. |
3. Количественный состав может быть произвольным. |
3. Количественный состав химического соединения всегда одинаков независимо от места нахождения и способа получения. |
3. Закрепление.
1. Выпишите простые вещества: сталь, чугун, железо, морская вода, дистиллированная вода, алюминий, лимонад, спиртовая настойка йода, нефть, глюкоза, поваренная соль, воздух, кислород, бронза.
2. Простые вещества состоят из атомов … химического элемента.
Сложные вещества состоят из атомов … Химических элементов. Сложные вещества иначе называют … .
Простое вещество, в отличие от сложного, нельзя … .
3. Чем морская вода отличается от дистиллированной воды?
4. Сравнить смесь со сложным веществом.
Вопросы и задания |
Вещества |
|
вода |
Водород и кислород (смесь) |
|
Можно ли разделить эти вещества на более простые компоненты. |
|
|
Сохраняется ли способность молекул кислорода поддерживать горение? Почему? |
|
|
Что нового узнали на уроке?
Какие вопросы вызвали затруднение?
Какие знания вы сегодня приобрели?
Домашнее задание: Читать стр. 15-17.
Выполнить упражнения 11-13 на стр.22.
Литература: Г.Е. Рудзитис, Ф.Г. Фельдман. «Химия 8 класс».
Методическая разработка. УРОК по химии в 8 классе «Простые и сложные вещества. Химический элемент.»
Устно отвечают на вопросы учителя:
Тема урока «Железо — элемент побочной подгруппы Периодической системы» Автор: учитель химии Зайцева Н. С. Цель: Создать условия для изучения свойств элементов побочных подгрупп Периодической системы химических
С. Цель: Создать условия для изучения свойств элементов побочных подгрупп Периодической системы химических
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Примерная программа по химии составлена на основе федерального компонента государственного стандарта основного общего образования. За основу рабочей программы взята программа курса
ПодробнееПЛАНИРУЕМЫЕ ПРЕДМЕТНЫЕ РЕЗУЛЬТАТЫ
ПЛАНИРУЕМЫЕ ПРЕДМЕТНЫЕ РЕЗУЛЬТАТЫ (Результаты изучения учебного предмета) В результате изучения химии в 8 классе Учащиеся должны знать: 1. важнейшие химические понятия, основные законы химии, основные
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Данная рабочая программа по химии в 8 «Б» классе составлена на основе федерального компонента образовательного стандарта и программы курса химии для 8-11 классов общеобразовательных
Рабочая программа по химии 8 класс
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа 3 г. о. Подольск мкр. Климовск УТВЕРЖДАЮ Директор МБОУ СОШ 3 С.Г. Пелипака 2016 Рабочая программа по химии 8 класс
о. Подольск мкр. Климовск УТВЕРЖДАЮ Директор МБОУ СОШ 3 С.Г. Пелипака 2016 Рабочая программа по химии 8 класс
Пояснительная записка
Пояснительная записка Решение задач занимает в химическом образовании важное место, так как это один из приемов обучения, посредством которого обеспечивается более глубокое и полное усвоение учебного материала
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
1 ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Рабочая программа по химии составлена в соответствии с федеральным компонентом государственного стандарта основного общего образования, одобренным совместным решением коллегии Минобразования
ПодробнееПо химии. 8 класс. Москва уч. год
По химии 8 класс Москва 2014 2015 уч. год Пояснительная записка Рабочая программа по химии составлена на основе Примерной программы основного общего образования по химии, а так же Программы курса химии
ПодробнееПояснительная записка
Пояснительная записка Рабочая программа составлена на основе авторской программы, Березиной Н. А.. Данный курс предназначен для учащихся 0- классов, проявляющих интерес к предмету и желающих лучше подготовиться
А.. Данный курс предназначен для учащихся 0- классов, проявляющих интерес к предмету и желающих лучше подготовиться
Календарно-тематический план
Предмет: химия Класс: 8 Календарно-тематический план Дата Тема урока Тип урока Форма контр оля Средства наглядности Элементы содержания Требования к уровню подготовки учащихся УУД, формируемые на уроке
Подробнееавтор/авторский коллектив учебника
Аннотация к рабочей программе по химии 8 9 класс Рабочая программа разработана на основе Примерных программ основного общего образования по химии (базовый уровень), соответствующих федеральному компоненту
ПодробнееРабочая программа по химии. 8 класс
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа 27 с углубленным изучением отдельных предметов городского округа Самара Рассмотрено на заседании методического объединения
ПодробнееПояснительная записка 6-7 класс
Пояснительная записка 6-7 класс В настоящее время в век развития экономики, компьютеризации, химия перешла в разряд не престижных наук. Тем не менее, всем известно, что химия один из самых трудоемких учебных
Тем не менее, всем известно, что химия один из самых трудоемких учебных
1.ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
1.ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Рабочая программа по химии для 8 класса составлена на основе следующих нормативно правовых документов: 1. Авторской программы: Химия. Рабочие программы. Предметная линия учебников
Подробнее1. Пояснительная записка
1 Содержание 1. Пояснительная записка 3 2. Содержание учебного предмета 4 3. Организация контроля 6 4. Требования к уровню подготовки обучающихся 7 5. Учебно-методическое обеспечение 8 6. Материально-техническое
ПодробнееПЛАН УРОКА. г. Астана, КГУ «Школалицей
ПЛАН УРОКА Предмет Учитель Школа, класс Тема урока Химия Калиакбарова Е.Б. г. Астана, КГУ «Школалицей 1», 8 класс Степень окисления Цель урока: знать понятие о степени окисления. Научить находить степени
Научить находить степени
Учитель химии: Андреева Ю. В.
Учитель химии: Андреева Ю. В. Предмет: химия класс: 8 автор учебника: Жилин Д.М. Тема урока: Количественные соотношения в химии. Цель урока: создание условий для систематизации знаний по теме «Количественные
ПодробнееОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ ВЕЩЕСТВА. СВОЙСТВА ВЕЩЕСТВ Агрегатные состояния вещества Состояние Характеристика Пример Газообразное Жидкое Твердое (кристаллическое или аморфное) Расстояние между частицами
Подробнее, ч т т, т по о о е т о., п т тет д оп еделе, деле е ло че е, у ло е к, е уч т у т. Ст., о о е по т те дел т.
ео 5-е классы:, ч т т, т по о о е т о., п т тет д оп еделе, деле е ло че е, у ло е к, е уч т у т. Ст., о о е по т те дел т. 6-е классы:,,, о т т ко пект, т че е деле ло. Ст., оп о д дл по то е у т о. 7-е
Ст., о о е по т те дел т. 6-е классы:,,, о т т ко пект, т че е деле ло. Ст., оп о д дл по то е у т о. 7-е
Пояснительная записка
Пояснительная записка Рабочая программа по учебному предмету «Химия», 8 класс составлена в соответствии требованиями федерального компонента государственного стандарта общего образования, примерной программы
ПодробнееПояснительная записка:
Пояснительная записка: Рабочая программа по химии 8 класса составлена на основе: «Программы курса химии для 8 11класса для общеобразовательных учреждений» — М.: «Дрофа» 2007 и учебника О.С. Габриелян «Химия.
ПодробнееТехнологическая карта урока
Тема урока: Признаки химических явлений Предмет: природоведение Класс: 5А Технологическая карта урока УМК: 1. Учебник «Природоведение» 5 класс, авторы Т.С. Сухова и В.И.Строганов, Москва Издательство «Вентана-Граф»
Учебник «Природоведение» 5 класс, авторы Т.С. Сухова и В.И.Строганов, Москва Издательство «Вентана-Граф»
КОНСПЕКТ УРОКА (ЗАНЯТИЯ)
Государственное бюджетное общеобразовательное учреждение школа-интернат 1 имени К. К. Грота Красногвардейского района Санкт-Петербурга КОНСПЕКТ УРОКА (ЗАНЯТИЯ) Образовательное учреждение: ГБОУ школа-интернат
Подробнееучебный год
Приложение к рабочей программе по химии для 8 класса Примерные оценочные и методические материалы для осуществления текущего контроля успеваемости и промежуточной аттестации учащихся 8 го класса по химии
ПодробнееСелюков С.В. Урок по теме: «Классификация химических реакций»
Селюков С.В. Урок по теме: «Классификация химических реакций»
Автор: edu1
Методическая копилка — Химия
МБОУ «Букреевская основная общеобразовательная школа» Курского района
Открытый урок
по теме:
«Классификация химических реакций»
Учитель химии:
Селюков Сергей Викторович
2015 г.
Цель урока – познакомить с классификацией химических реакций по составу исходных веществ и продуктов реакций, закрепить умение составлять химические уравнения.
Задачи урока:
Обучающие:закрепление навыков составления химических уравнений путем расстановки коэффициентов в уравнении реакций, познакомить с классификацией химических реакций по составу исходных веществ и продуктов реакций;
Развивающие: развитие образовательных компетенций:
$1· учебно-познавательных: сформировать умение классифицировать химические реакции, развить умение применять теоретические знания для решения задач; умение обобщать, делать выводы; проводить самопроверку и самооценку;
$1· коммуникативных: развитие умения отвечать на поставленный вопрос; организовывать и анализировать собственную деятельность;
Воспитательные: воспитание информационной культуры; воспитание усидчивости и культуры учебного труда при выполнении практических заданий и обсуждении их результатов.
Оборудование: компьютер, мультимедийный проектор, интерактивная доска, модуль ЭОР http://fcior.edu.ru/card/10532/testy-po-teme-himicheskaya-reakciya.html, презентация в программе MIMIO.
Тип урока – комбинированный
Ход урока:
$11. Организационный момент (1-2 мин.)
$12. Актуализация знаний учащихся (15 мин.) – Слайд презентации №1.
Фронтальный опрос
Вопросы:
$11. Что такое химическое уравнение?
$12. Чем отличаются физические и химические явления?
$13. Какой закон лежит в основе составления химических уравнений? Кто автор этого закона?
Работа с модулем ЭОР — http://fcior.edu.ru/card/10532/testy-po-teme-himicheskaya-reakciya.html — учащиеся по одному выходят для выполнения вопросов теста (РАБОТА НА ИНТЕРАКТИВНОЙ ДОСКЕ) – перейти на модуль можно нажав на знак ?
3. Изучение нового материала (15 мин.)
Изучение нового материала (15 мин.)
На сегодняшний день известно 118 химических элементов (правда, в природе обнаружены только 94, остальные получены искусственно). Эти элементы образуют огромное количество различных соединений, многие из которых могут вступать в химические реакции друг с другом.
Слайд презентации №2. Задание. Посмотрите видеофрагмент. Напишите уравнение описанной реакции.
4P+5O2 = 2P2O5
$11. Какие вещества вступают в реакцию?
$12. Какие вещества образуются в ходе реакции?
Легко растеряться от такого огромного числа химических реакций, однако, как и сами вещества могут быть объединены по определенным признакам (например, металлы и неметаллы), так и химические реакции можно классифицировать на разные типы.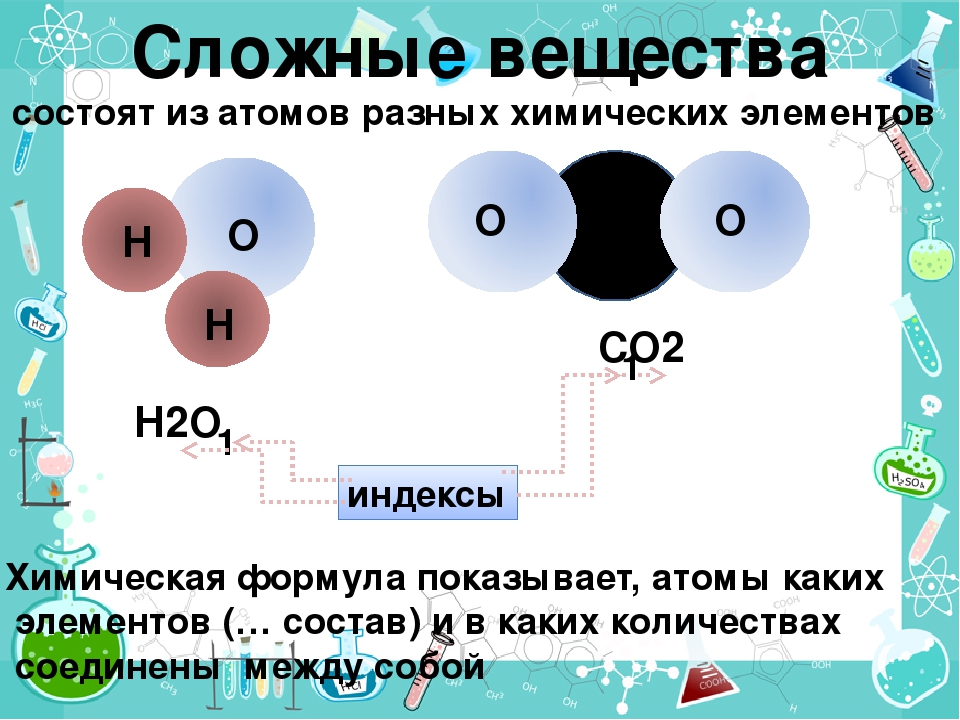 Таких классификаций существует много, их мы будем изучать в ходе дальнейшего изучения химии. На сегодняшнем уроке мы познакомимся с одной из таких классификаций.
Таких классификаций существует много, их мы будем изучать в ходе дальнейшего изучения химии. На сегодняшнем уроке мы познакомимся с одной из таких классификаций.
Слайд презентации №3. Задание. Посмотрите на следующие уравнения реакций. Определите, что общего и в чем различия между этими химическими процессами.
По этой классификации реакции можно разделить на 4 типа: реакции соединения, разложения, замещения, обмена. (Слайд презентации №4 – с помощью шторок открывается постепенно определенный фрагмент)
Реакции соединения– реакции, в результате которых из двух или более веществ образуется одно. Например – горение фосфора в кислороде:
4P +5O2 = 2P2O5
Реакции разложения – реакции, в результате которых из одного исходного вещества образуются два или более веществ.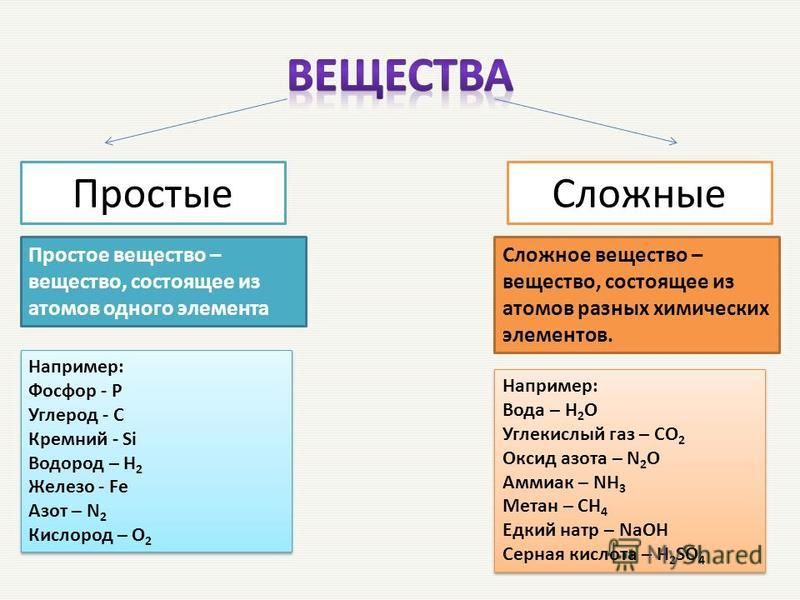
2HgO = 2Hg + O2
Реакции замещения – реакции, в ходе которых атомы простого вещества замещают атомы элементов в сложном веществе.
Fe + CuCl2 – FeCl2 + Cu
Реакции обмена – реакции между сложными веществами, в ходе которых сложные вещества обмениваются своими составными частями. (Эти реакции более подробно будем изучать во втором полугодии и в 9-м классе)
Итак, выделяют 4 типа реакций по составу исходных веществ и продуктов реакции – слайд презентации №5
$14. Закрепление (10 мин.)
Слайд презентации №6.
Определить тип химической реакции:
1) CaO + CO2 = CaCO3
2) CO2 + 2NaOH = Na2CO3 + H2O
3) Fe + S = FeS
4) 2H2O = 2H2 + O2↑
5) CuO + H2 = Cu + H2O
6) Zn + 2HCl = ZnCl2 + H2↑
7) ZnO + H2SO4 = ZnSO4 + H2O
8) Cu(OH)2 = CuO + H2O
Каждый учащийся самостоятельно выполняет это задание, а затем осуществляет самопроверку.
Слайд презентации №7.
Учитель зачитывает описание химической реакции, а учащиеся должны определить, о каком типе идет речь. После правильного ответа учитель открывает шторку схемы:
$1· В результате нагревания малахита идет выделение углекислого газа.
$1· При реакции металлов с кислотами выделяется водород.
$1· Кислоты взаимодействуют со щелочами с образованием соли и воды.
$1· Все простые вещества при взаимодействии с кислородом образуют оксиды.
Слайд презентации №8.
Работа на интерактивной доске. Учащиеся должны распределить уравнения по типам (разложить уравнения по сундукам, вынимая их с помощью стилуса за центральным овалом)
$15. Формулировка выводов (2 мин.)
Что такое хим.уравнения?
Какие типы хим.реакций выделяют?
$16. Домашнее задание (2 мин.) Слайд презентации №9. — §16 (по учебнику Рудзитиса)
— §16 (по учебнику Рудзитиса)
7. самостоятельная работа (решить тесть, написать тест в программе)слайд 11
8. Рефлексия
|
1. На уроке я работал 2. Своей работой на уроке я 3. Урок для меня показался 4. За урок я 5. Мое настроение 6. Материал урока мне был 7. Домашнее задание мне кажется |
активно / пассивно доволен / не доволен коротким / длинным не устал / устал стало лучше / стало хуже понятен / не понятен полезен / бесполезен интересен / скучен легким / трудным интересным / неинтересным |
Список используемой литературы:
$11. Гара, Н. Н. Химия. Уроки в 8 классе : пособие для учителя / Н. Н. Гара. — М. : Просвещение, 2009. — 95 с.
Химия. Уроки в 8 классе : пособие для учителя / Н. Н. Гара. — М. : Просвещение, 2009. — 95 с.
$12. Г.Е., Фельдман. Химия. 8 класс. М: «Просвещение», 2008.-176с.
$13. CD-ROM Виртуальная школа Кирилла и Мефодия. Уроки химии. 8-9 классы.-М.: ООО «Кирилл и Мефодий», 2002г.
О | |||||||
О | |||||||
О | |||||||
О | |||||||
О | |||||||
О |
тест по химии 8 класс Простые и сложные вещества. Качественный и количественный состав вещества.
Государственное бюджетное образовательное учреждение
Центр образования №354 им. Карбышева
Центрального округа города Москвы
Тест по химии
«Простые и сложные вещества. Качественный и количественный состав вещества»
подготовила
учитель биологии и химии
Червинская Елена Владимировна
2013год
Простые и сложные вещества. Качественный и количественный состав вещества.
Вариант №1
Часть I
А1 Простое вещество – это вещество,
содержащее атомы разных химических элементов
содержащее атомы одного химического элемента
которое не содержит примеси
которое редко встречается в природе
А2Только сложные вещества перечислены в списке:
вода, железо, бронза
воздух, вода, сероводород
поваренная соль, сахар, сода
сода, азот, алмаз
А3
На каком рисунке показана смесь
1.

5143516446500
203835189230005276856178550061341037973000 59817073025002.
3505208826500
56959545593000217170522605007429537020500112395-127000 33464573025003.
191770602615006299207550150017272024066500 4902208731250012827058737500425458350250057594534925000404495177800004.
А4Пять атомов фосфора можно обозначить так:
5Р
Р5
5Р5
Р2О5
А5
Наименьшую относительную атомную массу имеет:
калий 3. азот
кислород 4. магний
А6Какая из записей обозначает наибольшее число молекул кислорода:
2O2 3. О23О 4. О3
А7Молекула какого вещества содержит наименьшее число атомов?
Н2О 3. HClСО2 4. О3
А8
Относительная молекулярная масса железной окалины Fe3О4 равна
232 3. 110
210 4.
 34
34А9Какие из приведенных признаков не характерны для сложных веществ:
состав соединения постоянен
состоит из атомов одного химического элемента
состоит из атомов нескольких химических элементов
состав можно изобразить одной химической формулой
А10
Состав вещества выражен формулой K3РО4. Суммарное число атомов равно:
3
4
7
8
А11
В записи 7SO2 коэффициент равен:
7 3. 9
2 4. 14
А12
В записи 6Н2SO3 индексами являются:
6, 2, 3 3. 2, 3
6 4. 2, 1 и 3
Часть II
В1Установите соответствие между определенным химическим понятием и его характеристикой
ХАРАКТЕРИСТИКА ПОНЯТИЕ
А) состоит из атомов одного вида, обладает постоянными физическими свойствами 1) химический элемент
Б) состав можно записать в виде химической формулы 2) простое вещество
В) совокупность атомов одного вида Г) может входить в состав различных веществ А Б В Г
В2Установите соответствие между химической формулой вещества и его составом:
ФОРМУЛА СОСТАВ
А) HCl 1) Простое вещество
Б) h3
В) NaBr 2) Сложное вещество
Г) MgOД) Cu
А Б В Г Д
Часть III
С1Охарактеризуйте качественный и количественный состав вещества по его формуле Na2СО3.

С2Состав вещества выражен формулой Р2О5. Определите:
а) число химических элементов, входящих в состав молекулы
б) суммарное число атомов в молекуле
в) относительную молекулярную массу
г) массовые доли элементов
Простые и сложные вещества. Качественный и количественный состав вещества.
Вариант №2
Часть I
А1
Сложное вещество – это вещество,
которое содержит примеси
содержащее атомы разных химических элементов
содержащее атомы одного химического элемента
которое не встречается в природе
А2Только простые вещества перечислены в списке:
азот, алмаз, вода
железо, графит, водород
сахар, поваренная соль, вода
медь, спирт, водород
А3
На каком рисунке показано простое вещество
1.
5143516446500
203835189230005276856178550061341037973000 59817073025002.
3505208826500
56959545593000217170522605007429537020500112395-127000 33464573025003.
191770602615006299207550150017272024066500 4902208731250012827058737500425458350250057594534925000404495177800004.
А4Три молекулы хлора можно обозначить так:
Cl3
3Cl
3Cl2O5
3Cl2
А5
Наибольшую относительную атомную массу имеет:
натрий 3. сера
водород 4. хлор
А6Какая из записей обозначает наибольшее число молекул азота:
N2 3. 3N2
5N 4. N10
А7Молекула какого вещества содержит наименьшее число атомов?
Ch5 3. HNO3
СО 4. О3
А8
Относительная молекулярная масса пропана С3Н8 равна
11 3. 26
14 4. 44
А9Какие из приведенных признаков не характерны для простых веществ:
состав можно изобразить одной химической формулой
состоит из атомов нескольких химических элементов
состоит из атомов одного химического элемента
состав соединения постоянен
А10
Состав вещества выражен формулой С2Н6О.
 Суммарное число атомов равно:
Суммарное число атомов равно:3
6
8
9
А11
В записи 4СО2 коэффициент равен:
2 3. 6
4 4. 8
А12
В записи 7С4Н8 индексами являются:
7 3. 4, 8
7,4 4. 7, 4, 8
Часть II
В1Установите соответствие между определенным химическим понятием и его характеристикой
ХАРАКТЕРИСТИКА ПОНЯТИЕ
А) состоит из атомов нескольких видов, обладает постоянными физическими свойствами 1) химический элемент
Б) совокупность атомов одного вида 2) сложное вещество
В) может образовывать различные вещества Г) имеет постоянный состав А Б В Г
В1Установите соответствие между химической формулой вещества и его составом:
ФОРМУЛА СОСТАВ
А) Cl2 1) Сложное вещество
Б) h3SO4
В) N2 2) Простое вещество
Г) AlCl3
Д) CuOА Б В Г Д
Часть III
С1Охарактеризуйте качественный и количественный состав вещества по его формуле К3РО4.

С2Состав вещества выражен формулой N2O3. Определите:
а) число химических элементов, входящих в состав молекулы
б) суммарное число атомов в молекуле
в) относительную молекулярную массу
г) массовые доли элементов
Простые и сложные вещества. Качественный и количественный состав вещества.
Вариант №3
Часть I
А1 Простое вещество – это вещество,
которое имеет постоянный состав
которое можно выделить из смеси
содержащее атомы одного химического элемента
содержащее атомы разных химических элементов
А2Только сложные вещества перечислены в списке:
серная кислота, вода, сахар
вода, хлороводород, воздух
поваренная соль, сахар, графит
углекислый газ, кислород, железо
А3
На каком рисунке показано сложное вещество
422910101600001.
184785254000
37528540830500375285-1270005276856178550061341037973000 59817073025002.
3505208826500
56959545593000217170522605007429537020500112395-127000 33464573025003.
1250956978650055372050736500-4635515494000 4902208731250012827058737500425458350250057594534925000404495177800004.
А4Три атома серы можно обозначить так:
S3
3S
3S3
SO3
А5
Наименьшую относительную атомную массу имеет:
сера 3. натрий
фосфор 4. бор
А6Какая из записей обозначает наибольшее число молекул брома:
6Br 3. Br2
3Br2 4. Br8
А7Молекула какого вещества содержит наименьшее число атомов?
Н2S 3. P4
Сh5 4. HNO3
А8
Относительная молекулярная масса кремневой кислоты равна
40 3. 48
75 4. 78
А9Какие из приведенных признаков не характерны для сложных веществ:
состав можно изобразить одной химической формулой
состоит из атомов нескольких химических элементов
состоит из атомов одного химического элемента
состав соединения постоянен
А10
Состав вещества выражен формулой Na2CO3.
 Суммарное число атомов равно:
Суммарное число атомов равно:3
6
6
8
А11
В записи 5Nh4 коэффициент равен:
2 3. 5
3 4. 15
А12
В записи 10НNO3 индексами являются:
10 3. 1, 1 и 3
10 и 3 4. 3
Часть II
В1Установите соответствие между определенным химическим понятием и его характеристикой
ХАРАКТЕРИСТИКА ПОНЯТИЕ
А) может входить в состав различных веществ 1) химический элемент
2) простое вещество
Б) совокупность атомов одного вида В) состав можно записать в виде химической формулы
Г) состоит из атомов одного вида, обладает постоянными физическими свойствами
А Б В Г
В2Установите соответствие между химической формулой вещества и его составом:
ФОРМУЛА СОСТАВ
А) h3SO3 1) Простое вещество
Б) h3S
В) Br2 2) Сложное вещество
Г) Al
Д) NO
А Б В Г Д
Часть III
С1Охарактеризуйте качественный и количественный состав вещества по его формуле Н3РО4.

С2Состав вещества выражен формулой Al2O3. Определите:
а) число химических элементов, входящих в состав молекулы
б) суммарное число атомов в молекуле
в) относительную молекулярную массу
г) массовые доли элементов
Простые и сложные вещества. Качественный и количественный состав вещества.
Вариант №4
Часть I
А1 Сложное вещество – это вещество,
которое встречается в природе
которое содержит примеси
содержащее атомы одного химического элемента
содержащее атомы разных химических элементов
А2Только простые вещества перечислены в списке:
свинец, азот, вода
алмаз, графит, кислород
сахар, поваренная соль, спирт
медь, сероводород, стекло
А3
На каком рисунке показано простое вещество
18478573025001.
37528552260500381026543000527685-127000 59817073025002.
3505208826500
56959545593000217170522605007429537020500112395-127000 410845111125003.
499745383540009969546926500153670254000 4902208731250012827058737500425458350250057594534925000404495177800004.
А4Четыре молекулы азота можно обозначить так:
N4
4N2
4N
NO2
А5
Наибольшую относительную атомную массу имеет:
фтор 3. углерод
калий 4. азот
А6Какая из записей обозначает наибольшее число молекул водорода:
Н12 3. 3Н
6Н2 4. Н2А7Молекула какого вещества содержит наименьшее число атомов?
HNO2 3. HNO3
N2O5 4. h3SO4
А8
Относительная молекулярная масса натриевой селитры NaNO3 равна
42 3. 81
53 4. 85
А9Какие из приведенных признаков не характерны для простых веществ:
состав соединения постоянен
состоит из атомов нескольких химических элементов
состоит из атомов одного химического элемента
состав можно изобразить одной химической формулой
А10
Состав вещества выражен формулой K2CO3.
 Суммарное число атомов равно:
Суммарное число атомов равно:2
3
5
6
А11
В записи 12SiO2 коэффициент равен:
2 3. 14
12 4. 24
А12
В записи 7Н2СО3 индексами являются:
7 3. 7, 2 и 3
2 и 3 4. 2, 1 и 3
Часть II
В1Установите соответствие между определенным химическим понятием и его характеристикой
ХАРАКТЕРИСТИКА ПОНЯТИЕ
А) имеет постоянный состав 1) химический элемент
Б) состоит из атомов нескольких видов, обладает постоянными физическими свойствами 2) сложное вещество
В) может образовывать различные вещества Г) совокупность атомов одного вида А Б В Г
В2Установите соответствие между химической формулой вещества и его составом:
ФОРМУЛА СОСТАВ
А) НClО4 1) Сложное вещество
Б) h3
В) NО 2) Простое вещество
Г) I2
Д) PbOА Б В Г Д
Часть III
С1Охарактеризуйте качественный и количественный состав вещества по его формуле К2SiO3.
С2Состав вещества выражен формулой SO3. Определите:
а) число химических элементов, входящих в состав молекулы
б) суммарное число атомов в молекуле
в) относительную молекулярную массу
г) массовые доли элементов
Ответы
А1А2А3 А4А5 А6А7А8 А9А10 А11 А12 В1В2Вариант 1 2 3 4 1 3 1 3 1 2 4 1 4 2211 21221
Вариант 2 2 2 1 4 4 3 2 4 2 4 2 3 2112 21211
Вариант 3 3 1 2 2 4 2 1 4 3 3 3 3 1122 22112
Вариант 4 4 2 1 2 2 2 1 4 2 4 2 4 2211 12121
Вариант 1
С1. Охарактеризуйте качественный и количественный состав вещества по его формуле Na2СО3
Содержание верного ответа и указания по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла) Баллы
Элементы ответа.
1) качественный состав: натрий, углерод, кислород
2) количественный состав: 2 атома натрия, 1 атом углерода, 3 атома кислорода
1
1
Максимальный балл: 2
С2. Состав вещества выражен формулой Р2О5.

Содержание верного ответа и указания по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла) Баллы
Элементы ответа.
1) число химических элементов, входящих в состав молекулы -2 (фосфор и кислород)
2) суммарное число атомов в молекуле — 7
3) Мr = 142
4) (Р) = 0,4366 или 43,66% (О) = 0,5634 или 56,34%
1
1
1
2
Максимальный балл: 5
Вариант 2
С1. Охарактеризуйте качественный и количественный состав вещества по его формуле К3РО4.
Содержание верного ответа и указания по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла) Баллы
Элементы ответа.
1) качественный состав: калий, фосфор, кислород
2) количественный состав: 3 атома калия, 1 атом фосфора, 4 атома кислорода
1
1
Максимальный балл: 2
С2. Состав вещества выражен формулой N2O3
Содержание верного ответа и указания по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла) Баллы
Элементы ответа.

1) число химических элементов, входящих в состав молекулы -2 (азот и кислород)
2) суммарное число атомов в молекуле — 5
3) Мr = 76
4) (N) = 0,3684 или 36,84% (О) = 0,6316 или 63,16%
1
1
1
2
Максимальный балл: 5
Вариант 3
С1. Охарактеризуйте качественный и количественный состав вещества по его формуле Н3РО4.
Содержание верного ответа и указания по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла) Баллы
Элементы ответа.
1) качественный состав: водород, фосфор, кислород
2) количественный состав: 3 атома водорода, 1 атом фосфора, 4 атома кислорода
1
1
Максимальный балл: 2
С2. Состав вещества выражен формулой Al2O3
Содержание верного ответа и указания по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла) Баллы
Элементы ответа.

1) число химических элементов, входящих в состав молекулы -2 (алюминий и кислород)
2) суммарное число атомов в молекуле — 5
3) Мr = 102
4) (Al) = 0,5294 или 52,94% (О) = 0,4706 или 47,06%
1
1
1
2
Максимальный балл: 5
Вариант 4
С1. Охарактеризуйте качественный и количественный состав вещества по его формуле К2SiO3.
Содержание верного ответа и указания по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла) Баллы
Элементы ответа.
1) качественный состав: калий, кремний, кислород
2) количественный состав: 2 атома калия, 1 атом кремния, 3 атома кислорода
1
1
Максимальный балл: 2
С2. Состав вещества выражен формулой SO3.
Содержание верного ответа и указания по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла) Баллы
Элементы ответа.
1) число химических элементов, входящих в состав молекулы -2 (сера и кислород)
2) суммарное число атомов в молекуле — 4
3) Мr = 80
4) (S) = 0,4 или 40% (О) = 0,6 или 60%
1
1
1
2
Максимальный балл: 5
Часть А – 1 балл 23-21 балл – «5»
Часть В – 1- 2 балла 20-16 баллов – «4»
15- 12 баллов – «3»
Список литературы:
Габриелян О.С., Химия. 8 класс. Дрофа. 2010г
Рудзитис Г.Е. Химия 8 класс. М.: «Просвещение», 2010г.
Атомы и молекулы. Простые и сложные вещества (8 класс)
ХИМИЯ8 класс
Атомы и молекулы.
Простые и сложные вещества.
Мария Дмитриевна Смирнова
[email protected]
Vk.com/masha2101
1
Молекулы и атомы в веществе
Вещества бывают молекулярного и немолекулярного строения.
Молекулярные
соединения
Немолекулярные
соединения
Ch5
h3O
P2O5
SO2
NaCl
K2SO4
LiH
CaO
Более прочные химические
связи.
Более высокие температуры
кипения, плавления (фазовых
переходов)
Молекулярные и немолекулярные вещества
h3O, жидкость
Молекулярное вещество
Mg2SiО4
Кристаллическое вещество
Молекулярные и немолекулярные вещества
h3O, жидкость
Молекулярное вещество
h3O, лёд
Кристаллическое вещество
Порядок
В твёрдых и жидких телах существует упорядоченность во
взаимном расположении атомов или молекул.
Упорядоченность на расстояниях, сравнимых с межатомными,
называется
ближним
порядком,
а
упорядоченность,
повторяющаяся на неограниченно больших расстояниях, —
дальним порядком.
В идеальном газе расположение атома в какой-либо точке
пространства не зависит от расположения других атомов. То есть в
газах нет ни дальнего, ни ближнего порядков.
Порядок
Дальний порядок
Ближний порядок
Безпорядок
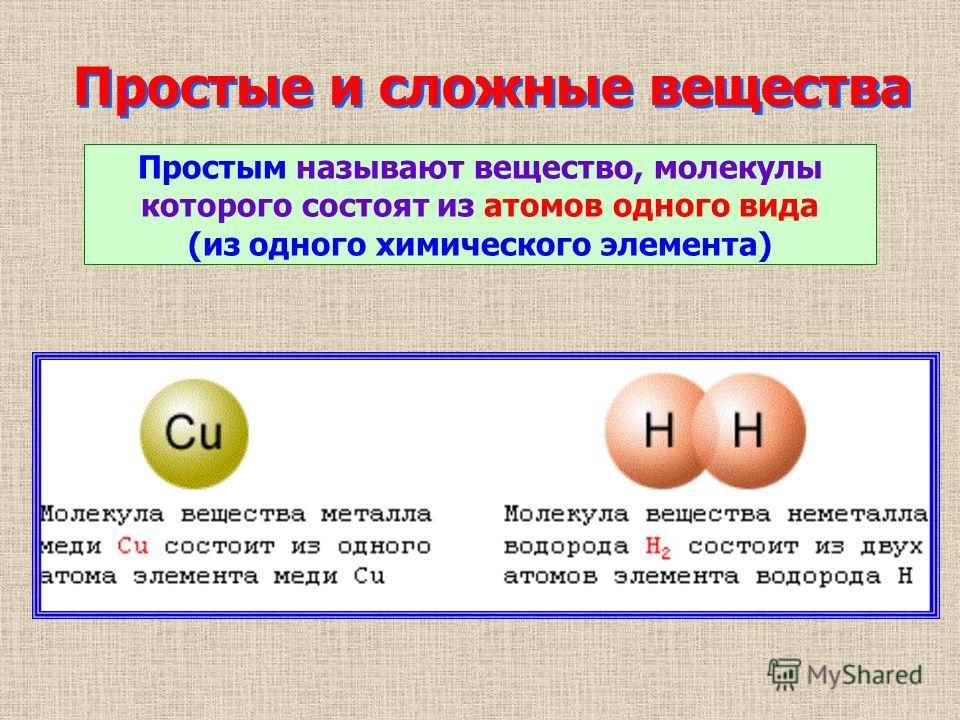
Простые и сложные вещества
Состоит только из себя
Является сочетанием
Простые и сложные вещества
Если вещество можно разложить на другие вещества –
оно является сложным.
Сложные вещества – такие вещества, которые сложены
атомами разного вида.
Простые вещества – вещества, сложенные атомами
одного вида.
Различие смесей и химических соединений
Смесь
Химические соединения
Вещества можно смешивать в
любых пропорциях. Их состав
переменен.
Состав химических соединений
постоянен.
Вещества в смесях сохраняют свои
индивидуальные свойства
Вещества входящие в химическое
соединения теряют свои свойства.
Вещества из смеси можно
выделить
Химическое соединение можно
только разложить
При смешивании не выделяется
теплота, свет или запах
У химической реакции есть
признаки…
Химические элементы
Химический элемент – определенный тип атомов.
Химический элемент – это вид атомов с определённым зарядом
ядра.
Простые вещества
S
О
Н
N
Sромб
О2
Н2
N2
Нельзя путать простое вещество и химический элемент!
Символы химических элементов
Почти все символы для химических элементов придумал Якоб
Берцелиус.
Он предложил присваивать символ по первой
букве латинского названия элемента.
Так, Carboneum – C (углерод).
Если буква уже занята, то добавляется вторая:
Calcium – Ca (кальций)
Chlorum – Cl (хлор)
Символы химических элементов
Алхимические символы
1 — олово; 2 — свинец; 3 — золото;
4 — сера; 5 — ртуть; 6 — серебро;
7 — железо
Символы предложенные Дальтоном.
Названия химических элементов
Название
химического
элемента
Символ
Водород
Н
Аш
1
h3
Гелий
He
Гелий
4
Не образует
Литий
Li
Литий
7
LiOH
Бериллий
Be
Бериллий
9
BeCl2
Бор
B
Бор
11
B2O3
Углерод
С
Це
12
CO2
Азот
Кислород
N
О
Эн
О
14
16
NO2
О2
Произношение Относительная
символа
атомная масса
Пример
соединения
Названия химических элементов
Название
химического
элемента
Символ
Фтор
F
Фтор
19
HF
Неон
Ne
Неон
20
Не образует
Натрий
Na
Натрий
23
NaOH
Магний
Mg
Магний
24
MgCl2
Алюминий
Al
Алюминий
27
Al(OH)3
Кремний
Si
Силициум
28
SiO2
Фосфор
Сера
P
S
Пэ
Эс
31
32
h4PO4
SO2
Произношение Относительная
символа
атомная масса
Пример
соединения
Названия химических элементов
Название
химического
элемента
Символ
Хлор
Cl
Хлор
35.5
Cl2
Аргон
Ar
Аргон
40
Не образует
Калий
K
Калий
39
KOH
Кальций
Ca
Кальций
40
CaCl2
Бром
Br
Бром
80
HBr
Железо
Fe
Феррум
56
FeO3
Золото
Медь
Au
Cu
Аурум
Купрум
197
64
Au
CuO
Произношение Относительная
символа
атомная масса
Пример
соединения
Название
химического
элемента
Символ
Произношение
символа
Относительная
атомная масса
Пример
соединения
Иод
Cl
Хлор
127
HI
Марганец
Ar
Аргон
55
MnO
Олово
Sn
Станум
119
SnO
Ртуть
Hg
Гидраргирум
201
Hg(NO3)2
Свинец
Pb
Плюмбум
207
PbO
Серебро
Ag
Аргентум
108
Ag₂[HgI₄]
Цинк
Zn
Цинк
65
ZnO
Химический тест простых и сложных веществ
.Содержание правильного ответа и инструкции по выставлению оценок (разрешены другие формулировки ответа без искажения его смысла)
Часть A — 1 балл 23-21 балл — «5» Часть B — 1-2 балла 20-16 баллов — «4» 15-12 баллов — «3»
Библиография:
- Габриелян О.С., Химия. 8 класс. Дрофа. 2010 Рудзитис Г.Э. Химия 8 класс. М .: «Просвещение», 2010.
ТЕСТ №2 (1). Молекулы и атомы.Простые и сложные вещества. Признаки химических элементов. Относительный атомный и молекулярный вес. Химические формулы.
Часть A
Современные химические символы были разработаны
1) Д.И. Менделеев 3) Я. Берцелиус
2) А. Лавуазье 4) А. Авогадро
2. Химический элемент
1) определенный вид атомов
2) вещество, которое не может быть разложено на более простые вещества
3) атомы с одинаковой массой
4) вещество, всегда увеличивающее свой вес при химическом превращении.
3. Относительная атомная масса химического элемента
1) масса его атома
2) масса его атома, выраженная в а.е.м.
3) отношение массы атома к 1/12 массы атома углерода
4) масса его атома, выраженная в граммах
4. Образуется простое вещество
1) идентичные молекулы
2) атомы одного химического элемента
3) молекулы, состоящие из одного атома
4) простые молекулы
5.Молекулярные массы Fe 3 O 4, H 3 PO 4, N 2 равны соответственно
.6. Массовая доля железа в соединении Fe 2 O 3 составляет
.7. Массовые доли элементов в сочетании железа с серой равны соответственно
46,67% и 53,33%. Формула соединения
4) Fe 2 (SO 4) 3
Часть B
8. Вставьте пропущенные слова в выписку: «_________________________ —
.наименьших химически неделимых частиц, из которых состоят молекулы.«
9. Установите соответствие между названием вещества и его видом. Запишите ответ
в виде последовательности букв и цифр, например А1, В2 и т. Д.
1) вода А — простые вещества
2) кислород Б — комплексные вещества
10. Разделить на группы — металлы (A) и неметаллы (B) — химические элементы:
Запишите ответ в виде последовательности букв и цифр, например, A123, B456.
ТЕСТ №2 (2).Молекулы и атомы. Простые и сложные вещества. Признаки химических элементов. Относительный атомный и молекулярный вес. Химические формулы
Часть A
Д. Далтон
DI. Менделеев
Аристотель
атомов одного химического элемента
атомов одного химического элемента, различающихся по массе
атомов одного химического элемента, равных по массе
атомов одного химического элемента, одинакового размера
Заслуга введения понятия химический элемент в науку принадлежит
Изотопы
Величина, указанная в таблице химических элементов Д.И. Менделеев
относительная атомная масса химического элемента
состоит из двух атомов
состоит из нескольких атомов
содержит идентичные атомы
состоит из атомов одного химического элемента
Массовая доля марганца в соединении Mn 2 O 7 составляет
Массовые доли фосфора и хлора в соединении равны 14.87% и 85,13% соответственно. Формула соединения
относительная атомная масса его самого тяжелого изотопа
относительная атомная масса его легчайшего изотопа
относительная атомная масса его самого распространенного изотопа в природе
средняя атомная масса всех изотопов с учетом их распространенности в природе
Азот (N 2) — простое вещество, так как его молекула
Относительные молекулярные массы HNO 3, P 2 O 5, O 3 соответственно равны
Часть B
Вставить пропущенные слова в выписку: «__________________________ —
.
атома одного вида. «
Установите соответствие между названием вещества и его типом. Запишите ответ в
1) сера А — простые вещества
2) кислород Б — комплексные вещества
10. Разделить на группы — металлы (A) и неметаллы (B) — химические элементы:
ТЕСТ №3 (1).Валентность химических элементов. Составление формул валентности. Химические уравнения … Типы химических реакций.
Часть A
Валентности серы, азота и углерода в их водородных соединениях (H 2 S, NH 3, CH 4) соответственно равны
2. Написаны символы химических элементов, образующих простые вещества-металлы
под номером
3. Валентность серы в соединениях Na 2 S, SO 3, CS 2 равны соответственно
4.Формулы бинарных соединений кальция с азотом и алюминия с серой записываются соответственно под номером
.Al 2 S 3, Ca 3 N 2
Ca 3 N 2, Al 2 S 3
Ca (NO 3) 2, Al 2 S 3
Ca 3 N 2, Al 2 (SO 4) 3
5. Сумма коэффициентов в уравнении реакции Na + H 2 O → NaOH + H 2 равна
.6. Заполните уравнение реакции (указаны коэффициенты): Fe + CuCl 2 =… + FeCl 2
сформирован из 5.6 г железа и 3,2 г серы.
Часть B
8. Вставить пропущенные в формулировку слова: «Масса веществ, указанная в
.химическая реакция ____________________ масса образующихся веществ ».
Установите соответствие между левой и правой частями уравнения реакции.
Запишите свой ответ в виде последовательности букв и цифр, например, A1, B2 и т. Д.
4Al + 3O 2 = А.Al 2 O3 + 3H 2 O
2Al (OH) 3 = B. 2AlCl 3 + 3H 2 O
Al 2 O 3 + 6HCl = B. 2Al 2 O 3
Разделите химические реакции на группы — соединения (A) и замещения (B):
4Fe + 3O 2 = 2Fe 2 O 3
Hg (NO 3) 2 + Cu = Cu (NO 3) 2 + HG
S + O 2 = SO 2,
Zn + 2HCl = ZnCl 2 + H 2
N 2 + O 2 = 2NO
2Al (OH) 3 = Al 2 O 3 + 3H 2 O
Запишите ответ в виде последовательности букв и цифр, например A123, B456.
ТЕСТ №3 (2). Валентность химических элементов. Составление формул валентности. Химические уравнения. Типы химических реакций.
Часть A
Валентность кальция, натрия и алюминия в их соединениях с кислородом — CaO, Na 2 O, Al 2 O 3 — соответственно равна
.1) I, II, III 3) II, I, III
2) III, II, I 4) II, III, I
2. Записаны обозначения химических элементов, образующих простые вещества — металлы
под номером
3.Валентность азота в соединениях Na 3 N, NO, NF 3 соответственно равна
.1) I, II, III 3) III, I, III
2) III, II, III 4) I, II, I
4. Формулы бинарных соединений магния с азотом и кальция с серой соответственно
записан под номером
1) CaS, Mg 3 N 2 3) Mg (NO 3) 2, CaS
2) Mg 3 N 2, CaSO 4 4) Mg 3 N 2, CaS
5. Сумма коэффициентов в уравнении реакции FeCl 2 + Cl 2 → FeCl 3 равна
.6.Заполните уравнение реакции (коэффициенты указаны): Mg + 2… = H 2 + MgCl 2
7. Используя закон сохранения массы, определите массу сульфида железа (II),
образован из 56 г железа и 32 г серы.
Часть B
8. Вставьте пропущенные слова в выписку: «_________________________ звоните
условное изображение протекания химической реакции с помощью знаков и формул. «
9.Установите соответствие между левой и правой частями уравнения реакции. Запишите свой ответ в виде последовательности букв и цифр, например, A1, B2 и т. Д.
1) 4Fe + 3O 2 = A. Fe 2 O 3 + 3H 2 O
2) 2Fe (OH) 3 = Б. 2FeCl 3 + 3H 2 O
3) Fe 2 O 3 + 6HCl = B. 2Fe 2 O 3
10. Распределите химические реакции по группам — разложение (A) и замещение (B):
1) 4Fe + 3O 2 = 2Fe 2 O 3
2) Hg (NO 3) 2 + Cu = Cu (NO 3) 2 + Hg
3) 4HNO 3 = 4NO 2 + O 2 + 2H 2 O
4) Zn + 2HCl = ZnCl 2 + H 2
5) CaCO 3 = CaO + CO 2
6) Al (OH) 3 = Al 2 O 3 + 3H 2 O
Запишите ответ в виде последовательности букв и цифр, например A123, B456.
ТЕСТ №4 (1). Молярная масса. Расчеты по уравнениям химических реакций
Часть A
Молярная масса соединения CuSO 4 ∙ 5H 2 O (г / моль)
Какое количество вещества (моль) содержится в оксиде серы (VI) массой 12 г?
При взаимодействии раствора, содержащего гидроксид натрия NaOH массой 4 г, с раствором хлорида меди (II) Cu (OH) 2 и хлорида натрия NaCl.Какая масса (г) оксида? (Ответьте целым числом.)
Какова масса (г) хлорида железа (III), полученного при реакции 16,8 г железа с хлором?
Какова масса (г) оксида железа Fe 3 O 4, образовавшегося при сгорании железа на воздухе весом 11,2 г?
Масса осадка сульфата бария BaSO 4, образовавшегося при смешивании растворов, содержащих сульфат натрия Na 2 SO 4 массой 1,42 г и хлорид бария BaCl 2 массой 2.8 г —
Какова масса соли хлорида алюминия AlCl 3 (г), образовавшейся в результате реакции гидроксида алюминия Al (OH) 3 весом 23,4 г и соляной кислоты HCl, содержащей 35 г хлористого водорода?
Какое количество молекул воды содержится в 3,6 г вещества?
Часть B
Рассчитайте массу оксида железа (III), образовавшегося в результате реакции 22,4 г железа с 10 г кислорода. Дайте свой ответ целым числом.
Когда метан (CH 4) горит на воздухе, образуется диоксид углерода и вода.Рассчитайте массу воздуха, необходимую для сжигания 16 г метана, если массовая доля кислорода в воздухе составляет 28,6%.
ТЕСТ №4 (2). Молярная масса. Расчеты по уравнениям химических реакций.
Часть A
Молярная масса соединения CaSO 4 ∙ 2H 2 O (г / моль)
Масса пробы серы 19.2 г. Какое количество серы (моль)?
Какая масса (г) карбоната натрия Na 2 CO 3 равна количеству вещества 0,25 моль?
При взаимодействии раствора, содержащего гидроксид натрия NaOH массой 8 г, с раствором нитрата меди (II) Cu (NO 3) 2 образуется осадок гидроксида меди (II) Cu (OH) 2 и нитрата натрия (NaNO 3). ). Какова масса (г) гидроксида меди (II)? (Ответьте целым числом.)
Какова масса серы (г), прореагировавшей с алюминием весом 2.7 г?
Какова масса гидроксида железа (III) (г), растворенного в серной кислоте H 2 SO 4, весом 9,8 г? Схема реакции: Fe (OH) 3 + H 2 SO 4 → Fe 2 (SO 4) 3 + H 2 O. (Ответьте целым числом).
Какое количество атомов фосфора в образце фосфора массой 155 г?
8. Какова масса осадка сульфата бария BaSO 4 (г), образовавшегося при перемешивании?
растворов, содержащих сульфат натрия Na 2 SO 4 массой 1,6 г и хлорид бария BaCl 2
весом 2,08 г?
Часть B
9.Рассчитайте массу оксида меди (II), образовавшегося при взаимодействии 27 г алюминия с
25 г кислорода. Дайте свой ответ целым числом.
При горении метана (CH 4) образуются диоксид углерода и вода. Рассчитайте массу воздуха, необходимую для сжигания 32 г метана, если массовая доля кислорода в воздухе составляет 28,7%.
Итоговое (тематическое) контрольное испытание
ИСПЫТАНИЕ №1 (1). Обобщение и контроль знаний по теме «Исходные химические представления»
Часть A
использовать лупу и пинцет
добавить воду к смеси, затем отфильтровать
пропустить смесь через сито
добавить воду к смеси, затем отфильтровать и выпарить фильтрат
вода дистиллированная, алюминий, воздух
почва, морская вода, духи
медь, железо, свинец
сталь, бронза, мельхиор
простокваша и горение свечи
таяние льда и испарение воды
замерзание воды и гниение остатков
свечение лампочки и образование облаков
PH 3, P 4, O 3
NH 3, N 2, N 2 O
H 2 O, Cl 2, HCl
три атома азота и один атом водорода
один атом азота и три атома водорода
один атом азота и один атом водорода
три атома азота и три атома водорода
Для разделения смеси порошков мела и поваренной соли,
Перечень чистых веществ размещен под номером
Формулы только простых веществ
Молекула аммиака состоит из
Сумма коэффициентов в уравнении реакции фосфора (P) с избытком кислорода (О 2)
Массовая доля цинка в хлориде цинка
Валентность хрома в соединении Cr 2 O 3 составляет
Часть B
А.Атомы — это самые маленькие химически неделимые частицы, из которых состоят молекулы.
B. В физических явлениях молекулы вещества сохраняются, а в химических — разрушаются.
1) оба утверждения верны
2) утверждение A верно, утверждение B неверно
3) утверждение B верно, утверждение A неверно
4) оба утверждения неверны
10. Установите соответствие между уравнением реакции и ее типом.Запишите ответ в
форма последовательности букв и цифр, например А1, В2 и т. Д.
Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O A. Замещение
Fe + 2HCl = FeCl 2 + H 2 B. Соединение
4Fe + 3O 2 = 2Fe 2 O 3 V. Разложение
2Fe (OH) 3 = Fe 2 O 3 + 3H 2 O G. Обмен
ТЕСТ №1 (2). Обобщение и контроль знаний по теме «Исходные химические представления»
Часть A
фильтрация
декантация
дистилляция
сахар, железо, воздух
почва, морская вода, духи
медь, бронза, свинец
сталь, кислород, мельхиор
обугливание сахара и сахарный джем
образование инея и облаков
кислое молоко и газовыделение из бутылки лимонада
образование газа при смешивании соды с уксусом и почернение серебряных изделий
S 8, P 4, NH 3
NaOH, KOH, HNO 3
один атом серы и один атом кислорода
один атом серы и три атома кислорода
один атом серы и два атома кислорода
два атома серы и один атом кислорода
Валентность хрома в соединении CrO 3 составляет
Массовая доля кальция в нитриде кальция
Смесь порошков серы и железа можно разделить с помощью
Перечень смесей размещен под номером
Под номером
описываются только химические явления.Формулы только простых веществ объединены под номером
Молекула оксида серы (IV) состоит из
Сумма коэффициентов в уравнении реакции алюминия с кислородом (О 2) равна
Часть B
Выскажите свое мнение о суждениях:
А.Молекулы веществ находятся в непрерывном движении. Скорость передвижения
молекул зависит от температуры.
B. В физических явлениях молекулы вещества разрушаются, а в химических явлениях
сохраняются.
оба оператора верны
оператор A верен, оператор B неверен
оператор B верен, оператор A неверен
оба оператора неверны
Установите соответствие между уравнением реакции и ее типом.Запишите ответ в
форма последовательности букв и цифр, например А1, В2 и т. Д.
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O A. Замещение
2Al + 6HCl = 2AlCl 3 + 3H 2 B. Соединение
4Al + 3O 2 = 2Al 2 O 3 V. Разложение
2Al (OH) 3 = Al 2 O 3 + 3H 2 O G. Обмен
- обобщить знания по теме «Простые и сложные вещества»;
- формирование коммуникативных навыков студентов при работе в группах.
Оснащение:
- Таблетки с меню на каждый стол — 4 шт .;
- Карта для оценки вклада студента в работу группы;
- Описание заданий (согласно меню) для студентов по каждому столу — 4 шт.
- Кредит на сумму 40 долларов США
- PSCE и таблица растворимости.
Студенты посещают кафе. Формируются 3 группы по 4 человека, каждая группа выбирает ответственный (администраторский) стол.Во время игры работу каждой группы оценивают как учитель, так и одноклассники (противники).
В меню вместо привычных блюд представлены задания по теме. Каждая группа получила кредит в размере 40 долларов США. При решении задач студенты получают оценку в у.е.
Успеваемость студентов оценивается по следующей схеме:
«Отлично» — 1 доллар, «Хорошо» — 2 доллара; «Удовлетворительно» — 3 у.е.
Количество полученных c.u. вычитается из этой ссуды. Побеждает группа, набравшая наибольшее количество очков.
Во время игры каждый участник должен выступить хотя бы 1 раз.
Игра проходит в несколько этапов:
1. «Холодные закуски»
- Кроссворд;
- Определение терминов;
- Распределение веществ по классам.
2. «Горячие блюда»
- Составьте формулы веществ;
- Давать названия веществам;
- Решите проблему по формуле.
3. Напитки
4. «Духи»
Тест № 2: 4 варианта.
5. «Десертный»
Отгадывать загадки.
Карта для оценки вклада студента в работу группы (проводится по 5-балльной шкале)
| Фамилия Имя | Оценка деятельности группы | Самооценка | Оценка учителя | итоговая оценка |
Доброго времени суток! Рад приветствовать вас в химическом кафе Firefly! Целью нашего кафе будет обобщение темы «Простые и сложные вещества».Каждый из вас занял свой стол, и я предлагаю вам выбрать администратора стола, который будет координировать работу его стола.
Прошу ознакомиться с меню. В нем вместо обычных блюд представлены задания по теме. Каждый должен хотя бы раз ответить.
| Деятельность учителя | Деятельность учащихся | Химический состав |
| 1. Краткое сообщение по теме урока Постановка цели. Ознакомление с правилами игры. Вид меню | Участие в определении цели урока. Деление на группы. Подбор ответственного лица в группе. | |
| 2. Холодные закуски Комментарии к заданиям. Подведение итогов 1-го этапа игры | 1. Кроссворд
2. Определите термины:
3.Распределите по классам следующие формулы веществ: Н 2, НС1, Na 2 SO 4, Н 2 SO 4, KNO 3, ВаС1 2, Са (ОН) 2, Н 2 S, NaOH, О 2, Н 2 СО 3. , N, P, KOH, Мg СО 3, CO 2, Na 2 O. | |
| 3. Горячие обеды. Комментарии к заданиям. Контроль за ходом работы в группах. Подведение итогов 2-го этапа. | Подбор горячего блюда группой. Завершение задания. Групповое обсуждение. Рисование на доске задания, выполненного группой.Обсуждение результатов задания. Подсчет израсходованных | долларов США 1. Составьте формулы веществ: N аСО 3, Н S, Ва ОН, А1 С1, Z p S О 4 2. Назовите следующие вещества: 3. Решаем задачу: |
| 4. Напитки. Комментарии к заданиям. Контроль за ходом работы в группах.Подведение итогов 3-го этапа. | Выполнение обучающего тестового задания в группе. Проверка и обсуждение результатов. Выполнение тестов. Подсчет потерянных у.е. | 1. В виде простого вещества кислород содержится в земной коре
2. Азот с наивысшей валентностью присутствует в оксиде
3. Наиболее выраженные неметаллические свойства
4.Формулы оксида, основания, соли соответственно:
5. Количество вещества гидроксида кальция 0,25 моль. Определите его массу. |
| 5. Физическая культура. Динамическая пауза | ||
| 6. Духи Комментарии к заданиям. Контроль за ходом работы в группах. Подведение итогов 4-го этапа. | Отдельное выполнение тестовых заданий … Самотестирование. Заполнение теста (правильные ответы представлены на доске) с подсчетом потраченных у.е. | Тест №2 — 4 варианта |
| 7. Десерт. Комментарии к заданиям. Подведение итогов 5-го этапа. Вручение сладкого приза группе победителей. | Отгадывать загадки. Расчет остатка кредита | 1. Мне, конечно, очень нужно Без меня ужин не приготовишь Огурцы не мариновать Холодец нельзя приправлять. Но не только в воде. Если слеза идет из глаза Ты сразу вспомнишь мой вкус. Кто сообразителен, говорит: Это … (хлорид натрия) 2. Чтобы я мог появиться, (Двуокись углерода — двуокись углерода) 3.Горю синим пламенем |
| 8. Домашнее задание по формулированию | Запись домашнего задания | Сделайте синквейн. У кого проблемы повторить § 17-21. |
Десертные задания:
- Что называется белым золотом? ( Хлопок. )
- Какое химическое вещество называется супом со свеклой и другими овощами? ( Б — борщ.)
- Что называют «живым серебром»? ( Рыба. )
- Как называется мех пушных зверей? ( Пушистое золото. )
- Выкиньте 4-ю букву в названии горной антилопы, и вы получите название химического элемента шестой группы ( Серна — это сера. )
- Начинается с маленького грызуна, заканчивается быком, как называется химический элемент? ( Мышьяк. )
- Какой химический элемент «зовет» кошку в гости? ( Кислород.)
Естественные науки 8 класс
Существует только два класса чистых веществ, а именно элементов и соединений . Чтобы понять разницу между ними, взгляните на две диаграммы ниже.
На диаграмме слева представлен элемент. Вы видите, что все атомы одного вида? Элемент — это материал, состоящий из атомов только одного вида.
Теперь посмотрите на диаграмму справа, представляющую комплекс.На этой диаграмме показаны две важные вещи о соединениях:
Соединение — это материал, состоящий из двух или более атомов, которые химически связаны друг с другом.
Теперь мы рассмотрим каждый из этих классов отдельно и обсудим несколько примеров каждого из них.
Элементы
Мы только что узнали, что элемент состоит из атомов одного вида. Это означает, что если бы у нас был кусок металлической меди, он бы полностью состоял из атомов меди. Точно так же кусок серебра будет полностью состоять из атомов серебра.Медь и серебро выглядят по-разному и имеют разные свойства, потому что состоят из разных атомов. Взгляните на следующую таблицу, которая иллюстрирует субмикроскопическое изображение атомов, а также ювелирное изделие, сделанное из каждого из различных металлов.
ВОПРОСЫ:
Почему атомы серебра больше, чем атомы меди на предыдущих диаграммах? Подсказка: найдите два элемента в Периодической таблице и сравните их положение.Серебро находится ниже меди в Периодической таблице, что означает, что атомы серебра больше, чем атомы меди.
Считаете ли вы, что вещество, представленное на следующей диаграмме, является элементом? Чтобы помочь вам ответить на вопрос, просмотрите вопросы под диаграммой.
Сначала запишите то, что вы видите на картинке.Учащиеся могут сказать, что видят пары атомов, слипшихся вместе.
Грозди плотно упакованы или далеко друг от друга?Они относительно далеко друг от друга.
Что это обозначает? Как вы думаете, это вещество — твердое, жидкое или газообразное?
Как вы думаете, это смесь веществ или чистое вещество? Почему ты так думаешь?Это чистое вещество, потому что все молекулы выглядят одинаково.
Все ли атомы одного вида?
Какой класс веществ состоит только из одного вида атомов?
Является ли вещество элементом? Почему?Вещество является элементом, потому что оно состоит только из одного вида атома.
Примечание: На самом деле это двухатомные элементы, такие как кислород (O 2 ), азот (N 2 ), водород (H 2 ), которые существуют в виде двухатомных (двухатомных) молекул при комнатной температуре. .
Могут ли элементы состоять из молекул?
Не важно, чтобы учащиеся ответили на этот вопрос; он предназначен для введения понятия, что оба элемента и соединения могут существовать как молекулы, но что молекулы элементов фундаментально отличаются от молекул соединений.
Кластеры атомов в предыдущем примере называются молекулами. Молекула — очень важное слово в химии. Молекула — это два или более атома, которые химически связаны друг с другом.
Атомы в молекуле могут быть одного типа (в этом случае это может быть молекула элемента) или они могут быть разных типов (в этом случае это может быть молекула соединения).
Не все элементы имеют молекулы. Металлы в левой и средней части Периодической таблицы представляют собой твердые тела при комнатной температуре, поэтому они существуют в виде плотно упакованных массивов атомов, как в предыдущих примерах серебра и меди.
Многие из неметаллов в правой части Периодической таблицы представляют собой газы при комнатной температуре, которые существуют в виде молекул, состоящих из двух атомов каждая.Их называют двухатомных молекул . Изображение элемента, которое мы обсуждали ранее, показывает, как выглядят двухатомные молекулы. Кислород (O 2 ), азот (N 2 ), водород (H 2 ), хлор (Cl 2 ) и некоторые другие элементы неметаллов образуют двухатомные молекулы.
Нарисуйте изображение одной из этих двухатомных молекул в пространстве ниже.
Учащиеся должны нарисовать два соединенных друг с другом круга одинакового размера и цвета.Предлагается научить учащихся создавать некоторые из двухатомных молекул с помощью бусинок, шариков из пластилина и т. Д. Убедитесь, что они знают, что бусинки теперь представляют собой целые атомы, а не субатомные частицы.
Двухатомный относится к молекуле, состоящей из двух одинаковых атомов, связанных вместе, как в кислороде (O 2 ). «Ди» означает два. Трехатомный относится к молекуле, состоящей из трех одинаковых атомов, связанных вместе, как озон (O 3 ).
Это краткий обзор того, что учащиеся только что узнали об атомах и молекулах, и возможность различать их.
Давайте убедимся, что понимаем разницу между атомами и молекулами.
ВОПРОСЫ:
Посмотрите на следующие схемы. Решите, представляет ли каждый из них атом или молекулу. Если это молекула, укажите, сколько атомов составляет молекула.
Диаграмма | Атом или молекула? |
Атом | |
Молекула из 2 атомов | |
Молекула из 4 атомов | |
Молекула из 9 атомов |
Посмотрите на следующую сложную молекулу.
Сколько атомов состоит в этой молекуле?
Сколько различных типов атомов состоит в этой молекуле?В состав этой молекулы входят 3 различных типа атомов.
Что удерживает атомы вместе в этой молекуле?Между атомами существуют химические связи.
Теперь давайте подумаем об этом: если соединения состоят из двух или более видов атомов, это будет означать, что соединения состоят из двух или более различных элементов, которые объединились.
Соединения
По мере того, как вы читаете этот материал, предложите учащимся создавать свои собственные молекулы, используя бусинки или пластилин на столе перед ними.
В известной нам Вселенной как минимум 118 элементов. Они могут образовывать соединения, связываясь в миллионы различных комбинаций — их слишком много, чтобы здесь обсуждать! Мы рассмотрим несколько простых комбинаций элементов, чтобы проиллюстрировать идею.
Поскольку вода является таким важным компонентом для организмов, живущих на Земле, мы будем использовать это в качестве нашего первого примера.Ученые знают, что молекула воды состоит из одного атома кислорода и двух атомов водорода. Если бы мы могли их увидеть, все молекулы воды были бы немного похожи на эту диаграмму молекулы воды.
Представление молекулы воды.Международный союз теоретической и прикладной химии (IUPAC) называет воду монооксидом дигидрогена.
Все молекулы воды абсолютно одинаковы. Мы говорим, что атомы связаны в фиксированном соотношении : два атома водорода на каждый атом кислорода.Атомы в молекуле удерживаются вместе особой силой, которую мы называем «химической связью ».
Эти связи известны как ковалентные связи, но учащиеся пока не обязаны это знать. На этом этапе вы также можете напомнить учащимся, что диаграммы молекул — это просто представления, и мы используем разные цвета, чтобы различать атомы разных элементов. Атомы кислорода на самом деле не красные.
Химические формулы
Можете ли вы вспомнить, что у каждого элемента есть свой уникальный химический символ? Мы можем объединить эти символы в химическую формулу воды.Химическая формула — еще одно очень важное понятие в химии.
Химическая формула воды: H 2 O. Она показывает отношение атомов водорода (два) к атомам кислорода (один) в одной молекуле воды. Как вы думаете, о чем нам говорит химическая формула CO 2 ?
Он говорит нам, что один атом углерода (C) связан с двумя атомами кислорода (O) в CO 2 . На этом этапе предлагается написать несколько химических формул на доске и попросить учащихся объяснить вам, что каждый из них говорит вам.Попросите учащихся делать заметки на боковых полях своих рабочих тетрадей, пока вы обсуждаете это в классе. Это послужит введением к следующему занятию. Например, вы также можете написать:
H 2 для газообразного водорода, что означает, что два атома водорода связаны вместе. Это двухатомная молекула.
- NaCl для хлорида натрия (поваренная соль), что означает, что один атом натрия связан с одним атомом хлора.
KMnO4 — перманганат калия.Это может быть немного сложнее, но подчеркивает, что молекула может состоять более чем из двух разных элементов. Здесь один калий, один марганец, один атом азота и четыре атома кислорода связаны вместе, образуя одну молекулу.
В следующем упражнении мы попрактикуемся в написании и понимании химических формул. Всегда полезно думать о новой концепции разными способами. По этой причине мы также собираемся построить модели молекул, для которых пишем формулы.
МАТЕРИАЛЫ:
- Пластилин или пластилин разных цветов
ИНСТРУКЦИЯ:
- В следующей таблице названия некоторых чистых веществ приведены в левом столбце. Заполните все пустые блоки в таблице.
- Постройте модель одной молекулы каждого соединения на столе. Ваши атомы должны быть размером с горошину. Это может помочь вам построить модель до того, как нарисовать молекулу в правом столбце.Когда вы закончите, покажите своему учителю.
Чтобы помочь вам в этом, вот несколько рекомендаций:
- Каждая строка в таблице содержит достаточно информации, чтобы вы могли заполнить все пустые блоки.
- Первая строка заполнена за вас, так что у вас есть пример:
- В графе 1 указано название: вода
Колонка 2 содержит формулу: H 2 O
Колонка 3: Формула воды (в колонке 2) содержит всю информацию, которая нам нужна для заполнения блока в «Из чего она сделана?» столбец.Когда мы читаем формулу H 2 O, нижний индекс «2» говорит нам, что существует два атома H. Поскольку у O нет нижнего индекса, это означает, что существует только один атом O.
- Колонка 4: Модель молекулы воды должна отражать наличие одного атома О и двух атомов Н. Откуда мы знаем, что О должен быть посередине? На данный момент достаточно знать, что атом, которого у нас меньше всего, обычно находится посередине.
На этом этапе не важно, чтобы учащиеся правильно знали точные углы между атомами, такие как угол между атомами водорода в молекуле воды, поскольку они узнают только о том, что влияет на это позже, в Gr.10-12.
Название вещества | Химическая формула | Из чего он сделан? | Как бы выглядела молекула этого соединения (если бы мы могли ее увидеть)? |
Вода | H 2 O | Два атома H и один атом O | |
Углекислый газ 9802 0 CO 2 | |||
Диоксид серы | |||
Сероводород | H 2 S | ||
Аммиак | Один атом N и три атома H | ||
Газообразный кислород | Два атома O | ||
Газообразный азот | N 2 | ||
Газообразный хлор | |||
Водородный газ | Два атома H |
Заполненная таблица должна выглядеть следующим образом.
Название вещества | Химическая формула | Из чего он сделан? | Как бы выглядела молекула этого соединения (если бы мы могли ее увидеть)? | |||
Вода | H 2 O | Два атома H и один атом O | ||||
Углекислый газ 98020 CO 2 Два атома O и один атом C | ||||||
Двуокись серы | SO 2 | Два атома O и один атом S | ||||
| 02 сероводород H 2 S | Два атома H и один атом S | |||||
Аммиак | NH 3 | Один атом N3 | Газообразный кислород | O 2 | Два атома O | 90 807 |
Газообразный азот | N 2 | Два атома азота | ||||
Газообразный хлор | 9089 Cl | Cl 9118 | ||||
Водородный газ | H 2 | Два атома H |
ВОПРОСЫ:
Перечислите все вещества из таблицы, которые являются элементами.Напишите их имена и формулы.Водород, H 2
Кислород, O 2
Хлор, Cl 2
Азот, N 2
Перечислите все вещества из таблицы, которые являются соединениями. Напишите их имена и формулы.Вода, H 2 O
Двуокись углерода, CO 2
Диоксид серы, SO 2
Натрия хлорид, NaCl
Сероводород, H 2 S
Аммиак, NH 3
Как вы узнали, какие вещества в таблице являются соединениями, а не элементами?
Вы, вероятно, искали, чтобы увидеть, какие из них состоят из более чем одного вида атомов.Соединение — это материал, состоящий из атомов двух или более различных элементов. Элементы не просто физически смешаны, но химически связаны друг с другом на атомном уровне.
Вода (H 2 O), диоксид углерода (CO 2 ) и соль или хлорид натрия (NaCl) являются примерами соединений, в то время как газообразный кислород (O 2 ), газообразный водород (H 2 ) и газообразный азот (N 2 ) являются примерами элементов.
Соединение формулы H 2 O 2 также состоит из атомов водорода и кислорода.Формула говорит нам, что одна молекула этого вещества состоит из двух атомов водорода и двух атомов кислорода. H 2 O 2 то же самое, что вода? Как вы думаете?
Не путайте H 2 O 2 с H 2 O! H 2 O 2 представляет собой соединение, называемое перекисью водорода. Перекись водорода похожа на воду в том, что при комнатной температуре (25 ° C) это прозрачная бесцветная жидкость, хотя и не такая жидкая, но во многом отличается.Следующие свойства перекиси водорода могут убедить вас, что это не то же самое, что вода:
- Пероксид водорода имеет температуру кипения 150 ° C и является очень эффективным отбеливателем для одежды и волос.
- Концентрированная перекись водорода настолько реактивна, что используется в качестве компонента ракетного топлива!
- Перекись водорода чрезвычайно агрессивна.
- Мы можем пить воду, но перекись водорода очень опасна и вредна.
Коррозионные вещества — это вещества, которые вызывают повреждение металла или других материалов в результате химического процесса.Представьте, что дождевая вода вызывает ржавчину, разъедающую металл.
Если это вас не убеждает, давайте сравним, как выглядит молекула перекиси водорода рядом с водой:
Перекись водорода. Вода.Несмотря на то, что они состоят из одних и тех же элементов, эти два соединения очень разные, и их никогда не следует путать друг с другом.
Целью приведенного выше сравнения перекиси водорода и воды было показать вам, что атомы в данном соединении всегда соединяются в фиксированном соотношении.Во всех молекулах воды во Вселенной всегда будет один атом O и два атома H, связанные вместе.
Это был пятый постулат Далтона:
5. Атомы химически соединяются в фиксированных соотношениях с образованием соединений.
Как атомы «сочетаются»? Что заставляет их слипаться и образовывать молекулы?
Химические связи
Посмотрите на фото с различным расположением металлических шариков. Эти шарики магнитные, и это позволяет вам создавать разные узоры, склеивая их вместе.Что заставляет магниты склеиваться?
Учащиеся могут сказать, что магниты слипаются, потому что они притягивают друг друга. Укажите им, что магниты действительно будут притягиваться друг к другу, если они выстроены правильно. Магниты также могут отталкивать друг друга, если они расположены по-другому. Учащиеся будут больше изучать магнитные силы в Gr. 9 Энергия и перемены.
Эти шары магнитные. http://www.flickr.com/photos/uscpsc/6331652875/Магниты притягивают (или отталкивают) друг друга из-за магнитной силы между ними (вы узнаете больше о магнитах в Gr.9). Когда атомы объединяются, они делают это, потому что они также испытывают силу притяжения. Сила немного сложнее, чем сила между магнитами, но работает она так же: сила удерживает атомы вместе, как будто они склеены клеем. Силы, удерживающие атомы вместе, называются химическими связями .
В молекуле воды химические связи между O и двумя атомами H удерживают всю молекулу вместе. Сколько химических связей в каждой молекуле воды? Если вы не уверены, посмотрите на диаграмму ниже:
Две облигации.Если вы хотите вывести учащихся за рамки требований учебной программы на данном этапе, вы можете дать краткое объяснение электронного обмена. Детали этого будут изучены только в Gr. 10. Эти прочные химические связи, называемые ковалентными связями, образуются, когда атомы делятся своими электронами. Это объясняет, почему после реакции разложения атомы немедленно преобразуются во что-то еще: требование совместного использования электронов, которое привело к первоначальной связи, все еще существует, они просто разделяют электроны с другим атомом.
Молекула воды имеет две идентичные связи O-H. Что бы произошло, если бы у нас было достаточно энергии, чтобы разорвать эти узы?
Если бы у нас было достаточно энергии, чтобы разорвать связи O-H, мы смогли бы отделить атомы друг от друга.
Что было бы, если бы мы разделили молекулы воды на их атомы? Теоретически у нас были бы атомы водорода и кислорода. На самом деле происходит то, что атомы водорода немедленно объединяются с образованием H 2 , а атомы кислорода немедленно объединяются с образованием O 2 .
Когда атомы отделяются друг от друга и рекомбинируют в различные комбинации атомов, мы говорим, что произошла химическая реакция .
В ходе указанной выше химической реакции вода разложилась (распалась) и рекомбинировала на более мелкие молекулы. Мы говорим, что вода претерпела реакцию разложения в приведенном выше примере. Конечно, не все химические реакции являются реакциями разложения. Существует много различных видов химических реакций, и мы собираемся исследовать некоторые примеры в следующем разделе.
Химические реакции
Во всех химических реакциях происходят два важных события:
- химические связи разорваны
- новые химические связи образуют
Это означает, что в всех химических реакциях атомы в молекулах перестраиваются, образуя новые молекулы.
В следующем упражнении мы собираемся смоделировать реакцию разложения воды, используя глину или шарики из пластилина для представления различных атомов.
Это дополнительное расширение.Позднее в семестре учащиеся будут больше изучать химические реакции.
МАТЕРИАЛЫ:
- Пластилин или пластилин двух разных цветов
ИНСТРУКЦИЯ:
- Соберите две молекулы воды из глины или пластилина. Посмотрите на предыдущие изображения, чтобы напомнить вам, как выглядит молекула воды. Вы можете использовать глину любого цвета для создания своей.
- Теперь разорвите все связи, удерживающие молекулы вместе, разделив их на отдельные атомы.
Ответьте на следующие вопросы:
Сколько у вас атомов водорода (H)?
Сколько у вас атомов кислорода (O)?
Объедините атомы водорода и кислорода в молекулы водорода (H 2 ) и молекулы кислорода (O 2 ).
Ответьте на следующие вопросы:
Сколько молекул водорода можно построить из атомов H?Две молекулы водорода (H 2 ) могут состоять из четырех атомов водорода.
Сколько молекул кислорода можно построить из атомов кислорода?Одна молекула кислорода (O 2 ) может состоять из двух атомов O.
Можете ли вы написать химическое уравнение для реакции, которую вы только что построили, с помощью глиняных моделей? Посмотрите на схему для вдохновения:
2 H 2 O \ (\ rightarrow \) 2 H 2 + O 2
Химические уравнения будут правильно представлены в последней главе Gr.8 Материя и материалы, но это может быть хорошим местом, чтобы привлечь к этому внимание учащихся. Вы могли бы объяснить, что когда есть только одна молекула определенного типа (O 2 в приведенном выше примере), мы не пишем число перед ней в химической реакции. На данном этапе балансировка уравнений не требуется.
Давайте посмотрим на другой пример химической реакции: реакция, когда углерод (в угле) реагирует с кислородом (в воздухе) с образованием диоксида углерода:
Вы можете использовать шарики из пластилина, чтобы имитировать эту реакцию.
Попытайтесь написать химическое уравнение реакции, когда углерод и кислород соединяются с образованием диоксида углерода. (Подсказка: используйте диаграмму, чтобы направлять вас.)
C + O 2 \ (\ rightarrow \) CO 2
Как атомы угля и кислорода перегруппировываются с образованием диоксида углерода? Какие облигации рвутся?
Связь между двумя атомами кислорода разрывается.
Какие новые облигации образуют?
Две новые углерод-кислородные связи образуются при образовании диоксида углерода.
Затем ваш учитель продемонстрирует классу две химические реакции. Ваша задача — внимательно наблюдать и записывать свои наблюдения, которые вы можете видеть в происходящем.
Мы предлагаем сделать это в качестве демонстрации или провести несколько экспериментов в классе, за которыми могут наблюдать разные группы учащихся. Видео в окне для посещения содержит простую демонстрацию электролиза с использованием сульфата меди вместо хлорида меди. Но наблюдения будут такими же, а именно: металлическая медь покрывает катод, и вы можете наблюдать пузырьки газа на аноде (на видео это газообразный кислород, а не газообразный хлор, как в исследовании здесь, в рабочей тетради.
Видео, демонстрирующее аналогичную реакцию с использованием сульфата меди.
ЦЕЛЬ: Определить, можно ли разложить хлорид меди с помощью электроэнергии.
МАТЕРИАЛЫ И АППАРАТ:
- стакан
- картонный диск, достаточно большой, чтобы закрыть верхнюю часть стакана
- два графитовых электрода
- 2 бита провода
- Растворы хлорида меди
- Аккумулятор 9 В
Вместо графитовых электродов можно также получить угольные электроды из использованных ячеек горелки.
Длина провода с зажимами типа «крокодил» на обоих концах является идеальной. Они понадобятся вам для построения электрической цепи. Включение переключателя в схему не является обязательным.
Раствор хлорида меди можно приготовить, растворив две чайные ложки хлорида меди (II) в стакане водопроводной воды.
Перед запуском сделайте следующие наблюдения:
Какого цвета раствор хлорида меди?Какого цвета графитовые электроды?
МЕТОД:
- Налейте раствор хлорида меди в стакан.
- Сделайте два небольших отверстия в картонном диске и протолкните электроды через отверстия, как показано на следующем рисунке.
- Поместите диск над стаканом так, чтобы большая часть каждого электрода находилась под поверхностью раствора.
- Подсоедините верхние части электродов к концам батареи с помощью длин проводов. Взгляните на схему экспериментальной установки.
- Дайте реакции развиться в течение нескольких минут и понаблюдайте за тем, что происходит.
- Когда реакция продолжается примерно 10 минут, можно отсоединить провода и разобрать установку.
НАБЛЮДЕНИЯ:
Что вы наблюдаете на поверхности двух электродов после того, как реакция продолжалась в течение нескольких минут?Один электрод покрывается маленькими пузырьками, а другой становится коричневым.
Какого цвета в конце эксперимента был хлорид меди?Решение все еще синее.
Если вы сохранили часть исходного решения, учащиеся могут сравнить решение до и после эксперимента. Они могут заметить, что решение «после» не такое синее, как решение «до». Попросите учащихся задуматься, почему это могло быть. Это связано с двумя причинами:
- ионы меди выходят из раствора, поскольку они принимают электроны и превращаются в твердую медь, которая выделяется на катоде красновато-коричневого цвета. (Учащиеся еще не знают об обмене ионами или электронами, поэтому они могут предположить, что атомы / частицы меди выходят из раствора и накапливаются на электроде.)
ионов хлора образуют газообразный хлор Cl 2 на аноде. (Учащиеся могут наблюдать образование пузырьков газа на другом электроде и, возможно, сделать вывод, что это хлорид, выходящий из раствора в виде газообразного хлора.)
Следовательно, , концентрация раствора хлорида меди становится слабее, в результате чего он становится немного менее синим.
Как изменился внешний вид графитовых электродов?Один электрод остается темно-серым или черным.Другой электрод покрыт красновато-коричневым слоем.
Можно отметить, что электрод, который остался серо-черным, был тем же электродом, на котором раньше были пузырьки. Попросите учащихся почувствовать запах этого электрода. Они могут чувствовать запах отбеливателя, который представляет собой запах газообразного хлора Cl 2 . Попросите учащихся сравнить цвет слоя с цветом медной монеты. Может ли налет на втором электроде быть медью? Да, это.
Учащимся не нужно понимать, что происходит в растворе на ионном уровне.Акцент здесь делается на демонстрации того, что соединение можно разбить на элементы. Тем не менее, объяснение электролиза раствора хлорида меди (II) приводится здесь для справки, и если вы хотите расширить свои знания учащихся:
Когда электроды подключены к источнику питания, электроны перемещаются, заставляя электрод, прикрепленный к положительному концу батареи, становиться положительным. Он называется анодом . Затем отрицательно заряженные ионы хлорида в растворе притягиваются к положительному аноду.Ионы хлора отдают свои электроны и образуют газообразный хлор, который наблюдается в виде пузырьков.
Электрод, прикрепленный к отрицательному полюсу батареи, становится отрицательным. Он называется катодом . На катоде положительно заряженные ионы меди в растворе притягиваются к отрицательному электроду. На катоде ионы меди приобретают электроны, образуя металлическую медь, которая осаждается на катоде. Наблюдается коричневый налет.
(Вы можете попросить учащихся нарисовать положительные и отрицательные знаки и пометить электроды на схемах в своих рабочих тетрадях в качестве дополнения.)
Электрод, прикрепленный к положительной стороне батареи, является положительным электродом и называется анодом . Электрод, прикрепленный к отрицательной стороне батареи, является отрицательным электродом и называется катодом .
Обобщите ваши экспериментальные наблюдения в следующей таблице.
Раствор хлорида меди | Электрод 1 (называемый анодом) | Электрод 2 (называемый катодом) | ||
До эксперимента | 908 эксперимент |
Раствор хлорида меди | Электрод 1 (называемый анодом) | Электрод 2 (называемый катодом) | |
До эксперимента | синий раствор цвет. | Темно-серая поверхность. | Темно-серая поверхность. |
После эксперимента | Раствор все еще был синим, но цвет был менее интенсивным. | Поверхность темно-серая, но со слабым запахом отбеливателя. Во время реакции пузырьков не наблюдалось. | Красновато-коричневый налет на поверхности. |
АНАЛИЗ И ОБСУЖДЕНИЕ:
Что придало раствору хлорида меди интенсивный синий цвет?Растворенный в нем хлорид меди.
Как вы думаете, часть хлорида меди могла измениться во время реакции во что-то другое? Объясните, почему вы так думаете.Раствор хлорида меди стал менее голубым. Это говорит нам о том, что часть хлорида меди превратилась во что-то другое.
Как бы вы объяснили появление пузырьков на поверхности первого электрода? Вы хоть представляете, какими они могли быть? Подсказка: чем пахнет электрод потом?Пузырьки означают, что на поверхности электрода образовался газ.Пахло отбеливателем. Газообразный хлор также пахнет отбеливателем, поэтому возможно, что газ, образующийся на электроде, мог быть хлором.
Примечание: Хлор фактически является активным ингредиентом отбеливателя.
Вы знаете, что такое красновато-коричневый налет на втором электроде? Подсказка: какой металл имеет такой же характерный красновато-коричневый цвет?Возможно, красновато-коричневый налет — это медь.
Как мы узнаем, что произошла химическая реакция?Атомы в хлориде меди были перегруппированы, чтобы образовать различные материалы: медь (Cu) и хлор (Cl 2 ).
ВЫВОД:
Напишите заключение для расследования. В своем заключении вам следует переписать цель расследования в изложение результатов вашего расследования.Заключение обучаемого должно содержать как минимум два из следующего:
Как вы думаете, возможно ли разделить хлорид меди на медь и хлор с помощью любого из методов физического разделения, о которых мы узнали в Gr.7 Материя и материалы, такие как просеивание, фильтрация, выпаривание, дистилляция или хроматография? Вот подсказка: ни один из этих методов не может разорвать связи между атомами в веществе.
Ответ — нет. Медь и хлор химически связаны в хлориде меди. Мы знаем это из его химической формулы: CuCl 2 . Методы физического разделения могут использоваться только для разделения смесей на вещества, из которых они состоят.
На данный момент мы узнали об атомах, молекулах, элементах и соединениях.Иногда эти концепции сбивают с толку, потому что они описывают вещи, которые слишком малы, чтобы их можно было увидеть, а иногда и трудно представить. В следующем разделе мы вернемся к идее смесей и посмотрим, как все, что мы узнали до сих пор, можно поместить в схему классификации материи и материалов.
Строительные блоки материи | Атомы
Есть только два класса чистых веществ, а именно элементов и соединений . Чтобы понять разницу между ними, взгляните на две диаграммы ниже.
На диаграмме слева представлен элемент. Вы видите, что все атомы одного вида? Элемент — это материал, состоящий из атомов только одного вида.
Теперь посмотрите на диаграмму справа, представляющую комплекс. На этой диаграмме показаны две важные вещи о соединениях:
Соединение — это материал, состоящий из двух или более атомов, которые химически связаны друг с другом.
Теперь мы рассмотрим каждый из этих классов отдельно и обсудим несколько примеров каждого из них.
Элементы
Мы только что узнали, что элемент состоит из атомов одного вида. Это означает, что если бы у нас был кусок металлической меди, он бы полностью состоял из атомов меди. Точно так же кусок серебра будет полностью состоять из атомов серебра. Медь и серебро выглядят по-разному и имеют разные свойства, потому что состоят из разных атомов. Взгляните на следующую таблицу, которая иллюстрирует субмикроскопическое изображение атомов, а также ювелирное изделие, сделанное из каждого из различных металлов.
ВОПРОСЫ:
Почему атомы серебра больше, чем атомы меди на предыдущих диаграммах? Подсказка: найдите два элемента в Периодической таблице и сравните их положение.Серебро находится ниже меди в Периодической таблице, что означает, что атомы серебра больше, чем атомы меди.
Считаете ли вы, что вещество, представленное на следующей диаграмме, является элементом? Чтобы помочь вам ответить на вопрос, просмотрите вопросы под диаграммой.
Сначала запишите то, что вы видите на картинке.Учащиеся могут сказать, что видят пары атомов, слипшихся вместе.
Грозди плотно упакованы или далеко друг от друга?Они относительно далеко друг от друга.
Что это обозначает? Как вы думаете, это вещество — твердое, жидкое или газообразное?
Как вы думаете, это смесь веществ или чистое вещество? Почему ты так думаешь?Это чистое вещество, потому что все молекулы выглядят одинаково.
Все ли атомы одного вида?
Какой класс веществ состоит только из одного вида атомов?
Является ли вещество элементом? Почему?Вещество является элементом, потому что оно состоит только из одного вида атома.
Примечание: На самом деле это двухатомные элементы, такие как кислород (O 2 ), азот (N 2 ), водород (H 2 ), которые существуют в виде двухатомных (двухатомных) молекул при комнатной температуре. .
Могут ли элементы состоять из молекул?
Не важно, чтобы учащиеся ответили на этот вопрос; он предназначен для введения понятия, что оба элемента и соединения могут существовать как молекулы, но что молекулы элементов фундаментально отличаются от молекул соединений.
Кластеры атомов в предыдущем примере называются молекулами. Молекула — очень важное слово в химии. Молекула — это два или более атома, которые химически связаны друг с другом.
Атомы в молекуле могут быть одного типа (в этом случае это может быть молекула элемента) или они могут быть разных типов (в этом случае это может быть молекула соединения).
Не все элементы имеют молекулы. Металлы в левой и средней части Периодической таблицы представляют собой твердые тела при комнатной температуре, поэтому они существуют в виде плотно упакованных массивов атомов, как в предыдущих примерах серебра и меди.
Многие из неметаллов в правой части Периодической таблицы представляют собой газы при комнатной температуре, которые существуют в виде молекул, состоящих из двух атомов каждая. Их называют двухатомных молекул .Изображение элемента, которое мы обсуждали ранее, показывает, как выглядят двухатомные молекулы. Кислород (O 2 ), азот (N 2 ), водород (H 2 ), хлор (Cl 2 ) и некоторые другие элементы неметаллов образуют двухатомные молекулы.
Нарисуйте изображение одной из этих двухатомных молекул в пространстве ниже.
Учащиеся должны нарисовать два соединенных друг с другом круга одинакового размера и цвета.Предлагается научить учащихся создавать некоторые из двухатомных молекул с помощью бусинок, шариков из пластилина и т. Д. Убедитесь, что они знают, что бусинки теперь представляют собой целые атомы, а не субатомные частицы.
Двухатомный относится к молекуле, состоящей из двух одинаковых атомов, связанных вместе, как в кислороде (O 2 ). «Ди» означает два. Трехатомный относится к молекуле, состоящей из трех одинаковых атомов, связанных вместе, как озон (O 3 ).
Это краткий обзор того, что учащиеся только что узнали об атомах и молекулах, и возможность различать их.
Давайте убедимся, что понимаем разницу между атомами и молекулами.
ВОПРОСЫ:
Посмотрите на следующие схемы.Решите, представляет ли каждый из них атом или молекулу. Если это молекула, укажите, сколько атомов составляет молекула.
Схема | Атом или молекула? |
Схема | Атом или молекула? |
Атом | |
Молекула из 2 атомов | |
Молекула из 4 атомов | |
Атом | |
Молекула из 9 атомов |
Посмотрите на следующую сложную молекулу.
Сколько атомов состоит в этой молекуле?
Сколько разных типов атомов состоит в этой молекуле?В состав этой молекулы входят 3 различных типа атомов.
Что удерживает атомы вместе в этой молекуле?Между атомами существуют химические связи.
Теперь давайте подумаем об этом: если соединения состоят из двух или более видов атомов, это будет означать, что соединения состоят из двух или более различных элементов, которые объединились.
Соединения
По мере того, как вы читаете этот материал, предложите учащимся создавать свои собственные молекулы, используя бусинки или пластилин на столе перед ними.
В известной нам Вселенной как минимум 118 элементов. Они могут образовывать соединения, связываясь в миллионы различных комбинаций — их слишком много, чтобы здесь обсуждать! Мы рассмотрим несколько простых комбинаций элементов, чтобы проиллюстрировать идею.
Поскольку вода является таким важным компонентом для организмов, живущих на Земле, мы будем использовать это в качестве нашего первого примера. Ученые знают, что молекула воды состоит из одного атома кислорода и двух атомов водорода. Если бы мы могли их увидеть, все молекулы воды были бы немного похожи на эту диаграмму молекулы воды.
Представление молекулы воды.Международный союз теоретической и прикладной химии (IUPAC) называет воду монооксидом дигидрогена.
Все молекулы воды абсолютно одинаковы. Мы говорим, что атомы связаны в фиксированном соотношении : два атома водорода на каждый атом кислорода. Атомы в молекуле удерживаются вместе особой силой, которую мы называем «химической связью ».
Эти связи известны как ковалентные связи, но учащиеся пока не обязаны это знать. На этом этапе вы также можете напомнить учащимся, что диаграммы молекул — это просто представления, и мы используем разные цвета, чтобы различать атомы разных элементов.Атомы кислорода на самом деле не красные.
Химические формулы
Можете ли вы вспомнить, что у каждого элемента есть свой уникальный химический символ? Мы можем объединить эти символы в химическую формулу воды. Химическая формула — еще одно очень важное понятие в химии.
Химическая формула воды: H 2 O. Она показывает отношение атомов водорода (два) к атомам кислорода (один) в одной молекуле воды.Как вы думаете, о чем нам говорит химическая формула CO 2 ?
Он говорит нам, что один атом углерода (C) связан с двумя атомами кислорода (O) в CO 2 . На этом этапе предлагается написать несколько химических формул на доске и попросить учащихся объяснить вам, что каждый из них говорит вам. Попросите учащихся делать заметки на боковых полях своих рабочих тетрадей, пока вы обсуждаете это в классе. Это послужит введением к следующему занятию.Например, вы также можете написать:
H 2 для газообразного водорода, что означает, что два атома водорода связаны вместе. Это двухатомная молекула.
- NaCl для хлорида натрия (поваренная соль), что означает, что один атом натрия связан с одним атомом хлора.
KMnO4 — перманганат калия. Это может быть немного сложнее, но подчеркивает, что молекула может состоять более чем из двух разных элементов.Здесь один калий, один марганец, один атом азота и четыре атома кислорода связаны вместе, образуя одну молекулу.
В следующем упражнении мы попрактикуемся в написании и понимании химических формул. Всегда полезно думать о новой концепции разными способами. По этой причине мы также собираемся построить модели молекул, для которых пишем формулы.
МАТЕРИАЛЫ:
- Пластилин или пластилин разных цветов
ИНСТРУКЦИЯ:
- В следующей таблице названия некоторых чистых веществ приведены в левом столбце.Заполните все пустые блоки в таблице.
- Постройте модель одной молекулы каждого соединения на столе. Ваши атомы должны быть размером с горошину. Это может помочь вам построить модель до того, как нарисовать молекулу в правом столбце. Когда вы закончите, покажите своему учителю.
Чтобы помочь вам в этом, вот несколько рекомендаций:
- Каждая строка в таблице содержит достаточно информации, чтобы вы могли заполнить все пустые блоки.
- Первая строка заполнена за вас, так что у вас есть пример:
- В графе 1 указано название: вода
Колонка 2 содержит формулу: H 2 O
Колонка 3: Формула воды (в колонке 2) содержит всю информацию, которая нам нужна для заполнения блока в «Из чего она сделана?» столбец.Когда мы читаем формулу H 2 O, нижний индекс «2» говорит нам, что существует два атома H. Поскольку у O нет нижнего индекса, это означает, что существует только один атом O.
- Колонка 4: Модель молекулы воды должна отражать наличие одного атома О и двух атомов Н. Откуда мы знаем, что О должен быть посередине? На данный момент достаточно знать, что атом, которого у нас меньше всего, обычно находится посередине.
На этом этапе не важно, чтобы учащиеся правильно знали точные углы между атомами, такие как угол между атомами водорода в молекуле воды, поскольку они узнают только о том, что влияет на это позже, в Gr.10-12.
Название вещества | Химическая формула | Из чего он сделан? | Как бы выглядела молекула этого соединения (если бы мы могли ее увидеть)? |
Вода | H 2 O | Два атома H и один атом O | |
Двуокись углерода | CO 2 | ||
Диоксид серы | |||
Сероводород | H 2 S | ||
Аммиак | Один атом N и три атома H | ||
Газообразный кислород | Два атома O | ||
Газообразный азот | N 2 | ||
Газообразный хлор | |||
Водородный газ | Два атома H |
Заполненная таблица должна выглядеть следующим образом.
Название вещества | Химическая формула | Из чего он сделан? | Как бы выглядела молекула этого соединения (если бы мы могли ее увидеть)? |
Вода | H 2 O | Два атома H и один атом O | |
Двуокись углерода | CO 2 | Два атома O и один атом C | |
Диоксид серы | СО 2 | Два атома O и один атом S | |
Сероводород | H 2 S | Два атома H и один атом S | |
Аммиак | NH 3 | Один атом N и три атома H | |
Газообразный кислород | O 2 | Два атома O | |
Газообразный азот | N 2 | Два атома азота | |
Газообразный хлор | Класс 2 | Два атома Cl | |
Водородный газ | H 2 | Два атома H |
ВОПРОСЫ:
Перечислите все вещества из таблицы, которые являются элементами.Напишите их имена и формулы.Водород, H 2
Кислород, O 2
Хлор, Cl 2
Азот, N 2
Перечислите все вещества из таблицы, которые являются соединениями.Напишите их имена и формулы.Вода, H 2 O
Двуокись углерода, CO 2
Диоксид серы, SO 2
Натрия хлорид, NaCl
Сероводород, H 2 S
Аммиак, NH 3
Как вы узнали, какие вещества в таблице являются соединениями, а не элементами?
Вы, вероятно, искали, чтобы увидеть, какие из них состоят из более чем одного вида атомов.Соединение — это материал, состоящий из атомов двух или более различных элементов. Элементы не просто физически смешаны, но химически связаны друг с другом на атомном уровне.
Вода (H 2 O), диоксид углерода (CO 2 ) и соль или хлорид натрия (NaCl) являются примерами соединений, в то время как газообразный кислород (O 2 ), газообразный водород (H 2 ) и газообразный азот (N 2 ) являются примерами элементов.
Соединение формулы H 2 O 2 также состоит из атомов водорода и кислорода.Формула говорит нам, что одна молекула этого вещества состоит из двух атомов водорода и двух атомов кислорода. H 2 O 2 то же самое, что вода? Как вы думаете?
Не путайте H 2 O 2 с H 2 O! H 2 O 2 представляет собой соединение, называемое перекисью водорода. Перекись водорода похожа на воду в том, что при комнатной температуре (25 ° C) это прозрачная бесцветная жидкость, хотя и не такая жидкая, но во многом отличается.Следующие свойства перекиси водорода могут убедить вас, что это не то же самое, что вода:
- Пероксид водорода имеет температуру кипения 150 ° C и является очень эффективным отбеливателем для одежды и волос.
- Концентрированная перекись водорода настолько реактивна, что используется в качестве компонента ракетного топлива!
- Перекись водорода чрезвычайно агрессивна.
- Мы можем пить воду, но перекись водорода очень опасна и вредна.
Коррозионные вещества — это вещества, которые вызывают повреждение металла или других материалов в результате химического процесса. Представьте, что дождевая вода вызывает ржавчину, разъедающую металл.
Если это вас не убеждает, давайте сравним, как выглядит молекула перекиси водорода рядом с водой:
Перекись водорода. Вода.Несмотря на то, что они состоят из одних и тех же элементов, эти два соединения очень разные, и их никогда не следует путать друг с другом.
Целью приведенного выше сравнения перекиси водорода и воды было показать вам, что атомы в данном соединении всегда соединяются в фиксированном соотношении. Во всех молекулах воды во Вселенной всегда будет один атом O и два атома H, связанные вместе.
Это был пятый постулат Далтона:
5. Атомы химически соединяются в фиксированных соотношениях с образованием соединений.
Как атомы «сочетаются»? Что заставляет их слипаться и образовывать молекулы?
Химические связи
Посмотрите на фото с различным расположением металлических шариков. Эти шарики магнитные, и это позволяет вам создавать разные узоры, склеивая их вместе. Что заставляет магниты склеиваться?
Учащиеся могут сказать, что магниты слипаются, потому что они притягивают друг друга.Укажите им, что магниты действительно будут притягиваться друг к другу, если они выстроены правильно. Магниты также могут отталкивать друг друга, если они расположены по-другому. Учащиеся будут больше изучать магнитные силы в Gr. 9 Энергия и перемены.
Эти шары магнитные. http://www.flickr.com/photos/uscpsc/6331652875/Магниты притягивают (или отталкивают) друг друга из-за магнитной силы между ними (вы узнаете больше о магнитах в Gr.9). Когда атомы объединяются, они делают это, потому что они также испытывают силу притяжения. Сила немного сложнее, чем сила между магнитами, но работает она так же: сила удерживает атомы вместе, как будто они склеены клеем. Силы, удерживающие атомы вместе, называются химическими связями .
В молекуле воды химические связи между O и двумя атомами H удерживают всю молекулу вместе. Сколько химических связей в каждой молекуле воды? Если вы не уверены, посмотрите на диаграмму ниже:
Две облигации.Если вы хотите вывести учащихся за рамки требований учебной программы на данном этапе, вы можете дать краткое объяснение электронного обмена. Детали этого будут изучены только в Gr. 10. Эти прочные химические связи, называемые ковалентными связями, образуются, когда атомы делятся своими электронами. Это объясняет, почему после реакции разложения атомы немедленно преобразуются во что-то еще: требование совместного использования электронов, которое привело к первоначальной связи, все еще существует, они просто разделяют электроны с другим атомом.
Молекула воды имеет две идентичные связи O-H. Что бы произошло, если бы у нас было достаточно энергии, чтобы разорвать эти узы?
Если бы у нас было достаточно энергии, чтобы разорвать связи O-H, мы смогли бы отделить атомы друг от друга.
Что было бы, если бы мы разделили молекулы воды на их атомы? Теоретически у нас были бы атомы водорода и кислорода.На самом деле происходит то, что атомы водорода немедленно объединяются с образованием H 2 , а атомы кислорода немедленно объединяются с образованием O 2 .
Когда атомы отделяются друг от друга и рекомбинируют в различные комбинации атомов, мы говорим, что произошла химическая реакция .
В ходе указанной выше химической реакции вода разложилась (распалась) и рекомбинировала на более мелкие молекулы.Мы говорим, что вода претерпела реакцию разложения в приведенном выше примере. Конечно, не все химические реакции являются реакциями разложения. Существует много различных видов химических реакций, и мы собираемся исследовать некоторые примеры в следующем разделе.
Химические реакции
Во всех химических реакциях происходят два важных события:
- химические связи разорваны
- новые химические связи образуют
Это означает, что в всех химических реакциях атомы в молекулах перестраиваются, образуя новые молекулы.
В следующем упражнении мы собираемся смоделировать реакцию разложения воды, используя глину или шарики из пластилина для представления различных атомов.
Это дополнительное расширение. Позднее в семестре учащиеся будут больше изучать химические реакции.
МАТЕРИАЛЫ:
- Пластилин или пластилин двух разных цветов
ИНСТРУКЦИЯ:
- Соберите две молекулы воды из глины или пластилина.Посмотрите на предыдущие изображения, чтобы напомнить вам, как выглядит молекула воды. Вы можете использовать глину любого цвета для создания своей.
- Теперь разорвите все связи, удерживающие молекулы вместе, разделив их на отдельные атомы.
Ответьте на следующие вопросы:
Сколько у вас атомов водорода (H)?
Сколько у вас атомов кислорода (O)?
Объедините атомы водорода и кислорода в молекулы водорода (H 2 ) и молекулы кислорода (O 2 ).
Ответьте на следующие вопросы:
Сколько молекул водорода можно построить из атомов H?Две молекулы водорода (H 2 ) могут состоять из четырех атомов водорода.
Сколько молекул кислорода можно построить из атомов кислорода?Одна молекула кислорода (O 2 ) может состоять из двух атомов O.
Можете ли вы написать химическое уравнение для реакции, которую вы только что построили, с помощью глиняных моделей? Посмотрите на схему для вдохновения:
2 H 2 O \ (\ rightarrow \) 2 H 2 + O 2
Химические уравнения будут правильно представлены в последней главе Gr.8 Материя и материалы, но это может быть хорошим местом, чтобы привлечь к этому внимание учащихся. Вы могли бы объяснить, что когда есть только одна молекула определенного типа (O 2 в приведенном выше примере), мы не пишем число перед ней в химической реакции. На данном этапе балансировка уравнений не требуется.
Давайте посмотрим на другой пример химической реакции: реакция, когда углерод (в угле) реагирует с кислородом (в воздухе) с образованием диоксида углерода:
Вы можете использовать шарики из пластилина, чтобы имитировать эту реакцию.
Попытайтесь написать химическое уравнение реакции, когда углерод и кислород соединяются с образованием диоксида углерода. (Подсказка: используйте диаграмму, чтобы направлять вас.)
C + O 2 \ (\ rightarrow \) CO 2
Как атомы угля и кислорода перегруппировываются с образованием диоксида углерода? Какие облигации рвутся?
Связь между двумя атомами кислорода разрывается.
Какие новые облигации образуют?
Две новые углерод-кислородные связи образуются при образовании диоксида углерода.
Затем ваш учитель продемонстрирует классу две химические реакции.Ваша задача — внимательно наблюдать и записывать свои наблюдения, которые вы можете видеть в происходящем.
Мы предлагаем сделать это в качестве демонстрации или провести несколько экспериментов в классе, за которыми могут наблюдать разные группы учащихся. Видео в окне для посещения содержит простую демонстрацию электролиза с использованием сульфата меди вместо хлорида меди. Но наблюдения будут такими же, а именно: металлическая медь покрывает катод, и вы можете наблюдать пузырьки газа на аноде (на видео это газообразный кислород, а не газообразный хлор, как в исследовании здесь, в рабочей тетради.
Видео, демонстрирующее аналогичную реакцию с использованием сульфата меди.
ЦЕЛЬ: Определить, можно ли разложить хлорид меди с помощью электроэнергии.
МАТЕРИАЛЫ И АППАРАТ:
- стакан
- картонный диск, достаточно большой, чтобы закрыть верхнюю часть стакана
- два графитовых электрода
- 2 бита провода
- Растворы хлорида меди
- Аккумулятор 9 В
Вместо графитовых электродов можно также получить угольные электроды из использованных ячеек горелки.
Длина провода с зажимами типа «крокодил» на обоих концах является идеальной. Они понадобятся вам для построения электрической цепи. Включение переключателя в схему не является обязательным.
Раствор хлорида меди можно приготовить, растворив две чайные ложки хлорида меди (II) в стакане водопроводной воды.
Перед запуском сделайте следующие наблюдения:
Какого цвета раствор хлорида меди?Какого цвета графитовые электроды?
МЕТОД:
- Налейте раствор хлорида меди в стакан.
- Сделайте два небольших отверстия в картонном диске и протолкните электроды через отверстия, как показано на следующем рисунке.
- Поместите диск над стаканом так, чтобы большая часть каждого электрода находилась под поверхностью раствора.
- Подсоедините верхние части электродов к концам батареи с помощью длин проводов. Взгляните на схему экспериментальной установки.
- Дайте реакции развиться в течение нескольких минут и понаблюдайте за тем, что происходит.
- Когда реакция продолжается примерно 10 минут, можно отсоединить провода и разобрать установку.
НАБЛЮДЕНИЯ:
Что вы наблюдаете на поверхности двух электродов после того, как реакция продолжалась в течение нескольких минут?Один электрод покрывается маленькими пузырьками, а другой становится коричневым.
Какого цвета в конце эксперимента был хлорид меди?Решение все еще синее.
Если вы сохранили часть исходного решения, учащиеся могут сравнить решение до и после эксперимента.Они могут заметить, что решение «после» не такое синее, как решение «до». Попросите учащихся задуматься, почему это могло быть. Это связано с двумя причинами:
- ионы меди выходят из раствора, поскольку они принимают электроны и превращаются в твердую медь, которая выделяется на катоде красновато-коричневого цвета. (Учащиеся еще не знают об обмене ионами или электронами, поэтому они могут предположить, что атомы / частицы меди выходят из раствора и накапливаются на электроде.)
ионов хлора образуют газообразный хлор Cl 2 на аноде.(Учащиеся могут наблюдать образование пузырьков газа на другом электроде и, возможно, сделать вывод, что это хлорид, выходящий из раствора в виде газообразного хлора.)
Следовательно, , концентрация раствора хлорида меди становится слабее, в результате чего он становится немного менее синим.
Как изменился внешний вид графитовых электродов?Один электрод остается темно-серым или черным.Другой электрод покрыт красновато-коричневым слоем.
Можно отметить, что электрод, который остался серо-черным, был тем же электродом, на котором раньше были пузырьки. Попросите учащихся почувствовать запах этого электрода. Они могут чувствовать запах отбеливателя, который представляет собой запах газообразного хлора Cl 2 . Попросите учащихся сравнить цвет слоя с цветом медной монеты.Может ли налет на втором электроде быть медью? Да, это.
Учащимся не нужно понимать, что происходит в растворе на ионном уровне. Акцент здесь делается на демонстрации того, что соединение можно разбить на элементы. Тем не менее, объяснение электролиза раствора хлорида меди (II) приводится здесь для справки, и если вы хотите расширить свои знания учащихся:
Когда электроды подключены к источнику питания, электроны перемещаются, заставляя электрод, прикрепленный к положительному концу батареи, становиться положительным.Он называется анодом . Затем отрицательно заряженные ионы хлорида в растворе притягиваются к положительному аноду. Ионы хлора отдают свои электроны и образуют газообразный хлор, который наблюдается в виде пузырьков.
Электрод, прикрепленный к отрицательному полюсу батареи, становится отрицательным. Он называется катодом . На катоде положительно заряженные ионы меди в растворе притягиваются к отрицательному электроду.На катоде ионы меди приобретают электроны, образуя металлическую медь, которая осаждается на катоде. Наблюдается коричневый налет.
(Вы можете попросить учащихся нарисовать положительные и отрицательные знаки и пометить электроды на диаграммах в своих рабочих тетрадях в качестве дополнения.)
Электрод, прикрепленный к положительной стороне батареи, является положительным электродом и называется анодом .Электрод, прикрепленный к отрицательной стороне батареи, является отрицательным электродом и называется катодом .
Обобщите ваши экспериментальные наблюдения в следующей таблице.
Раствор хлорида меди | Электрод 1 (называемый анодом) | Электрод 2 (называемый катодом) | |
До эксперимента | |||
После эксперимента |
Раствор хлорида меди | Электрод 1 (называемый анодом) | Электрод 2 (называемый катодом) | |
До эксперимента | Раствор имел интенсивный синий цвет. | Темно-серая поверхность. | Темно-серая поверхность. |
После эксперимента | Раствор все еще был синим, но цвет был менее интенсивным. | Поверхность темно-серая, но со слабым запахом отбеливателя. Во время реакции пузырьков не наблюдалось. | Красновато-коричневый налет на поверхности. |
АНАЛИЗ И ОБСУЖДЕНИЕ:
Что придало раствору хлорида меди интенсивный синий цвет?Растворенный в нем хлорид меди.
Как вы думаете, часть хлорида меди могла измениться во время реакции во что-то другое? Объясните, почему вы так думаете.Раствор хлорида меди стал менее голубым. Это говорит нам о том, что часть хлорида меди превратилась во что-то другое.
Как бы вы объяснили появление пузырьков на поверхности первого электрода? Вы хоть представляете, какими они могли быть? Подсказка: чем пахнет электрод потом?Пузырьки означают, что на поверхности электрода образовался газ.Пахло отбеливателем. Газообразный хлор также пахнет отбеливателем, поэтому возможно, что газ, образующийся на электроде, мог быть хлором.
Примечание: Хлор фактически является активным ингредиентом отбеливателя.
Вы знаете, что такое красновато-коричневый налет на втором электроде? Подсказка: какой металл имеет такой же характерный красновато-коричневый цвет?Возможно, красновато-коричневый налет — это медь.
Как мы узнаем, что произошла химическая реакция?Атомы в хлориде меди были перегруппированы, чтобы образовать различные материалы: медь (Cu) и хлор (Cl 2 ).
ВЫВОД:
Напишите заключение для расследования.В своем заключении вам следует переписать цель расследования в изложение результатов вашего расследования.Заключение обучаемого должно содержать как минимум два из следующего:
Как вы думаете, возможно ли разделить хлорид меди на медь и хлор с помощью любого из методов физического разделения, о которых мы узнали в Gr.7 Материя и материалы, такие как просеивание, фильтрация, выпаривание, дистилляция или хроматография? Вот подсказка: ни один из этих методов не может разорвать связи между атомами в веществе.
Ответ — нет. Медь и хлор химически связаны в хлориде меди. Мы знаем это из его химической формулы: CuCl 2 . Методы физического разделения могут использоваться только для разделения смесей на вещества, из которых они состоят.
На данный момент мы узнали об атомах, молекулах, элементах и соединениях. Иногда эти концепции сбивают с толку, потому что они описывают вещи, которые слишком малы, чтобы их можно было увидеть, а иногда и трудно представить. В следующем разделе мы вернемся к идее смесей и посмотрим, как все, что мы узнали до сих пор, можно поместить в схему классификации материи и материалов.
Тест на тему простых и сложных веществ.
.Содержание правильного ответа и рекомендации по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла)
Часть А — 1 балл 23-21 балл — «5» Часть Б — 1-2 балла 20-16 баллов — «4» 15-12 баллов — «3»
Список использованной литературы:
- Габриелян О.С., Химия. 8 класс. Дрофа. 2010 Рудзитис Г.Э. Химия 8 класс. М .: «Просвещение», 2010.
ТЕСТ № 2 (1). Молекулы и атомы. Простые и сложные вещества.Признаки химических элементов. Относительный атомный и молекулярный вес. Химические формулы.
Часть А
Разработанные современные химические символы
1) Д.И. Менделеев 3) Я. Берцелиус
2) А. Лавуазье 4) А. Авогадро
2. Химический элемент
1) определенный тип атомов
2) вещество, которое не может быть разложено на более простые вещества
3) атомы с одинаковой массой
4) вещество, которое при химическом превращении всегда увеличивает свой вес.
3. Относительная атомная масса химического элемента
1) масса его атома
2) масса его атома, выраженная в а.е.м.
3) отношение массы атома к 1/12 массы атома углерода
4) масса его атома, выраженная в граммах
4. Образовавшееся простое вещество
1) идентичные молекулы
2) атомы одного химического элемента
3) молекулы, состоящие из одного атома
4) простые молекулы
5.Молекулярные массы Fe 3 O 4, H 3 PO 4, N 2 равны соответственно
.6. Массовая доля железа в соединении Fe 2 O 3 составляет
.7. Массовые доли элементов в соединении железа и серы равны соответственно
46,67% и 53,33%. Формула соединения
4) Fe 2 (SO 4) 3
Часть B
8. Вставьте пропущенные слова в выписку: «_________________________ —
.наименьших химически неделимых частиц, из которых состоят молекулы.«
9. Установите соответствие между названием вещества и его видом. Запишите ответ
в виде последовательности букв и цифр, например А1, В2 и т. Д.
1) вода А — простые вещества
2) кислород Б — комплексные вещества
10. Распределить по группам — металлы (A) и неметаллы (B) — химические элементы:
Запишите ответ в виде последовательности букв и цифр, например, A123, B456.
ИСПЫТАНИЕ №2 (2). Молекулы и атомы. Простые и сложные вещества. Признаки химических элементов. Относительный атомный и молекулярный вес. Химические формулы
Часть А
Д. Далтон
DI. Менделеев
Аристотель
атомов одного химического элемента
атомов одного химического элемента, различающихся по массе
атомов одного химического элемента, одинаковых по массе
атомов одного и того же химического элемента, одинакового размера
Заслуга введения в науку понятия химического элемента принадлежит
Изотопы
Значение, указанное в таблице химических элементов D.И. Менделеев
относительная атомная масса химического элемента
состоит из двух атомов
состоит из нескольких атомов
содержит идентичные атомы
состоит из атомов одного химического элемента
Массовая доля марганца в соединении Mn 2 O 7
Массовые доли фосфора и хлора в соединении равны 14.87% и 85,13% соответственно. Формула соединения
относительная атомная масса его самого тяжелого изотопа
относительная атомная масса самого легкого изотопа
относительная атомная масса его наиболее распространенного изотопа в природе
средняя атомная масса всех изотопов с учетом их распространенности в природе
Азот (N 2) — простое вещество, так как его молекула
Относительные молекулярные массы HNO 3, P 2 O 5, O 3 равны соответственно
Часть B
Вставить пропущенные в выписке слова: «__________________________ —
.
атома одного вида. «
Установите соответствие между названием вещества и его типом. Запишите ответ в
1) сера А — простые вещества
2) кислород Б — комплексные вещества
10. Распределить по группам — металлы (A) и неметаллы (B) — химические элементы:
ИСПЫТАНИЕ №3 (1). Валентность химических элементов. Формулировка валентных формул. Химические уравнения. Типы химических реакций.
Часть А
Валентности серы, азота и углерода в их водородных соединениях (H 2 S, NH 3, CH 4) соответственно равны
2. Записаны обозначения химических элементов, образующих простые металлические вещества
под номером
3. Валентность серы в соединениях Na 2 S, SO 3, CS 2 равны соответственно
4.Формулы бинарных соединений кальция с азотом и алюминия с серой записываются соответственно под номером
.Al 2 S 3, Ca 3 N 2
Ca 3 N 2, Al 2 S 3
Ca (NO 3) 2, Al 2 S 3
Ca 3 N 2, Al 2 (SO 4) 3
5. Сумма коэффициентов в уравнении реакции Na + H 2 O → NaOH + H 2 равна
.6. Заполните уравнение реакции (коэффициенты указаны): Fe + CuCl 2 = … + FeCl 2
сформирован из 5.6 г железа и 3,2 г серы.
Часть B
8. Вставить пропущенные слова в выписку: «Масса веществ, поступивших в
.химическая реакция ____________________ к массе образующихся веществ. «
Сопоставьте левую и правую части уравнения реакции.
Запишите ответ в виде последовательности букв и цифр, например, A1, B2 и т. Д.
4Al + 3O 2 = A. Al 2 O3 + 3H 2 O
2Al (OH) 3 = B.2AlCl 3 + 3H 2 O
Al 2 O 3 + 6HCl = B. 2Al 2 O 3
Разделить на группы химические реакции — соединения (A) и замещения (B):
4Fe + 3O 2 = 2Fe 2 O 3
Hg (NO 3) 2 + Cu = Cu (NO 3) 2 + HG
S + O 2 = SO 2,
Zn + 2HCl = ZnCl 2 + H 2
N 2 + O 2 = 2NO
2Al (OH) 3 = Al 2 O 3 + 3H 2 O
Запишите ответ в виде последовательности букв и цифр, например A123, B456.
ИСПЫТАНИЕ № 3 (2). Валентность химических элементов. Формулировка валентных формул. Химические уравнения. Типы химических реакций.
Часть А
Валентность кальция, натрия и алюминия в их соединениях с кислородом — CaO, Na 2 O, Al 2 O 3 — соответственно равна
1) I, II, III 3) II, I, III
2) III, II, I 4) II, III, I
2. Записаны обозначения химических элементов, образующих простые вещества — металлы
под номером
3.Валентность азота в соединениях Na 3 N, NO, NF 3 соответственно равна
.1) I, II, III 3) III, I, III
2) III, II, III 4) I, II, I
4. Формулы бинарных соединений магния с азотом и кальция с серой соответственно
записан под номером
1) CaS, Mg 3 N 2 3) Mg (NO 3) 2, CaS
2) Mg 3 N 2, CaSO 4 4) Mg 3 N 2, CaS
5. Сумма коэффициентов в уравнении реакции FeCl 2 + Cl 2 → FeCl 3 равна
.6.Заполните уравнение реакции (коэффициенты указаны): Mg + 2 … = H 2 + MgCl 2
7. Используя закон сохранения массы, определите массу сульфида железа (II),
образован из 56 г железа и 32 г серы.
Часть B
8. Вставьте пропущенные слова в выписку: «_________________________ звоните
условное изображение протекания химической реакции с помощью знаков и формул. «
9. Сопоставьте левую и правую части уравнения реакции.Запишите ответ в виде последовательности букв и цифр, например, A1, B2 и т. Д.
1) 4Fe + 3O 2 = A. Fe 2 O 3 + 3H 2 O
2) 2Fe (OH) 3 = Б. 2FeCl 3 + 3H 2 O
3) Fe 2 O 3 + 6HCl = B. 2Fe 2 O 3
10. Распределите по группам химические реакции — разложение (A) и замещение (B):
1) 4Fe + 3O 2 = 2Fe 2 O 3
2) Hg (NO 3) 2 + Cu = Cu (NO 3) 2 + Hg
3) 4HNO 3 = 4NO 2 + O 2 + 2H 2 O
4) Zn + 2HCl = ZnCl 2 + H 2
5) CaCO 3 = CaO + CO 2
6) Al (OH) 3 = Al 2 O 3 + 3H 2 O
Запишите ответ в виде последовательности букв и цифр, например A123, B456.
ИСПЫТАНИЕ № 4 (1). Молярная масса. Расчеты по химическим уравнениям
Часть А
Молярная масса соединения CuSO 4 ∙ 5H 2 O (г / моль)
Какое количество вещества (моль) содержится в оксиде серы (VI) массой 12 г?
При взаимодействии раствора, содержащего гидроксид натрия NaOH массой 4 г, с раствором хлорида меди (II) Cu (OH) 2 и хлорида натрия NaCl.Какая масса (г) оксида? (Ответьте целым числом.)
Какова масса (г) хлорида железа (III), полученного реакцией железа массой 16,8 г с хлором?
Какова масса (г) оксида железа Fe 3 O 4, который образуется при сжигании железа на воздухе массой 11,2 г?
Масса осадка сульфата бария BaSO 4, образованного смешением растворов, содержащих сульфат натрия Na 2 SO 4 массой 1,42 г и хлорид бария BaCl 2 массой 2.8 г, равно
Какова масса соли хлорида алюминия AlCl 3 (г), образовавшейся в результате реакции гидроксида алюминия Al (OH) 3 весом 23,4 г и соляной кислоты HCl, содержащей 35 г хлористого водорода?
Какое количество молекул воды содержится в порции вещества массой 3,6 г?
Часть B
Рассчитайте массу оксида железа (III), полученного реакцией 22,4 г железа с 10 г кислорода. Ответьте целым числом.
При сжигании метана (CH 4) на воздухе образуются диоксид углерода и вода.Рассчитайте массу воздуха, необходимую для сжигания 16 г метана, если массовая доля кислорода в воздухе составляет 28,6%.
ИСПЫТАНИЕ № 4 (2). Молярная масса. Расчеты по уравнениям химических реакций.
Часть А
Молярная масса соединения CaSO 4 ∙ 2H 2 O (г / моль)
Масса пробы серы 19.2 г. Чему равно количество серы (моль)?
Какая масса (г) карбоната натрия Na 2 CO 3 равна 0,25 моль вещества?
При взаимодействии раствора, содержащего 8 г гидроксида натрия NaOH массой 8 г, с раствором нитрата меди (II) Cu (NO 3) 2 образуется осадок гидроксида меди (II) Cu (OH) 2 и нитрата натрия ( NaNO 3). Какова масса (г) гидроксида меди (II)? (Ответьте целым числом.)
Какая масса серы (г) прореагировала с алюминием весом 2,7 г?
Какая масса гидроксида железа (III) (г), растворенного в серной кислоте H 2 SO 4, весом 9,8 г? Схема реакции: Fe (OH) 3 + H 2 SO 4 → Fe 2 (SO 4) 3 + H 2 O. (Ответьте целым числом).
Какое количество атомов фосфора содержится в образце фосфора массой 155 г?
8. Какова масса осадка сульфата бария BaSO 4 (г), образовавшегося при смешивании
растворов, содержащих сульфат натрия Na 2 SO 4 массой 1 шт.6 г и хлорид бария BaCl 2
весом 2,08 г?
Часть B
9. Рассчитайте массу оксида меди (II), образовавшуюся при взаимодействии 27 г алюминия с
.25 г кислорода. Ответьте целым числом.
При сжигании метана (CH 4) образуются диоксид углерода и вода. Рассчитайте массу воздуха, необходимую для сжигания 32 г метана, если массовая доля кислорода в воздухе составляет 28,7%.
Тестовый итоговый (тематический) контроль
ИСПЫТАНИЕ №1 (1). Обобщение и контроль знаний по теме «Исходные химические представления»
Часть А
использовать лупу и пинцет
добавить воду к смеси, затем отфильтровать
пропустить смесь через сито
добавить воду к смеси, затем отфильтровать и выпарить фильтрат
вода дистиллированная, алюминий, воздух
почва, морская вода, духи
медь, железо, свинец
сталь, бронза, мельхиор
сквашивание молока и горящие свечи
таяние льда и испарение воды
замерзание воды и гниющие остатки
лампочки и образование облаков
PH 3, P 4, O 3
NH 3, N 2, N 2 O
H 2 O, Cl 2, HCl
три атома азота и один атом водорода
один атом азота и три атома водорода
один атом азота и один атом водорода
три атома азота и три атома водорода
Для разделения смеси порошков мела и поваренной соли необходимо
Перечень чистых веществ размещен под номером
Формулы простых веществ
Молекула аммиака состоит из
Сумма коэффициентов в уравнении реакции фосфора (P) с избытком кислорода (O 2)
Массовая доля цинка в хлориде цинка равна
Валентность хрома в соединении Cr 2 O 3 составляет
.Часть B
А.Атомы — это самые маленькие химически неделимые частицы, из которых состоят молекулы.
B. В физических явлениях молекулы вещества сохраняются, а в химических — разрушаются.
1) оба утверждения верны
2) утверждение A верно; утверждение B ложно
3) утверждение B верно, утверждение A неверно
4) оба утверждения неверны
10. Установите соответствие между уравнением реакции и ее типом.Запишите ответ в
как последовательность букв и цифр, например A1, B2 и т. Д.
Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O A. Замещение
Fe + 2HCl = FeCl 2 + H 2 B. Соединение
4Fe + 3O 2 = 2Fe 2 O 3 B. Разложение
2Fe (OH) 3 = Fe 2 O 3 + 3H 2 O G. Обмен
ИСПЫТАНИЕ № 1 (2). Обобщение и контроль знаний по теме «Исходные химические представления»
Часть А
фильтрация
декантация
дистилляция
сахар, железо, воздух
почва, морская вода, духи
медь, бронза, свинец
сталь, кислород, мельхиор
карбонизация сахара и сахарного джема
образование инея и облаков
прокисшее молоко и газовыделение из бутылки лимонада
образование газа при смешивании соды с уксусом и почернение изделий из серебра
S 8, P 4, NH 3
NaOH, KOH, HNO 3
один атом серы и один атом кислорода
один атом серы и три атома кислорода
один атом серы и два атома кислорода
два атома серы и один атом кислорода
Валентность хрома в соединении CrO 3 составляет
Массовая доля кальция в нитриде кальция равна
Смесь порошков серы и железа можно разделить с помощью
Перечень смесей размещен под номером
Под номером
описываются только химические явления.Формулы только простых веществ объединены под номером
Молекула оксида серы (IV) состоит из
Сумма коэффициентов в уравнении реакции алюминия с кислородом (O 2) равна
Часть B
Высказать мнение о судебных решениях:
А.Молекулы веществ находятся в непрерывном движении. Скорость передвижения
молекул зависит от температуры.
Б. При физических явлениях молекулы вещества разрушаются, а при химических —
сохранено.
оба утверждения верны
оператор A правильный, оператор B неверный
оператор B правильный, оператор A неверный
оба утверждения неверны
Сопоставьте уравнение реакции с его типом.Запишите ответ в
как последовательность букв и цифр, например A1, B2 и т. Д.
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O A. Замещение
2Al + 6HCl = 2AlCl 3 + 3H 2 B. Соединение
4Al + 3O 2 = 2Al 2 O 3 B. Разложение
2Al (OH) 3 = Al 2 O 3 + 3H 2 O G. Обмен
- обобщить знания по теме «Простые и сложные вещества»;
- формирование коммуникативных способностей студентов при работе в группах.
Оснащение:
- Таблетки с меню на каждом столе — 4 шт .;
- Карта оценки вклада студента в работу группы;
- Описание заданий (согласно меню) для студентов по каждому столу — 4 шт.
- Кредит в размере 40 у.е.
- ПСЧЭ и таблица растворимости.
Студенты посещают кафе. Формируются 3 группы по 4 человека, каждая группа выбирает ответственный (администраторский) стол.Во время игры работу каждой группы оценивают как учитель, так и одноклассники (противники).
Вместо привычных блюд в меню представлены задания по теме. Каждая группа получила ссуду в размере 40 у.е. При решении заданий ученики получают оценку в $
.Оценка успеваемости студентов проводится по схеме:
«Отлично» — 1 у.е., «хорошо» — 2 у.е. «Удовлетворительно» — 3 у.е.
Количество полученных у.е., вычитаемых из данной ссуды.Побеждает группа, накопившая наибольшую сумму.
Во время игры каждый участник должен выступить хотя бы 1 раз.
Игра проходит в несколько этапов:
1. «Холодные закуски»
- Кроссворд;
- Определение терминов;
- Классификация веществ.
2. «Горячие блюда»
- Составьте формулы веществ;
- Давать названия веществам;
- Решите задачу по формуле.
3. «Напитки»
4. «Крепкие напитки»
Тест № 2: 4 варианта.
5. «Десерт»
Отгадывать загадки.
Карта оценки вклада студента в работу группы (проводится по 5-балльной шкале)
| Фамилия Имя | Оценка деятельности Группы | Самоуважение | Рейтинг учителей | итоговая оценка |
Добрый день! Рад приветствовать вас в химическом кафе «Светлячок!».Целью нашего кафе будет обобщение темы «Простые и сложные вещества». Каждый из вас занял свой стол, и я предлагаю выбрать для вас администратора стола, который будет координировать работу его стола.
Прошу вас ознакомиться с меню. В нем вместо привычных блюд представлены задания по теме. Каждый должен хотя бы раз ответить.
| Деятельность учителей | Деятельность учащихся | Химический состав |
| 1.Краткое сообщение по теме урока. Постановка цели. Ознакомление с правилами игры. Вид меню | Участие в определении цели урока. Деление на группы. Выбор ответственного в группе. | |
| 2. Холодные закуски Комментарии к задачам. Подведение итогов 1-го этапа игры | 1. Кроссворд
2. Определите термины:
3.Отнесите к классам следующие формулы веществ: h3, HC1, Na2SO4, h3SO4, KNO3, BaCl2, Ca (OH) 2, h3S, NaOH, O2, h3CO3, N, P, KOH, MgCO3, CO 2, Na 2 O. | |
| 3. Горячие обеды. Комментарии к задачам. Контроль за ходом работы в группах. Подведение итогов 2-х этапов. | Групповой выбор горячих блюд. Завершение задания. Групповое обсуждение. Оформляйте на доске задание, выполненное группой. Обсуждение результатов задания.Подсчет потраченных у.е. | 1. Составьте формулы веществ: N aCO 3, HS, Ba OH, A1 C1, Z p SO 4 2. Назовите следующие вещества: 3. Решите задачу: |
| 4. Напитки. Комментарии к задачам. Контроль за ходом работы в группах. Подведение итогов 3-х этапов. | Выполнение обучающего тестового задания в группе. Проверка и обсуждение результатов. Запуск тестов. Подсчет потерянных у.е. | 1. В виде простого вещества кислород содержится в
2. Азот имеет более высокую валентность в оксиде
3. Наиболее выраженные неметаллические свойства
4.Формулы оксида, основания, соли соответственно:
5. Количество гидроксида кальция 0,25 моль. Определите его массу. |
| 5. Физическая культура. Динамическая пауза | ||
| 6. Крепкие напитки Комментарии к заданиям. Контроль за ходом работы в группах. Подведение итогов 4 этапов. | Индивидуальное выполнение тестовых заданий. Самооценочный тест. Заполнение теста (правильные ответы представлены на доске) израсходовано | Тест №2 — 4 варианта |
| 7. Десерт. Комментарии к задачам. Подведение итогов 5-го этапа. Вручение группе победителей сладкого приза. | Отгадывать загадки. Расчет остатка кредита | 1. Конечно, мне очень нужно Без меня не приготовишь обед Не мариновать огурец, Не заливать кисель. Но не только в воде. Если слеза льется из моего глаза Ты сразу вспомнишь мой вкус. Кто умен, говорит: Это … (хлорид натрия) 2. Появиться удалось (диоксид углерода — диоксид углерода) 3.Горю синим пламенем |
| 8. Определение домашнего задания | Запись домашнего задания | Приготовьте синквейн. У кого проблемы с повторением § 17–21. |
Десертные задания:
- Что называется белым золотом? ( Хлопок. )
- Какое название химического элемента содержится в супе со свеклой и другими овощами? ( В — борщ.)
- Что называют «живым серебром»? ( Рыба. )
- Как называется мех пушных зверей? ( Пушистое золото. )
- Выкиньте 4 буквы в названии горной антилопы, и вы получите название химического элемента группы 6. ( Серна — сера. )
- С маленького грызуна начинается, заканчивается бык, как называется химический элемент? ( Мышьяк. )
- Какой химический элемент «зовет» кошку в гости? ( Кислород.)
Химический тест Простые и сложные вещества. Задания на десерт
.Содержание правильного ответа и методика оценивания (допускается другая формулировка, не искажающая его смысла)
Часть A — 1 балл 23-21 балл — «5» Часть B — 1-2 балла 20-16 баллов — «4» 15-12 баллов — «3»
Библиография:
- Габриелян О.С., Химия. 8 класс. Дрофа. 2010 Рудзитис Г.Э. Химия 8 класс. М .: «Просвещение», 2010.
- обобщить знания по теме «Простые и сложные вещества»;
- формирование коммуникативных способностей студентов при работе в группах.
Оснащение:
- Таблетки с меню на каждом столе — 4 шт .;
- Карточка оценки вклада студента в работу группы;
- Должностная инструкция (меню) для студентов на каждый стол — 4 шт.
- Кредит в размере 40 у.е.
- PSHE и таблица растворимости.
Студенты посещают кафе. Формируются 3 группы по 4 человека, каждая группа выбирает ответственный (администраторский) стол. Во время игры оценивается работа каждой группы как учителя, так и одноклассников (противников).
В меню вместо обычных блюд представлены задания по теме. Каждая группа выдала ссуду в размере 40 долларов США. При решении задач ученики получают оценку в
н.э.Оценка активности студентов проводится по схеме:
«Отлично» — 1 ЕД.Е., «Хорошо» — 2 доллара США; «Удовлетворительно» — 3 у.е.
Количество полученных США, вычтенных из этой ссуды. Победителем становится группа, сохранившая наибольшую сумму.
Во время игры каждый участник должен выступить хотя бы 1 раз.
Игра проходит в несколько этапов:
1. «Холодные закуски»
- Кроссворд;
- Определение терминов;
- Распределение веществ по классам.
2.«Горячие блюда»
- Создавайте формулы;
- Дайте названия веществам;
- Решите задачу по формуле.
3. Напитки
4. «Крепкие напитки»
Тест № 2: 4 варианта.
5. «Десертный»
Отгадывать тайны.
Карта оценки вклада студента в работу группы (проводится по 5-балльной шкале)
| Фамилия Имя | Оценка рабочей группы | Самоудовлетворение | Оценка учителя | итоговая оценка |
Доброго времени суток! Рад приветствовать Вас в химическом кафе «Светлячок!».Цель нашего кафе — обобщить тему «Простые и сложные вещества». Каждый из вас взял свой стол, и я предлагаю выбрать администратора стола, который будет координировать работу вашего стола.
Прошу вас ознакомиться с меню. На месте вместо обычной посуды стоят задания по теме. Каждому нужно ответить хотя бы один раз.
| Деятельность учителя | Деятельность студентов | Химический состав |
| 1.Краткое сообщение по теме Постановка урока. Ознакомление с правилами игры. Просмотр меню | Участие в определении цели урока. Деление на группы. Выбор ответственного в группе. | |
| 2. Холодные закуски Комментарии к заданиям. Подведение итогов 1 этапа игры | 1. Кроссворд
2. Определить терминалы:
3.Распределите следующие формулы по классам: H 2, NS1, Na 2 SO 4, H 2 SO 4, KNO 3, VER1 2, CA (OH) 2, H 2 S, Naoh, O 2, H 2 CO 3, N , P, KOH, MG CO 3, CO 2, NA 2 O. | |
| 3. Горячие блюда. Комментарии к задачам. Мониторинг работы в группах. Подведение итогов 2-го этапа. | Выбор группы горячего блюда. Выполнить задание. Обсуждение в группе. Регистрация на доске объявлений, сделанная группой. Обсуждение результатов задания. Подсчет потраченных У. | 1. Создайте формулы веществ: N Aso 3, HS, va, A1 C1, ZPSO 4 2. Названия следующих веществ: 3. Выполните задание: |
| 4. Напитки. Комментарии к задачам. Мониторинг работы в группах. Подводя итоги 3 этапа. | Выполнение обучающего тестового задания в группе.Проверьте и обсудите результаты. Выполнение теста. Подсчет проигранных U.E. | 1. Как простое вещество, кислород содержится в
2. Наивысшая валентность азота проявляется в оксиде
3. Неметаллические свойства наиболее выражены.
4.Формулы оксидов, основания, соли соответственно:
5. Вещество гидроксида кальция 0,25 моль. Определите его массу. |
| 5. Физкультминутка. Динамическая пауза | ||
| 6. Обязательные напитки Комментарии к заданиям. Мониторинг работы в группах. Подведение итогов 4-го этапа. | Индивидуальные тестовые задания реализации.Самооценочный тест. Заполнение теста (правильные ответы представлены на доске) Подсчет проведенных C.E. | Номер испытания 2-4 варианта |
| 7. Десерт. Комментарии к задачам. Подведение итогов 5-го этапа. Вручение группы победителей Sweet Prize. | Отгадывать загадки. Расчетный остаток по кредиту | 1. Мне, конечно, очень нужен Без меня не свари обед, Не втыкай огурец, Не заправляй холодом. Но не только в воде. Если слезу из глаз пролить, Вкус запомнился мне сразу. Ждут, говорит: Это … (хлорид натрия) 2. Появиться, удалось, (Двуокись углерода — двуокись углерода) 3.Я — синее пламя, |
| 8. Домашнее задание по формулированию | Запись домашнего задания | Сделайте синхронизацию. У кого проблемы повторить § 17-12. |
Задания на десерт:
- Что называется белым золотом? ( Хлопок. )
- Название какого химического элемента содержится в супе со свеклой и другими овощами? ( Brutching.)
- Что называют «живым серебром»? ( Рыба. )
- Как называется мех пушных зверей? ( Пушистое золото. )
- Киньте 4 буквы в название горной антилопы, и вы получите название химического элемента 6 группы. ( Сульна — сера. )
- От маленького грызуна начинается, кончится бык, как химический элемент называется? ( Мышьяк. )
- Какой химический элемент «зовет» в гости кошку? ( Кислород.)
Тест № 2 (1). Молекулы и атомы. Простые и сложные вещества. Признаки химических элементов. Относительный атомный и молекулярный вес. Химические формулы.
Часть A.
Разработана современная химическая символика
1) Д.И. Иметелеев 3) Я. Бурцеллиус
2) А. Лавуазье 4) А. Авогадро
2. Химический элемент
1) определенный тип атомов
2) вещество, не разлагающееся на более простые вещества
3) атомы с одинаковой массой
4) Вещество, которое при химическом превращении всегда увеличивает свой вес.
3. Относительная атомная масса химического элемента
1) масса его атома
2) масса его атома, выраженная в A.Y.m.
3) Отношение массы атома к 1/12 массы атома углерода
4) масса его атома, выраженная в граммах
4. Образуется простое вещество
1) идентичные молекулы
2) атомы одного химического элемента
3) молекулы, состоящие из одного атома
4) простые молекулы
5.Молекулярные массы Fe 3 O 4, H 3 PO 4, N 2 равны соответственно
.6. Массовая доля железа в соединении Fe 2 O 3 равна
.7. Массовые доли элементов в соединении железа с серым равны соответственно
46,67% и 53,33%. Формула соединения
4) Fe 2 (SO 4) 3
Часть Б.
8. Вставьте пропущенные в выписку слова: «_________________________ —
.наименьших химически неделимых частиц, из которых состоят молекулы.«
9. Установите соответствие между названием вещества и его видом. Ответ написать
в виде последовательности букв и цифр, например А1, В2 и т. Д.
1) Вода А — простые вещества
2) кислород Б — комплексные вещества
10. Распределить по группам — металлы (A) и неметаллы (b) — Химические элементы:
Ответ напишите в виде последовательности букв и цифр, например, A123, B456.
Тест № 2 (2).Молекулы и атомы. Простые и сложные вещества. Признаки химических элементов. Относительный атомный и молекулярный вес. Химические формулы
Часть A.
Д. Далтон
DI. Менделеев
Аристотель
атомов одного химического элемента
атомов одного химического элемента, различающихся по массе
атомов одного химического элемента, одинаковых по массе
атомов одного химического элемента, одинаковых по размеру
Заслуга введения в науку понятия о химическом элементе принадлежит
Изотопы — это
Ограничено в таблице химических элементов D.И. РЕМЕЕЛЕЕВА СТОИМОСТЬ
Относительный атомный вес химического элемента
состоит из двух атомов
содержит несколько атомов
содержит те же атомы
состоит из атомов одного химического элемента
Массовая доля марганца в соединении Mn 2 O 7 равна
Массовые доли фосфора и хлора в соединении равны соответственно 14.87% и 85,13%. Формула соединения
относительная атомная масса его самого тяжелого изотопа
относительная атомная масса его более легкого изотопа
относительная атомная масса его наиболее распространенного изотопа
средняя атомная масса всех изотопов с учетом их распространенности в природе
Азот (N 2) — простое вещество, так как его молекула
Относительные молекулярные массы HNO 3, P 2 O 5, O 3 равны соответственно
Часть Б.
Вставить пропущенные в выписку слова: «__________________________ —
атомов одного сорта. «
Установите соответствие между названием вещества и его видом. Запись написать в Б.
1) сера а — простые вещества
2) кислород Б — комплексные вещества
10. Распределить по группам — металлы (A) и неметаллы (b) — Химические элементы:
Тест № 3 (1).Оценка химических элементов. Составление валентных формул. Химические уравнения. Типы химических реакций.
Часть A.
Валентность серы, азота и углерода в их водородных соединениях (H 2 S, NH 3, CH 4) соответственно равна
2. Зарегистрированные символы химических элементов, образующих простые металлы
под номером
3. Результат серы в соединениях Na 2 S, SO 3, CS 2 равны соответственно
4.Составы бинарных соединений кальция с азотом и алюминия с серым соответственно зарегистрированы под номером
.Al 2 S 3, Ca 3 N 2
Ca 3 N 2, Al 2 S 3
Ca (NO 3) 2, Al 2 S 3
Ca 3 N 2, Al 2 (SO 4) 3
5. Система коэффициентов в уравнении реакции Na + H 2 O → NaOH + H 2 равна
.6. Заполните уравнение реакции (коэффициенты указаны): Fe + Cucl 2 = … + FECL 2
— результат 5.6 г железа и 3,2 г серы.
Часть Б.
8. Вставить пропущенные в выписку слова: «Масса веществ, поступивших в
.химическая реакция ____________________ Масса образованных веществ. «
Задайте соответствие между левой и правой частями уравнения реакции.
Ответ записывается как последовательность букв и цифр, например, A1, B2 и т. Д.
4Al + 3O 2 = А.Al 2 O3 + 3H 2 O
2AL (OH) 3 = B. 2AlCl 3 + 3H 2 O
Al 2 O 3 + 6HCl = V. 2AL 2 O 3
Распределите химические реакции по группам — соединения (а) и замещения (б):
4Fe + 3O 2 = 2Fe 2 O 3
Hg (NO 3) 2 + Cu = Cu (NO 3) 2 + HG
S + O 2 = SO 2,
Zn + 2HCl = ZnCl 2 + H 2
N 2 + O 2 = 2NO
2AL (OH) 3 = Al 2 O 3 + 3H 2 O
Ответ напишите в виде последовательности букв и цифр, например A123, B456.
Тест № 3 (2). Оценка химических элементов. Составление валентных формул. Химические уравнения. Типы химических реакций.
Часть A.
Валентность кальция, натрия и алюминия в их соединениях с кислородом — CaO, Na 2 O, Al 2 O 3 — соответственно равна
1) I, II, III 3) II, I, III
2) III, II, I 4) II, III, I
2. Зарегистрированные символы химических элементов, образующих простые металлы
под номером
3.Оценка азота в соединениях Na 3 n, NO, NF 3 соответственно равна
.1) I, II, III 3) III, I, III
2) III, II, III 4) I, II, I
4. Формулы бинарных соединений магния с азотом и кальция с серым соответственно
записан под номером
1) CAS, MG 3 N 2 3) MG (NO 3) 2, CAS
2) Mg 3 N 2, Caso 4 4) Mg 3 N 2, CAS
5. Сумма коэффициентов в уравнении реакции 2 FeCl 2 + Cl 2 → FECL 3 равна
6.Закончите уравнение реакции (коэффициенты указаны): Mg + 2 … = H 2 + MgCl 2
7. Используя закон сохранения массы, определите массу сульфида железа (II),
образован из 56 г железа и 32 г серы.
Часть Б.
8. Вставить пропущенные в выписку слова: «_________________________
условное изображение химической реакции с помощью знаков и формул. «
9. Установите соответствие между левой и правой частями уравнения реакции.Ответ записывается как последовательность букв и цифр, например, А1, В2 и т. Д.
1) 4Fe + 3O 2 = A. Fe 2 O 3 + 3H 2 O
2) 2Fe (OH) 3 = Б. 2FeCl 3 + 3H 2 O
3) Fe 2 O 3 + 6HCl = V. 2fe 2 O 3
10. Распределите химические реакции по группам — разложение (я) и замещение (b):
1) 4Fe + 3O 2 = 2Fe 2 O 3
2) Hg (NO 3) 2 + Cu = Cu (NO 3) 2 + HG
3) 4HNO 3 = 4NO 2 + O 2 + 2H 2 O
4) Zn + 2HCl = ZnCl 2 + H 2
5) Caco 3 = CAO + CO 2
6) Al (OH) 3 = Al 2 O 3 + 3H 2 O
Ответ напишите в виде последовательности букв и цифр, например A123, B456.
Тест № 4 (1). Молярная масса. Расчеты по уравнениям химических реакций
Часть A.
Молярная масса of Cuso 4 ∙ 5H 2 O (г / моль)
Какое количество вещества (моль) содержится в оксиде серы (VI) весом 12 г?
При взаимодействии раствора, содержащего гидроксид натрия NaOH массой 4 г, с раствором хлорида меди (II) Cu (OH) 2 и хлорида натрия NaCl.Какова масса (г) оксида? (Ответ дайте в виде целого числа.)
Какова масса (г) хлорида железа (III), полученного реакцией железа массой 16,8 г с хлором?
Какова масса (г) оксида железа Fe 3 O 4, образовавшегося при горении на воздухе железа массой 11,2 г?
Масса осадка сульфата бария BASO 4, образованного смешением растворов, содержащих сульфат натрия Na 2 SO 4 массой 1,42 г и бариевый хлорид BACL 2 массой 2.8g, что равно
Чему равна масса солей хлорида алюминия (г), полученная в результате реакции гидроксида алюминия Al (OH) 3 массой 23,4 г и соляной кислоты HCl, содержащей 35 г хлороура?
Чему равно количество молекул воды, содержащихся в порции вещества массой 3,6 г?
Часть Б.
Рассчитайте массу оксида железа (III), которая образуется при взаимодействии 22,4 г железа с 10 г кислорода. Ответ вносить в виде целого числа.
При сжигании метана (CH 4) в воздухе образуются углекислый газ и вода.Рассчитайте массу воздуха, необходимую для сжигания 16 г метана, если массовая доля кислорода в воздухе составляет 28,6%.
Тест № 4 (2). Молярная масса. Расчеты по уравнениям химических реакций.
Часть A.
Молярная масса of CASO 4 ∙ 2H 2 O (г / моль)
Массовый образец образца 19.2. Какое количество серы (моль)?
Какова масса (г) карбоната натрия Na 2 Co 3 с веществом 0,25 моль?
При взаимодействии раствора, содержащего гидроксид натрия NaOH массой 8 г, с раствором нитрата меди (II) (NO 3) 2 образуется осадок гидроксида меди (II) Cu (OH) 2 и нитрата натрия (Nano 3). Какова масса (г) гидроксида меди (II)? (Ответ дайте в виде целого числа.)
Какая масса серы (г) вступила в реакцию с алюминием массой 2.7 г?
Какова масса гидроксида железа (III) (г), растворенного в серной кислоте H 2 SO 4, весом 9,8 г? Схема реакции: FE (OH) 3 + H 2 SO 4 → Fe 2 (SO 4) 3 + H 2 O. (ответ целым числом).
Какое количество атомов фосфора содержится в образце фосфора массой 155 г?
8. Какова масса осадка сульфата бария Baso 4 (г), образовавшегося при смешивании
растворов, содержащих сульфат натрия Na 2 SO 4 массой 1,6 г и хлорид бикарбоната BACL 2
вес 2,08 г?
Часть Б.
9.Рассчитайте массу оксида меди (II), образовавшегося при взаимодействии 27 г алюминия с
25 г кислорода. Ответ вносить в виде целого числа.
При сжигании метана (CH 4) образуются углекислый газ и вода. Рассчитайте массу воздуха, необходимую для сжигания 32 г метана, если массовая доля кислорода в воздухе составляет 28,7%.
Результат теста (тематический) контроль
Тест №1 (1). Обобщение и контроль знаний по теме «Исходные химические представления»
Часть А.
воспользоваться лупой и пинцетом
добавить воду к смеси, затем профиль
пропустить смесь через сито
добавить воду к смеси, затем профилировать и выпарить фильтрат
дистиллированная вода, алюминий, воздух
почва, морская вода, духи
медь, железо, свинец
сталь, бронза, мельхиор
Молоко Горение кожи и свечей
Таяние льда и испарение воды
Замерзание воды и гниющие остатки
свечение Электромама и образование облаков
PH 3, P 4, O 3
NH 3, N 2, N 2 O
H 2 O, Cl 2, HCl
три атома азота и один атом водорода
один атом азота и три атома водорода
один атом азота и один атом водорода
три атома азота и три атома водорода
Для разделения смеси порошков мела и крашеной соли следовать
Перечень чистых веществ размещен под номером
Формулы только простых веществ
Молекула аммиака состоит из
Сумма коэффициентов в уравнении реакции фосфора (P) с избытком кислорода (O 2)
Массовая доля цинка в хлориде цинка равна
Валентность хрома в соединении CR 2 O 3 равна
Часть Б.
A. Атомы — это мельчайшие химически неделимые частицы, из которых состоят молекулы.
B. В физических явлениях молекулы вещества сохраняются, а когда химические вещества разрушаются.
1) Оба утверждения верны
2) Верное утверждение A, утверждение B неверно
3) Верное высказывание Б, высказывание и неправильное
4) оба утверждения неверны
10. Установите соответствие между уравнением реакции и ее типом.Запись написать в Б.
форма последовательности букв и цифр, например А1, В2 и т. Д.
Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O A. Замещение
Fe + 2HCl = FECL 2 + H 2 B. Соединение
4Fe + 3O 2 = 2Fe 2 O 3 V. Разложение
2Fe (OH) 3 = Fe 2 O 3 + 3H 2 O
Тест № 1 (2). Обобщение и контроль знаний по теме «Исходные химические представления»
Часть А.
фильтрация
декантация
дистилляция
сахар, железо, воздух
почва, морская вода, духи
медь, бронза, свинец
сталь, кислород, мельхиор
обугливание сахара и сахарное варенье
образование и образование облаков
обман молока и выделение газа из лимонадной бутылки
газообразование при смешивании соды с уксусом и чернении изделий из серебра
S 8, P 4, NH 3
Naoh, Koh, HNO 3
один атом серы и один атом кислорода
один атом серы и три атома кислорода
один атом серы и два атома кислорода
два атома серы и один атом кислорода
Валентность хрома в соединении CRO 3 равна
Массовая доля кальция в нитриде кальция равна
Смесь порошков серы и железа делится на
Список смесей размещен под номером
Под номером
описываются только химические явления.Формулы только простых веществ объединены под номером
Молекула оксида серы (IV) состоит из
Сумма коэффициентов в уравнении реакции алюминия с кислородом (O 2) равна
Часть Б.
Экспресс-заключение на судебные решения:
A. Молекулы веществ находятся в непрерывном движении. Скорость движения
молекул зависит от температуры.
Б. При физических явлениях молекулы вещества разрушаются, а при химическом воздействии —
сохраняются.
оба утверждения верны
верны утверждения A, говорят B неправильно
верны говорят b, говорят и неверны
оба утверждения неверны
Установите соответствие между уравнением реакции и ее типом.Запись написать в Б.
форма последовательности букв и цифр, например А1, В2 и т. Д.
Al 2 O 3 + 6HCl = 2ALCL 3 + 3H 2 O A. Замена
2AL + 6HCl = 2AlCl 3 + 3H 2 B. Соединение
4AL + 3O 2 = 2AL 2 O 3 В. Разложение
2AL (OH) 3 = Al 2 O 3 + 3H 2 O
На языке химии обозначены химические элементы рудзита. Химические элементы. Символы химических элементов.Национальные параметры записи
Химия, как и любая наука, требует точности. Система представления данных в этой области знаний разрабатывалась веками, и текущий стандарт представляет собой оптимизированную структуру, содержащую всю необходимую информацию для дальнейшей теоретической работы с каждым конкретным элементом.
При написании формул и уравнений крайне неудобно использовать целые числа, и сегодня для этого используются одна или две буквы — химические символы элементов.
История
В Древнем мире, как и в средние века, ученые использовали символические изображения для обозначения различных элементов, но эти знаки не были стандартизированы. Лишь к 13 веку были попытки систематизировать символы веществ и элементов, а с 15 века вновь открытые металлы стали обозначать по первым буквам их названий. Похожая стратегия именования применяется в химии и по сей день.
Текущее состояние системы наименований
На сегодняшний день известно более ста двадцати химических элементов, некоторые из которых чрезвычайно трудно найти в природе.Неудивительно, что еще в середине 19-го века наука знала, что существует только 63 из них, и не было единой системы именования, никакой целостной системы для представления химических данных.
Последнюю задачу решил во второй половине того же века русский ученый Д. И. Менделеев, опираясь на неудачные попытки его предшественников. Процесс именования продолжается и сегодня — есть несколько элементов с номерами от 119 и выше, условно обозначенных в таблице латинским сокращением их порядкового номера.Символы химических элементов этой категории произносятся по латинским правилам чтения чисел: 119 — неразъединенные (букв. «Сто девятнадцатый»), 120 — унбинил («сто двадцать») и так далее.
Большинство элементов имеют собственные имена, происходящие от латинских, греческих, арабских, немецких корней, в некоторых случаях отражающие объективные характеристики веществ, а в других действующих как немотивированные символы.
Этимология некоторых элементов
Как упоминалось выше, некоторые названия и символы химических элементов основаны на объективно наблюдаемых признаках.
Название фосфор, светящийся в темноте, происходит от греческого слова «нести свет». При переводе на русский язык встречается много «говорящих» названий: хлор — «зеленоватый», бром — «дурно пахнущий», рубидий — «темно-красный», индий — «индиго». Поскольку химические обозначения элементов даны латинскими буквами, прямая связь названия с веществом для носителя русского языка обычно остается незамеченной.
В названии есть более тонкие ассоциации.Итак, название «селен» происходит от греческого слова, означающего «луна». Произошло это потому, что в природе этот элемент является спутником теллура, название которого на том же греческом языке означает «Земля».
Ниобий также называется. Согласно древнегреческой мифологии, Ниоба — дочь Тантала. Химический элемент тантал был открыт ранее и по своим свойствам подобен ниобию — таким образом, логические отношения отца и дочери были спроецированы на «отношения» химических элементов.
Более того, тантал не случайно получил свое название в честь известного мифологического персонажа. Дело в том, что получение этого элемента в чистом виде было сопряжено с большими трудностями, из-за чего ученые обратились к фразеологизму «танталовая мука».
Еще один любопытный исторический факт — название платина дословно переводится как «серебро», то есть нечто подобное, но не такое ценное, как серебро. Причина в том, что этот металл плавится намного тверже серебра, а потому долгое время не находил применения и не представлял особой ценности.
Общий принцип наименования элементов
При взгляде на таблицу Менделеева первое, что бросается в глаза, — это названия и символы химических элементов. Это всегда одна или две латинские буквы, первая из которых — заглавная. Выбор букв определяется латинским названием элемента. Несмотря на то, что корни слов происходят и от древнегреческого, и от латинского, и от других языков, по стандарту именования к ним добавляются латинские окончания.
Интересно, что большинство символов для носителя русского языка будут интуитивно понятными: алюминий, цинк, кальций или магний, школьник легко запоминает с первого раза. Сложнее обстоит дело с теми именами, которые отличаются в русском и латинском вариантах. Студент может не сразу вспомнить, что кремний — это кремний, а ртуть — это гидраргирум. Тем не менее, об этом придется помнить — графическое изображение каждого элемента ориентировано на латинское название вещества, которое будет фигурировать в химических формулах и реакциях как Si и Hg соответственно.
Чтобы запомнить такие названия, студентам полезно выполнять такие упражнения, как: «Установите соответствие между символом химического элемента и его названием».
Другие способы наименования
Названия некоторых элементов взяты из арабского языка и были «стилизованы» под латынь. Например, натрий получил свое название от корня, что означает «бурлящее вещество». Аравийские корни прослеживаются также в названиях калия и циркония.
Немецкий язык также оказал влияние.Отсюда и названия таких элементов, как марганец, кобальт, никель, цинк, вольфрам. Логическая связь не всегда очевидна: например, никель — это сокращение от слова, означающего «медный дьявол».
В редких случаях названия переводились на русский язык в виде кальки: гидрогениум (буквально «рождающий воду») превращался в водород, а карбонон — в углерод.
Имена и географические названия
Более дюжины элементов названы в честь различных ученых, в том числе Альберта Эйнштейна, Дмитрия Менделеева, Энрико Ферми, Эрнеста Резерфорда, Нильса Бора, Мари Кюри и других.
Некоторые имена произошли от других имен собственных: названий городов, штатов, стран. Например: Московия, Дубний, Европиум, Тенессин. Не все топонимы покажутся знакомыми носителю русского языка: вряд ли человек без культурного фона узнает японское имя Нихон в слове nichony (букв .: Страна восходящего солнца), а в гафнии — Латинская версия Копенгагена. Узнать даже название своей родной страны в слове рутений — задача не из легких.Тем не менее, Россия на латыни называется рутением, и именно в честь него назван 44-й химический элемент.
Названия космических тел появляются в периодической таблице: планеты Уран, Нептун, Плутон, Церера. Помимо имен персонажей древнегреческой мифологии (Тантал, Ниобий), есть скандинавские: торий, ванадий.
Периодическая таблица
В известной нам сегодня периодической таблице, носящей имя Дмитрия Ивановича Менделеева, элементы представлены сериями и периодами.В каждой ячейке химический элемент обозначается химическим символом, рядом с которым представлены другие данные: его полное название, порядковый номер, распределение электронов по слоям, относительная атомная масса. Каждая ячейка имеет свой цвет, который зависит от того, выделен ли элемент s-, p-, d- или f-.
Принципы регистрации
При регистрации изотопов и изобар в верхнем левом углу символа элемента ставится массовое число — общее количество протонов и нейтронов в ядре.В этом случае атомный номер, представляющий количество протонов, помещен в нижнем левом углу.
Заряд иона записан справа вверху, а на той же стороне внизу указано количество атомов. Символы химических элементов всегда начинаются с заглавной буквы.
Национальные параметры записи
В Азиатско-Тихоокеанском регионе существуют варианты написания символов химических элементов на основе местных методов письма. В китайской нотации используются знаки радикалов, за которыми следуют иероглифы в их фонетическом значении.Символам металлов предшествует знак «металл» или «золото», газов — радикал «пар», неметаллов — иероглиф «камень».
В европейских странах также бывают ситуации, когда знаки элементов во время записи отличаются от тех, которые записываются в международных таблицах. Например, во Франции азот, вольфрам и бериллий имеют собственные названия на национальном языке и обозначаются соответствующими символами.
Наконец
При обучении в школе или даже в высшем учебном заведении запоминание содержания всей таблицы Менделеева совершенно не требуется.В памяти следует хранить химические символы элементов, которые чаще всего встречаются в формулах и уравнениях и время от времени просматриваются в Интернете или в учебниках.
Однако во избежание ошибок и недоразумений необходимо знать, как структурированы данные в таблице, в каком источнике искать нужные данные, четко помнить, какие названия элементов отличаются в русской и латинской версиях. В противном случае вы можете случайно принять Mg за марганец, а N за натрий.
Для практики на начальном этапе выполняйте упражнения. Например, укажите символы химических элементов для произвольно взятой последовательности названий из периодической таблицы. По мере накопления опыта все станет на свои места, и вопрос запоминания этой базовой информации отпадет сам собой.
Часть I
1. Горизонтальная таблица Д. И. Менделеева разделена на периоды, которые делятся на:
а) малые, это периоды — 1, 2, 3;
б) большие, это периоды — 4, 5, 6, 7.
2. Вертикальная таблица Д. И. Менделеева разбита на группы, каждая из которых делится на:
а) основная, или группа А;
б) вторичный, или групповой.
IA группа — это группа щелочных металлов.
IIA группа — это группа щелочноземельных металлов.
ВИИА группа — группа галогенов.
Группа VIIIA — это группа благородных или инертных газов.
4. Аналогии языка химии с русским языком.
5.Заполните таблицу «Названия и символы химических элементов».
6. Примеры названий химических элементов (указать химический знак в скобках) по этимологическим источникам.
1) Свойства простых веществ
Водород (H), кислород (O), фтор (F)
2) Астрономия
Селен (Se), теллур (Te), уран (U)
3) География
Германий (Ge), галлий (Ga), полоний (Po)
4) Древнегреческие мифы
Тантал (Ta), Прометий (Pm), Лютеций (Lu)
5) Великие ученые
Менделей (Md. ), Резерфордий (Rt), Эйнштейний (Es)
Часть II
1.Установите соответствие между положением химического элемента в Периодической таблице Д. И. Менделеева и химическим знаком.
А — 5; Б — 1; В 2; G — 4
2. Выберите символы или названия химических элементов одного большого периода. Из букв, соответствующих правильным ответам, вы составите название металла, из которого делают бенгальские огни: магний.
1) калий M
2) Br A
5) марганец G
6) Cu N
8) Ca And
9) Zn
3.Введите названия следующих химических элементов в соответствующие столбцы:
Cl, He, Br, Ne, Li, I, K, Ba, Ca, Na, Xe, Sr.
4. Заполните пропуски в логической схеме.
Химический элемент (Н, О) → химическая реакция (Н₂О) → химическое производство (2 Н₂О = 2 Н₂ + О₂).
5. Сделайте обобщение:
химических элементов — углерод, кремний, олово, свинец — относятся к группе IVA.
6. В левом столбце таблицы запишите, по какому признаку химические элементы делятся на две группы.
7. Установите соответствие между произношением и химическим знаком (символом).
А — 3; В — 6; В 2; G — 7; D — 5; E — 1.
8. Вычеркнуть «лишнее»:
.Кюрий, Менделий, бром, Эйнштейн.
9. Общий этимологический источник названий химических элементов:
U, Te, Se — планетарий.
10. В честь различных штатов или частей света названы следующие элементы:
Германий, галлий, Франция, Дубний.
Меркурий соответствует планете Меркурий, которая наиболее быстро движется по небу. Да на «охране окружающей среды» кормится большое количество людей! Ртуть — химический элемент, переходный металл. Вы, конечно, догадались, что речь идет о ртути. Сколько ртути в люминесцентных лампах? Что делать? Опасность ртути сильно преувеличена!
«Химический элемент алюминий» — Каковы физические свойства алюминия. Чужой человек. Алюминий. Каковы свойства алюминия в зависимости от его использования.Цепочки преобразований. Заявление. Посуда из алюминия. Состав. Химические свойства. Темные пятна. Физические свойства Посуда из алюминия.
«Знаки стихий» — мифы древних греков. Астрономические начала. Признаки химических элементов. Понятие о признаках химических элементов. Период. Имена великих ученых. Металлы Свойства элементов. Географические начала. Координаты. Фтор. Литий. Небольшие периоды. Водород. Йенс Якоб Берцелиус. Химический элемент.Подгруппы. Сера.
«Никель» — Блестящий серебристо-белый металл. Стихия земных глубин. Никелевые сплавы шведский минералог А. Кронштедт. Немецкий химик Иеремия Рихтер. Он используется во многих отраслях экономики. Никель горит только в виде порошка. Это главный компонент метеоритов. Серебристый металл. Нержавеющая сталь.
«Медь, серебро, золото» — комплексные соединения. Особенности химии меди. Простые вещества. Получение меди. Серебро. Получение и уничтожение.Чернение серебряных предметов. Кислородные соединения. Простые вещества. Элементы группы IB. Выплавка меди. Редокс-свойства. Минералы Степень окисления. Химия элементов.
«Химический элемент — водород» — слово хранителям знаний. Любители. Лучший спортсмен. Каждый человек. Фронтальный разговор. Свойства водорода. Ведущий. Скорость чистая. Водород. Количество практически возможных реакций. Материалы проекта или урока. Основное использование водорода.Проведем проверку знаний. Уравнения реакций. Символы.
Всего 46 презентаций
Как и в любой науке, у химии есть своя система символов, свой язык. Урок посвящен знакомству с языком химической науки, изучению символов химических элементов. Вы узнаете, когда и кем были изобретены современные символы химических элементов.
Тема: Исходные химические концепции
Урок: Символы химических элементов
1.История развития химического языкаЕще в средние века, во времена алхимии, различные знаки использовались для обозначения веществ, в основном металлов. Ведь главной целью алхимиков было получение золота из различных металлов. Поэтому для каждого из них использовались свои обозначения.
В 19 веке возникла необходимость использовать символы, понятные всем ученым. И одним из первых, кто предложил такую символику, был Джон Далтон. Но использовать его обозначения было неудобно.
Рис. 1. Джон Дальтон и его система обозначений химических элементов
2. Система обозначения химических элементов Я. Я. БерцелиусВ начале 19 века он предложил современную систему химических знаков. Шведский химик Йенс Якоб Берцелиус. Ученый предложил обозначать химических элементов первой буквой их латинского названия. В то время все научные статьи печатались на латыни; это было общепринятым и понятным для всех ученых.
Например, химический элемент кислород (на латыни Oxygenium) обозначался как O.
А химический элемент — водород (Hydrogenium) — N. Если названия нескольких элементов начинались с одной и той же буквы, то в символе элемента указывалась вторая или одна из следующих букв названия. Например, ртуть (Hydrageryrum) обозначается Hg.
Обратите внимание, что первая буква знака химического элемента всегда заглавная, если есть вторая буква, то она строчная.Необходимо помнить не только названия элементов и их символы, но и произношение, то есть то, как эти символы читаются.
Нет никаких особых правил произношения знаков химических элементов. Их нужно выучить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород — «о», сера — «es», фосфор — «pe», азот — «en», углерод — «ce».
Знаки других элементов произносятся так же, как и сами элементы: «натрий», «калий», «хлор», «фтор».
Произношение некоторых знаков соответствует их латинскому названию: кремний — «кремний», ртуть — «гидраргирум», медь — «медь», железо — «железо».
Рис. 2. Символы и названия некоторых химических элементов
3. Значение знаков химических элементовЗнак химического элемента имеет несколько значений. Во-первых, они обозначают все атомы данного элемента. Во-вторых, знак химического элемента может обозначать один или несколько атомов данного элемента.Например, запись O может означать: «химический элемент кислород» или «один атом кислорода».
Чтобы указать несколько атомов данного химического элемента, необходимо поставить перед его знаком число, соответствующее количеству атомов. Например, обозначение 3N означает «три атома азота».
Число перед знаком химического элемента называется коэффициентом.
1. Сборник заданий и упражнений по химии: 8 класс: к учебнику П.А.Оржековский и другие. «Химия, 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. — М .: АСТ: Астрель, 2006.
.2. Ушакова О.В. Рабочая тетрадь по химии: 8 класс: к учебнику П. А. Оржековского и др. «Химия. 8 класс »/ О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. изд. проф. Оржековский П.А. — М .: АСТ: Астрель: Профиздат, 2006. (с.19-21)
3. Химия: 8 класс: учеб. для общеобразовательных учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Контакт. М .: АСТ: Астрель, 2005. (§8)
.4. Химия: неорг. химия: учебник. за 8 кл. общеобразовательные учреждения / Г. Э. Рудзитис, ФьюГю Фельдман. — М .: Просвещение, ОАО «Московские учебники», 2009. (§6)
.5. Энциклопедия для детей. Том 17. Химия / Гл. изд. В.А. Володин, Вед. научное изд. И. Леенсон. — М .: Аванта +, 2003.
.Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов.
2. Электронная версия журнала «Химия и жизнь».
3. Тесты по химии (онлайн).
Домашнее задание
с.19-21 №№ 1-5 из Рабочей тетради по химии: 8 класс: к учебнику П.А. Оржековского и др. «Химия. 8 класс »/ О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. изд. проф. Оржековский П.А. — М .: АСТ: Астрель: Профиздат, 2006.
.Дж. Дж. Берцелиус Обозначение химических элементов Д. Дальтоном Таблица названий и обозначений некоторых химических элементов Алхимические знаки химических элементов и веществ Массовые доли химических элементов в земной коре
Язык химии.Признаки химических элементов. Относительная атомная масса. Тема урока: Задачи: Знать: признаки химических элементов, их названия и произношение, понятие «относительная атомная масса». Уметь: определять принадлежность химических элементов к металлам и неметаллам, записывать знаки химических элементов и значения их относительных атомных масс.
В природе нет ничего другого. Ни здесь, ни там, в космических глубинах: Все — от песчинок до планет — состоит из отдельных элементов.Степан Щипачев «Читающий Менделеева» Как формула, как график, система труда системы Менделеева строгая. Вокруг вас создается живой мир, войдите в него, вдохните, прикоснитесь к нему руками.
Проверка домашнего задания 1. Какие вещества называют простыми? Привести примеры. 2. Какие вещества называют сложными? Привести примеры. 3. Что такое химический элемент? Сколько химических элементов известно? 4. Речь идет о кислороде как о простом веществе 1) кислород поддерживает горение 2) кислород входит в состав углекислого газа 3) кислород находится в периодической таблице рядом с азотом 4) атом кислорода 5.Речь идет о меди как о простом веществе 1) атомы меди входят в состав 2) медь хорошо проводит электрический ток 3) атом меди тяжелее атома железа 4) медь находится в периодической таблице рядом с цинком
Проверка домашнего задания 5. Мы говорим о водороде как об элементе 1) водород горит 2) водород входит в состав воды 3) водород — самый легкий газ 4) водород слабо растворяется в воде 6. О сере говорят как простое вещество 1) атом серы 2) сера — один из элементов 3) желтый порошок серы 4) сера входит в состав сульфида железа
Первую символику для обозначения химического элемента в 1814 году предложил шведский ученый Йенс-Якоб Берцелиус.Он предложил использовать первую букву их латинских названий в качестве символов элементов, а если первые буквы совпадают, использовать вторую букву.
Водород (на латинском «Hydrogenium», Hydrogenium) — Н кислород (на латинском «оксигениум», Oxygenium) — О углерод (на латинском «карбононеум», Carboneum) — С фтор (на латинском «fluorum», Fluorum) — F железо (на латинском «ferrum», Ferrum) — Fe золото (на латинском «aurum», Aurum) — Au
Относительная атомная масса атомной массы H равна 1.67 × g атома C 1,995 × g атома O 2,66 × g Введена атомная единица массы (а.е.м.) m (а.е.м.) = 1/12 m (12 C) = 1, г. Ar (H) = m (атом) / m (а.е.м.) = 1, г / 1, г = 1,0079 а.е.м. A r — показывает, во сколько раз данный атом тяжелее 1/12 атома 12 C, это безразмерная величина. Относительная атомная масса составляет 1/12 массы атома углерода, масса которого составляет 12 а.е.м.
Самый тяжелый из природных элементов — уран U.Фтор F — самый жестокий из неметаллов, ничто не может устоять перед его «натиском». Имя самого редкого элемента на Земле — Атат. В толще земной коры его содержится всего 69 мг. Считается, что азот N — самое неудачное название элемента. По-гречески «зоопарк» означает «безжизненный». Но этот газ, входящий в состав воздуха, совершенно не токсичен, он просто непригоден для дыхания.
В честь ученых названы элементы: Md (101) — Mendelian — D.И. Менделеев № (102) — Нобель — А. Нобель Cm (96) — Кюрий — Пьер и Мария Кюри Es (99) — Эйнштейн — А. Эйнштейн Fm (100) — Фермий — Э. Ферми Lr (103) — Лоуренс — E Lawrence Rf (104) — Rutherfordium — E. Rutherford Bh (107) — Барий — N. Bohr Mt (109) — Meitnerium — L. Meitner
Названия элементов связаны с цветом простых веществ и соединений (от индийского «отец» — светло-желтый цвет) сера S (от индийского «отец» — светло-желтый цвет) (от греческого «хлороз» — зеленый ) хлор Cl (от греч. «хлороз» — зеленый) (от греч. «todes» — пурпурный) йод I (от греч. «todes» — пурпурный) образован от греческого «хром» — окрашен, из-за разного цвета соединений этого элемента.Cr-хром образован от греческого «хром» — окрашенный из-за разнообразного цвета соединений этого элемента. Названия происходят от греческих слов «бром» и «осме», что означает «зловоние», «запах»; ясно, какое именно впечатление произвело самое сильное впечатление на химиков, открывших эти элементы. Названия Br br и Osmium происходят от греческих слов «бром» и «Osme», означающих «зловоние», «запах»; ясно, что именно произвел сильнейшее впечатление на химиков, открывших эти элементы.
Решите новое слово, которое можно получить, удалив количество букв, соответствующее количеству точек в начале или в конце названия химического элемента. Например, Cr, убираем одну начальную букву из названия «хром» и получаем «ром». а) .. На. б) Mg … в). F g) Ba ..
ЛОГОРИФ От названия какого химического элемента, выбрасывая первые две буквы, можно получить название одной из распространенных игр? (Золото — лото) От названия какого химического элемента, выбрасывая последнюю букву, можно получить слово — крик, с которым солдаты идут в атаку, а мирные жители — на парад? (Уран — Ура) К названию какой химический элемент можно добавить в конце двух букв и получить название корабля, затонувшего при столкновении с айсбергом? (Титан — Титаник) Какой химический элемент можно добавить к имени в конце трех букв, чтобы получить имя героя древнегреческого мифа, отправившегося в Колхиду за золотым руном? (Аргон — Аргонавт)
МЕТОД Из названия какого химического элемента, заменив первую букву на другую, можно получить слово, обозначающее название: пролив между Европой и Азией.(Phosphorus — Босфор) — место, где в почве много воды. (Золото — это болото) — это название инструмента. (Золото — долото) От названия какого химического элемента, заменив последнюю букву на другую, можно получить слово, обозначающее название горной системы, которая является границей между Европой и Азией? (Уран — Урал)
АНАГРАММА Из названия какого химического элемента, заменяя последнюю букву и читая с конца, можно получить слово, обозначающее название животного, которое может быть как домашним, так и диким? (Азот — коза) От названия какого химического элемента, переставив первую букву в конец, можно получить название: минерал.(Фтор — торф) один из видов четырехугольника (Бром — ромб)
Скачать презентацию щелочноземельных металлов. Щелочноземельные металлы (9 сорт)
Чтобы использовать предварительный просмотр презентаций, создайте себе учетную запись (учетную запись) Google и войдите в нее: https://accounts.google.com
Подписи к слайдам:
БЕРИЛИЙ, МАГНИЙ И ЩЕЛОЧНЫЕ МЕТАЛЛЫ ЗЕМЛИ
Что мы узнаем … 18.04.17 Положение металлов в Периодической системе Изменения свойств в группе История названия Находка в природе Физические свойства Химические свойства Крепежная литература
18.04.17 Бериллий, магний и щелочноземельные металлы находятся в IIA-группа Максимальная степень окисления +2 Структура внешнего энергетического уровня ns 2 Валентность — II
18.04.17 Ra Ba Sr Ca М g Be Изменение свойств группы В ряду металлов: Радиус атома увеличивается Восстанавливающие свойства (способность отдавать электроны) увеличиваются; Прочность химической связи металл-металл уменьшается.
18.04.17 «Если вы не знаете имен, знание вещей умрет» Карл Линней
ОТКРЫТИЕ МЕТАЛЛОВ Магний и кальций были впервые получены англичанами. химик и физик Х.Дэви в 1808 году. Магний из белой магнезии. Элемент был назван в честь минерала. Название элемента кальций происходит от лат. Эти слова — кальс, что означает «известь, мягкий камень». 18.04.17 Хамфри Дэви (1778 — 1829)
Магниевая порода — магнезит. Находка в природе Как активные металлы, они встречаются в природе только в виде соединений кальциевых пород — известняка, мрамора, мела.
18.04.17 Щелочные металлы легкие, мягкие и плавкие, серебристые, стронций имеет золотистый оттенок. Стронций — пластичный Физические свойства Бериллий — светло-серый, твердый, хрупкий Магний — относительно мягкий, пластичный, пластичный Кальций — твердый и пластичный
18.04.17 Химические свойства 1.Металлы взаимодействуют практически со всеми неметаллами: 2Ме 0 + О 2 0 = 2Ме +2 О -2 (оксид) Ме 0 + Н 2 0 = Ме +2 Н 2 -1 (гидрид) Ме 0 + Cl 2 0 = Me + 2 Cl 2 -1 (хлорид) Me 0 + S 0 = Me + 2 S -2 (сульфид) 3Me 0 + N 2 0 = Me 3 + 2 N 2-3 (нитрид)
04 / 18/17 Химические свойства 2. Бериллий не реагирует с водой, магний реагирует медленно, остальные металлы реагируют с водой, образуя щелочи и восстанавливая воду до водорода: Ме 0 + 2Н 2 О = Ме +2 (ОН) 2 + Н 2 3 Магний реагирует с кислотами.Ме 0 + 2Н Cl = Ме + 2 Cl 2 + Н 2 4. Магний и кальций реагируют с оксидами. 2 М g 0 + Ti О 2 = 2 М g + 2 О + Ti
Проверь себя (работа с таблицей Д.И. Менделеева) Сравните атомы элементов, поставив знаки или = вместо *: а) заряд ядра : Be * Ba; M g * Al; Ca * K; б) количество электронных слоев: Be * Ba; M g * Al; Ca * K; в) количество электронов на внешнем уровне: Be * Ba; M g * Al; Ca * K; г) радиус атома: Be * Ba; M g * Al; Ca * K; д) восстановительные свойства: Be * Ba; M g * Al; Ca * K.18.04.17
18.04.17 Завершите схемы взаимодействия щелочных металлов с неметаллами, общие формулы и названия продуктов реакции. Запишите конкретные уравнения реакций, расположив в них коэффициенты с помощью метода электронных весов. a) M + H 2 c) M + C1 2 Пример: ___________________ Пример: b) M + S d) M + N 2 Пример: _______________________________ Пример: ___________________________ Добавьте уравнения реакций. Как изменяется скорость реакций в указанной стрелкой последовательности? а) Ca + H 2 O → ……………………….б) Sr + H 2 O → ………………………. в) Ba + H 2 O → ……………………… .. Объясните, какой фактор определяет скорость реакции взаимодействия щелочных металлов с водой ……………………… .. Назовите продукты реакции. Опишите, как доказать свое образование. ……………………… ………………………………….. … Проверь себя
Тема: Соединения щелочноземельных металлов Цель: — на основе знания общих свойств металлов и их соединений (оксидов и гидроксидов) охарактеризовать свойства оксидов и гидроксидов щелочноземельных металлов; обобщать, устанавливать взаимосвязь между структурой и свойствами веществ, рассуждать логически.Эпиграф к уроку Единственный путь к познанию — это деятельность. Б. Шоу
Я игра пятиминутная. Определите металл 1. Этот металл используется для металлотермии — извлечения редких металлов из их руд. 2. Сульфат этого элемента, известный как горькая соль или английская соль, используется в медицине как слабительное. 3. Морская соль имеет горький вкус из-за наличия катионов этого металла. 4. Горение этого металла сопровождается ослепляющей вспышкой, поэтому ранее он использовался для фотографирования.5. В его атоме на внешнем уровне два электрона, все электроны расположены на трех энергетических уровнях.
1. Из-за высокой химической активности этот металл не подходит для изготовления изделий. 2. В организме взрослого человека содержится более 1 кг этого элемента в виде фосфата. 3. Этот металл впервые был получен Дж. Дэви в 1808 году. 4. Соединения этого элемента широко используются, например, в строительстве. Его карбонат — мел, мрамор, известняк. 5. В его атоме на внешнем уровне два электрона, все электроны расположены на четырех энергетических уровнях.
Продолжайте говорить 1. Кальций отличается по физическим свойствам от щелочных металлов a) цвет b) плотность c) твердость d) температура плавления 2. Реагирует с кальцием a) CI 2, P, Si b) C, CI 2, S c) O 2, H 2, Fe 3. Водород может быть получен путем взаимодействия кальция с a) HCl b) CO2 c) H 2 O d) NaOH e) H 2 SO 4 4. В кальции электроны распределены по энергетическим уровням a) 2,8,8,3 б) 2,8,8,1 в) 2,8,8,2 5. Кальций проявляет свойства а) окисляющие б) восстанавливающие в) окислительные и восстанавливающие
CaCO 3 — карбонат кальция — одно из самых распространенных соединений на Земле.Известны такие содержащие его минералы, как мрамор, мел, известняк. Важнейшим из этих минералов является известняк, без которого не обходится ни одно строительство, а во-вторых, это сырье для получения других материалов: цемента, гашеной и негашеной извести, стекла и др. В нашем регионе есть большие месторождения известняка и мела. . Поэтому в Белгородской области много заводов по производству цемента и технического мела.
МРАМОР (от греч. Marmaros — блестящий камень), кристаллическая гранулированная метаморфическая карбонатная порода, продукт перекристаллизации известняка, реже доломита.За счет плотного прилегания зерен кальцита друг к другу порода хорошо полируется. В машиностроении и строительстве мрамором называют любую карбонатную породу, удовлетворительно поддающуюся полировке, — известняк, доломит или мрамор. Метаморфизм чистого известняка приводит к образованию мрамора, поскольку единственное возможное изменение кальцита при высоких давлениях и температурах — это его перекристаллизация. Цвет мрамора обычно светлый, но наличие даже доли процента примесей — силикатов, оксидов железа и графита — приводит к окрашиванию породы в разные цвета и оттенки, включая желтый, коричневый, красный, зеленый и даже черный; есть также пестрые, разноцветные шарики.
Известняки ИЗВЕСТНЯК, осадочная порода, состоящая в основном из кальцита, реже арагонита; часто с примесью доломита, глины и песчинок. Известняки часто содержат остатки известняковых скелетов ископаемых организмов. Применяется в металлургии (флюсы), строительстве, химической промышленности и др.
MgCO 3 — карбонат магния, необходим в производстве цемента, стекла, кирпича, а также в металлургии для перевода пустой породы, то есть не содержащей соединения металлов, в шлак.CaSO 4 — сульфат кальция, встречается в природе в виде минерала гипса CaSO 4 * 2H 2 O, который представляет собой кристаллогидрат. Применяется в строительстве, медицине для наложения неподвижных гипсовых слепков, для снятия слепков. Для этого используют полуводный гипс 2CaSO 4 — алебастр.
MgSO 4 — это сульфат магния, известный как горькая соль, или английская соль, используемый в медицине как слабительное. Содержится в морской воде и придает ей горький вкус Ca 3 (PO 4) 2 — фосфат кальция, входит в состав фосфоритов (порода) и апатита (минерал), а также в костях и зубах.В организме взрослого человека содержится более 1 кг кальция в виде соединения Ca 3 (PO 4) 2.
Кодированный диктант 1. Оксиды проявляют основные свойства, за исключением бериллия. (1) 2. Все оксиды основной подгруппы II реагируют с водой. (0) 3. Оксиды кальция в технике называют негашеной известью. (1) 4. Раствор гидроксида кальция — известковая вода используется для обнаружения углекислого газа. (1) 5. Карбонат бария — основная часть полезных ископаемых: мел, мрамор, известняк. (0) Студенты проводят перекрестную проверку работы.
Чтобы использовать предварительный просмотр презентаций, создайте себе учетную запись (учетную запись) Google и войдите в нее: https://accounts.google.com
Подписи к слайдам:
Щелочноземельные металлы
Позиция в периодической таблице. В периодической системе они находятся в основной подгруппе группы II. Они являются сильными восстановителями, выделяют 2 ē, во всех соединениях имеют степень окисления +2. Общая конфигурация внешнего энергетического уровня nS ² Mg +12 2 ē, 8 ē, 2 ē Ca +20 2 ē, 8 ē, 8 ē, 2 ē Sr +38 2 ē, 8 ē, 18 ē, 8 ē, 2 ē Ba +56 2 ē, 8 ē, 18 ē, 18 ē, 8 ē, 2 ē
Позиция в таблице Менделеева Be Mg Ca Sr Ba Ra Улучшены восстановительные свойства
Атомная структура +4)) +12)) ) +20)))) +38))))) +56)))))) Be Mg Ca Sr Ba 2 2 2 2 2
Физические свойства щелочноземельных металлов Щелочноземельные металлы — серебристо-белые твердые вещества .По сравнению со щелочными металлами они имеют более высокую t ° пл. и t ° кипения, потенциалы ионизации, плотности и твердости. Бериллий (Be) очень твердый материал и способен оставлять царапины на стекле; твердость остальных элементов подгруппы снижается, а барий по твердости близок к свинцу
Физические свойства щелочноземельных металлов. Значения Be Mg Ca Sr Ba Ra Ρ г / см 1,85 1,737 1,54 2,63 3,6 6 Т пл. ° C 1287 648 842 768 727 969
Физические свойства цвет пламени þ плавление t 1.74 г / см 3 651 C 0 1,54 г / см 3 851 C 0 2,63 г / см 3 770 C 0 3,76 г / см 3 710 C 0 Mg Ca Sr Ba
Встречаемость в природе Бериллий: 3BeO Al2O3 6SiO2 — берилл Магний: MgCO3 — магнезит Кальций: CaCO3 MgCO3 — доломит KCl MgSO4 3h3O — каинит KCl MgCl2 6h3O — карналлит CaCO3 — кальцит (известняк, мрамор, мел) 2 Ca3 (PO3) фосфорит CaSO4 2h3O — гипс CaSO4 — флюорит CaSO4 — флюорит SrSO4 — целестин SrCO3 — стронцианит Барий: BaSO4 — барит BaCO3 — витерит
Химические свойства С простыми веществами (неметаллами) 2Me 0 + O 2 → 2Me +2 O -2 — оксид Me 0 + H 2 → Me +2 H 2 — гидрид Me 0 + Cl 0 2 → Me +2 Cl 2 — хлорид Me 0 + S 0 → Me +2 S -2 — сульфид 2.С комплексными веществами Me 0 + 2HCl → Me +2 Cl 2 + H 2 Me 0 + 2HOH → Me +2 (OH) 2 + Н 2
Соединения щелочноземельных металлов Оксиды щелочноземельных металлов — МеО имеют основной характер , легко реагируют с оксидами неметаллов с образованием соответствующих солей.
BaSO 4 Из-за нерастворимости и способности блокировать рентгеновское излучение используется в рентгенодиагностике — баритовая каша.
Ca 3 (PO 4) 2 Часть фосфоритов и апатитов, а также кости и зубы. В организме взрослого человека содержится 1 кг кальция в виде фосфата кальция.
CaCO 3 Карбонат кальция — одно из самых распространенных соединений на Земле. Он содержит породы — мел, мрамор, известняк.
CaSO 4 ∙ 2H 2 O В природе встречается в виде минерала гипса, который представляет собой кристаллогидрат. Применяется в строительстве, в медицине для наложения гипсовых слепков, для изготовления слепков.
MgCO 3 Широко используется в производстве стекла, цемента, кирпича, а также в металлургии для преобразования пустой породы в шлак.
Ca (OH) 2 Гидроксид кальция или гашеная известь с песком и водой называется известковым раствором и широко используется в строительстве.При нагревании разлагается на оксид и воду.
Включить эффекты
1 из 21
Отключить эффекты
Посмотреть похожие
Код для вставки
Связаться с
Одноклассники
Телеграмма
Обзоры
Добавьте свой отзыв
Зарегистрируйтесь, чтобы добавить отзыв.Аннотация к презентации
В презентации «Щелочные и щелочноземельные металлы» по химии в доступной и сжатой форме представлена информация о щелочных металлах, их свойствах и использовании в организме человека. Состоит из 21 слайда, содержит информацию об истории открытия элементов. Кроме того, в него включены вопросы для закрепления изученного материала.
- Щелочные металлы — элементы ИА группы
- Из истории открытия элементов
- Физические свойства
- Применение щелочных металлов
- Соединения щелочных металлов
- Химические свойства
- Вопросы
Формат
pptx (powerpoint)
Количество слайдов
Муравьева Н.А.
Аудитория
Слова
Аннотация
Настоящее время
Назначение
Слайд 1
Муравьева Н.А. — учитель химии, МОУ «Арбузовская сошь»
Слайд 2
Щелочные металлы — элементы ИА группы
- Перечислите известные вам щелочные металлы.
- Сколько электронов на внешнем энергетическом уровне имеют атомы всех щелочных металлов?
- Восстановителями или окислителями являются щелочные металлы.
- Что они имеют в виду, когда говорят о металлических свойствах элемента?
Slide 3
Из истории открытия элементов
- 19 ноября 1907 года в Лондоне на заседании Королевского химического общества сэр Хамфри Деви объявил о своем открытии новых элементов — натрия и калия.
- В течение 17 лет эти элементы не использовались, их называли «элементами только для химиков».
Слайд 4
Slide 5
3 января 1959 г.
- В небе появилась комета.Необычная комета — искусственная: облако паров натрия было выпущено советской космической ракетой, летевшей к Луне. Пурпурное свечение этих паров позволило уточнить траекторию полета первого самолета по маршруту Земля-Луна.
- Это было первое космическое применение натрия.
Slide 6
Физические свойства
- Какова структура кристаллов щелочного металла?
- Как меняются точки кипения и плавления?
- Какой из щелочных металлов самый легкий?
Слайд 7
Применение щелочных металлов
- Электровакуумная техника
- В мощных осветительных лампах
- Производство органических веществ
- Производство сверхлегких сплавов
- Гальванические элементы для космических аппаратов
- Фотоэлементы
- Очистка инертных газов
- Теплоноситель в ядерных реакторах
Slide 8
Соединения щелочных металлов
- Ветхий Завет упоминает некую субстанцию «нетер».Это вещество использовалось как моющее средство. Скорее всего, он образовался в солёных египетских озерах с известняковыми берегами. Об этом веществе, но под названием «нитрон», позже писали греческие авторы — Аристотель, Диоскорид.
- Сода каустическая.
- Сода кальцинированная.
- Сода пищевая.
- Соль.
- Нитрат калия.
- Калий
Slide 9
Химические свойства
- Используя схему, напишите уравнения соответствующих реакций.
HCl NaCl Na Na2O (Na2O2)
NaNO3 NaOH Cu (OH) 2
Слайд 10
Щелочноземельные металлы-элементы IIA группа
- Не все элементы группы IIA являются щелочноземельными, но только начиная с кальция и ниже по группе.
- Оксиды этих элементов («земля» — по старой терминологии) взаимодействуют с водой, образуя щелочи.
- Напишите уравнения реакции любого из оксидов металлов с водой.
Slide 11
Окраска пламенем соединениями щелочных и щелочноземельных металлов
Slide 12
Кальций — типичный щелочноземельный металл
- Дайте названия соединениям кальция:
- Запомните банальные названия этих веществ
- Как изменяются свойства элементов группы IIA с увеличением размеров атомов и образующихся ими ионов при движении по группе сверху вниз?
- Какие свойства проявляют оксиды и гидроксиды этих элементов?
Slide 13
Жесткость воды
Slide 14
Химические свойства
Slide 15
Генетический диапазон кальция
Ca CaO Ca (OH) 2
Slide 16
Кальций в природе
- Кальциевые породы — известняк, мрамор, мел.
- Запомните формулу этих камней.
- В чем их разница?
Slide 17
- Мел, известняк, мрамор не растворяются в чистой воде, но они растворяются в кислых растворах, даже таких слабых, как природная вода.
- Если порода залегает под тонкослойными грунтами — образуются провалы;
Slide 18
2. Если скалы залегают на большой глубине, появляются подземные карстовые пещеры.
- Какие химические реакции происходят в этом случае?
Slide 19
- Под воздействием кислотного дождя разрушаются здания. Какие реакции происходят в этом случае?
- Известняк и мрамор используются в архитектуре и скульптуре
Slide 20
- Какое значение имеют щелочные и щелочноземельные металлы в жизни человека?
- Как меняются свойства оксидов и гидроксидов в группах с увеличением заряда ядра?
- Какой из элементов, калий или цезий, является более сильным восстановителем?
Slide 21
Спасибо за вашу работу!
Посмотреть все слайды
Аннотация
Урок химии
Разработано
учитель химии Муравьева Н.А.
Арбузовка 2011
Тип урока —
Тип урока
Цели и задачи урока.
Веществ:
Во время занятий.
Основная часть урока.
Слайд 2.
щелочных металлов?
Слайд 3.
Слайд 4.
Slide 6. Физические свойства.
Слайд 7.
Cs — в фотоэлементах.
руб. — в часовом деле.
Слайд 8.
Как вы думаете, о каком веществе идет речь?
Запомните названия соединений щелочных металлов и составьте их формулы:
Сода каустическая.
Сода кальцинированная.
Сода пищевая.
Нитрат калия.
Slide 9. Химические свойства.
NaNO3 ← NaOH → Cu (OH) 2
Слайд 10.
Слайд 11. Демонстрация опыта.
Слайд 12.
Слайд 13. Жесткость воды.
Slide 14. Химические свойства.
Кислоты
Органические вещества
Слайд 15. Генетический диапазон кальция.
Ca → CaO → Ca (OH) 2 → CaCO3↔CaHCO3
Напишите уравнения реакций, с помощью которых можно осуществить превращение веществ.
Slide 16. Кальций в природе.
Слайд 17.
Когда вода просачивается с поверхности земли через известняковые отложения, происходят следующие процессы:
Как называется залежь, свисающая в виде гигантских сосулек из свода пещеры? А как насчет колонн, растущих к ним со дна пещеры?
Слайд 19.
Краткое содержание урока.
Слайд 20. Ответьте на вопросы.
Подержанные книги:
МОУ «Арбузовская сошь» Павловского района Алтайского края
Урок химии
«Щелочные и щелочноземельные металлы»
Разработано
учитель химии Муравьева Н.А.
Арбузовка 2011
Металлы щелочные и щелочноземельные.
(Повторно-обобщающий урок в 9 классе на компьютере)
Урок проводится как многократное обобщение по данной теме, так как свойства щелочных металлов, т.е.е. химические элементы группы IA учитывались в 8 классе, свойства кальция — элемента группы IIA — в 9 классе. У детей уже есть определенные знания, которые необходимо запомнить на уроке и систематизировать. Слайды из этой презентации также могут быть использованы для объяснения связанных тем в 8 и 9 классах.
На уроке учащиеся, основываясь на информации на слайдах, должны вспомнить полученную ранее информацию о щелочных и щелочноземельных металлах и осознать их значение в жизни человека.Кроме того, на основе полученных знаний выполняйте предложенные задания, четко излагайте свои мысли и формулируйте концепции.
Урок-презентация проводится с использованием мультимедийного проектора. Переходя от слайда к слайду, учащиеся вспоминают ранее изученный материал и используют свои знания для выполнения упражнений и ответов на вопросы.
Тип урока — повторяюще-обобщающий, на котором знания по теме актуализируются посредством осознания и понимания того, что было изучено на предыдущих уроках образовательной информации, с использованием имеющихся навыков и способностей, а также с опорой на жизненный опыт.
Урок типа — пояснительно-иллюстративный, с элементами самостоятельной работы по поиску правильных ответов на предложенные вопросы и задания, содержащиеся на слайдах.
Методы и методические приемы. Самостоятельная работа по поиску правильных ответов, составлению уравнений реакций, обсуждению выбранного ответа, демонстрации экспериментов с последующим написанием уравнений реакций, обсуждением результатов работы.
Цели и задачи урока.
Образовательный. Создать условия: систематизировать и расширить знания и умения по данной теме; закрепить представления о щелочных и щелочноземельных металлах и о взаимосвязи между группой элементов и их свойствами; показать, насколько велико значение этих элементов в жизни человека; создать условия для совершенствования навыков поиска и формулирования правильного ответа на поставленный вопрос, исходя из ранее полученных знаний; закрепить в работе учащихся последовательность действий при составлении уравнений реакций, характеризующих процессы, происходящие в природе, на основе имеющегося жизненного опыта.
Развивающийся. Стимулировать познавательную активность студентов, развивать интерес к предмету, смекалку, умение быстро и четко излагать свои мысли, применять полученные знания на практике при выполнении тех или иных заданий. Создайте условия для развития: умения выделять главное; отстаивайте свою точку зрения.
Образовательный. Продолжить: формирование научного мировоззрения; формирование позитивного отношения к получению знаний, уверенности в себе.
Дидактическое обеспечение и оборудование. Компьютер, запись урока-презентации на диск, мультимедийный проектор. Лабораторная посуда для демонстрации экспериментов.
Вещества: оксид кальция, вода, натрий, кальций, литий, мел, мрамор, известняк.
Во время занятий.
Мотивационный целевой этап урока.
Слайд 1. Тема «Щелочные и щелочноземельные металлы».
Учитель: Вы уже встречались с основными представителями этих групп элементов.Помните, где в Периодической таблице они расположены. Сегодня на уроке мы постараемся систематизировать имеющиеся у вас знания об этих металлах.
Основная часть урока.
Слайд 2. Щелочные металлы — элементы ИА группы.
Перечислите известные щелочные металлы.
Сколько электронов на внешнем энергетическом уровне делают атомы всех
щелочных металлов?
Щелочные металлы являются восстановителями или окислителями?
Что они имеют в виду, когда говорят о металлических свойствах элемента?
Слайд 3. Из истории открытия элементов.
19 ноября 1907 года в Лондоне на заседании Королевского химического общества сэр Хамфри Деви объявил о своем открытии новых элементов — натрия и калия. 17 лет эти элементы не использовались, их называли «элементами только для химиков».
Слайд 4. Биографические сведения о Г. Деви.
В небе появилась комета. Комета необычная, искусственная. Облако паров натрия было выпущено космической ракетой, летевшей к Луне.Пурпурное свечение этих паров позволило уточнить траекторию первого самолета, пролетевшего по маршруту Земля-Луна. Это было первое космическое применение натрия.
Slide 6. Физические свойства. (Видео фрагмент демонстрирующий мягкость, пластичность, металлический блеск щелочных металлов).
Какова структура кристаллов щелочного металла?
Как меняются точки плавления и кипения в группе?
Какой из щелочных металлов самый легкий?
Слайд 7. Использование щелочных металлов.
Li — производство сверхлегких сплавов, очистка инертных газов, гальваника
элементов для космических аппаратов.
Na — теплоноситель в ядерных реакторах, в вакуумной технике,
в мощных электрических лампах освещения, в производстве органических
Cs — в фотоэлементах.
руб. — в часовом деле.
Слайд 8. Соединения щелочных металлов.
Ветхий Завет упоминает некую субстанцию «нетер».Это вещество использовалось как моющее средство. Скорее всего, он образовался в соленых египетских озерах с известняковыми берегами. Более поздние греческие авторы — Аристотель, Диоскорид писали об этом веществе, но под названием «нитрон».
Как вы думаете, о каком веществе идет речь?
Запомните названия соединений щелочных металлов и составьте их формулы:
Сода каустическая.
Сода кальцинированная.
Сода пищевая.
Нитрат калия.
Potash (Проверка правильности формул).
Slide 9. Химические свойства.
Используя схему, напишите уравнения соответствующих реакций:
HCl ← NaCl ← Na → Na2O (Na2O2)
NaNO3 ← NaOH → Cu (OH) 2
(Проверка правописания уравнений у одного-двух учеников в тетрадях)
Slide 10. Щелочноземельные металлы относятся к элементам группы IIA.
Не все элементы группы IIA являются щелочноземельными, а только начиная с кальция и заканчивая группой.
Оксиды этих элементов («земля» — по старой терминологии) взаимодействуют с водой, образуя щелочи. Демонстрация эксперимента «Гашение извести».
Напишите уравнение реакции любого из оксидов металлов с водой.
Slide 11. Огненная окраска соединениями щелочных и щелочноземельных металлов. Демонстрация опыта.
Li — карминно-красный Ca — оранжево-красный
Na — желтый Sr — карминно-красный
K — фиолетовый Ba — желтовато-зеленый
Слайд 12. Кальций — типичный щелочноземельный металл.
Дайте названия соединениям кальция: CaO, Ca (OH) 2, CaCO3, CaHCO3
помню банальные названия этих веществ.
Как изменяются свойства элементов IIA группы с увеличением размеров атома и образующихся ими ионов при движении по группе сверху вниз?
Каковы свойства оксидов и гидроксидов этих элементов?
Слайд 13. Жесткость воды.
Slide 14. Химические свойства.
Кальций взаимодействует с: — солями малоактивных металлов
Малоактивные оксиды металлов
Кислоты
Органические вещества
Слайд 15. Генетический диапазон кальция.
Ca → CaO → Ca (OH) 2 → CaCO3↔CaHCO3
Напишите уравнения реакций, с помощью которых можно осуществить превращение веществ.
Slide 16. Кальций в природе.
Кальциевые породы — известняк, мрамор, мел. (Демонстрация образцов горных пород). Запомните формулу этих камней. В чем их отличие?
Slide 17. Мел, известняк, мрамор не растворяются в чистой воде, но они растворимы в кислых растворах, даже таких слабых, как природная вода.
Когда вода просачивается с поверхности земли через известняковые отложения, происходят следующие процессы:
Если скала лежит под тонким слоем почвы, образуются провалы;
Если скалы залегают на большой глубине, появляются подземные карстовые пещеры.
Как называется залежь, свисающая в виде гигантских сосулек из свода пещеры? А как насчет колонн, растущих к ним со дна пещеры?
Какие химические процессы происходят в этом случае?
Slide 19.

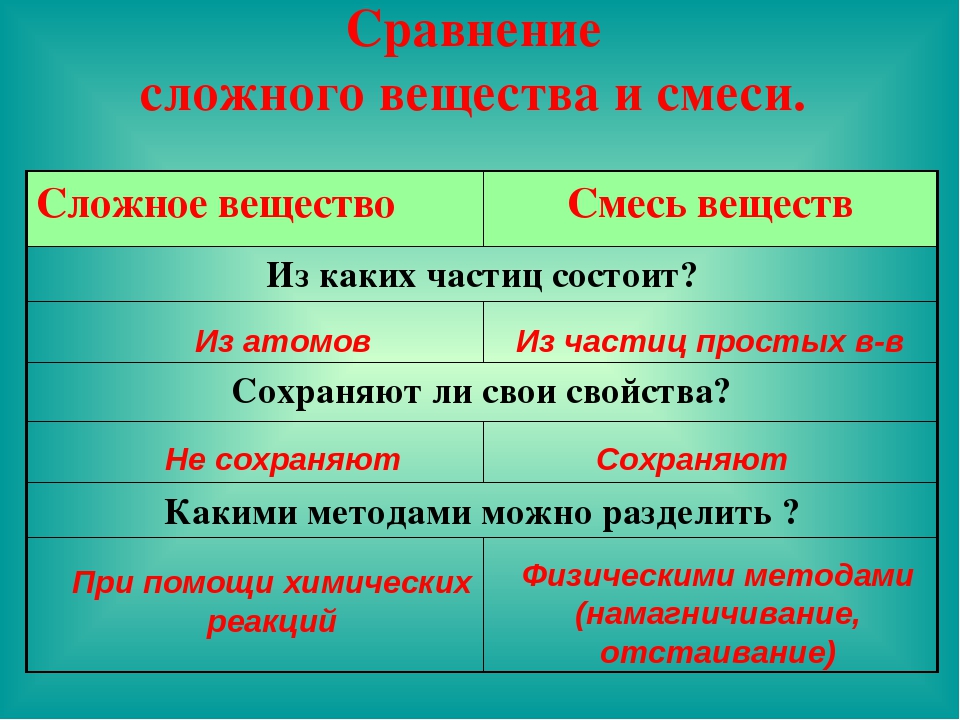
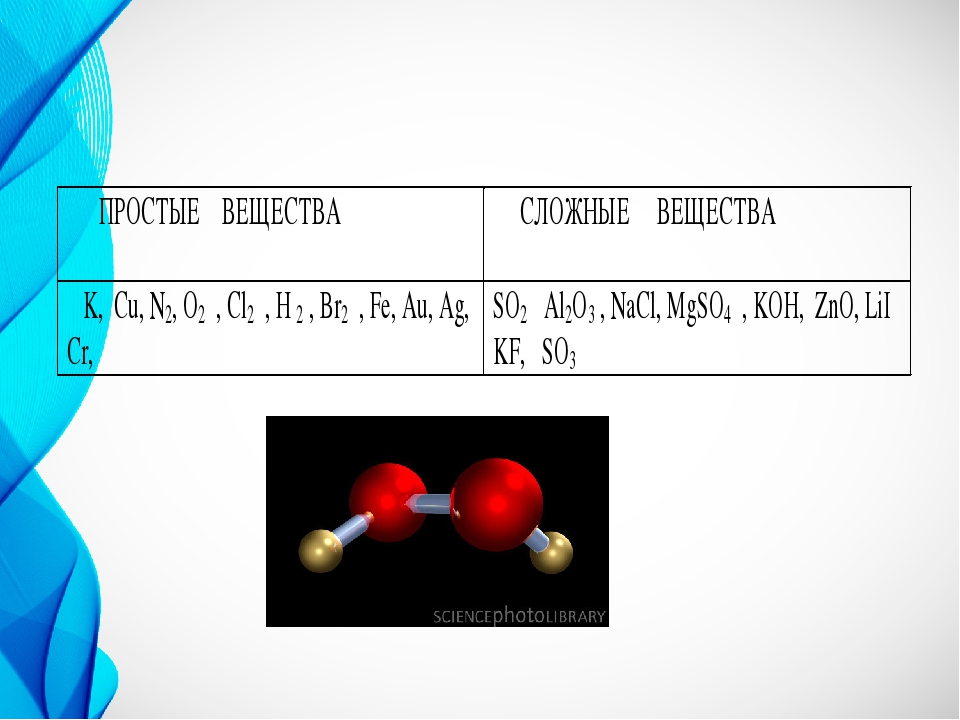
 Не разрушая молекул? Почему?
Не разрушая молекул? Почему? И.Менделеева;
И.Менделеева;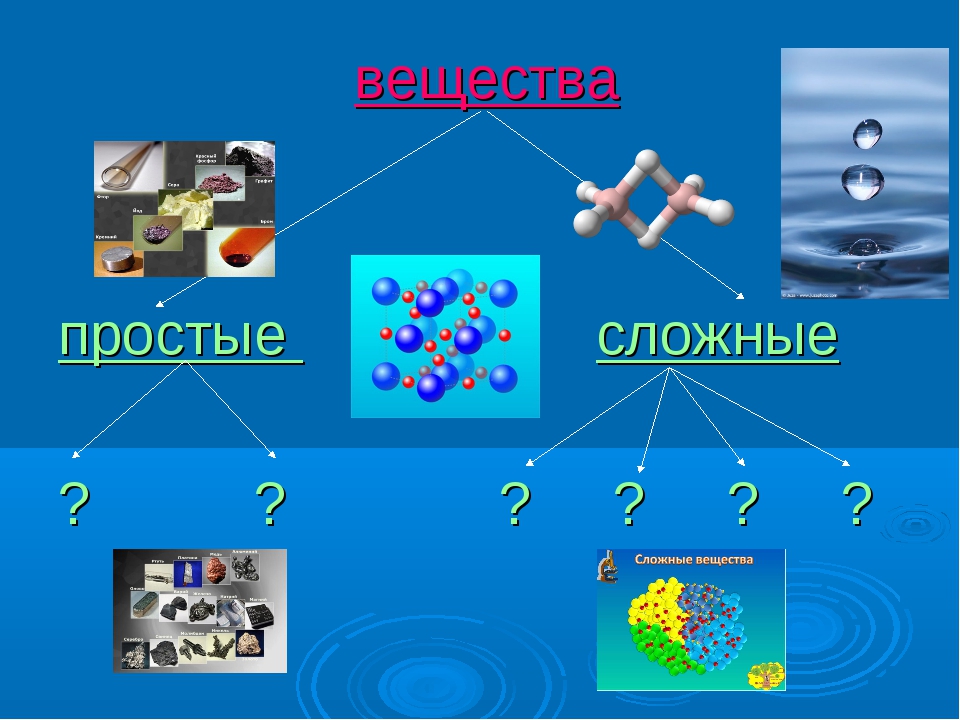

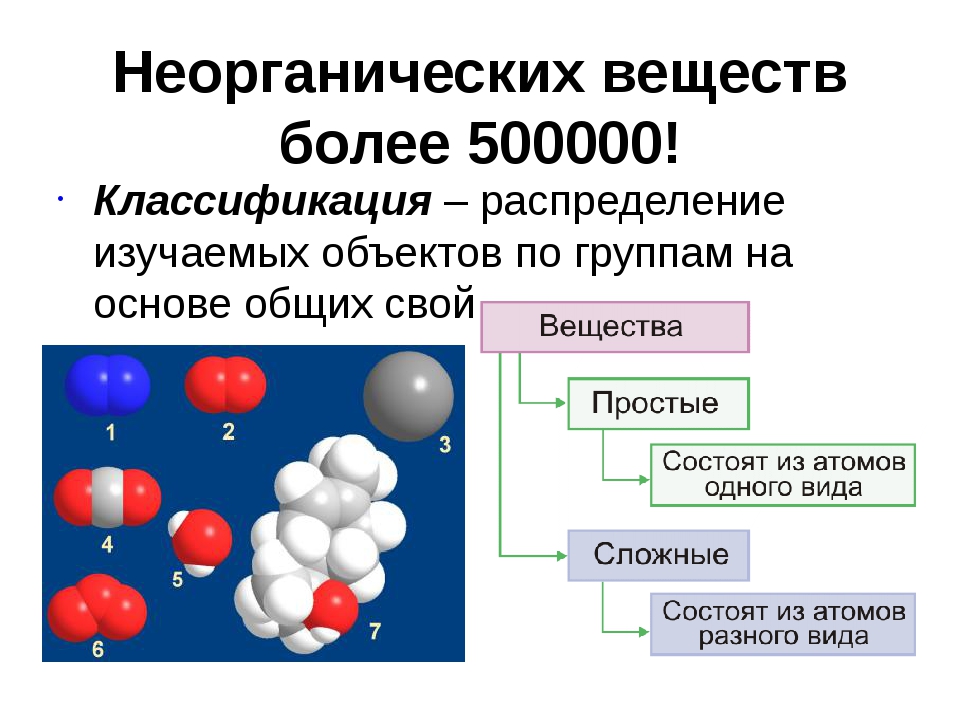 Сложные вещества состоят из разных:
Сложные вещества состоят из разных: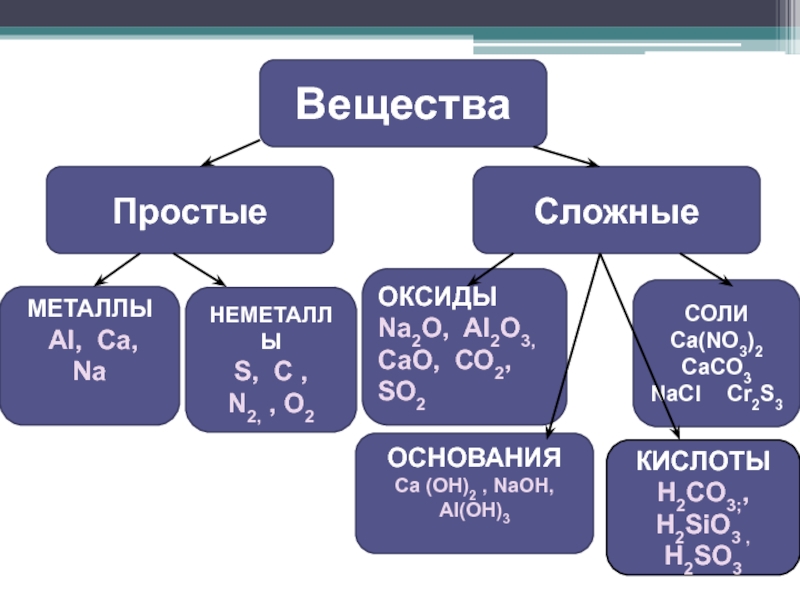

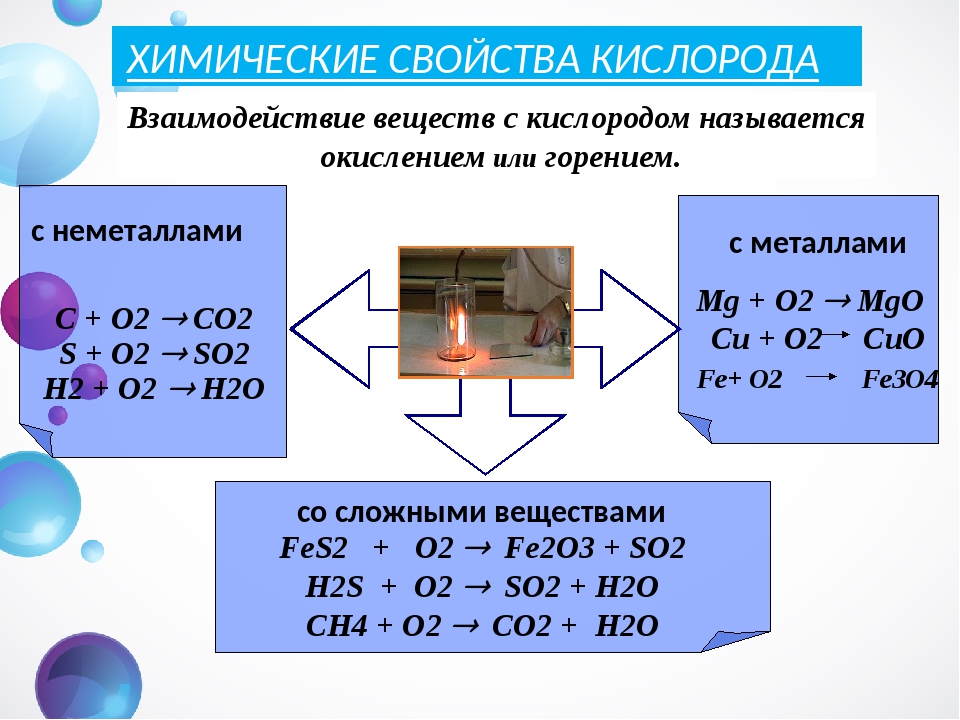 В название, какого химического элемента входит название игры: лото?
В название, какого химического элемента входит название игры: лото?

 Кто же испытал в чём-то затруднения, ещё проработают дома этот вопрос.
Кто же испытал в чём-то затруднения, ещё проработают дома этот вопрос.