Металлы электроотрицательные — Справочник химика 21
Для разделения цинка и кадмия часто используют образование тройных комплексов, содержащих ионы металла, электроотрицательный лиганд и органическое основание. В основе разделения лежат различная устойчивость галогенидных и роданидных комплексов металлов. В качестве органических оснований используют хлороформные растворы реагентов, указанных в табл. 25. При этом более слабые основания (р С > 9) образуют экстрагируемые соединения с иодидным комплексом Сси » в кислой среде. Цинк в этих условиях не экстрагируется из-за различия в устойчивости этих комплексов. Сильные органические основания (р С 9) взаимодействуют в слабощелочной среде и с кадмием и с цинком (рис. 32, а). [c.151]
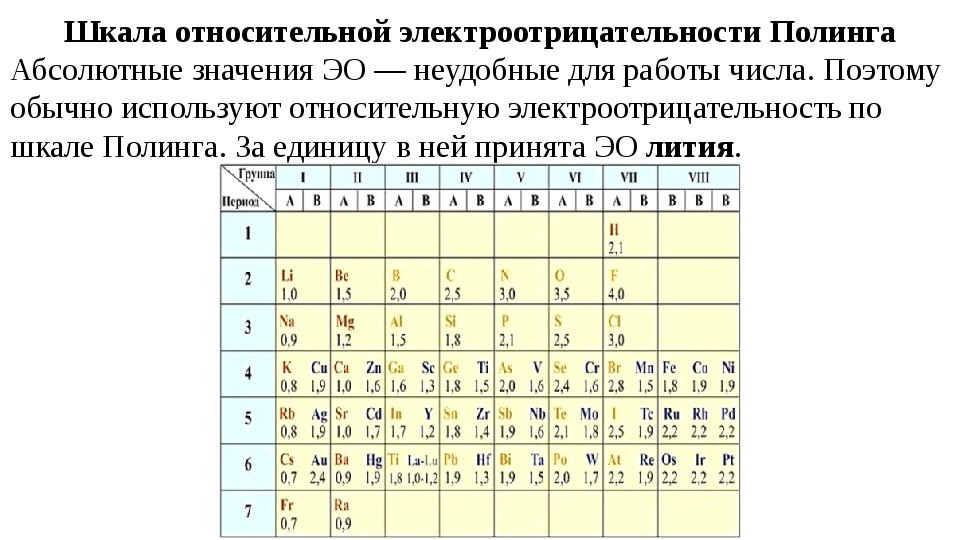
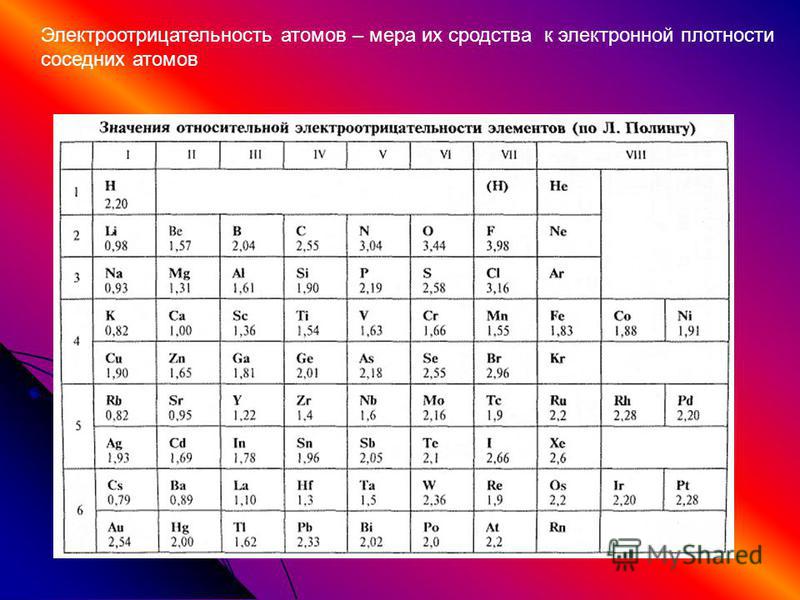
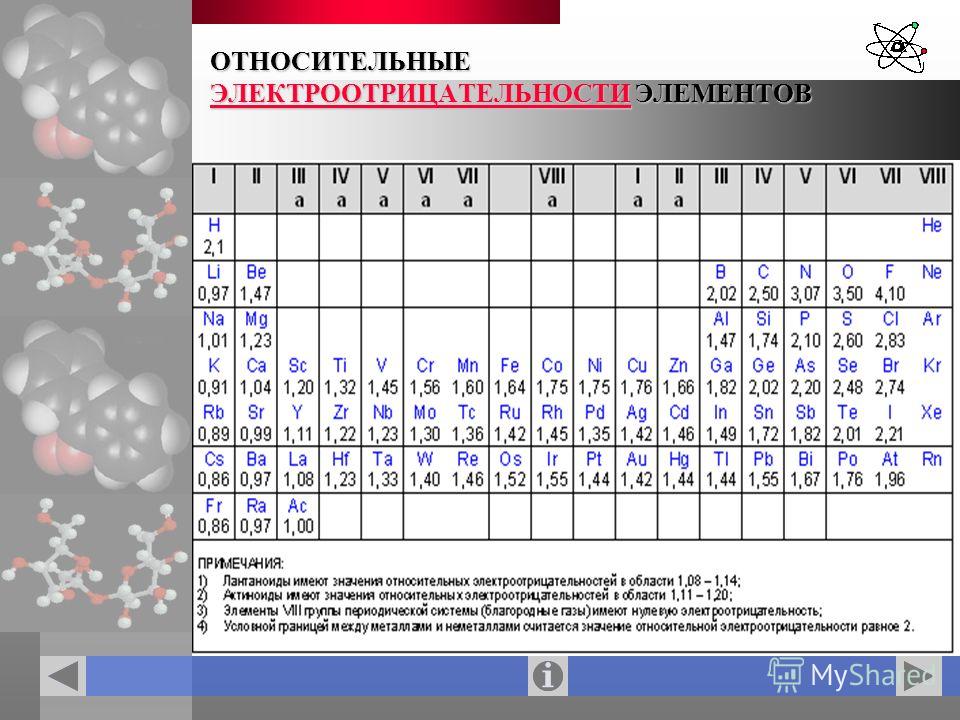
Электроотрицательность. В общем смысле электроотрицательпость означает сродство к электронам . Обычно химики используют это выражение, подразумевая степень притяжения между ядром и электронами на внешпей орбитали (орбиталях).
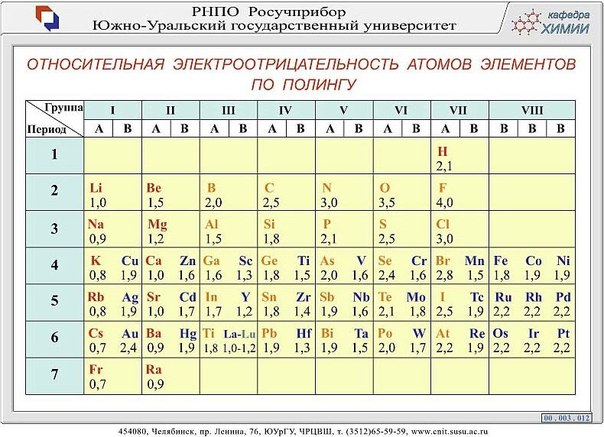
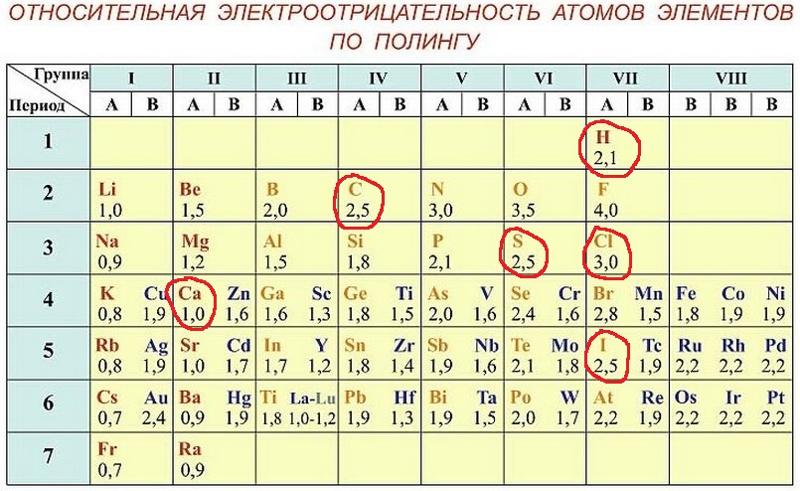
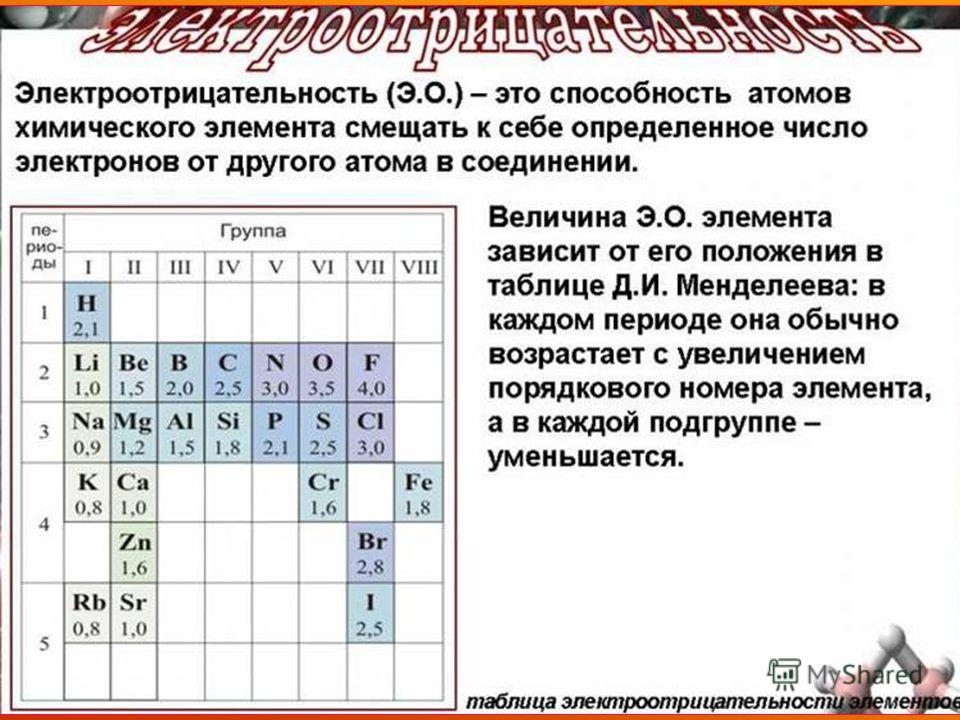
Рассматривая связь электроотрицательности с положением элемента в периодической системе, можно отметить некоторые закономерности. В горизонтальных направлениях периодической системы (по периодам) наблюдается увеличение электроотрицательности (особенно для элементов главных подгрупп). Например, электроотрицательность элементов второго периода увеличивается от 1,0 для лития до 4,0 для фтора электроотрицательность элементов третьего периода — от 0,9 для натрия до 3,0 для хлора. В вертикальных направлениях периодической системы (по подгруппам) наблюдается уменьшение электроотрицательности. Так, в подгруппе ш,елочных металлов электроотрицательность уменьшается от 1,0 для лития до 0,7 для цезия в подгруппе галогенов — от 4,0 для фтора до 2,2 для астата.
Большинство металлоорганических связей полярно-кова-лентные. Только у щелочных металлов электроотрицательность достаточно низка, чтобы возможно было образование ионных связей с углеродом, но даже алкиллитиевые соединения по своим свойствам напоминают скорее ковалентные, а не ионные соединения. Простые алкильные и арильные производные натрия, калия, рубидия и цезия представляют собой нелетучие твердые вещества [93], нерастворимые в бензоле и других органических растворителях, в то же время алкильные производные лития — растворимые, хотя, как правило, тоже нелетучие твердые вещества. В таких растворителях, как эфир и углеводороды, алкиллитиевые соединения не существуют в виде мономерных частиц [94]. Наблюдения за понижением точки за-
Металлы, потенциал к-рых менее положительный, чем у кислородного электрода, термодинамически неустойчивы в контакте с (или воздухом) и водой.
 Поэтому Э. р. н. служит дои ориентировочных оценок скорости электрохим. коррозии в водных р-рах при обычных т-рах, а также для выбора безопасных контактных пар (гальванич. пар) разнородных металлов. Если металл электроотрицательнее, чем Hj, то может нити активный коррозионный процесс (см. Коррозия металлов, Коррозионностойкие материалы. Электрохимическая защита), Практич. реализация электродных процессов определяется наряду с термодинамич. таюке и кинетич. факторами (см. Электрохимическая кинетика). [c.465]
Поэтому Э. р. н. служит дои ориентировочных оценок скорости электрохим. коррозии в водных р-рах при обычных т-рах, а также для выбора безопасных контактных пар (гальванич. пар) разнородных металлов. Если металл электроотрицательнее, чем Hj, то может нити активный коррозионный процесс (см. Коррозия металлов, Коррозионностойкие материалы. Электрохимическая защита), Практич. реализация электродных процессов определяется наряду с термодинамич. таюке и кинетич. факторами (см. Электрохимическая кинетика). [c.465] Наиболее часто используемой шкалой электроотрицательностей является шкала, рассчитанная Полингом из термохимических данных. Значения электроотрицательностей по шкале Малликена (в электрон-вольтах) могут быть переведены в шкалу Полинга путем деления на коэффициент 3,17. При этом полного согласия данных не достигается, но соответствие обеих шкал вполне удовлетворительное. Фтор представляет собой наиболее электроотрицательный атом (4,0 по шкале Полинга), а цезий — наименее электроотрицательный атом (0,7 по шкале Полинга).
Однако водород выделяется на цинке с большим перенапряжением, что тормозит эти процессы и практически позволяет использовать цинк в качестве отрицательного электрода. Если на поверхности пинка будут присутствовать металлы, на которых перенапряжение для выделения водорода меньше, чем на. цинке (например, медь, железо), то водород будет выделяться на этих металлах, и коррозия цинка резко усилится. Появление таких металлов может иметь место при использовании цинка или электролита недостаточной чистоты. Цинк, как металл электроотрицательный, вытесняет более благородные металлы из раствора, и они осаждаются на его поверхности, усиливая саморазряд. Наличие в электролите железа н других металлов переменной степени окисления может вызвать саморазряд как отрицательного, так и положительного электродов. На положительном электроде ионы железа будут окисляться до Ре +, на что будет расходоваться МпОг. Диффундируя к отрицательному электроду, ионы Ре + будут в контакте с цинком восстанавливаться до Ре + (или до металла), на что будет расходоваться цинк. Коррозия цинка в присутствии кислорода может происходить и без выделения водорода [c.326]
Появление таких металлов может иметь место при использовании цинка или электролита недостаточной чистоты. Цинк, как металл электроотрицательный, вытесняет более благородные металлы из раствора, и они осаждаются на его поверхности, усиливая саморазряд. Наличие в электролите железа н других металлов переменной степени окисления может вызвать саморазряд как отрицательного, так и положительного электродов. На положительном электроде ионы железа будут окисляться до Ре +, на что будет расходоваться МпОг. Диффундируя к отрицательному электроду, ионы Ре + будут в контакте с цинком восстанавливаться до Ре + (или до металла), на что будет расходоваться цинк. Коррозия цинка в присутствии кислорода может происходить и без выделения водорода [c.326]
Для многих случаев методом изомолярных серий установлено образование соединений с простыми стехиометрическими отношениями в системе ТБФ (или металл)—электроотрицательный лиганд. [c.347]
Общей характеристикой борогидридов, используемых при полимеризации на окислах металлов VA группы, может служить то, что эффективными промоторами являются два класса борогидридов. К первому классу относятся борогидриды щелочных металлов, в том числе борогидриды лития, натрия, калия, рубидия и цезия. Во второй класс входят борогидриды магния, бериллия, алюминия, тория, гафния, циркония и урана, которые характеризуются своей способностью восстанавливать соли многовалентных металлов и присутствием металла, электроотрицательность которого не менее единицы по шкале Полинга. В этом случае эффективные вещества не могут быть все определены и охарактеризованы одинаковым образом.
К первому классу относятся борогидриды щелочных металлов, в том числе борогидриды лития, натрия, калия, рубидия и цезия. Во второй класс входят борогидриды магния, бериллия, алюминия, тория, гафния, циркония и урана, которые характеризуются своей способностью восстанавливать соли многовалентных металлов и присутствием металла, электроотрицательность которого не менее единицы по шкале Полинга. В этом случае эффективные вещества не могут быть все определены и охарактеризованы одинаковым образом.
В связи с уменьшением электроотрицательности в главных группах периодической системы возрастают металлические свойства элементов. Увеличение радиуса атомов в IV (С, 51, Ое, 5п, РЬ), V (Н, Р, Аз, ЗЬ) и VI (О, 8, 8е, Те) группах приводит к изменению характера элементов от ярко выраженных неметаллов к металлам. Электроотрицательность — периодическая функция порядкового номера (рис. 5.4). [c.160]
Ионизация на поверхности в случае молекул представляет более сложное явление, в к-ром большую роль должны играть процессы диссоциации с адсорбцией нейтрального осколка, а также ионно-молеку-лярные взаимодействия.
На основе аналогичных рассуждений Мулликен нашел исправленные значения электроотрицательности, приведенные в табл. 9. К ним для сравнения добавлена величина электроотрицательности для лития. Сродство лития к электрону было оценено приближенно, но так как оно очень мало, то достаточной оказывается даже очень грубая оценка.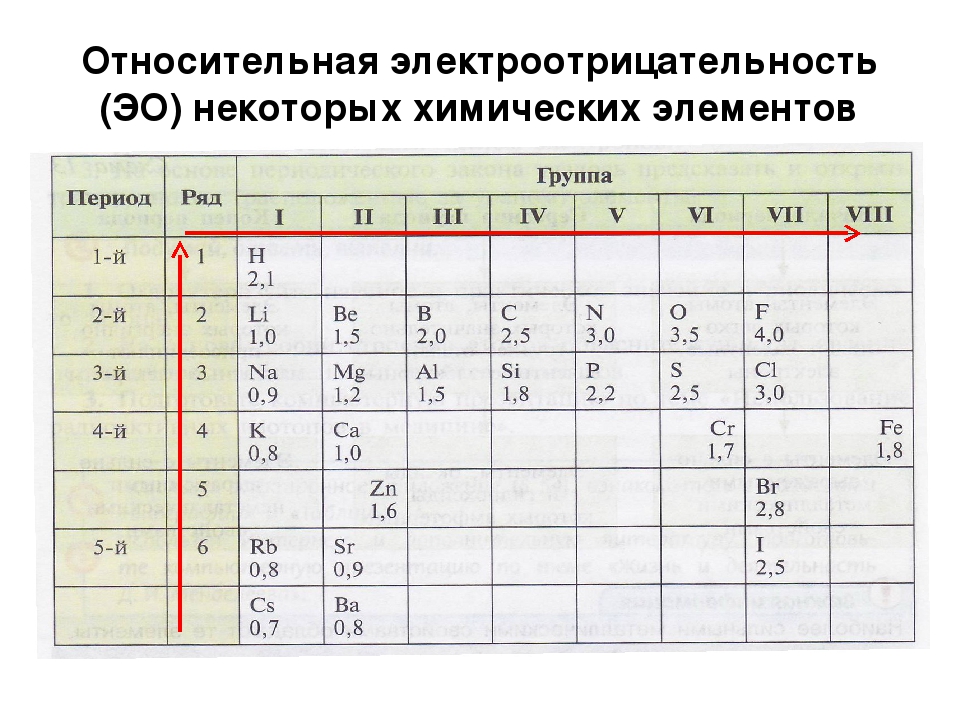
В Киевском университете в течение ряда лот велись работы по изучению комплексообразования в системе ион металла — электроотрицательный адденд — органическое основание. Из анионов были изучены галогениды, роданид, салнцилат и пирокате-хинат. Из органических оснований исследовали пиридин, хинолин, антипирин, пирамидон и диант1шнрилметан. Наши опыты показали, что равновесие образования и тип образующихся комплексов зависят прежде всего от природы реагирующих компо- [c.
 118]
118] Для реакций в системе высокомолекулярный амин — ион металла— электроотрицательный лиганд часто характерно взаимодействие типа ионного обмена. Многие высокомолекулярные основания, нерастворимые в воде, применяются в виде растворов в инертном растворителе, как бензол, керосин, хлороформ и т. п. При встряхивании такого раствора с кислотой (HF, НС1, h3SO4 и др.) образуются соли высокомолекулярных оснований, которые также нерастворимы в воде и растворимы в органической жидкости, Таким образом, в органической фазе находится аммониевая соль [АгпН]Х, химические свойства которой аналогичны аниониту
Число известных соединений в системах амин—металл—электроотрицательный компонент очень велико. Однако строение и свойства их недостаточно изучены. В частности, в ряде случаев, по-видимому, недостаточно представлений о координационной сфере с шестью местами. Например, в системе лантаноид — дибензоилметан (ДБМ)—фенантролин (Phen) образуются соединения с отношением компонентов [Ln] [Phen] [ДБМ]= 1 1 3. Учитывая состав соединения, а также способность к координации как фенантролина (см. выше)., так и дибензоилметана (дикетон) [c.349]
Учитывая состав соединения, а также способность к координации как фенантролина (см. выше)., так и дибензоилметана (дикетон) [c.349]
Адсорбция всех исследованных присадок при повышенных температурах сопровождается величением работы выхода электрона, т.е. образованием на поверхности металла электроотрицательных слоев. Эго объясняется как непосредственным окислением поверхности металла и последующем реакцией ее с молекулами присадки, так и физико-хими-ческиы изменением молекул присадки под действием кислорода с образоваиием продуктов, способных вступать в реакцию с металлом Г42], что находится в хорошем соответствии с теорией Г.В.йиноградова, [c.40]
Интересно отношение бериллия к воде несмотря на то что бериллий является металлом электроотрицательным, находящимся в ряду напряжений между магнием и кальцием, он не вытесняет водорода из воды ни в холодном, ни в нагретом состоянии. Это объясняется образованием на поверхности металла пленкц окиси, препятствующей дальнейшему взаимодействию его с водой. Однако металлический бериллий вытесняет воду из различных твердых кристаллогидратов [1156]. Подобное же явление было установлено ранее для магния, алюминия и цинка. Растертый в порошок металлический бериллий реагирует с растертыми же в порошок различными солями с различной скоростью. [c.431]
Однако металлический бериллий вытесняет воду из различных твердых кристаллогидратов [1156]. Подобное же явление было установлено ранее для магния, алюминия и цинка. Растертый в порошок металлический бериллий реагирует с растертыми же в порошок различными солями с различной скоростью. [c.431]
Для удаления из металла электроотрицательных примесей и предотвращения перехода в него кремния из электролита перед измерениями пропускали некоторое время анодный ток в 10—20 ма/см . Релаксационные измерения проводили в основном гальваностатическим методом. В отдельных опытах применялся еще и кулоностатический метод [6]. [c.172]
Какой самый электроотрицательный элемент? — 2022
Какой самый электроотрицательный элемент? Электроотрицательность — это одна из мер способности элемента образовывать химические связи путем привлечения электрона. Вот взгляд на наиболее электроотрицательный элемент и объяснение того, почему он обладает такой высокой электроотрицательностью.
Почему фтор является наиболее электроотрицательным элементом
Фтор является наиболее электроотрицательным элементом. Фтор имеет электроотрицательность 3,98 по шкале электроотрицательности Полинга и валентность 1.
Атому фтора нужен один электрон, чтобы заполнить его внешнюю электронную оболочку и достичь стабильности, поэтому свободный фтор существует как F— ион. Другими сильно электроотрицательными элементами являются кислород и хлор. Водородный элемент не обладает такой высокой электроотрицательностью, потому что, хотя он имеет наполовину заполненную оболочку, он легко теряет электрон, а не приобретает его. При определенных условиях водород образует Н— ион, а не H+.
В целом, все элементы группы галогеновых элементов имеют высокие значения электроотрицательности. Неметаллы слева от галогенов в периодической таблице также имеют довольно высокую электроотрицательность. Элементы, принадлежащие к группе благородных газов, имеют очень низкие значения электроотрицательности, потому что они имеют полные валентные электронные оболочки.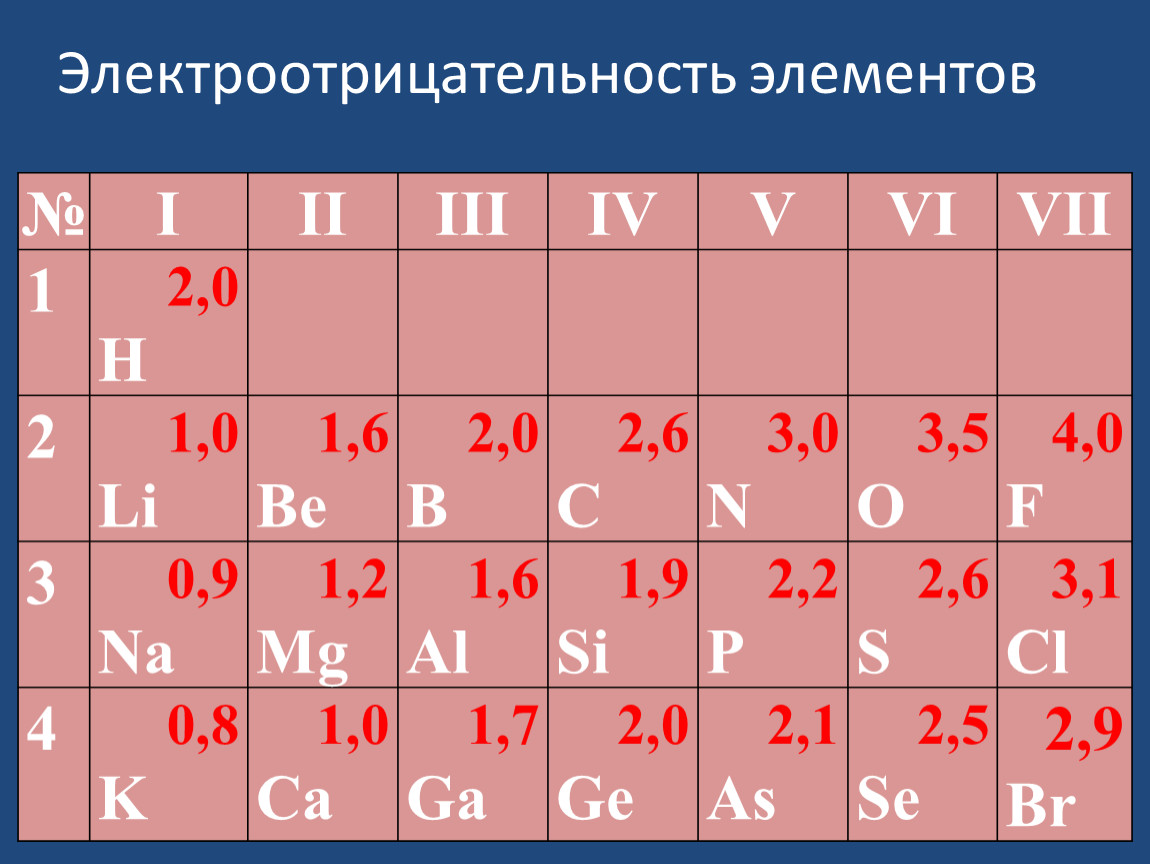
Подробнее об электроотрицательности
- Наиболее электроположительный элемент. Противоположностью электроотрицательности является электроположительность. Узнайте, какой элемент является наиболее электроположительным или имеет самую низкую электроотрицательность.
- Периодическая таблица электроотрицательности: в этой удобной таблице перечислены все значения электроотрицательности элементов. Значения могут использоваться для прогнозирования того, будут ли два атома образовывать ионные или ковалентные связи.
- Тенденции Периодической таблицы: электроотрицательность — одна из тенденций, замеченных в организации элементов в периодической таблице.
Элементы жизни. Вода — Индикатор
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой — в первую очередь потому, что образуют с ней водородные связи, «цепляясь» за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы. Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
К гидрофильным веществам относятся, например, спирты и углеводы. Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Правда, рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Менделеев убедительно показал, что растворение — это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор — это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кислорода обычно образуются водородные связи. Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными («боящимися воды»). Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела. Вода как бы «выталкивает» эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка.
Гидрофильными бывают и некоторые бескислородные органические вещества — например, амины. В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно. Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ — да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям прежде всего в виде углекислого газа, который мы выдыхаем, но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
В этом растворителе могут жить даже земные микробы. Например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых суперземлях — планетах с массой, в несколько раз превосходящей массу Земли. Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни — аммиак (NH3). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода, ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, — метиловый спирт, или метанол (CH3OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем. Вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Элементы с большей электроотрицательностью будут оттягивать общие электроны от элементов с меньшей электроотрицательностью.  Ряд электроотрицательностей Ряд электроотрицательностейПравила определения электроотрицательности по периодической таблице: 1) слева направо по периоду и снизу вверх по группе электроотрицательность атомов увеличивается; 2) самый электроотрицательный элемент – фтор, так как инертные газы имеют завершенный внешний уровень и не стремятся отдавать или принимать электроны; 3) атомы неметаллов всегда более электроотрицательны, чем атомы металлов; 4) водород имеет низкую электроотрицательность, хотя расположен в верхней части периодической таблицы. | |||||||||||
В Новосибирске создали новые материалы для микроэлектроники — Сибирь
НОВОСИБИРСК, 2 июля. /Корр. ТАСС Анастасия Аникина/. Ученые Института катализа (ИК) Сибирского отделения РАН создали новый класс материалов на основе ионных жидкостей, которые обладают способностью к самоорганизации и в перспективе могут использоваться, в частности, в микроэлектронике. Об этом ТАСС сообщил заведующий лабораторией ИК СО РАН Николай Адонин.
«Мы вышли на целый класс материалов на основе ионных жидкостей (веществ, состоящих из заряженных частиц — прим. ТАСС), которые, возможно, в будущем станут элементами новых электронных устройств. Благодаря специфическому взаимодействию компонентов эти материалы могут самоорганизовываться на поверхности раздела фаз и образовывать новые упорядоченные структуры. При этом мы можем с большой долей вероятности спрогнозировать, как будут взаимодействовать между собой компоненты, и какими свойствами будут обладать самоорганизованные структуры», — сказал собеседник агентства.
По его словам, такие материалы перспективны для различных микроустройств за счет их способности к самоорганизации и изменению свойств поверхностей. «Например, в основе технологии изготовления микросхемы лежит модификация поверхности. Если вещество модифицирует поверхность, оно может быть потенциально использовано для создания новых электронных микроустройств», — пояснил Адонин.
Ключевую роль в новых материалах играет фтор. «Атом фтора по размеру примерно равен атому водорода, но при этом у него прямо противоположные электронные свойства — это самый электроотрицательный элемент. Если мы берем углеводородную молекулу и ее аналог, где все атомы заменены на фтор, мы получаем два противоположных по свойствам вещества. Так, например, наиболее интересным свойством перфторированных материалов является повышенная химическая стабильность», — добавил ученый.
«Атом фтора по размеру примерно равен атому водорода, но при этом у него прямо противоположные электронные свойства — это самый электроотрицательный элемент. Если мы берем углеводородную молекулу и ее аналог, где все атомы заменены на фтор, мы получаем два противоположных по свойствам вещества. Так, например, наиболее интересным свойством перфторированных материалов является повышенная химическая стабильность», — добавил ученый.
Сейчас специалисты ИК СО РАН продолжают работать над новыми материалами и изучают их свойства.
Электроотрицательность атома. Единство природы химических связей.
Дата: класс: 8 урок 24 | ||||
Тема: Электроотрицательность атома. Единство природы химических связей. | ||||
Цель урока: : раскрыть сущность образования химической связи между атомами, начать формирование понятий о видах химической связи, электроотрицательности. Задачи урока: на основе знаний о строении атомов выяснить, что и как заставляет атомы соединяться друг с другом в молекулы и другие структурные объединения сложных веществ. Ожидаемый результат: Знатют понятия «химическая связь», «электроотрицательность», причину и природу химической связи, её виды.и сравнивать элементы по ЭО; объяснять причину образования химической связи;. | ||||
Деятельность учителя | Деятельность обучающихся | наглядности | ||
2 мин. | I. Организационный момент. Приветствует учащихся, проверяет готовность к уроку, желает успеха. Для создания психологической атмосферы проводит игру«Атомы и молекулы», а также делятся на группы. | Ученики осмысливают поставленную цель. | пазлы | |
5 мин. | II. Проверка домашней работы. С помощью метода «Ромашка Блума» осуществляет проверку домашней работы . Каково строение атома?
а) 1s22s22p63s1 б) 1s22s22p63s23p4 в) 1s22s22p63s23p63d04s2 г ) 1s22s22p5 6) Сколько электронов на внешнем слое атомов главных подгрупп? 7) Как определить число спаренных и неспаренных электронов на внешнем слое атома? | Ученики демонстрируют свои знания. | Карточки | |
3 мин. | III. Подготовка к восприятию новой темы.
| Обучающиеся внимательно слушают преподавателя. Все предложения осложнены обращениями. | ||
20 мин. | IY. Актуализация знаний. Электроотрицательность — химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны от атомов других элементов. Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. г) водородная. Используется схема и учебная таблица «Виды химической связи».
| |||
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ.
1) КНС ковалентная неполярная связь (образуется между …… …… с одинаковой электроотрицательностью).
Механизм образования:
2) КПС ковалентная полярная связь (образуется между …… ….. с незначительно отличающейся электроотрицательностью).
Механизм образования:
3. ИС ионная связь (образуется между ……и …. с резко отличающейся ……..).
Механизм образования:
Задание для группы :
“О каком понятии идет речь”.
Разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов в ядре, но разную массу. (изотопами.)
Вид атомов с одинаковым зарядом ядра. (Химический элемент)
Мельчайшая, химически неделимая, частица (атом)
В центре атома находится заряженное ……(ядро)
Ядра атомов состоят из ………и……. (протонов и нейтронов).
Вокруг ядра по замкнутым орбитам вращаются отрицательно заряженные……(электроны).
Групповая работа.
Работа с учебником. Ответить на вопросы. (письменно)
Как изменяются металлические и неметаллические свойства в периоде, в группе?
Какие элементы обладают сильными металлическими свойствами?
Какие элементы обладают сильными неметаллическими свойствами?
Что такое электроотрицательность? (выписать в словарь).
. Рассмотрите схему.Обсудите вопросы в группе (устно).
Какими свойствами обладают химические элементы в начале периода?
Какими свойствами обладают химические элементы в середине периода?
Какими свойствами обладают химические элементы в конце периода?
1. Выполните задания:
Расположите химические знаки перечисленных ниже элементов в порядке возрастания значений электроотрицательности: Магний, натрий, хлор, сера, кислород, цезий, бор, калий, азот, бериллий, литий,фтор. Подчеркните элементы с наименьшей и наибольшей электроотрицательностью.
Выпишите чему равна электроотрицательность лития?
У какого элемента I группы самая наименьшая электроотрицательность?
Наибольшую степень электроотрицательности имеет элемент?
Какие значения электроотрицательности имеют металлы?
Какие значения электроотрицательности имеют неметаллы?
1. Вставьте пропущенные слова:
Вставьте пропущенные слова:
Зная численные значения электроотрицательностей, можно судить о принадлежности соответствующего элемента к ……или ………
У металлов электроотрицательность, как правило, …….., а у неметаллов……..
Электроотрицательность элементов возрастает в периодах…….., а в главных подгруппах –………
При химических реакциях электроны ……… или ………. к атомам элементов, обладающих ……….. электроотрицательностью.
II. В приведенных ниже формулах подчеркните атомы наиболее электроотрицательного химического элемента: СаСL2, К2O, N2, H2S, Al2O3.
10 мин.
V. Закрепление урока.
Просмотрите все выполненные ранее упражнения и ответьте на следующие вопросы:
Назовите более электроотрицательные элементы: а) углерод и кремний; б) фосфор и сера; в) водород и азот.
Укажите неверное выражение:
а) Химическая связь – это взаимодействие, которое связывает отдельные атомы в более сложные системы.
б) Причина возникновения связи в стремлении атомов к менее устойчивому состоянию.
в) Природа химической связи электростатическая.
г) ЭО элементов главных подгрупп увеличивается сверху вниз.
д) Самый электроотрицательный элемент – хлор.
е) Второй по электроотрицательный элемент – кислород.
ж) В атоме азота на последнем электронном слое два неспаренных электрона.
з) В периодах справа налево ЭО элементов уменьшается.
Расположите элементы в порядке уменьшения ЭО: хлор, калий, водород, фосфор, натрий, сера, магний. (Cl, S, P, H, Mg, Na, К)
Можете ли вы сейчас ответить на вопросы, которые мы ставили в начале урока
Ученики проявляют свои способности по данной теме.
—
3 мин.
VI. Итог урока. Рефлексия
Игра «Цель вопросов» Составьте предложения с обращениями к учителю или коллегам, выразив свое отношение к уроку или свое настроение.
Работа в группах. Обсуждение вопросов.
Обсуждение вопросов.
Что означает понятие электроотрицательность?
Может ли быть электроотрицательность равна нулю? Поясните примерами. (Устно).
.Как меняется электроотрицательность в ряду химических элементов : F, I , B, C, O.
Назовите наиболее электроотрицательный химический элемент.
Электроотрицательность какого химического элемента принята за единицу.
Оценивают работу своих одноклассников, используя обращения в своей речи. Пишут телеграмму своим друзьям.
Стикеры
2 мин.
VII. Домашнее задание. Объясняет особенности выполнения домашней работы. Напишите небольшое письмо другу, используя обращения.
Записывают домашнюю работу.
|
Электроотрицательность по периоду 3 | Творческая химия
Результаты обучения
Изучив эту страницу, вы сможете:
- описать и объяснить тенденцию электроотрицательности в период 3
Электроотрицательность
В таблице приведены значения электроотрицательности элементов от Na до Ar.
| Элемент | Символ | Атомный номер | Электроотрицательность |
|---|---|---|---|
| натрий | На | 11 | 0.93 |
| магний | мг | 12 | 1,31 |
| алюминий | Ал | 13 | 1,61 |
| кремний | Си | 14 | 1,90 |
| фосфор | Р | 15 | 2,19 |
| сера | С | 16 | 2.58 |
| хлор | Кл | 17 | 3,16 |
| аргон | Ар | 18 | — |
Электроотрицательность — это способность атома притягивать связывающие электроны в ковалентной связи.
В таблице приведены значения по шкале Полинга, которые не имеют единиц измерения.
Фтор (3,98) является наиболее электроотрицательным элементом.
Электроотрицательность в периодической таблице
Описание тренда
На графике показано изменение электроотрицательности в периоде 3:
- по мере увеличения атомного номера электроотрицательность элементов увеличивается.
×
Объяснение этой тенденции
Переход через период 3:
- ядерный заряд увеличивается…
- атомный радиус уменьшается …
- электронов больше, но увеличение экранирования незначительно, потому что каждый лишний электрон входит в ту же оболочку …
- , поэтому электроны будут сильнее притягиваться к ядру.

В периоде 3 натрий с 11 протонами является наименее электроотрицательным элементом, а хлор с 17 протонами является наиболее электроотрицательным элементом.Вы могли бы ожидать, что аргон (с 18 электронами) будет самым электроотрицательным элементом в периоде 3. Однако он не образует ковалентных связей, поэтому у него нет значения электроотрицательности.
Спасибо Исмаилу Абебанджо из Нигерии за указание на ошибку на этой странице.
Теперь это исправлено!
Электроотрицательность вниз группа 2 | Творческая химия
Результаты обучения
Изучив эту страницу, вы сможете:
- описать и объяснить тенденцию к снижению электроотрицательности группа 2
Электроотрицательность
В таблице приведены значения электроотрицательности для обычных элементов группы 2.
| Элемент | Символ | Атомный номер | Электроотрицательность |
|---|---|---|---|
| бериллий | Быть | 4 | 1,57 |
| магний | мг | 12 | 1,31 |
| кальций | Са | 20 | 1. 00 00 |
| стронций | Старший | 38 | 0,95 |
| барий | Ва | 56 | 0,89 |
Электроотрицательность — это способность атома притягивать связывающие электроны в ковалентной связи.
В таблице приведены значения по шкале Полинга, не имеющие единиц измерения. фтор (3.98) — самый электроотрицательный элемент.
Электроотрицательность в периодической таблице
Описание тренда
На графике показано изменение электроотрицательности по группе 2:
- с увеличением атомного номера электроотрицательность элементов уменьшается.

×
Объяснение этой тенденции
Спуск группы 2:
- атомный радиус увеличивается …
- внешние электроны более защищены от притяжения ядра …
- , поэтому электроны будут меньше притягиваться к ядру.
Можно было бы ожидать, что электроотрицательность будет увеличиваться при движении вниз по группе, потому что увеличивается заряд ядра.Этого не происходит, потому что вышеописанные факторы оказывают большее влияние на электроотрицательность.
Спасибо Исмаилу Адебанджо из Нигерии за указание на ошибку на этой странице.
Теперь это исправлено!
Самый электроотрицательный элемент среди следующих: A) Кислород B) Хлор C) Азот D) Натрий
Электроотрицательность | Примеры и тенденции
Выучите определение электроотрицательности. Посмотрите пример электроотрицательности и узнайте, как найти электроотрицательность, используя правильные инструменты для измерения.
Посмотрите пример электроотрицательности и узнайте, как найти электроотрицательность, используя правильные инструменты для измерения.
Единицы измерения температуры: преобразование между кельвинами и градусами Цельсия
Описание погоды звучит по-разному в разных странах и для ученых, которые используют как шкалу Кельвина, так и шкалу Цельсия для измерения температуры в разных единицах.Узнайте, как по-разному измеряется температура выше абсолютного нуля и как преобразовать шкалу Фаренгейта, шкалу Цельсия и шкалу Кельвина.
Измаил и капитан Ахав: отношения и сравнение
В «Моби Дике» Мелвилла Измаил ценит природу, но капитан Ахав хочет над ней господствовать. Узнайте об Измаиле и капитане Ахаве, отношениях Измаила с Ахавом и их основных различиях в характере.
Ионные связи представляют собой электростатические взаимодействия между двумя противоположно заряженными ионами.Узнайте о химической связи и о том, как образуются ионные связи, откройте для себя свойства электроотрицательности и просмотрите примеры элементов, содержащих ионные связи.
Сродство к электрону: определение, тенденции и уравнение
Сродство к электрону — это изменение энергии, которое происходит, когда атом приобретает электроны.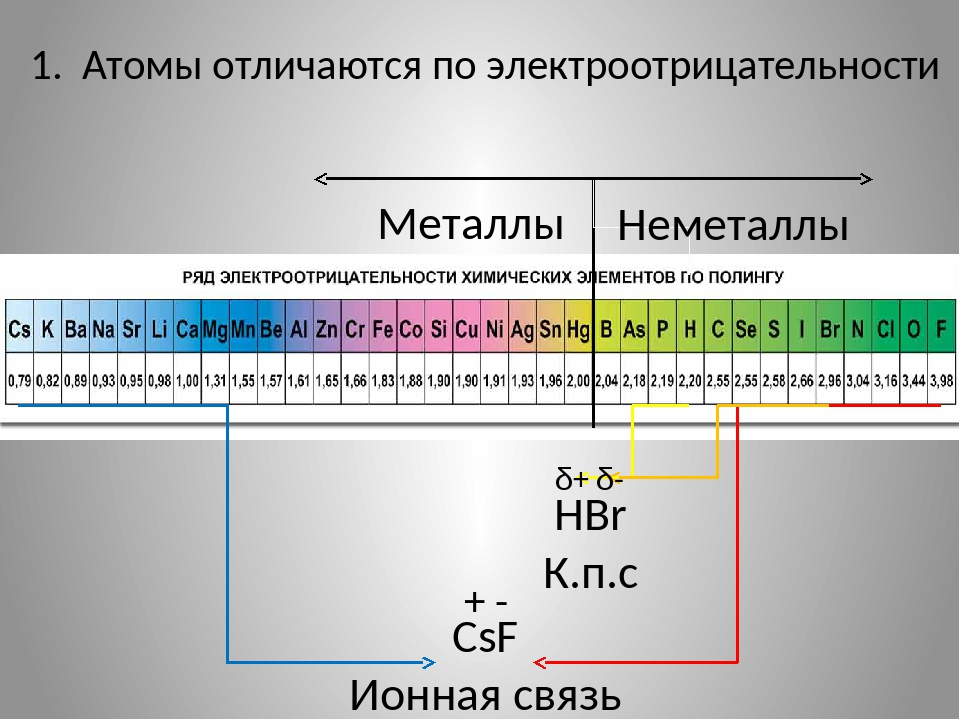 Узнайте больше о его определениях, факторах, влияющих на процесс, и о том, какие элементы не соответствуют стандартным тенденциям сродства к электрону.
Узнайте больше о его определениях, факторах, влияющих на процесс, и о том, какие элементы не соответствуют стандартным тенденциям сродства к электрону.
Что такое натрий? — Определение, факты, свойства и использование
Натрий — чрезвычайно распространенный элемент, который содержится во многих вещах в мире, таких как океан и камни.Узнайте, что такое натрий, его свойства, исторические факты и его многочисленные применения, такие как улучшение вкуса пищи и использование в качестве ингредиента в чистящих средствах.
Диагональное соотношение, металлический характер и точка кипения
118 известных в настоящее время элементов в периодической таблице организованы по возрастанию атомного веса, но есть также несколько тенденций или взаимосвязей между элементами. Узнайте о трех тенденциях в периодической таблице (соотношение диагоналей, металлический характер и температура кипения) и узнайте, почему металлы являются отличными проводниками электричества.
Узнайте о трех тенденциях в периодической таблице (соотношение диагоналей, металлический характер и температура кипения) и узнайте, почему металлы являются отличными проводниками электричества.
Химические связи III: полярная ковалентная
Полярная ковалентная связь возникает, когда два атома разделяют электроны неравным образом.Узнайте о химической связи, о том, как образуются полярные ковалентные связи, о разнице между полярными и неполярными ковалентными связями и изучите эффекты частичных изменений.
Химическая лаборатория Безопасность и точность Процедуры и оборудование
Химическое лабораторное оборудование помогает проводить исследования этично и безопасно, не причиняя вреда ученым или студентам, а процедуры точности помогают поддерживать надежность результатов. Узнайте больше о советах по безопасности для лаборатории, определении точности и способах точного сбора информации.
Узнайте больше о советах по безопасности для лаборатории, определении точности и способах точного сбора информации.
Как соединения и молекулы строятся из элементов
Соединения и молекулы построены из элементов, состоящих как минимум из двух атомов, соединенных химической связью.Узнайте, как элементарные личности строят соединения и молекулы, исследуйте ионные и ковалентные химические связи и сравнивайте чистые вещества со смесями.
Энергия связи: определение и уравнение
Энергия связи — это мера энергии, которая должна быть достигнута для разрыва химической связи. Узнайте, как рассчитать уравнения энергии связи с различной длиной связи и как это применяется для понимания химических реакций.
Узнайте, как рассчитать уравнения энергии связи с различной длиной связи и как это применяется для понимания химических реакций.
Электроотрицательнее, чем вы думаете
Электроотрицательность — одно из самых полезных понятий в химии. В двух словах, это мера того, насколько элемент «голоден» по электронам, что является функцией числа электронов в валентной оболочке и ощущаемого ими эффективного ядерного заряда.Что делает его замечательным, так это его простота : как и средний балл, это единственное число, которое дает немедленное мысленное впечатление о личности элемента. Фтор, «Тигр химии», лидирует в классе на уровне 4.0. В левом нижнем углу периодической таблицы находится цезий, у которого нет броского прозвища [но он привлек странным образом преданных последователей] с электроотрицательностью 0,79.
Как и во многих человеческих отношениях, когда элементы собираются вместе, чтобы сформировать связи, устанавливается своего рода иерархия: в этом случае более электроотрицательный элемент получает неравную долю электронов. Образовавшиеся диполи играют огромную роль в органической химии. Если вы только начинаете изучать органическую химию, позвольте мне сказать: электроотрицательность поднимает голову в органической химии в большем количестве способов, чем вы можете себе представить. Прямое и косвенное влияние электроотрицательности определяет такие важные свойства, как растворимость, кислотность, водородные связи, точки плавления и кипения, химическая активность и многие другие.
Образовавшиеся диполи играют огромную роль в органической химии. Если вы только начинаете изучать органическую химию, позвольте мне сказать: электроотрицательность поднимает голову в органической химии в большем количестве способов, чем вы можете себе представить. Прямое и косвенное влияние электроотрицательности определяет такие важные свойства, как растворимость, кислотность, водородные связи, точки плавления и кипения, химическая активность и многие другие.
В органической химии мы склонны сосредотачиваться на элементах, которые образуют ковалентные связи с углеродом и водородом.Вот таблица электроотрицательностей 12 элементов, с которыми вы, вероятно, столкнетесь чаще всего [шкала Полинга]. Из концепций, вытекающих из фактов в этой таблице, вытекает 90 319 многих, многих 90 320 потенциальных экзаменационных вопросов.
| Элемент | Электронегативность (Pauling) | ||
| F | 4. 0 [3.98] 0 [3.98] | ||
| O | 3.4 [3.44] | ||
| CL | 3.2 [3.16] | ||
| Н | 3.0 [3.04] | ||
| BR | 3.0 [2.96] | 3.0 [2.96] | |
| I | |||
| [2.66] | |||
| S | 2.6 [2.58] | ||
| C | 2.6 [2.55 | 7||
| h | 2.2 [2.20] | 2.2 [2.20] | p |
| p | 2.2 [2.19] | ||
| B | 2.0 [2.04] | ||
| Si | 1.9 [1.90] | ||
Источник : Википедия [содержит ссылку на более полный список].Одно лишь знание этих 12 чисел поможет вам пройти долгий путь. Это хороший пример того, что стоит потратить время на грубое запоминание.
Несколько замечаний:
- Углерод более электроотрицательный, чем вы думаете . Хотя разница электроотрицательностей для связи C-F велика (1,4), она очень быстро уменьшается по мере снижения до C-Cl (0,6), C-Br (0,4) и C-I (0,1).

- Галогениды обладают сходными свойствами, но будьте осторожны, проводя аналогии между кислородом/серой [халькогены] и азотом / фосфором [пниктиды]: электроотрицательности C и S практически идентичны [2.6], в то время как CP фактически поляризован по отношению к углероду [0,4]. [Примечание 1]
- Точно так же, хотя связь O-H сильно поляризована (1,2), t здесь очень небольшая поляризация в связи S-H (0,4). Результатом этого является отсутствие водородной связи: если вам нужен жидкий h3S, вы должны конденсировать его при -60 °C. [Примечание 2]
- Галогениды водорода (HF, HCl, HBr, HCl) поляризованы в сторону галогенид, но к тому времени, когда вы доберетесь до HI, разница в электроотрицательности не так велика (0.5).
- Посмотрите на бор: он менее электроотрицателен, чем водород [2,0 против 2,2]. Это основная причина, по которой реакция гидроборирования является так называемой «анти-марковниковской» — водород частично отрицателен, а бор частично положителен.

[Примечание 1] Один отказ от ответственности: значений электроотрицательности относятся к самим нативным элементам. Электроотрицательность фосфора в виде фосфина (PH 3 ) намного ниже, чем электроотрицательность фосфора в виде фосфата [O=P(OH)3].«Эффективные электроотрицательности» функциональных групп достойны отдельного поста.
[Примечание 2] Сделав это лично и нервно подогрев полученный жидкий h3S до комнатной температуры в сосуде под давлением, я могу сообщить, что это можно сделать, не становясь социальным изгоем на следующие несколько часов, при условии, что это будет сделано в хорошо работающий вытяжной шкаф. Химики прежних времен, такие как Шееле, которые работали с ним без современного оборудования для борьбы со зловонием, заслуживают нашего бессмертного восхищения: с h3S нельзя шутить.
Самый электроотрицательный элемент в периодической таблице 11 класс химии CBSE
Подсказка: Вы должны попытаться вспомнить положение этих элементов в периодической таблице и иметь в виду, что электроотрицательность увеличивается, когда мы движемся слева направо в периоде .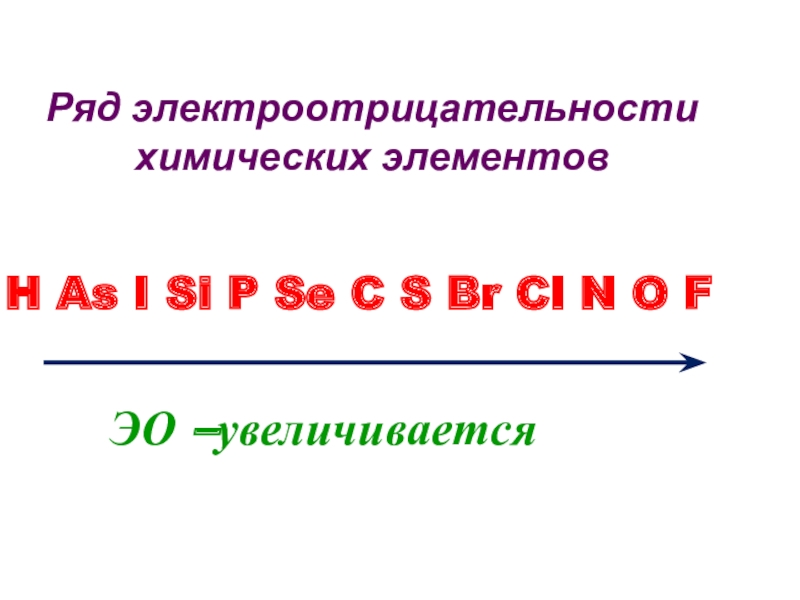 Теперь вы должны попытаться ответить на это соответствующим образом.
Теперь вы должны попытаться ответить на это соответствующим образом. Полный пошаговый ответ:
— Электроотрицательность — это понятие, описывающее тенденцию атома притягивать к себе общую пару электронов (или плотность электронов).
— В периодической таблице электроотрицательность обычно увеличивается по мере движения слева направо по периоду (это связано с тем, что, несмотря на одинаковое количество энергетических уровней, в ядре больше положительных протонов, что создает более сильное притяжение). отрицательные электроны во внешней оболочке.) и уменьшается по мере продвижения вниз по группе (из-за увеличения расстояния между ядром и оболочкой валентного электрона, тем самым уменьшая притяжение, делая атом менее притягивающим для электронов или протонов ).В результате наиболее электроотрицательные элементы находятся в верхней правой части таблицы Менделеева, а наименее электроотрицательные — в нижней левой.
Давайте обсудим каждый вариант этого вопроса —
Вариант А, Азот — это химический элемент с символом N и атомным номером 7. По шкале Полинга азоту присвоена электроотрицательность 3,04.
По шкале Полинга азоту присвоена электроотрицательность 3,04.
Вариант B. Кислород — это химический элемент с символом O и атомным номером 8. По шкале Полинга кислороду присваивается электроотрицательность 3.44.
Вариант C. Хлор представляет собой химический элемент с символом Cl и атомным номером 17. По шкале Полинга хлору присвоена электроотрицательность 3,16.
Вариант D. Фтор является самым электроотрицательным элементом в периодической таблице, а это означает, что он является очень сильным окислителем. Фтор имеет электроотрицательность 3,98.
Таким образом, мы можем заключить, что правильный ответ на этот вопрос — вариант D.
Примечание:
Шкала Полинга представляет собой числовую шкалу электроотрицательностей, основанную на расчетах энергии связи для различных элементов, соединенных ковалентными связями.
Электроотрицательность — Викиверситет
Электроотрицательность — это термин, используемый для описания способности ядра атома притягивать к себе электроны от других атомов.
Тенденция в периодической таблице такова, что по мере того, как вы проходите через группы от одного до семи (не восемь или ноль, поскольку это инертные элементы), электроотрицательность элементов увеличивается. Кроме того, по мере опускания периодов электроотрицательность уменьшается. Следовательно, из-за этой тенденции фтор является наиболее электроотрицательным элементом.
Эта тенденция очевидна, поскольку вы можете рассчитать электроотрицательность данного элемента, зная количество внутренних электронов, которые вызывают экранирование от ядра, и общее количество электронов. Например, у фтора всего девять электронов, и два из них вызывают экранирование от ядра. Поэтому его общая электроотрицательность обозначается как 7+. Ясно, что это также может быть определено количеством внешних электронов, которые имеет элемент, и группой, в которой он находится (поскольку фтор имеет семь внешних электронов и является членом седьмой группы).
Хотя этот метод определения электроотрицательности подразумевает, что все элементы одной и той же группы имеют одинаковую электроотрицательность, определяющим фактором является размер. Это связано с тем, что у атомов меньшего размера меньше электронов, экранирующих потенциальные связи от ядра. Поэтому электроны от других атомов легче притягиваются. Принимая во внимание, что у более крупных атомов есть гораздо больше электронов, экранирующих ядро, что затрудняет привлечение других электронов и, следовательно, менее электроотрицательно.
Это связано с тем, что у атомов меньшего размера меньше электронов, экранирующих потенциальные связи от ядра. Поэтому электроны от других атомов легче притягиваются. Принимая во внимание, что у более крупных атомов есть гораздо больше электронов, экранирующих ядро, что затрудняет привлечение других электронов и, следовательно, менее электроотрицательно.
Эта электроотрицательность играет роль в полярных молекулах. Это происходит в ковалентных соединениях, где данное соединение может проявлять свойства ионного соединения.
Примером полярного соединения может быть HF. Это связано с тем, что фтор более электроотрицательный, чем водород, и поэтому притягивает к себе электроны в ковалентной связи. Это означает, что атом фтора слегка отрицателен, а атом водорода слегка положителен.
Положительные и отрицательные заряды — это то, что происходит при ионной связи, когда, как правило, металлы либо теряют, либо приобретают электроны (что делает их положительными или отрицательными).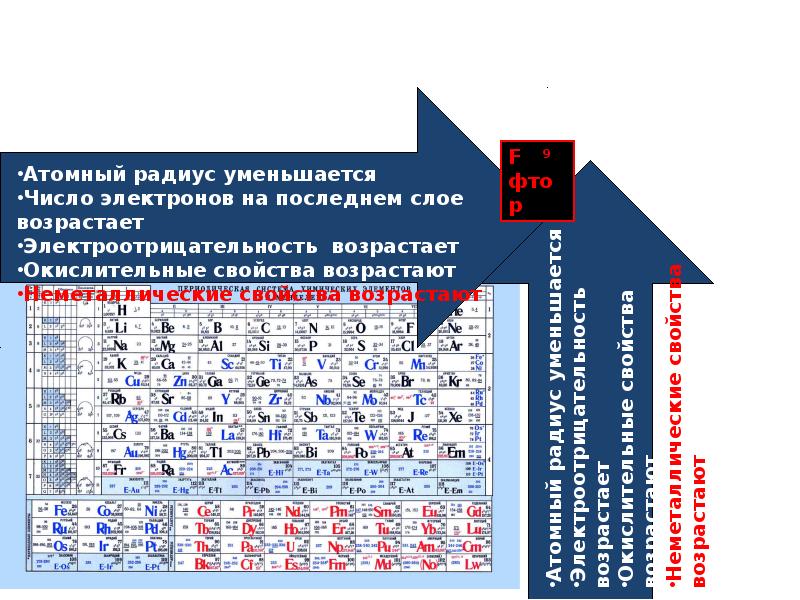 Следовательно, хотя заряды в HF не так значительны, как если бы атом превратился в ион, небольшой заряд создает некоторые ионные свойства.
Следовательно, хотя заряды в HF не так значительны, как если бы атом превратился в ион, небольшой заряд создает некоторые ионные свойства.
Однако это происходит не со всеми ковалентными соединениями. Например, в F 2 поляризация отсутствует, потому что каждый присутствующий атом одинаково электроотрицательен. Также в BF 3 отсутствует поляризация, поскольку, хотя фтор более электроотрицательный, чем бор, каждый из трех атомов фтора в равной степени притягивает к себе электроны, а это означает, что распределение не является неравномерным.
Тренды в химии электроотрицательности Учебное пособие
Ключевые понятия
- В 1932 году Лайнус Полинг определил электроотрицательность как способность атома в молекуле притягивать к себе электроны.
- Полинг разработал числовую шкалу электроотрицательности, основанную на энергии связи.
- Как правило, электроотрицательность уменьшается вниз по группе Периодической таблицы.
- Как правило, электроотрицательность увеличивается слева направо по периоду периодической таблицы. 1
| электроотрицательность увеличивается по периоду слева направо | ||||||||||
| самый маленький | → | → | → | → | самый большой | |||||
| электроотрицательность убывает вниз группа от сверху вниз | самый большой | Ли | Быть | Б | С | Н | О | Ф | ||
| ↓ | На | мг | Ал | Си | Р | С | Кл | |||
| ↓ | К | Са | Га | Ге | Как | Se | Бр | |||
| ↓ | руб. | Старший | В | Сн | Сб | Те | я | |||
| самый маленький | цезий | Ва | Тл | Пб | Би | ПО | В | |||
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Анимированный учебник (youtube)
Тенденции электроотрицательностей в группах Периодической таблицы
Как правило, электроотрицательность элементов в группе периодической таблицы уменьшается по мере продвижения по группе сверху вниз.
По мере увеличения атомного радиуса 2 и увеличения числа заполненных электронных оболочек (энергетических уровней) при движении вниз по группе способность ядра атома притягивать к себе электроны уменьшается.
| Группа | Тренд атомного радиуса | Тренд электроотрицательности | |
|---|---|---|---|
| верхний элемент | период 2 элемент | самый маленький | самый электроотрицательный |
| ↓ | период 3 элемент | ↓ | ↑ |
| ↓ | период 4 элемент | ↓ | ↑ |
| ↓ | период 5 элемент | ↓ | ↑ |
| нижний элемент | период 6 элемент | самый большой | наименее электроотрицательный |
Мы рассмотрим тенденции электроотрицательности элементов группы 1 и элементов группы 17 в следующих разделах.
(A) Тенденции электроотрицательности элементов группы 1 (IA, щелочные металлы)
Рассмотрим данные для элементов группы 1 в таблице ниже.
Видите ли вы закономерность (тенденцию) в размерах атомов и их электроотрицательности?
| Элемент | Атомный Номер (Z) | Символ | Атомный радиус (пм) 3 | Электроотрицательность | Тренд | ||
|---|---|---|---|---|---|---|---|
| период 2 | литий | 3 | Ли | 134 | 0.98 | самый электроотрицательный ↓ | |
| период 3 | натрий | 11 | На | 154 | 0,93 | ↓ | |
| период 4 | калий | 19 | К | 196 | 0,82 | ↓ | |
| период 5 | рубидий | 37 | руб. | 211 | 0.82 | ↓ | |
| период 6 | цезий | 55 | цезий | 225 | 0,79 | ↓ наименее электроотрицательный | |
Вы заметили, что по мере продвижения по группе сверху вниз:
- Увеличение атомного радиуса (со 134 пм для Li до 225 пм для Cs)
- Электроотрицательность уменьшается (от 0.98 для Li до 0,79 для Cs)
По мере увеличения атомного радиуса и увеличения количества заполненных электронных оболочек (энергетических уровней) при движении вниз по группе способность ядра атома притягивать к себе электроны уменьшается.
(B) Тенденции электроотрицательности элементов группы 17 (VIIA, галогены)
Рассмотрим данные для элементов группы 17 в таблице ниже.
Видите ли вы закономерность (тенденцию) в размерах атомов и их электроотрицательности?
| Элемент | Атомный Номер (Z) | Символ | Атомный радиус (пм) | Электроотрицательность | Тренд | ||
|---|---|---|---|---|---|---|---|
| Период 2 | фтор | 9 | Ф | 71 | 3. 98 98 | самый электроотрицательный ↓ | |
| Период 3 | хлор | 17 | Кл | 99 | 3,16 | ↓ | |
| Период 4 | бром | 35 | Бр | 114 | 2,96 | ↓ | |
| Период 5 | йод | 53 | я | 133 | 2.66 | ↓ самая низкая электроотрицательность | |
Вы заметили, что по мере продвижения по группе сверху вниз:
- Увеличивается атомный радиус (с 71 пм для F до 133 пм для I)
- Электроотрицательность уменьшается (с 3,98 для F до 2,66 для I)
По мере увеличения атомного радиуса и увеличения количества заполненных электронных оболочек (энергетических уровней) при движении вниз по группе способность ядра атома притягивать к себе электроны уменьшается.
Тенденции электроотрицательности элементов в периоды периодической таблицы
Как правило, электроотрицательность элементов одного и того же периода увеличивается по мере движения слева направо по периоду.
По мере увеличения заряда ядра и уменьшения атомного радиуса в периоде увеличивается способность ядра атома притягивать к себе электроны.
| атомный радиус уменьшается по периоду слева направо | |||||||||
| самый большой атом | → | → | → | самый маленький атом | |||||
| период | Группа 1 Элемент | Группа 2 Элемент | Группа 13 элемент | Группа 14 Элемент | Группа 15 Элемент | Группа 16 Элемент | Группа 17 элемент | ||
| самая низкая электроотрицательность | → | → | → | наивысшая электроотрицательность | |||||
| электроотрицательность увеличивается по периоду слева направо | |||||||||
В следующем разделе мы рассмотрим тенденции электроотрицательности элементов в периоде и периоде 3 периодической таблицы.
(A) Тенденции электроотрицательности элементов во 2 периоде периодической таблицы
Рассмотрим данные в таблице ниже для элементов периода 2 периодической таблицы.
Видите ли вы закономерности (тренды) в
- атомный радиус
- электроотрицательность
| Элемент | Ли | Быть | Б | С | Н | О | Ф |
|---|---|---|---|---|---|---|---|
| Атомный номер (Z) | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Атомный радиус (пм) | 134 | 90 | 82 | 77 | 75 | 73 | 71 |
| Электроотрицательность | 0.98 | 1,57 | 2,04 | 2,55 | 3,04 | 3,44 | 3,98 |
| Общая тенденция | минимум электроотрицательный | → | → | → | → | → | самый электроотрицательный |
Вы заметили, что по мере прохождения периода 2 слева направо
- атомный радиус уменьшается (со 134 пм для Li до 71 пм для F)
- увеличивается электроотрицательность (от 0.
 от 98 для Li до 3,98 для F)
от 98 для Li до 3,98 для F)
По мере увеличения заряда ядра и уменьшения атомного радиуса в периоде увеличивается способность ядра атома притягивать к себе электроны.
(B) Тенденции электроотрицательности элементов в периоде 3 Периодической таблицы
Рассмотрим данные в таблице ниже для элементов в периоде 3 периодической таблицы.
Видите ли вы закономерности (тренды) в
- атомный радиус
- электроотрицательность
| Элемент | На | мг | Ал | Си | Р | С | Кл |
|---|---|---|---|---|---|---|---|
| Атомный номер (Z) | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| Атомный радиус (пм) | 154 | 130 | 118 | 111 | 106 | 102 | 99 |
| Электроотрицательность | 0. 93 93 | 1,31 | 1,61 | 1,9 | 2,19 | 2,58 | 3,16 |
| Общая тенденция | минимум электроотрицательный | → | → | → | → | → | самый электроотрицательный |
Вы заметили, что по мере прохождения периода 3 слева направо
- атомный радиус уменьшается (со 154 пм для Na до 99 пм для Cl)
- увеличивается электроотрицательность (от 0.от 93 для Na до 3,16 для Cl)
По мере увеличения заряда ядра и уменьшения атомного радиуса в периоде увеличивается способность ядра атома притягивать к себе электроны.
| Вопрос: Рассмотрим основные элементы группы W, X, Y и Z, расположенные в периодической таблице, как показано ниже:
Какой из этих элементов, W, X, Y или Z, будет наиболее электроотрицательным? |
| СТОП | СТОП! Сформулируйте вопрос. |
Какой вопрос просит вас сделать? Определите самый электроотрицательный элемент. | |
| ПАУЗА | ПАУЗА для подготовки плана игры |
| (1) Какая информация (данные) была вам предоставлена в вопросе? (a) Символы четырех неизвестных элементов: W, X, Y и Z. (b) Расположение четырех элементов в периодической таблице:
(2) Какая связь между тем, что вы знаете, и тем, что вам нужно узнать? (а) электроотрицательность уменьшается по группе сверху вниз (б) электроотрицательность возрастает по периоду слева направо | |
| ГО | GO с планом игры |
(а) электроотрицательность уменьшается по группе сверху вниз
(b) электроотрицательность увеличивается по периоду слева направо (i) Немеченый элемент группы 2 над X в периоде 2 менее электроотрицательный, чем W | |
| ПАУЗА | ПАУЗА для обдумывания правдоподобия |
| Ваш ответ правдоподобен? Элементы группы 2 — это металлы, которые с большей вероятностью потеряют электрон с образованием положительного иона, поэтому не очень электроотрицательны. Поскольку это согласуется с ответом, который мы получили выше, мы достаточно уверены, что наш ответ правдоподобен. | |
| СТОП | СТОП! Сформулируйте решение |
Вт является наиболее электроотрицательным из этих четырех элементов. |
Сноски
1. Мы будем исключать переходные металлы, лантаноиды (лантаноиды) и актиноиды (актиноиды) из обсуждения.
2. Представленные здесь значения атомных радиусов являются приблизительными значениями, полученными на основе измерений межатомных расстояний.
Существует несколько различных подходов к измерению атомных и ионных радиусов. Мы не собираемся обсуждать ни один из них, мы просто собираемся использовать некоторые приближения с хорошим поведением, чтобы проиллюстрировать некоторые общие тенденции.
3. Общепринятыми единицами измерения атомных радиусов являются пикометр (используемый здесь), нанометр и ангстрем.
1 пм = 1 пикометр = 10 -12 метра
1 Å = 1 ангстрем = 10 -10 метра
1 нм = 1 нанометр = 10 -9 метра
Пример преобразования атомного радиуса лития,
134 пм = 134 × 10 -12 м = 0,134 × 10 -9 м = 0,134 нм
134 пм = 134 × 10 -12 м = 1.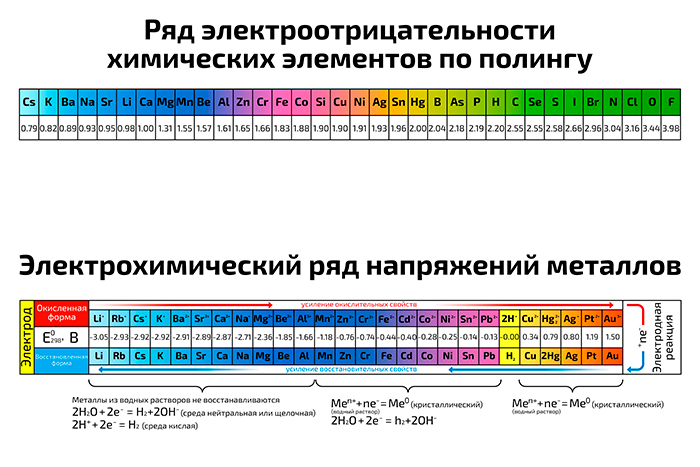


 Делятся на группы.
Делятся на группы. Отвечают на вопросы преподавателя.
Отвечают на вопросы преподавателя.
 Химические элементы в порядке возрастания относительной электроотрицательности (X) по Полингу (Pauling)
Химические элементы в порядке возрастания относительной электроотрицательности (X) по Полингу (Pauling)