Общая характеристика кислот — урок. Химия, 8–9 класс.
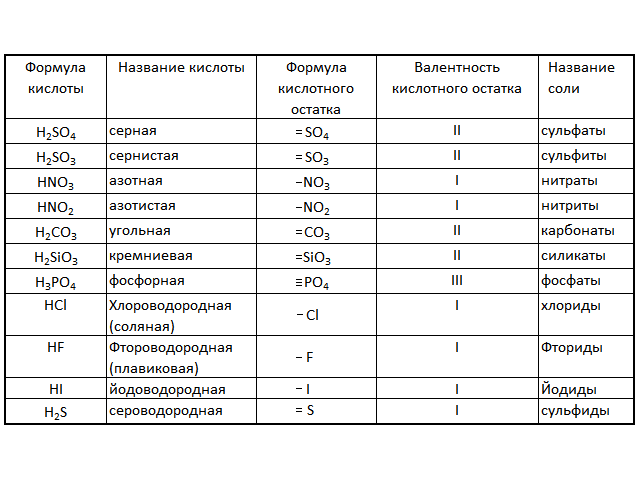
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
Название кислоты | Формула кислоты | Формула кислотного остатка | Название соли этой кислоты |
| Фтороводородная (плавиковая) | HF | −F | Фторид |
| Хлороводородная (соляная) | HCl | −Cl | Хлорид |
| Бромоводородная | HBr | −Br | Бромид |
| Угольная | h3CO3 | =CO3 | Карбонат |
| Кремниевая | =SiO3 | Силикат | |
| Азотная | HNO3 | −NO3 | Нитрат |
Ортофосфорная (фосфорная) | h4PO4 | ≡PO4 | Ортофосфат (фосфат) |
| Серная | h3SO4 | =SO4 | Сульфат |
| Сернистая | h3SO3 | Сульфит | |
| Сероводородная | h3S | =S | Сульфид |
Представителем органических кислот является уксусная кислота Ch4COOH.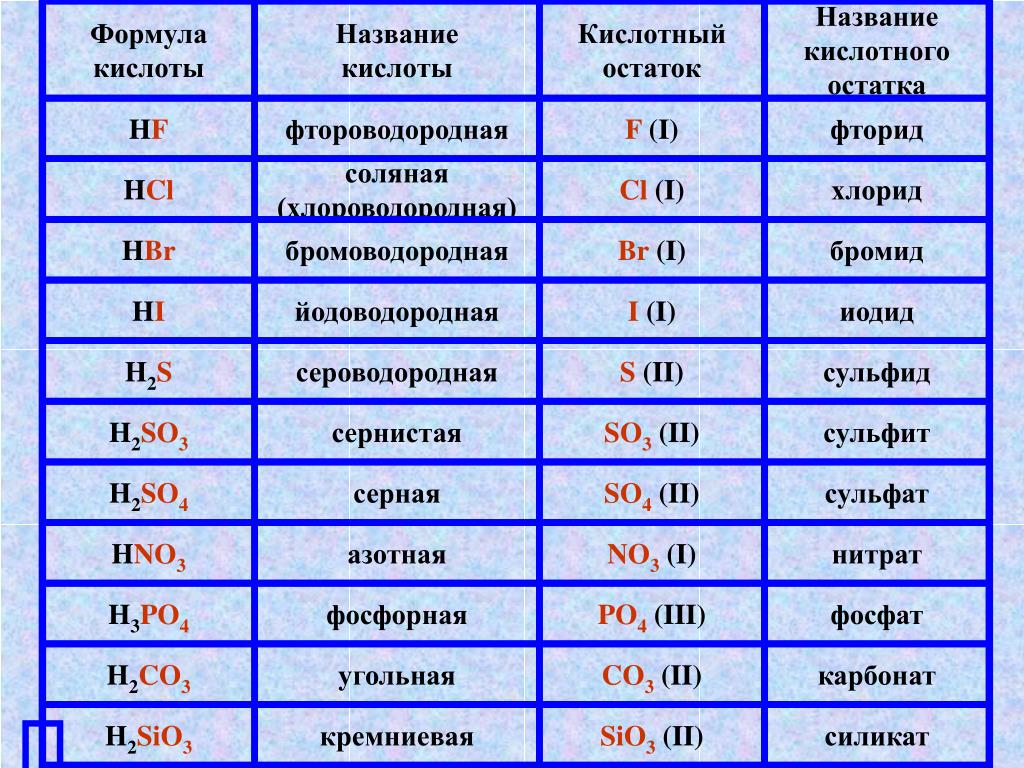 Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.
I.Определение потребностей и мотивов: а) мотивация к учебной деятельности. II. Актуализация знаний и фиксация затруднения в пробном учебном действии. III. Выявление места и причины затруднения IV.Построение проекта выхода из затруднения. V. Реализация построенного проекта VI. Первичное закрепление во внешней речи VII. Самостоятельная работа с самопроверкой по эталону VIII. Информация о домашнем задании IX. Рефлексия учебной деятельности. | Эпиграф: Per aspera ad astra», что в переводе с латинского языка означает – через тернии к звездам. Приветствие учителя. Вопрос к классу: «Что вы думаете по поводу этого эпиграфа к нашему сегодняшнему уроку?» Для успешного перехода на новую ступень знания химии класс делится на 3 варианта по количеству рядов, учащиеся работают в парах. Положительный настрой на работу и сотрудничество. Известно более 700 тысяч неорганических веществ и все их по определенным признакам можно классифицировать. Какие 2 класса неорганических соединений вы изучили, дайте их определения и классификацию. Выполните следующее задание – написано на доске: дан перечень веществ: В-1 Li2O, Ca(OH)2, CO2, CaO, SiO2, LiOH, В-2 FeO, NaOH N2O5, Na2O, SO3, Fe(OH)2 В-3 BaO, SO2, Cu(OH)2 N2O3, CuO, Ba(OH)2, Определите принадлежность веществ к соответствующему классу, назовите вещества. Фиксация индивидуальных затруднения в выполнении учебного действия. Побуждение обучающихся к выдвижению гипотезы и выработке плана действий по ее проверке. Гипотеза: если оксидам металлов соответствуют гидроксиды металлов, значит и кислотным оксидам соответствуют гидроксиды неметаллов, которые называют кислотами. На доске учитель записывает тему урока. План изучения нового материала: — определение кислот, номенклатура; — классификация кислот; — некоторые свойства кислот; С помощью таблицы-эталона учащиеся находят соответствие кислотных оксидов кислородосодержащим кислотам — индивидуальное затруднение устранено. определяют и называют кислотные остатки, усваивают определение их валентности. Учитель обращает внимание учащихся на необходимость выучивания формул и названий кислот, т.к. без этого будет невозможно понимание следующего класса веществ – солей. Физкультминутка Фронтальная беседа. 1)Что общего вы видите в формулах всех представленных вам кислот? 2) Отчего происходит название «кислота»? 3) Как можно определить реакцию среды в щелочи и кислоте? Химия – наука экспериментальная. Проведем демонстрационный опыт по определению реакции среды и распознаем растворы кислоты и щелочи Применение кислот. С.142 — №1,2,3 – тестовые задания с выбором ответа – устно. Письменно — выполните №4 (б) Работа с текстом учебника п.32 Кратко выписать важнейшие свойства серной и соляной кислот Запись на доске: д/з п.32, №4(а,б,г), учить формулы и названия кислот, кислотных остатков. Творческое задание – презентация по теме: Кислоты у нас дома». Написать синквейн на тему «Кислоты» Предлагаю вспомнить какую цель поставили в начале урока, достигли ли ее? Побуждаю оценить свою деятельность на уроке. Вопросы на слайде: 1. на уроке я работал активно/пассивно 2. своей работой на уроке я доволен/ не доволен 3. за урок я не устал/устал 4. материал урока мне был понятен/ не понятен; полезен/бесполезен; интересен/скучен 5. мое настроение стало лучше/хуже Спасибо за урок! | Высказывают свои соображения. Фронтально: учащиеся дают определение оксидов, их классификацию; определение оснований, их классификацию. Учащиеся успешно овладели номенклатурой оксидов и оснований, их классификацией, выстроили соответствие основных оксидов и оснований, а кислотным оксидам они не могут верно построить формулы гидроксидов неметаллов. Фронтально проверка знаний по определениям и классификации. Проверка правильности выполнения задания — у доски – 3 ученика Формулирование проблемы: существует ли формула гидроксида неметалла и как она составляется? Выдвигают гипотезу и план действий по аналогии с основаниями. Формулируют тему урока «Кислоты» и учебную цель – открыть п.32, стр.139 Запись в тетрадях определения «Кислоты» — стр. 140 Работа в парах с индивидуальными таблицами «Кислоты и соли» по формулам и названиям кислот, кислотным остаткам, соответствию кислотных оксидов и кислородосодержащих кислот, определяют и называют кислотные остатки, усваивают определение их валентности. Запись в тетрадях классификации кислот — стр. 140, рис.64 Взаимоопрос в парах по названию и формулам наиболее часто употребляемых кислот: НСI, HNO3, h3SO4, h3SO3, h3S, h4PO4 Предполагаемые ответы. 1) Наличие атомов водорода. Каждая формула начинается химическим знаком Н. 2) Кислый вкус, например лимон, незрелое яблоко. В желудке человека раствор соляной кислоты. 3) Реакцию среды можно определить с помощью индикаторной бумаги по изменению ее цвета Демонстрационный опыт, выполненный по желанию одним из учащихся с пронумерованными пробирками, в которых раствор кислоты, раствор щелочи и индикаторная бумага и цветовая шкала кислотно-основных свойств. Вывод: в растворах кислот – кислотная среда, это – их общее свойство. Ответы с места по желанию Решение на доске и в тетрадях. Акцентируется внимание на технике безопасности при работе с кислотами. Выписывают в тетради свойства важнейших кислот – стр.141 Предлагаются несколько вариантов ответа например: Кислоты Важные, опасные, необходимые Растворяются, прожигают, обугливают В природе все взаимосвязано, достойное место. Отвечают на вопросы и проводят самооценку по критериям, сдают учителю. | Регулятивные: волевая саморегуляция. Коммуникативные: сотрудничество с учителем и партнерами в группе. Регулятивные: прогнозирование в процессе выполнения пробного действия Познавательные: умения структурировать знания, формулировать проблему, грамотно ее озвучивать. Регулятивные: умение планировать свою деятельность, оценивать эффективность своей работы в паре и группе. Познавательные: умения структурировать знания; Постановка и формулировка проблемы Коммуникативные: планирование учебного сотрудничества со сверстниками, управление поведением партнера, умение выражать свои мысли. Коммуникативные: управление поведением партнера, умение выражать свои мысли Регулятивные: оценивание качества и уровня усвоения, коррекция. Познавательная, общеучебная: умение осознанно и правильно строить речевое высказывание Регулятивные: прогнозирование Регулятивный: контроль в форме сличения способа действия и его результата с заданным эталоном, коррекция. Регулятивные: прогнозирование Познавательные: общенаучные: умение структурировать знания; оценка процесса и результатов деятельности. Коммуникативные: умение выражать свои мысли. Регулятивные: волевая саморегуляция, оценка – выделение и осознание учащимися того, что же усвоено и что еще подлежит усвоению, прогнозированию. |
Помогите с заполнением таблицы) Химия, 8 класс, параграф 32, 1 вопрос.
 Рудзитис и Фельдман
Рудзитис и ФельдманЯ в столбик напишу тебе, сама в табличку впишешь
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться атомами металла.
Кислоты кислородосодержащие
ΗΝO3 — кислотный остаток NO3 — валентность I
H2SO4 — кислотный остаток SO4 — валентность II
Н3РO4 — кислотный остаток РO4 — валентность III
H2SO3 — кислотный остаток SO3 — валентность II
HNO2 — кислотный остаток NO2 — валентность I
Н2СO3 — кислотный остаток СO3 — валентность II
НВO3 — кислотный остаток ВO3 — валентность I
H3AsO4 — кислотный остаток AsО4 — валентность III
Кислоты бескислородные
НСl — кислотный остаток Сl — валентность I
H2S — кислотный остаток S — валентность II
HF — кислотный остаток F — валентность I
HI — I — валентность I
НВr — кислотный остаток Вr — валентность I
НСl — кислотный остаток Сl — валентность I
HF — кислотный остаток F — валентность I
HI — кислотный остаток I — валентность I
НВг — кислотный остаток Вr — валентность I
ΗΝO3 — кислотный остаток NO3 — валентность1
HNO2 — кислотный остаток NO2 — валентность I
НВO3 — кислотный остаток ВO3 — валентность I
H2SO4 — кислотный остаток SO4 — валентность II
Кислоты двухосновные
H2SO3 — кислотный остаток SO3 — валентность II
Н2СO3 — кислотный остаток СO3 — валентность II
H2S — кислотный остаток S — валентность II
Кислоты трехосновные
Н3РO4 — кислотный остаток РO4 — валентность III
H3AsO4 — кислотный остаток AsO4 — валентность III
Урок по химии в 8-м классе на тему «Кислоты» с элементами исследовательской деятельности
Тип урока:урок изучения нового материала.
Форма урока:комбинированный урок с элементами исследовательской работы.
Цель урока:сформировать понятия «кислота», «кислородосодержащие и бескислородные кислоты», «основность кислоты», умение экспериментально определять кислоты среди других веществ, продолжить формирование умений работать с веществами, соблюдая правила безопасности.
В результате учащиеся должны
- Знать: понятие «кислота», формулы кислот, классификацию кислот, признаки действия кислот на индикаторы;
- Уметь: выбирать формулы кислот среди предложенных веществ, классифицировать кислоты по наличию кислорода, определять кислоту с помощью индикаторов, работать с растворами кислот, соблюдать правило техники безопасности.
Оборудование и реактивы:пробирки с растворами соляной и лимонной кислот, газированная кислота, индикаторы (лакмусовая бумажка, раствор фенолфталеина, метилоранжа), стеклянная палочка, учебник О. С. Габриеляна — 8 класс, раздаточный материал с планом и заданиями урока, инструктивные карточки для проведения исследовательской работы.
С. Габриеляна — 8 класс, раздаточный материал с планом и заданиями урока, инструктивные карточки для проведения исследовательской работы.
Ход урока
1. Организация класса и краткое повторение материала.
Приветствие класса, посадка на места.
Актуализация знаний:
На доске схема классификации неорганических веществ состоящая из карточек. Ребятам задаются вопросы:
? Вспомним, на какие классы классифицируют неорганические вещества? (На оксиды, основания, кислоты, и соли).
? Назовите, какие из них мы с вами уже изучили? ( оксиды и основания).
ПОКАЗЫВАЮ 2–3 карточки с формулами оксидов.
? Какой класс неорганических соединений я вам показываю сейчас? (Оксиды).
? На основании чего вы сделали такой вывод? (дают определение оксидам).
? Прочитайте и назовите каждый оксид.
ПОКАЗЫВАЮ 2–3 карточки с формулами оснований.
? Формулы, каких веществ я показываю сейчас? (Оснований).
? Почему эти вещества относятся к основаниям? (Дают определение оснований).
? Прочитайте и дайте названия этим основаниям.
2. Постановка проблемы:
Демонстрация первого слайда презентации: (Приложение 1).
? Какие на вкус эти продукты питания. (Кислые).
Слово кислый имеет однокоренное слово кислота.
Тема нашего сегодняшнего урока КИСЛОТЫ.
Записывают в тетради тему урока.
После изучения данной темы вы должны:
- Знать: что такое кислота, какие они бывают, как их классифицируют, правила техники безопасности при работе с кислотами.
- Уметь: распознавать кислоты среди других соединений, определять заряды ионов кислотных остатков, составлять формулы кислот, используя таблицу растворимости.
Материал по данной теме мы будем изучать по плану, который имеется у вас на партах:
- Знакомство с кислотами.

- Исследование веществ с помощью индикаторов;
- Определение понятия «кислоты», их состав, степени окисления элементов в кислотах.
- Классификация кислот.
- Представители кислот.
Многие природные кислоты вызывают неприятные ощущения.
Вы испытывали действие муравьиной кислоты? …. (3-й слайд).Приведите примеры кислот, которые мы используем в своей жизни.
Это вкус газированной воды, некоторые органические кислоты: молочная (содержится в простокваши), лимонная, яблочная, щавелевая, уксусная и др.
Все кислоты имеют кислый вкус, но не следует пробовать на вкус все кислоты подряд, некоторые кислоты очень опасны и могут вызвать ожоги. (4-й слайд).
- Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление.
- При попадании кислоты на кожу надо смыть её струёй воды.

- Обработать 2% раствором гидрокарбонатом натрия.
Но, чтобы этого не случилось нужно при выполнении лабораторных работ с кислотами соблюдать правила техники безопасности.
Повторим:
- выполнять все указания учителя,
- Не пробовать вещества на вкус,
- пробирку в руки не брать,
- не приступать к выполнению опыта, не зная, что и как нужно делать,
- Обращаться с лабораторной посудой бережно и закончив работу, привести рабочее место в порядок.
3. Лабораторный опыт (исследование окраски индикаторов в кислой среде).
Если кислоты такие опасные, как можно определить раствор кислоты среди других веществ, не пробуя на вкус, какие вещества для этого можно использовать?
Какое можно выдвинуть предположение (гипотезу)? (ребята отвечают – индикаторами).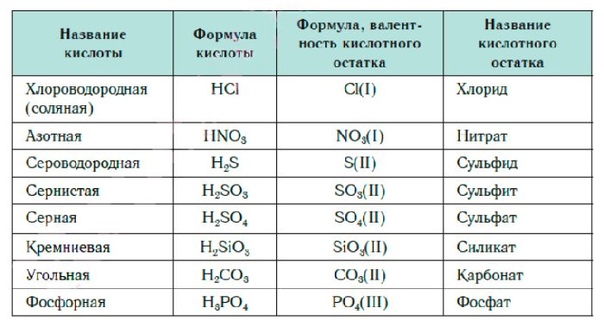
Сейчас вам предстоит исследовать выданные вам кислоты это соляная кислота и лимонная, на изменение окраски индикаторов в кислых средах.
Обратите внимание они разные по агрегатному состоянию.
Для этого у вас имеются на партах инструктивные карточки и необходимое оборудование и реактивы. (Приложение 2).
Читая внимательно инструкцию, выполните опыты, соблюдая правила техники безопасности (они на доске слайд 4).
Итак, приступаем.
ИНСТРУКТИВНАЯ КАРТА:
лабораторной работы «изменение окраски индикаторов в кислых средах».
Форма работы: парная.
Время работы – 8–10 минут.
Задание: Исследовать окраску индикаторов в кислых средах.
Оборудование и реактивы: 2 пробирки с соляной и 2 пробирки с лимонной кислотами, лакмусовая бумажка, жидкие фенолфталеин и метилоранж, стеклянные палочки, вода.
Проведение исследовательского опыта и оформление результатов:
- Перепишите в тетрадь таблицу, представленную в конце опыта.
- Смочите лакмусовую бумажку в первой пробирке с соляной кислотой результаты исследований (изменение окраски бумажки) запишите в таблицу. Затем в эту же пробирку добавьте каплю фенолфталеина. Перемешайте стеклянной палочкой. Результаты исследований запишите в таблицу. Во вторую пробирку добавьте каплю метилоранжа. Перемешайте стеклянной палочкой. Результаты наблюдений сравните, и запишите в таблицу.
- Повторите опыты, описанные выше (в пункте 2), используя две другие пробирки с лимонной кислотой предварительно их растворив.
Не забывайте результаты наблюдений фиксировать в таблице!
ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
| Индикатор |
Окраска индикатора в воде |
Окраска индикатора в растворе соляной кислоты (HCl) |
Окраска индикатора в лимонной кислоте |
Лакмусовая бумажка |
Желтая |
|
|
Фенолфталеин |
Бесцветная |
|
|
метилоранж |
Оранжевая |
|
|
Обсуждение результатов и формулирование выводов: (слайд 5).
- Как можно определить раствор кислоты среди других веществ? (раствор кислоты среди других веществ можно определить с помощью индикаторов).
- Какие индикаторы изменили свой цвет в кислотах? (лакмус и метилоранж).
- Одинаковые ли изменения цвета этих индикаторов вы наблюдали в обеих кислотах? (да).
- Какую окраску приобрели лакмус и метилоранж и в соляной, и в лимонной кислотах? (лакмус стал красным, а метилоранж – розовым)
На основании проведенных опытов сделаем выводы:
- независимо от вида кислот индикаторы изменяют свой цвет одинаково;
- а это означает, что все кислоты обладают сходными свойствами.
С чем же это связано?
Для того чтобы объяснить сходные свойства кислот, необходимо изучить их состав.
4. Изучение нового материала с элементами самостоятельной работы по учебнику (Стр.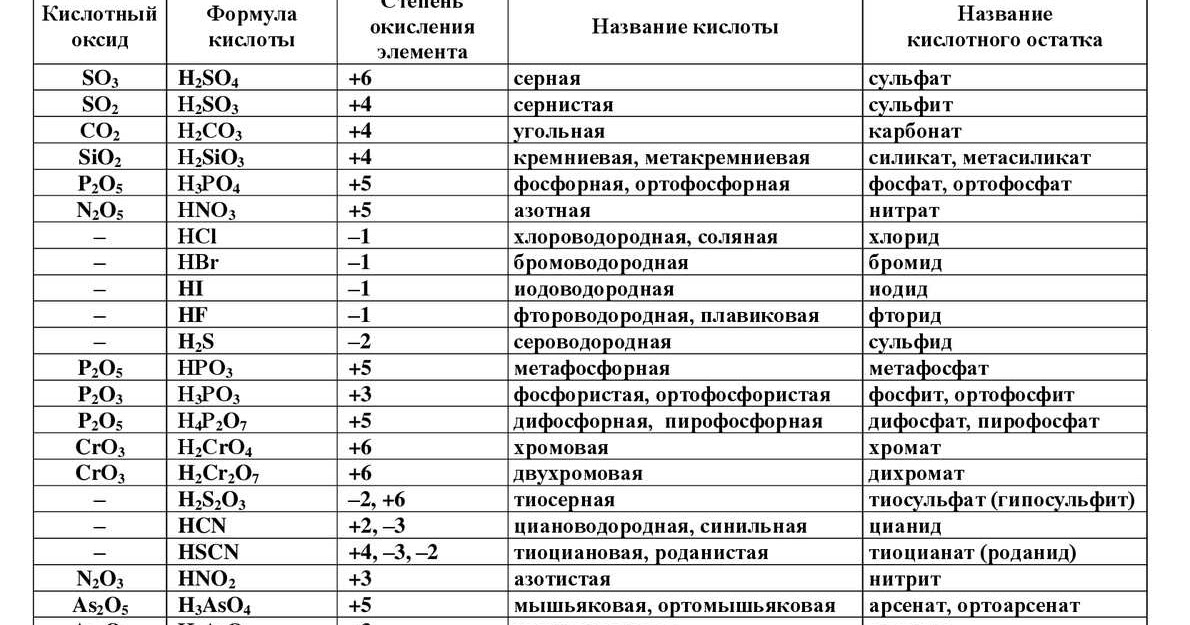 ) 102.
) 102.ПОКАЗЫВАЮ 3 карточки с кислотами (HCl, H2SO4, H3PO4).
? Прочитайте формулы кислот, используя учебник стр. 102. (как правильно назвать кислоты?).
? Что общего во всех этих формулах? (все содержат элемент Н).
СЛЕДОВАТЕЛЬНО, все общие свойства кислот, кислый вкус, изменение окраски индикаторов, связаны с элементом водородом.
? На каком месте в формуле кислоты записывают знак водорода? (На первом).
Если закрыть водород, то остальная часть молекулы называется кислотным остатком.
? В кислотах разные кислотные остатки? (да).
СЛЕДОВАТЕЛЬНО, специфические свойства каждой кислоты связаны с наличием в них разных кислотных остатков.
Прочитайте кислотные остатки.
Сколько частей можно выделить в молекулах кислот? (две: один-ион Н, другой – ион кислотного остатка).
Чему равен заряд иона Н? (1+).
Какой по знаку будет заряд иона кислотного остатка? (отрицательным).
А как можно определить число этого заряда?
Оказывается для этого нужно посмотреть на число атомов водорода в формуле кислоты.
Чему равен заряд иона кислотного остатка в HCl, H2SO4, H3PO4?
Какое же можно дать определение кислотам из всего сказанного.
КИСЛОТЫ – это сложные вещества, состоящие из атомов водорода и кислотных остатков.
Как правило, кислотные остатки образуют элементы не металлы, по ним называют кислоты.
По формулам кислот можно определить степени окисления атомов химических элементов, образующих кислоты.
Для этого нужно вспомнить пройденную тему, что суммарная степень окисления атомов всех элементов равна нулю.
Вам предлагается самостоятельно найти в следующих кислотах степень окисления, используя учебник стр. 103.
Задание:
- Определить степени окисления в кислотах.

- Какой оксид соответствует данной кислоте.
- Подумаете и ответьте, почему у одинаковых кислотных остатков разные названия.
А чем еще кроме разных кислотных остатков отличаются формулы этих кислот? (числом атомов водорода).
Как вы думаете можно ли по этому признаку классифицировать кислоты? (да).
Откройте учебник стр.104 & 20 со слов «Число атомов водорода в кислоте…»
И найдите название этого признака. (Число атомов водорода называется основностью кислоты. Признак классификации – основность).
Какие бывают кислоты по основности? (Одноосновные, двухосновные, трехосновные).
Назовите кислоты по основности.
ПОКАЗЫВАЮ карточки
Н2SO4 и H2S. Прочитайте формулы кислот.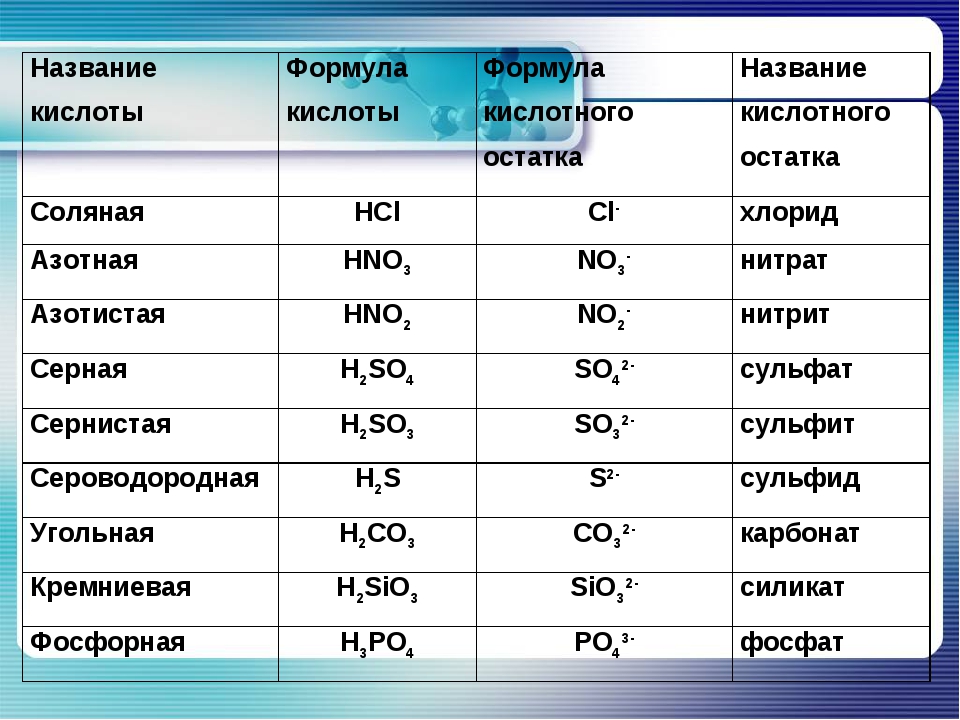
А чем отличаются кислотные остатки в этих формулах? (есть или нет кислород).
На стр. 102 второй абзац найдите название второго признака классификации кислот. (По наличию кислорода).
Как классифицируют кислоты по этому признаку (Кислородные и бескислородные).
Назовите кислоты по наличию кислорода в кислотном остатке.
Кислоты можно классифицировать еще по растворимости.
Откройте таблицу растворимости, найдите ряд кислот, учащиеся сами делают выводы: единственная не растворимая кислота кремниевая.
Кислоты имеют различные физические свойства: (показывая) соляная, серная, азотная – жидкости, борная, стеариновая – твердые.
Угольная и сернистая кислоты в свободном виде не существуют.
Проводится опыт: Если в газированную воду опустить лакмусовую бумагу она покраснеет, если стакан оставить на некоторое время открытым и повторить опыт снова лакмусовая бумажка не покраснеет. Почему?
Почему?
Многие кислоты нужны в народном хозяйстве в огромных количествах.
К их числу относят серную и соляную кислоты.
С соляной кислотой мы с вами познакомились при изучении темы гидриды, сегодня на уроке я вам расскажу о серной кислоте.
Сейчас мы с вами посмотрим электронное пособие, где нам расскажут о свойствах серной кислоты, будьте внимательны!
Какие особенные свойства вы узнали о серной кислоте?
Как правильно нужно растворять серную кислоту?
Итак, мы познакомились еще с одним классом соединений – кислотами.
Чтобы привести знания о кислотах в систему, прошу вас заполнить таблицу, которая находится на партах.
Формулы кислот |
Название кислот |
Кислотный остаток и заряд его иона |
Основность кислот |
Кислородосодержащая или бескислородная |
HCl |
|
|
|
|
HNO3 |
|
|
|
|
HNO2 |
|
|
|
|
H2S |
|
|
|
|
H2SO4 |
|
|
|
|
H2SO3 |
|
|
|
|
H3РО4 |
|
|
|
|
5. Закрепление изученного материала:
Закрепление изученного материала:
1. Найдите формулы кислот. Разместите их в таком порядке, чтобы внизу получилось название индикатора.
Приложение 3.
2. Игра «Третий лишний».
В каждом ряду найдите лишнюю формулу, ответ мотивируйте:
3. Ребята решили укомплектовать свою учебную лабораторию оксидами, основаниями и кислотами. Заказ им прислали по почте в виде двух посылок:
1-я посылка: NaOH, CaO, H3PO4, HNO3, Ca(OH)2, Cr2O3
2-я посылка: FeO, H2SO4, KOH, Fe(OH)2, P2O5, HCl,
4. Даны кислотные остатки:
F–; СlO–4; SiO32–.
Составьте формулы возможных кислот, назовите их и дайте им характеристику, используя признаки классификации.
6. Итог урока. Домашнее задание & 20 изучить, № 1, 3, на стр. 107 (письменно).
107 (письменно).
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа № 12
Предмет: ХИМИЯ
Дата: 10.02.2016г
Пользуясь образцом выполнения варианта №1 таблицы 20 на стр.144 (приложение 1), выполнить вариант №2
Приложение 1.
|
Вариант 1 |
а) |
б) |
в) |
г) |
д) |
|
Формула вещества |
Принадлежит к классу |
Название вещества |
Валентность кислотного остатка (в кислоте, соли) |
Растворимость (по таблице растворимости на форзаце 2 учебника) |
Физические свойства знакомых (агрегатное состояние, цвет, запах, растворимость в воде) |
|
CaO |
Оксид основный |
Оксид кальция |
|
|
твёрд. |
|
H2S |
Кислота |
Сероводородная кислота |
II |
Р(растворимое вещество) |
|
|
NaCl |
Соль |
Хлорид натрия (повареная соль) |
I |
Р |
твёрд., белый, растворим. |
|
Ca3(PO4)2 |
Соль |
Фосфат кальция |
III |
Н (нерастворимое вещество) |
|
|
N2O5 |
Оксид кислотный |
Оксид азота (V) |
|
|
|
|
AgNO3 |
Соль |
Нитрат серебра |
I |
Р |
|
|
Mg |
Металл |
Магний |
|
|
твёрд. |
|
FeSO4 |
Соль |
Сульфат железа (II) |
II |
Р |
|
|
HNO3 |
Кислота |
Азотная кислота |
I |
Р |
|
Если тетрадь в школе, выполняете все задания в новой тетради!
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр.144
Предмет: ХИМИЯ
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр. 144
144
Предмет: ХИМИЯ
Дата: 03.02.2016г
Выучить наизусть формулы и название кислот, кислотных остатков, оксидов, соответствующих кислотам по таблице №1:
Таблица №1
|
Формула кислоты |
Название кислоты |
Формула кислотного остатка |
Валентность кислотного остатка |
Название кислотного остатка |
Оксид, соответствующий кислоте |
|
HCl |
Хлороводородная (соляная) |
Cl |
I |
Хлорид |
— |
|
HF |
Фтороводородная (плавиковая) |
F |
I |
Фторид |
— |
|
HBr |
Бромоводородная |
Br |
I |
Бромид |
— |
|
HI |
Иодоводородная |
I |
I |
Иодид |
— |
|
H2S |
Сероводородная |
S |
II |
Сульфид |
— |
|
H2SO3 |
Сернистая |
SO3 |
II |
Сульфит |
SO2 |
|
H2SO4 |
Серная |
SO4 |
II |
Сульфат |
SO3 |
|
HNO2 |
Азотистая |
NO2 |
I |
Нитрит |
N2O3 |
|
HNO3 |
Азотная |
NO3 |
I |
Нитрат |
N2O5 |
|
H2CO3 |
Угольная |
CO3 |
II |
Карбонат |
CO2 |
|
H2SiO3 |
Кремниевая |
SiO3 |
II |
Силикат |
SiO2 |
|
H3PO4 |
Фосфорная (Ортофосфорная) |
PO4 |
III |
Фосфат (Ортофосфат) |
P2O5 |
Выполните следующее задание в тетради:
Начертите таблицу и заполните свободные клеточки (впишите формулу или название) в таблице №2 (по памяти, не пользуясь таблицей №1)
Таблица №2
|
Формула кислоты |
Название кислоты |
Формула кислотного остатка |
Валентность кислотного остатка |
Название кислотного остатка |
Оксид, соответствующий кислоте |
|
HNO3 |
|
|
|
Нитрат |
N2O5 |
|
|
Иодоводородная |
|
|
|
— |
|
H3PO4 |
|
|
|
|
|
|
|
Сернистая |
SO3 |
|
|
|
|
H2CO3 |
|
|
|
|
|
|
HCl |
|
|
|
Хлорид |
— |
|
|
Кремниевая |
|
|
|
|
|
HF |
|
|
|
|
— |
|
|
|
|
|
Сульфид |
— |
|
|
|
|
|
Бромид |
— |
|
|
Серная |
|
|
|
|
|
HNO2 |
Азотистая |
NO2 |
I |
Нитрит |
N2O3 |
Все работы, выполненные в дни карантина, будут проверены и оценены. Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Предмет: ХИМИЯ
Дата: 28.01.2016г
Изучить §32, записать в тетради основные понятия:
Кислотами называются сложные вещества ………..
Валентность кислотного остатка находят ………..
К бескислородным кислотам относят: ….., ……, ……, …..
К кислородсодержащим кислотам относят: …, …,…..,….,….,….,…..
Выучить наизусть формулы и название кислот (таблица 19 на стр.141)
Выполните в тетради задания:
№1. Распределите химические формулы кислот из перечня формул веществ в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI , HClO4 ,HBr , CaCl2, Na2O, HCl , H2SO4 , HNO3 , HMnO4 , Ca(OH)2, SiO2, H2SO3 , Zn(OH)2, H3PO4 , HF , HNO2,H2CO3 , N2O, NaNO3 ,H2S , H2SiO3
|
Кислоты |
||||||
|
Бес-кисло- родные |
Кислород- содержащие |
растворимые
|
нераст-воримые |
одно- основные |
двух-основные |
трёх-основные |
Выполните задания №1, №2, №3 на стр. 142
142
При изучении нового материала можно воспользоваться дополнительным материалом:
Урок по теме: Кислоты: классификация, номенклатура, физические и химические свойства
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода,
способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
По числу атомов водорода:число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих
кислотных оксидов:
|
Кислота (НnА) |
Кислотный остаток (А) |
Соответствующий кислотный оксид |
|
HClO4 хлорная |
ClO4 (I) перхлорат |
Cl2O7 оксид хлора (VII ) |
|
H2SO4 серная |
SO4 (II) сульфат |
SO3 оксид серы (VI ), серный ангидрид |
|
HNO3 азотная |
NO3 (I) нитрат |
N2O5 оксид азота ( V ) |
|
HMnO4 марганцевая |
MnO4 (I) перманганат |
Mn2O7 оксид марганца (VII ) |
|
H2SO3 сернистая |
SO3 (II) сульфит |
SO2 оксид серы (IV ) |
|
H3PO4 ортофосфорная |
PO4 (III) ортофосфат |
P2O5 оксид фосфора (V ) |
|
HNO2 азотистая |
NO2 (I) нитрит |
N2O3 оксид азота (III ) |
|
H2CO3 угольная |
CO3 (II) карбонат |
CO2 оксид углерода ( IV), углекислый газ |
|
H2SiO3 кремниевая |
SiO3 (II) силикат |
SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
|
Кислота (НnА) |
Кислотный остаток (А) |
|
HCl соляная, хлороводородная |
Cl (I) хлорид |
|
H2S сероводородная |
S(II) сульфид |
|
HBr бромоводородная |
Br (I) бромид |
|
HI йодоводородная |
I(I) йодид |
|
HF фтороводородная,плавиковая |
F(I) фторид |
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны
известны
также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все
кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
|
бескислородные |
кислородсодержащие |
|
HCl, HBr, HI, HF, H2S |
HNO3, H2SO4 и другие |
|
ПОЛУЧЕНИЕ |
|
|
1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl |
1. SO3 + H2O = H2SO4 |
|
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl |
|
Предмет: ХИМИЯ
Дата: 27.01.2016г
Изучить §31, записать в тетради основные понятия:
Основаниями называются …………
По характеру свойств различают ………
К щелочам относят …………….
Исторически сложившиеся названия щелочей:
KOH – едкое кали
NaOH – …..
Ca(OH)2 – ……..
Ba(OH)2– ……..
Ca(OH)2– ……..
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Распределите химические формулы в таблицу :
LiOH , NO , Al 2 O 3, Zn(OH)2, CaO , SiO 2, CrO , NaOH , Mn 2 O 7, Fe(OH)2, Cr 2 O 3
|
Основный оксид |
Кислотный оксид |
Амфотерный оксид |
Безразличный оксид |
Щёлочь |
Нерастворимое основание |
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
При изучении нового материала можно использовать дополнительный материал:
Урок по теме: Основания: классификация, номенклатура, получение
|
ОСНОВАНИЯ Основания — это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами — ОН. Общая формула:
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Классификация оснований
Щёлочи – это основания растворимые в воде. Классификация оснований по числу групп ОН: n=1 однокислотное n=2 двухкислотное n=3 трехкислотное Физические свойства Большинство оснований – твёрдые вещества с различной растворимостью в воде. СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ ЩЁЛОЧЕЙ 1. Металл + H2O = ЩЁЛОЧЬ + Н2↑ 2Na + 2H2O = 2NaOH + H2 Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba,Ra) 2. Na2O + H2O = 2 NaOH Здесь, ОКСИД МЕТАЛЛА (основный оксид, растворимый в воде) – щелочного металла (Li,Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra) НЕРАСТВОРИМЫХ ОСНОВАНИЙ СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
|
Кислоты и кислотные остатки | Решаем химию: вопросы и ответы
При взаимодействии основных оксидов с водой получаются основания.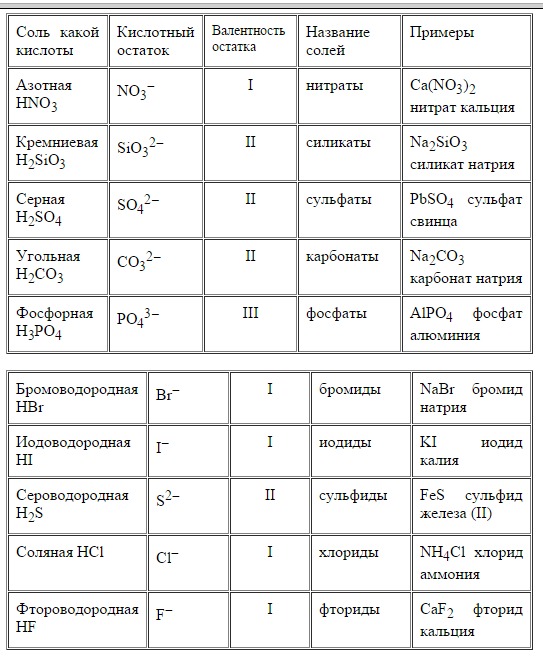 А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Фото: istockphoto.comФото: istockphoto.com
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная h4PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная h3S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота h3SO3 – двухосновная (здесь два атома водорода), а фосфорная h4PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте h4PO4 кислотный остаток — PO4.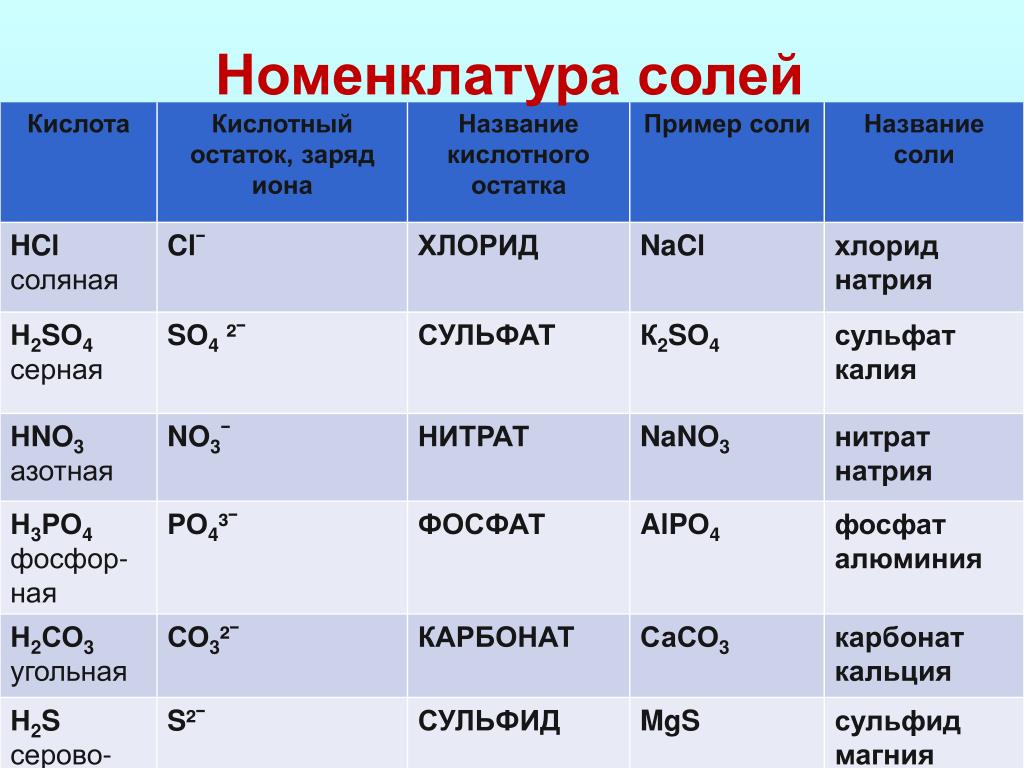 Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты h3SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты h3S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия h3S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота h3SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты h4PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Фосфат – соль фосфорной кислоты h4PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Урок №36. Кислоты: классификация, номенклатура, физические и химические свойства
Урок №36. Кислоты: классификация, номенклатура, физические и химические свойства
Посмотрите видео по теме:
Видео YouTube
Изучите материал на странице, формулы и названия кислот нужно будет выучить наизусть.Вам, наверное, известны некоторые кислоты. В лимонах и грейпфрутах содержится лимонная кислота, в щавеле — щавелевая, в яблоках — яблочная, а в уксусе, образующемся при брожении виноградного или яблочного сока — уксусная. Все эти примеры органических кислот. К числу неорганических или минеральных кислот относятся соляная, серная кислоты. [1]
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:
По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
Кислота (НnА) | Кислотный остаток (А) | Соответствующий кислотный оксид |
HClO4хлорная | ClO4 (I) перхлорат | Cl2O7 оксид хлора (VII ) |
H2SO4 серная | SO4 (II) сульфат | SO3 оксид серы (VI ), серный ангидрид |
HNO3 азотная | NO3 (I) нитрат | N2O5 оксид азота ( V ) |
HMnO4 марганцевая | MnO4 (I) перманганат | Mn2O7 оксид марганца (VII ) |
H2SO3 сернистая | SO3 (II) сульфит | SO2 оксид серы (IV ) |
H3PO4 ортофосфорная | PO4 (III) ортофосфат | P2O5 оксид фосфора (V ) |
HNO2 азотистая | NO2 (I) нитрит | N2O3 оксид азота (III ) |
H2CO3 угольная | CO3 (II) карбонат | CO2 оксид углерода ( IV), углекислый газ |
H2SiO3 кремниевая | SiO3 (II) силикат | SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
Кислота (НnА) | Кислотный остаток (А) |
HCl соляная, хлороводородная | Cl (I) хлорид |
H2S сероводородная | S(II) сульфид |
HBr бромоводородная | Br (I) бромид |
HI йодоводородная | I(I) йодид |
HF фтороводородная,плавиковая | F(I) фторид |
Физические свойства кислот
Многие кислоты,
например серная, азотная, соляная – это бесцветные жидкости. известны также
твёрдые кислоты: ортофосфорная, метафосфорная HPO3,
борная H3BO3.
известны также
твёрдые кислоты: ортофосфорная, метафосфорная HPO3,
борная H3BO3.
Почти все кислоты растворимы в воде.
Пример нерастворимой кислоты – кремниевая H2SiO3.
Растворы кислот имеют кислый вкус — он присущ всем кислотам, растворимым в воде. Его мы ощущаем и в неспелых яблоках, и в разведенном водой уксусе. Однако в лаборатории пробовать вещества на вкус запрещается — это может привести к ожогам и отравлениям. Как же химики судят о том, является ли данное вещество кислотой ? Для этого используют индикаторы — сложные органические вещества, изменяющие окраску в присутствии кислоты. Из них наиболее известны лакмус и метилоранж. Как объяснить тот факт, что растворы различных кислот проявляют сходные свойства? Постараемся найти общее в составе кислот. Обратите внимание — все они содержат водород. Именно атомы водорода и обуславливают общие свойства кислот, поэтому в формулах минеральных кислот водород записывается на первом месте. Группа атомов, стоящая в формуле кислоты после водорода, носит название кислотного остатка.[1] Количество атомов водорода в формуле равно валентности кислотного остатка.
Способы получения кислот
бескислородные | кислородсодержащие |
HCl, HBr, HI, HF, H2S | HNO3, H2SO4 и другие |
ПОЛУЧЕНИЕ | |
1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl | 1. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 |
2. 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl | |
Обязательно посмотрите видео-опыты:
Химические свойства кислот
1. Изменяют окраску индикаторов
Видео «Действие кислот на индикаторы»
Название индикатора | Нейтральная среда | Кислая среда |
Лакмус | Фиолетовый | Красный |
Фенолфталеин | Бесцветный | Бесцветный |
Метилоранж | Оранжевый | Красный |
Универсальная индикаторная бумага | Оранжевая | Красная |
2. Реагируют с металлами в ряду активности до H2
Реагируют с металлами в ряду активности до H2
(искл. HNO3 –азотная кислота)
Видео «Взаимодействие кислот с металлами»
Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения)
Zn + 2 HCl = ZnCl2 + H2
3. С основными (амфотерными) оксидами – оксидами металлов
Видео «Взаимодействие оксидов металлов с кислотами»
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
CuO + H2SO4 = Cu SO4 + H2O
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O (
р. обмена)
обмена)
H3PO4 + 3NaOH = Na3PO4 + 3H2O
5. Реагируют с солями слабых, летучих кислот — если образуется соль, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑ ( р. обмена)
Сила кислот убывает в ряду: HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 . Каждая предыдущая кислота может вытеснить из соли последующую |
Видео «Взаимодействие кислот с солями»
6. Разложение кислородсодержащих кислот при нагревании
Разложение кислородсодержащих кислот при нагревании
( искл. H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ (письменно в тетрадь)
№1. Распределите химические формулы кислот в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI , HClO4 ,HBr , CaCl2, Na2O, HCl , H2SO4 , HNO3 , HMnO4 , Ca(OH)2, SiO2, H2SO3 , Zn(OH)2, H3PO4 , HF , HNO2 ,H2CO3 , N2O, NaNO3 ,H2S , H2SiO3
Кислоты | ||||||
Бескислородные | Кислород содержащие | растворимые
| нераство- римые | одно-основные | двух-основные | трёх-основные |
№2. Составьте уравнения реакций:
Составьте уравнения реакций:
Ca + HCl
Na + H2SO4
Al + H2S
Ca
+ H3PO4
Назовите продукты реакции.
№3. Составьте уравнения реакций, назовите продукты:
Na2O + H2CO3
ZnO + HCl
CaO + HNO3
Fe2O3 + H2SO4
№4. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO3
NaOH + H2SO3
Ca(OH)2 + H2S
Al(OH)3 + HF
HCl + Na2SiO3
H2SO4 + K2CO3
HNO3 + CaCO3
Назовите продукты реакции.
Выполните тест:
ТРЕНАЖЁРЫ для самопроверки ( не оцениваются, но Вы видите результат )
Тренажёр №1. «Формулы и названия кислот»
Тренажёр №2. » Установление соответствия:
формула кислоты — формула оксида»
Тренажёр №3. «Действие кислот на индикаторы»
Тренажёр №4. «Классификация кислот по наличию кислорода в кислотном остатке»
Тренажёр №5. «Классификация кислот по основности»
Тренажёр №6. «Классификация кислот по растворимости в воде»
Тренажёр №7. «Классификация кислот по стабильности»
Техника безопасности — Оказание первой помощи при попадании кислот на кожу
Техника безопасности — Правила техники безопасности при работе с кислотами файл
Техника безопасности — Правило разбавления концентрированной серной кислоты водой
Это интересно:
Химия просто
Набор задач # ключ ответа
Набор задач # ключ ответа Химия 333Структура и функция белков
Осень 2001 г.
 Набор задач #1 Ключ ответа
Набор задач #1 Ключ ответа 1.
| Аминокислота | заправка при pH 2 | заправка при pH 7 | заправка при pH 12 |
| Глутаминовая кислота | 0 | -1 | -1 |
| Кислота аспарагиновая | 0 | -1 | -1 |
| Лизин | +1 | +1 | 0 |
| Аргинин | +1 | +1 | +1 (50%) |
| Гистидин | +1 | +1 (25%) | 0 |
| Тирозин | 0 | 0 | -1 |
| Цистеин | 0 | 0 | -1 |
2. При pH = 7,8 гистидины будут иметь нейтрально заряженный
боковой цепи, поэтому полипептид будет менее растворим в воде, чем при pH 5,5, где гистидины будут
имеют чистый положительный заряд.
При pH = 7,8 гистидины будут иметь нейтрально заряженный
боковой цепи, поэтому полипептид будет менее растворим в воде, чем при pH 5,5, где гистидины будут
имеют чистый положительный заряд.
3. (г), pH = 9. Для решения этой задачи определите заряд каждой функциональной группы при каждом рН. Например, при рН=9 заряд концевого карбоксила равен -1, заряд концевого амино равно 0, а заряд боковой цепи равен +1.
4. Валин занимает больше места, чем аланин, поэтому конформация внутренняя часть белка, вероятно, значительно изменяется когда Ала меняется на Вал.Вторая мутация компенсирует уменьшение размера другого остатка в салоне, замена больший Ile с меньшим Gly.
5. При pH 7 Arg имеет полностью протонированную боковую цепь и способен
быть только донором водородной связи (см. Stryer, стр. 33). Любое амино
кислотная боковая цепь, способная принимать водородную связь, может водород
связь с Arg при pH = 7. Это включает E, D, N, Q, S, T, Y и
H (т. е. любая боковая цепь с неподеленной парой электронов на
атом O или N).
K и R полностью протонированы при pH = 7, поэтому не могут быть приняты водородная связь с другим R (когда они полностью протонированы, у них нет неподеленных пар электронов на N, которые могут принимать водородная связь).Триптофан также может служить только водородом. донор связи, поэтому он не может водородно связываться с полностью протонированным аргинин.
6.
A. В этой задаче мы хотим выяснить заряд каждого
боковая цепь аминокислоты, а затем сложите их, чтобы получить общую чистую
оплата:
Все K равны +1; есть 4 K, и поэтому они вносят +4 к общему заряду пептида.
Все R равны +1; есть 3 R, и поэтому они дают +3 к общий заряд пептида.
Все Е равны -1; есть 4 E, поэтому они вносят -4 в общий заряд пептида.
Все D равны -1; есть 2 D, и поэтому они вносят -2 в общий заряд пептида.Итак, после суммирования K, R, D и E у нас есть чистая из +1 до сих пор.
Гистидин имеет рКа, близкое к нашему рН (рН = 7, рКа = 6,0 от таблицу в Страйере).
Используя уравнение Хендерсона-Хаслебаха, мы можем определить, что около 9% гистидинов имеют положительный обвинение; к общему вкладу формы гистидина составляет 9% от +1 = +0,09
Все другие боковые цепи будут нейтральными при рН 7; итак, всего вклад боковых цепей в общий заряд +1.09
Теперь рассмотрим вклады от терминалов.
При pH = 7 карбоксильный конец будет иметь полный заряд -1.
При pH = 7 нам нужно использовать метод Хендерсона-Хассельбаха для определения пропорция N концов, которые заряжены; начиная с pKa Конец N — 7,8, используя Хендерсон — Хассельбах, мы получаем сеть заряд ~+0,86.
Для общей чистой стоимости:
Боковые цепи +1,09
Термини: -0.14
Итого: +0,95
B. Чтобы рецептор мог связать этот пептид, его заряд должен быть
дополнительный; другими словами, поскольку пептид имеет чистый положительный
заряд, вы могли бы ожидать, что рецептор будет иметь чистый отрицательный заряд. Итак, рецептор должен содержать кислотные остатки (кислые остатки,
подобно Asp и Glu, имеют суммарный отрицательный заряд при pH 7).
Итак, рецептор должен содержать кислотные остатки (кислые остатки,
подобно Asp и Glu, имеют суммарный отрицательный заряд при pH 7).
7. Мы можем использовать уравнение Хендерсона-Хассельбаха, чтобы определить доля гистидинов, протонированных при pKa 7.4, и фракция, протонированная, когда pKa составляет 7,0.
, когда pKa равно 7,4, pKa = pH; так что доля гистидинов протонированный 0,5.
Когда pKa равно 7,0, мы можем определить долю протонированного Н от:
Количество протонов, полученных при снижении pKa с 7,0 к 7,4 дается разностью 0,5 — 0,28 = 0,21.
Итак, улавливается 0,21 протона/молекула гемоглобина.
8. ЭЛВИС жив и здоров (найден в ~21 эпизоде).
9. Ответы будут разными.
10. Последовательности №1 и №3 должны показать наибольшее сходство в
выравнивание. Я получаю идентичность ~ 40% и оценку 576 (положительный результат).
оценка хорошая). Для № 1 и № 2 я получаю идентичность 16,9% с -453.
оценка (плохо).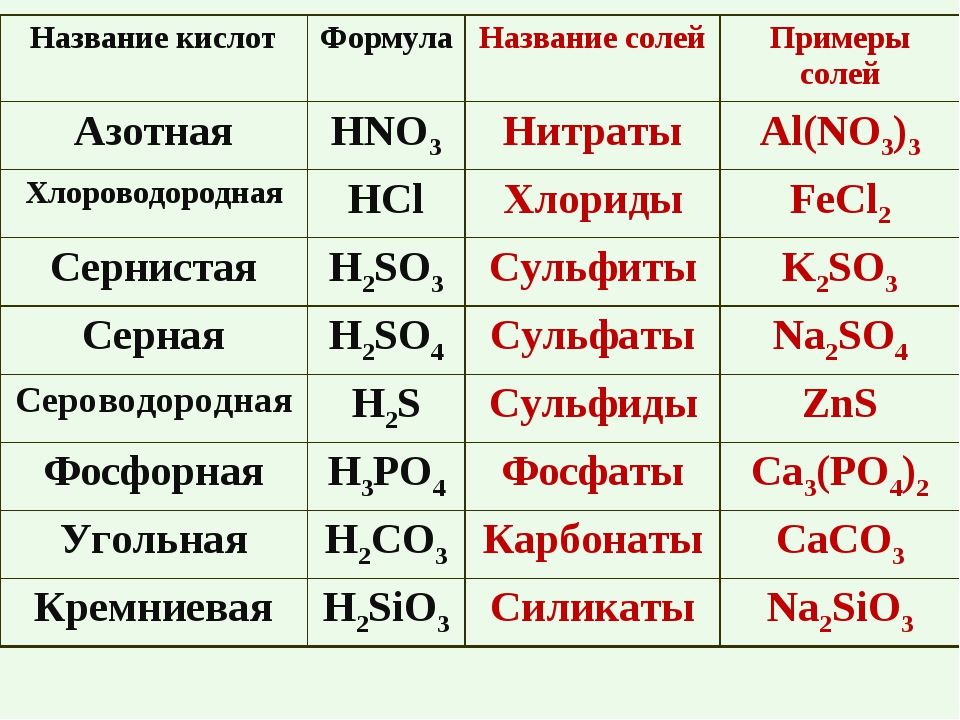 Для № 2 и № 3 я получаю идентичность 16,7% с -151.
оценка (тоже плохая).
Для № 2 и № 3 я получаю идентичность 16,7% с -151.
оценка (тоже плохая).
Все три белка представляют собой сериновые протеазы; №1 и №3 — субтилизины взяты из двух разных видов; эти два белка гомологичны. Последовательность № 2 представляет собой трипсин и не связана последовательностью с субтилизин (хотя, как мы узнаем позже, его функция аналогична).При сканировании PROSITE этих последовательностей вы должны были обнаружить несколько паттернов для каждой последовательности — самое главное, №1 и №3 должен содержать паттерны из семейства субтилаз, а #2 из семейство трипсина.
Незаменимые аминокислоты: таблица, сокращения и структура
Ала-аминокислота Обнаруженный в белке в 1875 году, аланин составляет 30% остатков в шелке. Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, устойчивость к растяжению и гибкость.В биосинтезе белков участвует только l-стереоизомер.
В организме человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован в оксид азота в организме человека, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Из-за его сосудорасширяющего действия аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования в этих областях все еще продолжаются.Аргинин также может быть получен синтетическим путем, а соединения, родственные аргинину, могут использоваться для лечения людей с дисфункцией печени из-за его роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, а не поддержания тела, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Аминокислота Asn В 1806 году аспарагин был выделен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника. Однако только в 1932 году ученым удалось доказать, что аспарагин присутствует в белках. В биосинтезе белков млекопитающих участвует только l-стереоизомер. Аспарагин играет важную роль в удалении токсичного аммиака из организма.
Однако только в 1932 году ученым удалось доказать, что аспарагин присутствует в белках. В биосинтезе белков млекопитающих участвует только l-стереоизомер. Аспарагин играет важную роль в удалении токсичного аммиака из организма.
Обнаруженная в белках в 1868 году, аспарагиновая кислота обычно встречается в животных белках, однако в биосинтезе белков участвует только L-стереоизомер. Растворимость этой аминокислоты в воде способствует присутствию рядом с активными центрами ферментов, таких как пепсин.
Цис-аминокислотаЦистеин особенно богат белками волос, копыт и кератином кожи, он был выделен из мочевого конкремента в 1810 году и из рога в 1899 году. и структура решена в 1903–1904 гг.
Серосодержащая тиольная группа в боковой цепи цистеина играет ключевую роль в его свойствах, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петель внутри одной цепи, влияя на конечную структуру белка. Две молекулы цистеина, связанные вместе дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в L-стереоизомере белков млекопитающих.
Две молекулы цистеина, связанные вместе дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в L-стереоизомере белков млекопитающих.
Люди с генетическим заболеванием цистинурия неспособны эффективно реабсорбировать цистин в кровь. Следовательно, высокий уровень цистина накапливается в их моче, где он кристаллизуется и образует камни, блокирующие почки и мочевой пузырь.
Аминокислота Gln Глютамин был впервые выделен из свекольного сока в 1883 г., выделен из белка в 1932 г. и впоследствии синтезирован химически в следующем году. Глютамин является наиболее распространенной аминокислотой в нашем организме и выполняет несколько важных функций. В организме человека глютамин синтезируется из глютаминовой кислоты, и этот этап превращения жизненно важен для регулирования уровня токсичного аммиака в организме с образованием мочевины и пуринов.
Глутаминовая кислота была выделена из пшеничной клейковины в 1866 году и химически синтезирована в 1890 году.Обычно встречающийся в животных белках, только L-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из обычного промежуточного соединения α-кетоглутаровой кислоты. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG), обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты способна действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками.Свободная глутаминовая кислота также может разлагаться до углекислого газа и воды или превращаться в сахара.
Аминокислота Gly
Глицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной, которая не является оптически активной (нет d- или l-стереоизомеров). ). Структурно самая простая из α-аминокислот, она практически не реагирует при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
). Структурно самая простая из α-аминокислот, она практически не реагирует при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
Его аминокислота
Гистидин был выделен в 1896 году, а его структура подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и теми, которые участвуют в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого времени обходиться без приема пищи, но все же считается незаменимой.
Ile аминокислота
Изолейцин был выделен из свекловичной патоки в 1904 году. Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он входит.
Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он входит.
Те, кто страдает от редкого наследственного заболевания, называемого болезнью мочи кленового сиропа, имеют неисправный фермент в пути деградации, общем для изолейцина, лейцина и валина.Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название этому заболеванию.
Leu аминокислота
Лейцин был выделен из сыра в 1819 г. и из мышц и шерсти в кристаллическом состоянии в 1820 г. В 1891 г. он был синтезирован в лаборатории.
В белке млекопитающих присутствует только L-стереоизомер, который может расщепляться ферментами организма до более простых соединений.Некоторые ДНК-связывающие белки содержат области, в которых лейцины расположены в конфигурациях, называемых лейциновыми застежками-молниями.
Lys аминокислота
Лизин был впервые выделен из казеина молочного белка в 1889 году, а его структура была установлена в 1902 году. как функционируют гистоны.
как функционируют гистоны.
Многие зерновые культуры содержат очень мало лизина, что привело к дефициту лизина у некоторых групп населения, которые в значительной степени полагаются на него в пищу, а также у вегетарианцев и людей, придерживающихся диеты с низким содержанием жиров.Следовательно, были предприняты усилия по созданию штаммов кукурузы, богатых лизином.
Метионин аминокислота
Метионин был выделен из казеина молочного белка в 1922 году, а его структура была определена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и способствует детоксикации метаболических отходов и токсинов.
Метионин является единственной незаменимой аминокислотой, которая не содержится в значительных количествах соевых бобов и поэтому производится в промышленных масштабах и добавляется во многие продукты из соевой муки.
Phe аминокислота
Фенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году, а затем химически синтезирован в 1882 году. у людей с наследственной фенилкетонурией (ФКУ) фермент, который выполняет это преобразование, неактивен.Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. На 10 000 детей, родившихся с этим заболеванием, переход на диету с низким содержанием фенилаланина в раннем возрасте может облегчить последствия.
Про аминокислота
В 1900 году был химически синтезирован пролин. В следующем году он был выделен из молочного белка казеина, и было показано, что его структура осталась прежней. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только в виде l-стереоизомера в белках млекопитающих.Когда пролин включается в белки, его особая структура приводит к резким изгибам или изгибам в пептидной цепи, что в значительной степени влияет на окончательную структуру белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Ser аминокислота
Серин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года.Люди могут синтезировать серин из других метаболитов, включая глицин, хотя в белках млекопитающих присутствует только L-стереоизомер. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервно-паралитические газы и некоторые инсектициды действуют путем соединения с остатком серина в активном центре ацетилхолинэстеразы, полностью ингибируя фермент. Активность эстеразы необходима для разрушения нейротрансмиттера ацетилхолина, в противном случае накапливается опасно высокий уровень, быстро приводящий к судорогам и смерти.
Thr аминокислота
Треонин был выделен из фибрина в 1935 году и синтезирован в том же году. Только L-стереоизомер появляется в белках млекопитающих, где он относительно нереактивен. Хотя он важен во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Только L-стереоизомер появляется в белках млекопитающих, где он относительно нереактивен. Хотя он важен во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Trp аминокислота
Выделенный из казеина (молочный белок) в 1901 году, структура триптофана была установлена в 1907 году, но в белках млекопитающих присутствует только L-стереоизомер.В кишечнике человека бактерии расщепляют пищевой триптофан, высвобождая такие соединения, как скатол и индол, которые придают фекалиям неприятный запах. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но с недостаточной скоростью, чтобы поддерживать наше здоровье. Следовательно, мы также должны потреблять витамин B3, а невыполнение этого требования приводит к дефициту, называемому пеллагра.
Tyr аминокислота
В 1846 году тирозин был выделен в результате разложения казеина (белок из сыра), после чего он был синтезирован в лаборатории и определена его структура в 1883 году. Только представленный в виде l-стереоизомера в белках млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента меланина для волос и кожи. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Только представленный в виде l-стереоизомера в белках млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента меланина для волос и кожи. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие серьезным генетическим заболеванием фенилкетонурия (ФКУ) неспособны преобразовывать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией нарушен метаболизм тирозина, из-за чего выделяется моча, которая темнеет на воздухе.
Val аминокислота
Структура валина была установлена в 1906 году после того, как он впервые был выделен из альбумина в 1879 году. В белке млекопитающих присутствует только L-стереоизомер. Валин может расщепляться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, дефектный фермент прерывает этот процесс и может привести к летальному исходу, если его не лечить.
Почему двадцати типов аминокислотных остатков достаточно(d) для поддержания всех живых систем
Abstract
Хорошо известно, что белки состоят из алфавита 20 различных типов аминокислот.Этого достаточно, чтобы позволить белку свернуться в свою действующую форму, соответствующую его требуемым функциональным ролям. Для выполнения этих назначенных функций в некоторых случаях может потребоваться посттрансляционная модификация, и было установлено, что в какой-то момент в этот процесс были вовлечены три дополнительных типа аминокислот. Но по-прежнему остается фактом, что упомянутые 20 типов остатков являются основными строительными блоками во всех наземных белках и, вероятно, «универсально».Учитывая этот факт, удивительно, что не было дано удовлетворительного ответа на два вопроса: «почему 20?». и «почему только эти 20?». Кроме того, делается предположение о том, как эти 20 кодонов сопоставляются с репертуаром кодонов, который, в принципе, способен обслуживать 64 различных типа остатков. В этой статье предпринимаются попытки ответить на эти вопросы, используя комбинацию квантово-химических и хемоинформационных инструментов, которые применяются к стандартным 20 типам аминокислот, а также к 3 «нестандартным» типам, встречающимся в природе, набору вымышленных, но осуществимых аминокислот. аналоговые структуры, разработанные для проверки потребности в большем охвате функционального пространства и набора возможных альтернативных структур, найденных либо на метеоритах, либо в экспериментах, предназначенных для реконструкции сценариев до жизни.
В этой статье предпринимаются попытки ответить на эти вопросы, используя комбинацию квантово-химических и хемоинформационных инструментов, которые применяются к стандартным 20 типам аминокислот, а также к 3 «нестандартным» типам, встречающимся в природе, набору вымышленных, но осуществимых аминокислот. аналоговые структуры, разработанные для проверки потребности в большем охвате функционального пространства и набора возможных альтернативных структур, найденных либо на метеоритах, либо в экспериментах, предназначенных для реконструкции сценариев до жизни.
Образец цитирования: Bywater RP (2018) Почему двадцати типов аминокислотных остатков достаточно (d) для поддержания всех живых систем. ПЛОС ОДИН 13(10): e0204883. https://doi.org/10.1371/journal.pone.0204883
Редактор: Christos A. Ouzounis, CPERI, ГРЕЦИЯ
Поступила в редакцию: 4 мая 2017 г.; Принято: 17 сентября 2018 г. ; Опубликовано: 15 октября 2018 г.
; Опубликовано: 15 октября 2018 г.
Copyright: © 2018 Robert P.Байуотер. Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все данные предоставляются либо загруженными «как есть» (рисунки), либо в качестве дополнительной информации (таблицы).
Финансирование: Эта работа была поддержана Институтом Фрэнсиса Крика, который получает основное финансирование от Cancer Research UK (FC001179), Совета медицинских исследований Великобритании (FC001179) и Wellcome Trust (FC001179).Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Автор заявил об отсутствии конкурирующих интересов.
Введение
Поиск органических соединений, которые могли бы выступать в качестве компонентов или предшественников ключевых пребиотических химических веществ, активно ведется уже более 60 лет [1–3]. Было найдено лишь относительно небольшое количество таких кандидатов, около 50 человек.Это число исчезающе мало по сравнению с предполагаемым потенциальным населением химического пространства («пространство» здесь используется в его общем, математическом смысле). Химическое пространство было определено [4] как совокупность всех возможных молекул, которая, как считается, содержит не менее 10 60 органических молекул с молекулярной массой менее 500 Да. Возможно, в космическом пространстве еще предстоит открыть миллионы соединений, но число действительно известных соединений ничтожно по сравнению с этим числом. Между тем на Земле и биология, и изобретательность человечества способны генерировать миллионы различных химических структур в крошечных замкнутых пространствах.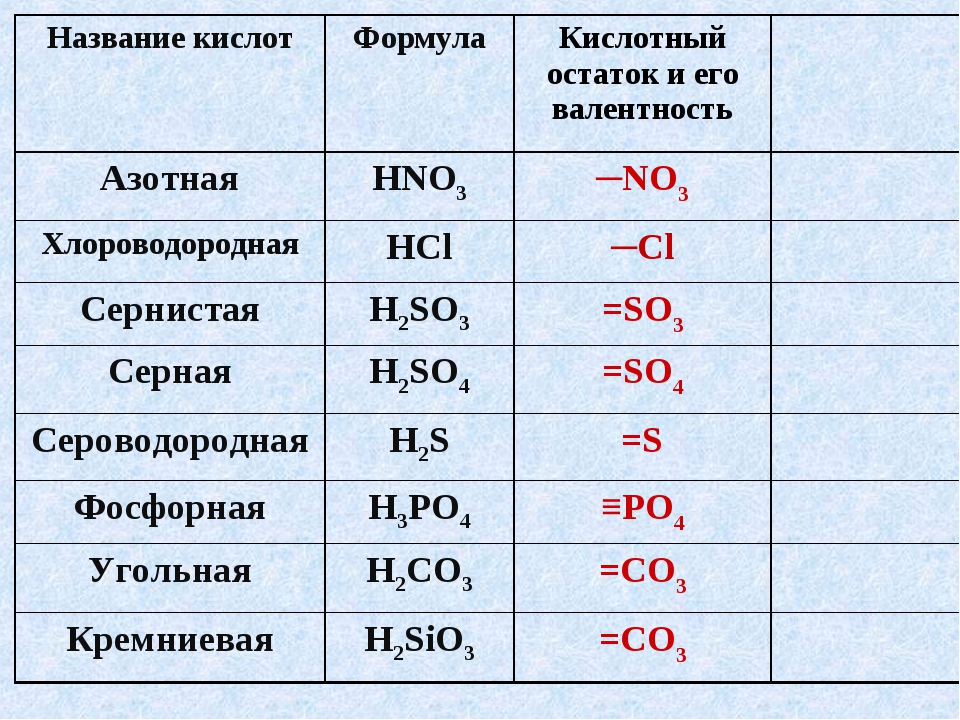 Контраст между химической стерильностью известного космического пространства и Земли не может быть большим. Конечно, биологическая эволюция во многом связана с производством этих миллионов соединений (однако все еще далеко от оценки Реймонда и др.), но химическая эволюция, которая привела к возникновению жизни, должна была довольствоваться 50 обсуждаемых здесь, из которых 19 являются существующими и все еще необходимыми L-аминокислотами вместе с ахиральным глицином и на каком-то этапе еще 3 типа.
Контраст между химической стерильностью известного космического пространства и Земли не может быть большим. Конечно, биологическая эволюция во многом связана с производством этих миллионов соединений (однако все еще далеко от оценки Реймонда и др.), но химическая эволюция, которая привела к возникновению жизни, должна была довольствоваться 50 обсуждаемых здесь, из которых 19 являются существующими и все еще необходимыми L-аминокислотами вместе с ахиральным глицином и на каком-то этапе еще 3 типа.
Степень, в которой химическое пространство было заполнено пребиотическими химическими веществами, рассматривалась ранее, и в этих поисках использовались передовые хемоинформационные инструменты [5–9]. В частности, было указано [6], что «…данные о частоте аминокислот, образованных этими разнообразными механизмами, и … независимо от источника, эти 10 ранних аминокислот могут быть ранжированы в порядке (можно предсказать с помощью термодинамики) убывающей распространенности. в пребиотических контекстах»._20-1200x800.jpg) Именно в этом духе (хемоинформатика и термодинамические ограничения) этот поиск продолжается здесь с использованием нескольких новых и некоторых старых методологий.
Именно в этом духе (хемоинформатика и термодинамические ограничения) этот поиск продолжается здесь с использованием нескольких новых и некоторых старых методологий.
Белки выполняют широкий спектр функций, которые имеют решающее значение для выживания всех живых организмов. К ним относятся структурные, каталитические, регуляторные функции, транспорт биоактивных материалов, трансдукция сигналов и роль транскрипции генов и многие другие. Это огромное разнообразие функций тем более примечательно, что химический состав белков кажется обманчиво простым — алфавит всего из 20 типов аминокислотных остатков обеспечивает платформу или сцену, на которой могут быть сыграны все эти сложные роли.Эти 20 типов остатков благодаря химической природе своих боковых цепей обладают почти всеми необходимыми химическими функциями. Нужно сказать «почти все», потому что в некоторых случаях существует значительная дополнительная поддержка, обеспечиваемая посттрансляционными модификациями, добавлением кофакторов или ионов металлов 90–414 и т. д. 90–415 . но сами аминокислоты предоставляют необходимую информацию для правильного прикрепления этих вспомогательных веществ. Уже упоминалось о трех дополнительных, относительно редких, протеиногенных типах аминокислот, два из которых кодируются перекрыванием стоп-кодона, UAG в случае или пирролизин и UGA в случае селеноцистеина [10–14].Основное внимание в этой работе уделяется 20 стандартным или каноническим типам аминокислот, но хотя эти два дополнительных типа до сих пор не были обнаружены за пределами биосферы, они играют важную роль в биологии «пост-РНК», поэтому они включены в анализ, который следует, наряду с третьим новичком, селенометионином [15] и другими аналогами аминокислот-кандидатов, как указано ниже.
д. 90–415 . но сами аминокислоты предоставляют необходимую информацию для правильного прикрепления этих вспомогательных веществ. Уже упоминалось о трех дополнительных, относительно редких, протеиногенных типах аминокислот, два из которых кодируются перекрыванием стоп-кодона, UAG в случае или пирролизин и UGA в случае селеноцистеина [10–14].Основное внимание в этой работе уделяется 20 стандартным или каноническим типам аминокислот, но хотя эти два дополнительных типа до сих пор не были обнаружены за пределами биосферы, они играют важную роль в биологии «пост-РНК», поэтому они включены в анализ, который следует, наряду с третьим новичком, селенометионином [15] и другими аналогами аминокислот-кандидатов, как указано ниже.
Выбор из 20 стандартных типов остатков был сделан на ранней стадии эволюции — их появление предшествовало РНК и ДНК, и весьма вероятно, что они уже играли жизненно важную роль на протяжении всей добиотической химической эволюции (~ 4 млрд лет назад) [7,8].Вопросы, которые возникают сейчас и даже ранее [16], заключаются в следующем: почему именно эти 20 «канонических» типов аминокислот пришли заселить белковый мир и почему не были выбраны другие (в принципе, множество возможных альтернатив [16])?
Эти вопросы актуальны для современной биохимии, а также для рассмотрения их роли в происхождении жизни (OoL). Недавно нам сообщили о природе полезной органической химической нагрузки на борту кометы 67P [17], но это были в основном очень примитивные структуры, включающие множество азотсодержащих соединений, но не содержащие серу (или селен), а также четыре органических соединения: метилизоцианат, ацетон, пропионовый альдегид. и ацетамид, но без аминокислот.Со временем мы получим информацию о ряде планет Солнечной системы, а также о бесчисленном количестве экзопланет. Хотя могут быть некоторые сюрпризы, кажется, что, исходя из текущих данных, «универсально» является допустимым наречием для использования. Если это так, то ответ должен потребовать, чтобы мы выяснили, какие факторы, относящиеся к белкам, ограничивают поглощение любых мономеров, которые может предложить органическая химия в условиях, которые, по крайней мере, вначале были суровыми.
Недавно нам сообщили о природе полезной органической химической нагрузки на борту кометы 67P [17], но это были в основном очень примитивные структуры, включающие множество азотсодержащих соединений, но не содержащие серу (или селен), а также четыре органических соединения: метилизоцианат, ацетон, пропионовый альдегид. и ацетамид, но без аминокислот.Со временем мы получим информацию о ряде планет Солнечной системы, а также о бесчисленном количестве экзопланет. Хотя могут быть некоторые сюрпризы, кажется, что, исходя из текущих данных, «универсально» является допустимым наречием для использования. Если это так, то ответ должен потребовать, чтобы мы выяснили, какие факторы, относящиеся к белкам, ограничивают поглощение любых мономеров, которые может предложить органическая химия в условиях, которые, по крайней мере, вначале были суровыми.
Наконец, самый актуальный вопрос, упомянутый в Abstract и уже представленный в более раннем списке [16] вопросов: почему только 20, а не 64 типа аминокислот. Этот вопрос рассматривается в данной статье.
Этот вопрос рассматривается в данной статье.
Методы
Ключом к этой статье является понимание понятия и ценности использования различных определений молекулярной сложности. Если кто-то когда-либо хочет понять, как жизнь могла возникнуть из пребиотической химической библиотеки из 50 соединений (среди огромного множества возможных химических кандидатов, с большинством из которых мы никогда не встретимся), необходимо прибегнуть к количественным измерениям, отражающим вероятность того, что какое-либо данное соединение когда-либо будет создано.К этому есть два (дополняющих друг друга) подхода: один основан на математических описаниях молекулярной структуры (хемоинформатика), а другой основан на квантовой химии. Здесь применяются оба подхода. Обратите внимание, что в настоящей работе используется молекулярная сложность, основанная только на структуре, более раннее использование метрики «синтезируемости» [7,8] не имеет значения в этом контексте, поскольку нас интересует спонтанное образование различных молекулярных видов, а не их синтез.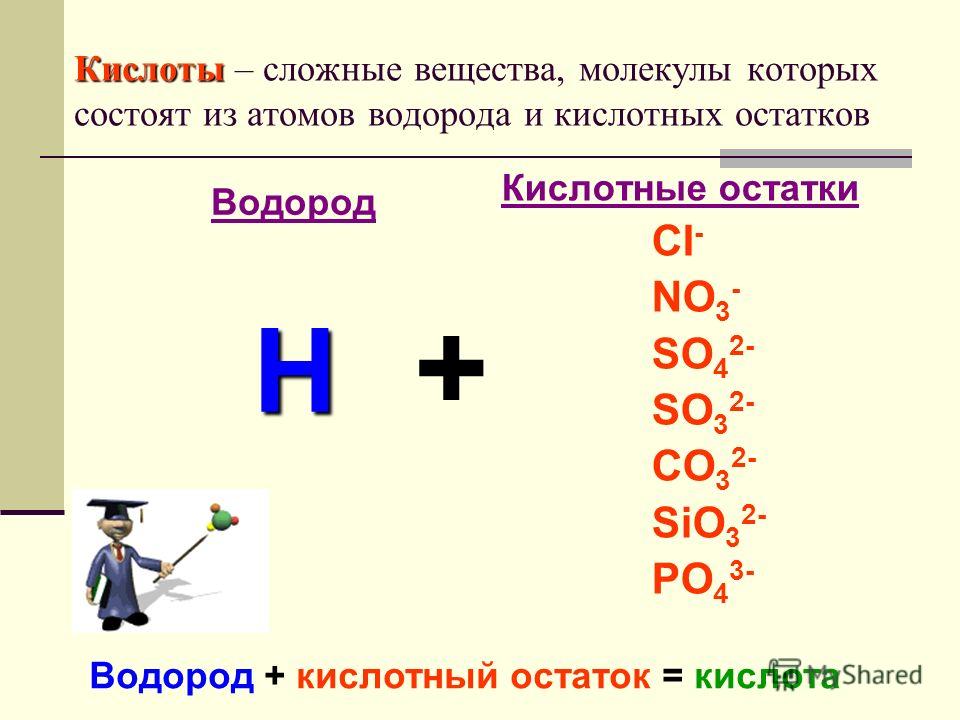 включая сложные процедуры и циклы очистки на лабораторном столе.
включая сложные процедуры и циклы очистки на лабораторном столе.
Чтобы исследовать эти вопросы, группа из 58 соединений, включая 20 канонических аминокислот, была подвергнута строгому статистическому аудиту их структурных и квантово-химических свойств. Выбор соединений-кандидатов для данного исследования был продиктован известными фактами появления аминокислот, их предшественников и аналогов в метеорите Мерчисон [18] и в классическом эксперименте Миллера [1–3]. Выбранная здесь группа соединений представлена соединениями, перечисленными в таблицах S1–S5 и идентифицированными по названию в таблице S6 .В описанной здесь работе эти наборы обозначены как mrchsn для Murchison и mllr для Miller и Miller-Urey соответственно. (Для соединений с номерами 1–30 см.: http://en.wikipedia.org/wiki/Non-proteinogenic_aminos_acids). Следует отметить, что после первоначальных экспериментов Миллера было проведено много экспериментов в разных условиях, но во всех смыслах и целях производятся одни и те же химические вещества [5,6,19–21]. Химические вещества, рассматриваемые в данной работе, изначально были разделены на две группы: L-аминокислоты, входящие в «канонический набор» (12 из 20) ( S2 Таблица ) и другие аминокислотоподобные соединения ( S1 Таблица ), именуемые «кандидатами».Важно подчеркнуть, что большинство этих кандидатов не являются аминокислотами. Они не могут быть включены в пептиды, поскольку в них отсутствует одна или другая или обе определяющие химические функциональные группы для образования пептидной связи. Есть некоторые исключения из этого, которые обсуждаются ниже.
Химические вещества, рассматриваемые в данной работе, изначально были разделены на две группы: L-аминокислоты, входящие в «канонический набор» (12 из 20) ( S2 Таблица ) и другие аминокислотоподобные соединения ( S1 Таблица ), именуемые «кандидатами».Важно подчеркнуть, что большинство этих кандидатов не являются аминокислотами. Они не могут быть включены в пептиды, поскольку в них отсутствует одна или другая или обе определяющие химические функциональные группы для образования пептидной связи. Есть некоторые исключения из этого, которые обсуждаются ниже.
Далее, поскольку мы хотим исследовать химическую эволюцию, очень важно рассмотреть, каких химических веществ (имеющих отношение к современной биохимии) не было в этих двух источниках. Следовательно, была добавлена третья группа ( S3 Table ): это были оставшиеся 8 из набора 20, которые не были обнаружены в метеоритах или в экспериментах по моделированию OoL.Конечно, эти 8, а также все другие типы пептидогенных аминокислот в пост-РНК-эру продуцируются ферментативным катализом, но они присутствовали до появления РНК и белков. Все 20 следует рассматривать как пребиотики, а 8, не обнаруженные в экспериментах по моделированию или на метеоритах, должны своим происхождением земным катализаторам, как обсуждается ниже. Установленные (из свидетельств метеоритов и экспериментов Миллера) 12 аминокислот соответствуют тем же самым основным 12 структурам, которые мы имеем сегодня. Возможно, было много усовершенствований этих структур, но они не были засвидетельствованы.Причина этого в том, что все такие разработки, такие как разветвление цепи или введение новых хиральных центров (которое обычно следует из разветвления цепи), обходится дорого, что можно измерить с точки зрения сложности и возможности синтеза и наблюдать с точки зрения возникновения. Эти строгие требования также действуют, чтобы ограничить следующий набор 8, которые мы все еще наблюдаем сегодня. Помимо изолейцина и треонина, не существует типов аминокислот с более чем одним хиральным центром, за исключением пирролизина (соединение 51 в таблице S4 ), который имеет два дополнительных хиральных центра.
Все 20 следует рассматривать как пребиотики, а 8, не обнаруженные в экспериментах по моделированию или на метеоритах, должны своим происхождением земным катализаторам, как обсуждается ниже. Установленные (из свидетельств метеоритов и экспериментов Миллера) 12 аминокислот соответствуют тем же самым основным 12 структурам, которые мы имеем сегодня. Возможно, было много усовершенствований этих структур, но они не были засвидетельствованы.Причина этого в том, что все такие разработки, такие как разветвление цепи или введение новых хиральных центров (которое обычно следует из разветвления цепи), обходится дорого, что можно измерить с точки зрения сложности и возможности синтеза и наблюдать с точки зрения возникновения. Эти строгие требования также действуют, чтобы ограничить следующий набор 8, которые мы все еще наблюдаем сегодня. Помимо изолейцина и треонина, не существует типов аминокислот с более чем одним хиральным центром, за исключением пирролизина (соединение 51 в таблице S4 ), который имеет два дополнительных хиральных центра. Это отражено в очень высоком показателе сложности для этой аминокислоты, как описано ниже.
Это отражено в очень высоком показателе сложности для этой аминокислоты, как описано ниже.
Белковый мир (за исключением некоторых простетических групп и посттрансляционных модификаций) в основном населен атомными типами H, C, N и O, но мы уже упоминали аминокислоты, содержащие Se, и они включены сюда (соединения 52–54 в таблице S4). ).
Могли быть или могли быть другие способы разработки аминокислотных структур путем изучения пространства ароматичности или создания альтернатив существующим функциональным группам, таким как -CO2 (-) и -Nh4 (+).Чтобы исследовать это, был разработан небольшой набор аминокислот в решительных усилиях по изучению области «функционального пространства», ранее неизведанной ни с помощью химической эволюции, ни даже синтетически. Члены этого набора были тщательно отобраны с целью изучения функционального пространства с хорошим охватом, но без избыточности. Это приняло форму расширения пространства ароматичности за счет замены одиночного бензольного кольца фенилаланина нафталином (2-амино-3-нафтилпропановая кислота, соединение 55 в таблице S5 ) и замены имидазольного фрагмента гистидина триазолами (2- Амино-3-(1H-1,2,3,триазол-4-ил)пропановая кислота, соединение 56 и 2-амино-3-(1H-1,3,5,триазол-4-ил)пропановая кислота, соединение 57) и тетразол (1H-1,2,3,5,тетразол-4-ил)пропановая кислота, соединение 58). Имидазольная боковая цепь гистидина ионизируется в диапазоне рН биологических систем, что придает ему каталитические свойства, в то время как триазолы всегда заряжены положительно, а тетразолы отрицательно заряжены при физиологическом рН. Эти аналоги не встречаются в природе, и их действительно было бы довольно сложно синтезировать.
Имидазольная боковая цепь гистидина ионизируется в диапазоне рН биологических систем, что придает ему каталитические свойства, в то время как триазолы всегда заряжены положительно, а тетразолы отрицательно заряжены при физиологическом рН. Эти аналоги не встречаются в природе, и их действительно было бы довольно сложно синтезировать.
Не было сочтено необходимым дальнейшее исследование пространства алифатичности (соединения с высоким logP, как обсуждается ниже), так как это было адекватно охвачено ранней химической эволюцией (многие соединения в первой группе, в частности, нет.14). В любом случае расширение алифатичности путем изучения более высоких гомологов или очень разветвленных боковых цепей быстро натолкнется на два недостатка: низкая растворимость и, со структурной точки зрения, чрезмерная избыточность без какого-либо компенсирующего выигрыша с точки зрения потенциала для улучшенного молекулярного распознавания или функции. Точно так же увеличение заряда за счет добавления дополнительных заряженных групп было бы обречено на провал, поскольку растворимые противоионы вскоре нейтрализуют дополнительные заряды, при этом будет сопутствующее увеличение «затрат на сложность» без какого-либо увеличения функциональности.
Пять групп соединений подробно обсуждаются ниже.
Входные модели выбранных соединений были построены с использованием пакета моделирования YASARA [22]. Сначала они были оптимизированы с помощью полуэмпирических квантово-химических расчетов в рамках гамильтониана PM3 и сохранены в форматах PDB, XYZ и SMILES. Файлы XYZ использовались в качестве входных данных для получения точных электронных структурных данных с использованием ab initio квантовых методов типа B3LYP/6-31G*, реализованных в рамках программы MOLCAS [23].Это было выбрано потому, что все соединения представляют собой структуры с закрытой оболочкой без возбужденных состояний или радикалов. Расчеты последнего типа необходимо проводить с осторожностью и вниманием ко многим факторам, помимо структуры, и необходимо выбирать специальные базисные наборы. Но для соединений, подобных изучаемым здесь, вполне достаточно B3LYP. Дополнительная сложность в случае селеносоединений (№№ 52, 52 и 54) заключается в том, что для обеспечения точной scf-сходимости требовалась релятивистская поправка (Основание: АНО-РКЦ-ВДЗП), что несколько увеличивало вычислительные затраты. .Поскольку нет конкретной информации о характере окружающей среды, применимой ко всем случаям (это может быть вакуум, вода, минеральные поверхности, липидный бислой в зависимости от случая), диэлектрическая проницаемость была принята равной единице. (Указано [20], что во всех опытах Миллера и последующих попытках их повторения в других условиях не учитывались геохимические условия). Из выходных данных B3LYP были извлечены энергии DFT ( dften ) и дипольные моменты ( dipm ) для каждого соединения.Эти переменные обобщают различные электронные атрибуты молекул: dipm — это суммарный дипольный момент молекулы. Дипольные моменты обычно разделяются по трем основным осям момента инерции молекулы, но, поскольку нет общего способа выровнять все молекулы (если такое выравнивание существует, то это точно направление этого результирующего дипольного вектора), В данной работе допустимо использовать величину этого вектора как меру полярности. Энергия DFT молекулы, dften , сильно коррелирует со сложностью и молекулярной массой (см.
.Поскольку нет конкретной информации о характере окружающей среды, применимой ко всем случаям (это может быть вакуум, вода, минеральные поверхности, липидный бислой в зависимости от случая), диэлектрическая проницаемость была принята равной единице. (Указано [20], что во всех опытах Миллера и последующих попытках их повторения в других условиях не учитывались геохимические условия). Из выходных данных B3LYP были извлечены энергии DFT ( dften ) и дипольные моменты ( dipm ) для каждого соединения.Эти переменные обобщают различные электронные атрибуты молекул: dipm — это суммарный дипольный момент молекулы. Дипольные моменты обычно разделяются по трем основным осям момента инерции молекулы, но, поскольку нет общего способа выровнять все молекулы (если такое выравнивание существует, то это точно направление этого результирующего дипольного вектора), В данной работе допустимо использовать величину этого вектора как меру полярности. Энергия DFT молекулы, dften , сильно коррелирует со сложностью и молекулярной массой (см.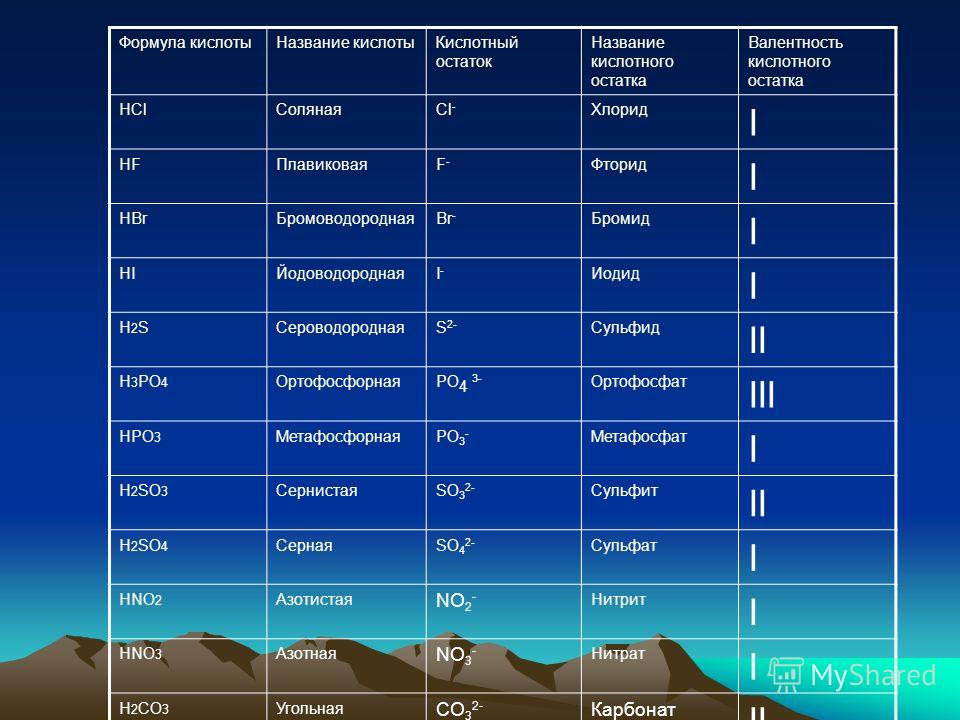 рис. 1 ), как и следовало ожидать.
рис. 1 ), как и следовало ожидать.
( cmplx в S1–S5 Таблицы и Рис. 2–4 ) на основе данных энтропии Шеннона с использованием ранее опубликованного алгоритма [24] проводились, как описано ранее [7,8]. Этот метод собирает важную информацию о молекулярной структуре, включая количество и типы атомов, их связность, количество кратных связей и хиральность. Вопрос о «типах атомов» нуждается в некотором разъяснении: замена одного гетероатома другим гетероатомом сама по себе не меняет сложности в соответствии с этим методом оценки.Пример: селеноцистеин имеет тот же балл, что и цистеин. Но в действительности селеноаналоги синтезировать гораздо труднее, и они электронно намного сложнее (см. приведенные выше замечания о квантово-химических расчетах). По этим причинам они почти наверняка «прибудут позже».
В дополнение к этой метрике сложности была пересмотрена гораздо более ранняя методология, парахор ( prchr в S1–S5 , таблицы и , рис.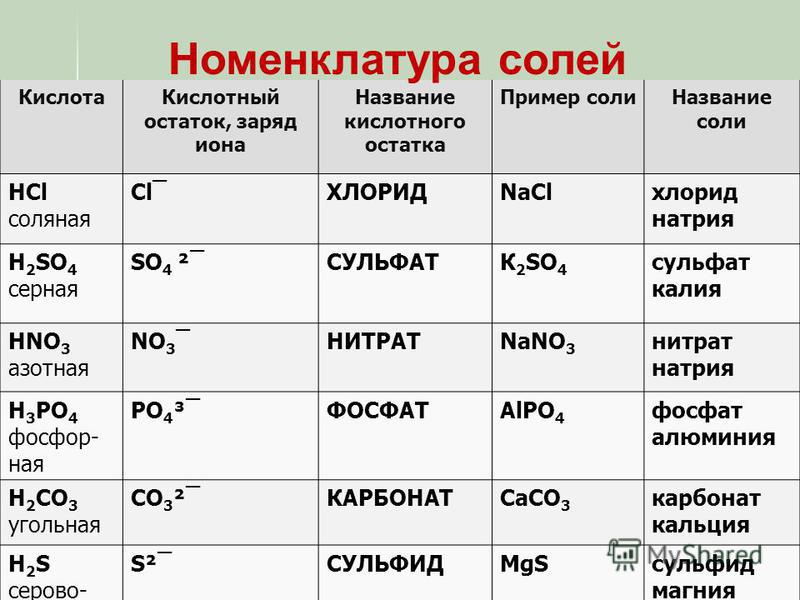 2–4 ), которая основана на вкладе в поверхностное натяжение составляющих молекулярных фрагментов. 25] и набраны для этого исследования.Это произошло потому, что это было сочтено способом обогатить статистическую обработку, что на практике оказалось так (см. ниже). В качестве еще одного дополнения к приведенным выше расчетам сложности, данные о сложности по Колмогорову, полученные из строк дескриптора SMILES, были получены с использованием bzip2 в качестве алгоритма сжатия [26,27]. Эти баллы обозначаются как smlx . Липофильность ( logp ) определяли с помощью программы ALOGPS2.1 [28] (http://www.vcclab.org/lab/alogps/).
2–4 ), которая основана на вкладе в поверхностное натяжение составляющих молекулярных фрагментов. 25] и набраны для этого исследования.Это произошло потому, что это было сочтено способом обогатить статистическую обработку, что на практике оказалось так (см. ниже). В качестве еще одного дополнения к приведенным выше расчетам сложности, данные о сложности по Колмогорову, полученные из строк дескриптора SMILES, были получены с использованием bzip2 в качестве алгоритма сжатия [26,27]. Эти баллы обозначаются как smlx . Липофильность ( logp ) определяли с помощью программы ALOGPS2.1 [28] (http://www.vcclab.org/lab/alogps/).
Существует богатая традиция статистических исследований свойств аминокислот, начиная с основополагающей работы [29], которая привела к разработке программного обеспечения Sigma для этой цели. В этой работе программа R (R Development Core Team, 2008) использовалась для всех статистических вычислений и графиков (см. , рис. 1–4, и S1–S5, , таблицы ).
1–4, и S1–S5, , таблицы ).
Результаты
Все данные для всех 58 соединений показаны в таблицах S1–S5. Порядок в этом списке:
- ➢.Группа 1 (синяя / номера: 1–30) нестандартные аминокислоты и непептидогенные аналоги, обнаруженные либо в наборах Мерчисона ( mrchsn ), либо в наборах Миллера ( mllr ),
- ➢. Группа 2 (зеленые / номера: 31–42): члены канонического набора, которые наблюдались либо на метеорите Мерчисон, либо в эксперименте Миллера, 90 515
- ➢. Группа 3 (красный / №: 43–50) члены канонического набора, которые не наблюдались в этих наборах, но сохранились,
- ➢. Группа 4 (пурпурный / ном.: 51–54) аминокислоты, которые не учитывались при разработке первоначального генетического кода, но теперь известно, что они присутствуют у многих видов во всех трех сферах жизни. Это пирролизин (стандартная аббревиатура O, кодируемая стоп-кодоном UAG). селеноцистеин (стандартная аббревиатура U, кодируется как UGA, другой стоп-кодон) и селенометионин (не кодируется, но продуцируется ферментативно и здесь обозначается аббревиатурой J).
 В этот набор включен гомоселеноцистеин, который не встречается в природе (называемый здесь гомоU).Члены этой группы не были обнаружены на метеоритах или в экспериментах типа Миллера. Все они, вероятно, являются «постРНК», за исключением homoU, который не был обнаружен/описан.
В этот набор включен гомоселеноцистеин, который не встречается в природе (называемый здесь гомоU).Члены этой группы не были обнаружены на метеоритах или в экспериментах типа Миллера. Все они, вероятно, являются «постРНК», за исключением homoU, который не был обнаружен/описан. - ➢. Группа 5 (оранжевые/номера: 55–58) полностью вымышленный набор аминокислот, предназначенный для изучения неисследованных областей «функционального пространства».
Даже беглое изучение данных показывает, что то, что характеризует многих членов группы 3, помимо остальных, — это более высокие показатели сложности ( cmplx ) по сравнению с группой 2.Это было замечено и прокомментировано ранее [8]. Примечательно, что D (соединение № 41) и E (№ 42) присутствуют в группе 2, но их амиды N (№ 44) и Q (№ 45) соответственно появляются первыми в группе 3. Сложность данные не объясняют этого и не объясняют, почему гомоцистеин (не встречающийся в белках) присутствует в группе 1, в то время как его более простой «канонический» родственный цистеин появляется первым в группе 3. Эти наблюдения предполагают, что действуют другие факторы, такие как можно увидеть на рисунках, как показано ниже.Нет прямого объяснения, почему гомоцистеин (соединение № 2) появляется более заметно по сравнению с его низшим гомологом цистеином (№ 43), но ответ может заключаться в функциональных потребностях, которые диктуют выбор ротамерной структуры (обсуждается ниже). Также может быть аспект стабильности/истощения: цистеин может образовываться в больших количествах, но он более чувствителен к деградации, чем гомоцистеин.
Эти наблюдения предполагают, что действуют другие факторы, такие как можно увидеть на рисунках, как показано ниже.Нет прямого объяснения, почему гомоцистеин (соединение № 2) появляется более заметно по сравнению с его низшим гомологом цистеином (№ 43), но ответ может заключаться в функциональных потребностях, которые диктуют выбор ротамерной структуры (обсуждается ниже). Также может быть аспект стабильности/истощения: цистеин может образовываться в больших количествах, но он более чувствителен к деградации, чем гомоцистеин.
Рис. 1 показывает парные корреляции между различными структурными и квантовыми химическими переменными, статистическими нагрузками ( CMPLX , PRCHR , DIPM , DFTEN , LOGP , MLLR , MRCHSN , mw и smlx , как указано выше).Хорошие корреляции четко наблюдаются для cmplx , prchr с mw и между cmplx и prchr , хотя эти методы оценки сложности имеют совершенно другое происхождение. C показатель сложности smlx скорее антикоррелирует с cmplx , prchr и mw . Это связано с тем, что струны SMILES уже очень компактны и состоят из линейных струн, в которые проецируются трехмерные хиральные и гетероатомные структуры.Длина и содержание этих строк действительно отражают размер молекулы и, конечно же, сложность, и алгоритм сжатия передает меру этой сложности.
C показатель сложности smlx скорее антикоррелирует с cmplx , prchr и mw . Это связано с тем, что струны SMILES уже очень компактны и состоят из линейных струн, в которые проецируются трехмерные хиральные и гетероатомные структуры.Длина и содержание этих строк действительно отражают размер молекулы и, конечно же, сложность, и алгоритм сжатия передает меру этой сложности.
Переменные dipm и dften , полученные из ab initio квантово-химических расчетов, как описано выше, по-разному коррелируют с mw , в частности: dipm почти полностью инвариантна по отношению к mw , тогда как или менее линейно зависимы (молекулярная масса по самой своей природе подразумевает большую внутреннюю энергию).(см. , рис. 1 ).
На рис. 2 показаны результаты первого анализа PCA. Здесь наблюдается очень четкое объединение трех групп. Группа 3 (красный цвет, №№ 43–50 в таблице S3 ) наиболее отчетлива и характеризуется большими отрицательными значениями компонента 1. В этом компоненте преобладают cmplx , mw , prchr и dften . Наряду с компонентом 2 члены группы 3 находятся в промежуточном диапазоне, особенно избегая сильной липофильности ( logp ).Как правило, Группа 2 (номера 31–42, S2 Таблица ) объединяется с более низкими степенями сложности (более высокие значения Компонента 1) и несколько перекрывает кластер Группы 1 (синий). Последнее понятно, учитывая, что группа 1 состоит в основном из изомеров или близких аналогов аминокислот класса 2. Два выброса, №. 31 и 32 — аминокислоты глицин и аланин соответственно. Они являются структурно простейшими членами группы и могут рассматриваться как родители всех членов групп 2, 3 и 4 и «настоящих» аминокислот в группе 1.Они были наиболее распространены как в mllr , так и в mrchsn , и такие простые соединения, вероятно, можно найти почти где угодно в межзвездном пространстве. Два других выброса группы 2 №. 41 и 42 представляют собой аспарагиновую и глутаминовую кислоты соответственно, обе высокополярные, и они удовлетворяют потребности всех образующихся впоследствии белков в обеспечении кислотной функции в их боковых цепях.
В этом компоненте преобладают cmplx , mw , prchr и dften . Наряду с компонентом 2 члены группы 3 находятся в промежуточном диапазоне, особенно избегая сильной липофильности ( logp ).Как правило, Группа 2 (номера 31–42, S2 Таблица ) объединяется с более низкими степенями сложности (более высокие значения Компонента 1) и несколько перекрывает кластер Группы 1 (синий). Последнее понятно, учитывая, что группа 1 состоит в основном из изомеров или близких аналогов аминокислот класса 2. Два выброса, №. 31 и 32 — аминокислоты глицин и аланин соответственно. Они являются структурно простейшими членами группы и могут рассматриваться как родители всех членов групп 2, 3 и 4 и «настоящих» аминокислот в группе 1.Они были наиболее распространены как в mllr , так и в mrchsn , и такие простые соединения, вероятно, можно найти почти где угодно в межзвездном пространстве. Два других выброса группы 2 №. 41 и 42 представляют собой аспарагиновую и глутаминовую кислоты соответственно, обе высокополярные, и они удовлетворяют потребности всех образующихся впоследствии белков в обеспечении кислотной функции в их боковых цепях. Также очень важна, особенно для аспартата, способность связывать ионы металлов, чтобы обеспечить каталитические центры.
Также очень важна, особенно для аспартата, способность связывать ионы металлов, чтобы обеспечить каталитические центры.
Группа 2 и Группа 3 вместе представляют то, что «выжило», канонический набор типов аминокислот, которые мы имеем сегодня. Но они разные, кажется, что каждый из них находится по разные стороны «разделения». Группа 2 смешивается с Группой 1, и эти два набора обнаруживаются в межзвездном пространстве, на метеоритах ( mchlsn ) или в лабораторных экспериментах ( mllr ), тогда как для Группы 3 фактор, который, по-видимому, проявляется как наиболее важным для их появления представляется сложность в общем смысле.Более конкретно: cmplx , prchr и smlx служат для «растягивания» ( рис. 2 ) членов всех трех групп вдоль оси Компонента 1, главной характеристикой которого является явно молекулярная сложность. Это сложность, за которую приходится «платить», чтобы выполнять требуемые функции. В силу этих результатов были бы все основания изучать эти различные меры сложности и в других контекстах. Возможно, даже у почти полностью забытого парахора есть будущее.
Возможно, даже у почти полностью забытого парахора есть будущее.
Здесь представлены еще два результата. Во-первых, адекватно ли для задачи покрытие функционального пространства каноническим набором из 20 типов аминокислот. Ясно, что это так, как рассудили апостериори . Как только эти остатки включены в белки, необходимо выполнить дополнительные функциональные требования (в частности, катализ). Это достигается за счет посттрансляционных модификаций. Для правильной укладки самого белка требуется ряд типов остатков с липофильными боковыми цепями как алифатического, так и ароматического типа.Но нет необходимости впадать в крайности, как в вымышленном соединении 55 или соединении Миллера (но не Мерчисона) 14. Эти крайние типы остатков не используются. Не являются «альтернативами» положительно заряженные остатки лизина/аригинина (соединения 56 и 57) или отрицательно заряженные остатки аспартата/глутамата (соединение 58). Распределение этих нестандартных «типов остатков» показано оранжевым цветом на рис. 2 . Но есть типы остатков, ранее не входящие в «канонический набор», которые используются, и их нужно учитывать.Хотя нет никаких доказательств того, что они играли какую-либо роль в пребиотической химической эволюции или самой OoL, сегодня они, безусловно, играют значительную роль. Они образуют группу 4 и включены в первый график PCA. Все три проявляются как выбросы, окрашенные в пурпурный цвет: 51 (пирролизин) и 52–54 (селеносоединения). Первые обязаны своей высокой сложностью присутствию трех хиральных центров, в то время как селеносоединения обязаны своим положением простому факту, что селен заменил серу — электронная энергия ( dften ) и молекулярная масса ( mw ) соответственно выше.
2 . Но есть типы остатков, ранее не входящие в «канонический набор», которые используются, и их нужно учитывать.Хотя нет никаких доказательств того, что они играли какую-либо роль в пребиотической химической эволюции или самой OoL, сегодня они, безусловно, играют значительную роль. Они образуют группу 4 и включены в первый график PCA. Все три проявляются как выбросы, окрашенные в пурпурный цвет: 51 (пирролизин) и 52–54 (селеносоединения). Первые обязаны своей высокой сложностью присутствию трех хиральных центров, в то время как селеносоединения обязаны своим положением простому факту, что селен заменил серу — электронная энергия ( dften ) и молекулярная масса ( mw ) соответственно выше.
Разделение и кластеризация, наблюдаемые в группах 1, 2 и 3, становятся более четкими, когда удаляются выбросы пирролизина и селеносоединений, как показано на рис. 3 .
Наконец, был сделан график, чтобы посмотреть, к каким последствиям приведет исключение млр и мрчсн , чтобы развеять любые возражения, что они каким-то образом искажают результат. Этот график показан на рис. 4 . Есть некоторая локальная взаимная перетасовка точек в сюжете, но она никак не нарушается.На самом деле, какое бы «предвзятое отношение» ни вносили mllr и mrchsn , оно необходимо для этого анализа, потому что первое отражает экспериментальные данные, а второе представляет реальные события из межзвездного пространства.
Этот график показан на рис. 4 . Есть некоторая локальная взаимная перетасовка точек в сюжете, но она никак не нарушается.На самом деле, какое бы «предвзятое отношение» ни вносили mllr и mrchsn , оно необходимо для этого анализа, потому что первое отражает экспериментальные данные, а второе представляет реальные события из межзвездного пространства.
Чтобы установить отображение панели соединений в химическое пространство, был изучен очень полный и разнообразный набор параметров ( mw , cmplx , smlx , prchr , dften , dipm ) логп , мллр и мрчсн ).Из этих cmplx был выделен как важный и, вероятно, является основным компонентом первого основного компонента на графиках PCA рис. 2 и 3 . Сложность является атрибутом молекулярной структуры, но она также является основной причиной других атрибутов: способности вообще быть синтезированным [7] и допускать более широкий спектр химических функций.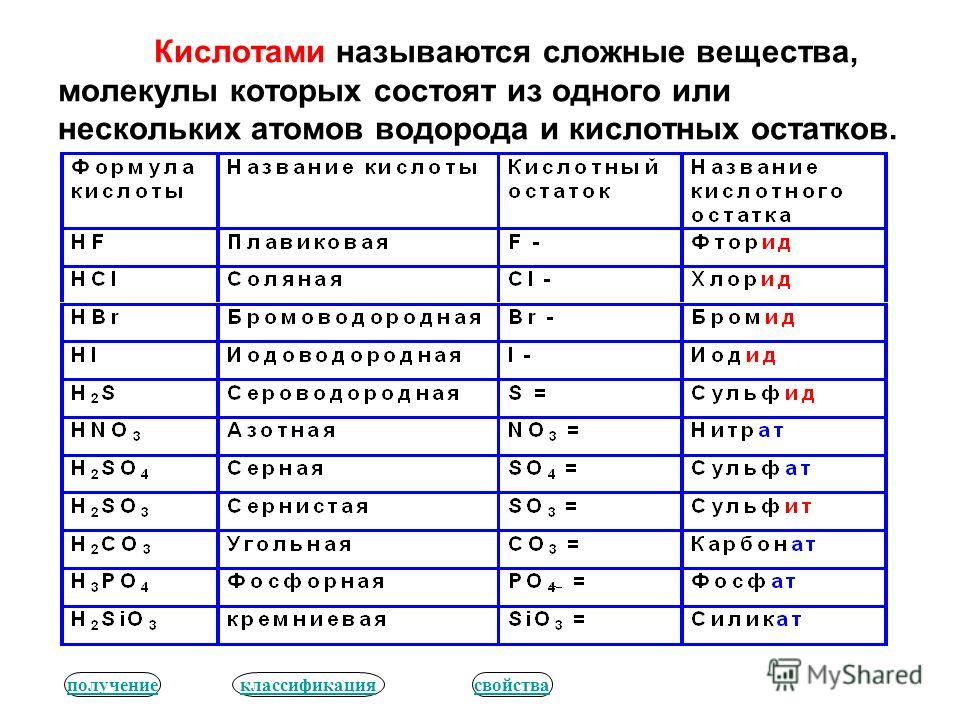 Таким образом, это также может рассматриваться как фактор стоимости. Чтобы прояснить этот момент, был построен новый график, на котором cmplx были опущены как отдельный параметр, а вместо этого каждый оставшийся параметр был разделен на соответствующее значение для cmplx .Это дает нормализованную версию двух предыдущих графиков, что позволяет больше акцентировать внимание на влиянии оставшихся атрибутов.
Таким образом, это также может рассматриваться как фактор стоимости. Чтобы прояснить этот момент, был построен новый график, на котором cmplx были опущены как отдельный параметр, а вместо этого каждый оставшийся параметр был разделен на соответствующее значение для cmplx .Это дает нормализованную версию двух предыдущих графиков, что позволяет больше акцентировать внимание на влиянии оставшихся атрибутов.
Как показано на Рис. 4 Группы 1 и 2 очень сильно взаимно перекрываются, как и Группы 3 и 4, но теперь между этими двумя созвездиями существует очень четкое разделение («разделение», упомянутое выше). Это говорит о том, что существует реальное разделение между подмножествами соединений, которые, как известно, появляются в космосе, и теми, которые известны только в земной среде.Это не означает, что они обязательно являются продуктами биосинтеза — как раз наоборот, как обсуждается ниже. Но это подтверждает идею о том, что существуют определенные физические особенности планеты Земля (и, возможно, некоторых экзопланет), которые способствуют производству этих более сложных соединений.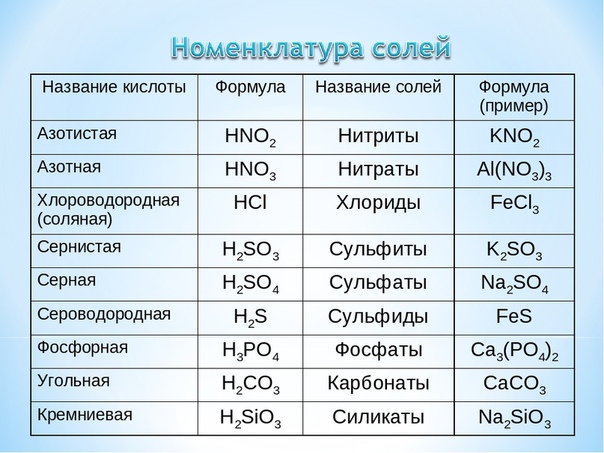 Некоторые новые особенности графика Рис. 4 требуют комментариев и пояснений: Соединение 43 (цистеин) теперь появляется в кластере, образованном «простыми» группами 1 и 2. такой же, как у серина (а его «показатель синтезируемости» даже ниже, чем у серина [7]).Соединения 41 и 42, принадлежащие к группе 2, теперь переместились в кластер группы 3 + 4. Аминокислоты, аспарагиновая кислота и аспарагин, были отнесены к группе 2 на основании их сильного присутствия в mrchsn и mllr , но их комплексность и оценка способности к синтезу поставили их на границу между группами 2 и 3.
Некоторые новые особенности графика Рис. 4 требуют комментариев и пояснений: Соединение 43 (цистеин) теперь появляется в кластере, образованном «простыми» группами 1 и 2. такой же, как у серина (а его «показатель синтезируемости» даже ниже, чем у серина [7]).Соединения 41 и 42, принадлежащие к группе 2, теперь переместились в кластер группы 3 + 4. Аминокислоты, аспарагиновая кислота и аспарагин, были отнесены к группе 2 на основании их сильного присутствия в mrchsn и mllr , но их комплексность и оценка способности к синтезу поставили их на границу между группами 2 и 3.
Подводя итог, На рис. 2–4 показано, как аминокислоты (группа 2 (зеленые) соединения 31–42 и группа 3 (красные) 43–50) распределяются по отношению к другим пребиотическим соединениям (группа 1 (синий) 1– 30).Многофакторный анализ выявил две основные ортогональные переменные, компонент 1, который четко выражает сложность (как определено в совокупности переменными cmplx , prchr , smlx , mldx , а также prchr и dftn , в то время как компонент 2 в равной степени определяется как prchr и dftn имеет характер гидрофобности против полярности (ранее предложено Higgs and Pudritz, 2009), о чем свидетельствует направление векторов logp и dipm . Группа 2 имеет непересекающееся распределение, где A (32) и G (31) расположены отдельно от основной группы, как уже упоминалось. Они небольшие (низкая сложность) и почти полностью лишены гидрофобного характера ( logp ). Другой набор выбросов, D (41) и E (42), имеет чрезвычайно полярный характер. В остальном группа 2 занимает центральное место, частично перекрываясь с группой 1, но в основном распределена в сторону большей сложности по сравнению с группой 1. Простейшие в функциональном отношении пептидные структуры могут образовываться спонтанно из аминокислот этой группы (особенно трансмембранные пептиды [7]).Позже, когда появятся более сложные типы аминокислот группы 3, они тоже могут быть включены в пептиды и, в конечном счете, в белки. Они распределены по спектру гидрофобности/полярности (компонент 2) по мере необходимости, а их большая сложность отражает потребность в еще более высоких функциональных требованиях.
Группа 2 имеет непересекающееся распределение, где A (32) и G (31) расположены отдельно от основной группы, как уже упоминалось. Они небольшие (низкая сложность) и почти полностью лишены гидрофобного характера ( logp ). Другой набор выбросов, D (41) и E (42), имеет чрезвычайно полярный характер. В остальном группа 2 занимает центральное место, частично перекрываясь с группой 1, но в основном распределена в сторону большей сложности по сравнению с группой 1. Простейшие в функциональном отношении пептидные структуры могут образовываться спонтанно из аминокислот этой группы (особенно трансмембранные пептиды [7]).Позже, когда появятся более сложные типы аминокислот группы 3, они тоже могут быть включены в пептиды и, в конечном счете, в белки. Они распределены по спектру гидрофобности/полярности (компонент 2) по мере необходимости, а их большая сложность отражает потребность в еще более высоких функциональных требованиях.
Последнее замечание, относящееся к разделу Результаты , заключается в том, чтобы отметить совпадения между сериновыми номерами. 34 и его изомер №. 30, лейцин нет. 36 и его гомолог, ни лейцин №.20 и валин нет. 33 и его изомеров нет. 19 и 29. Также заметна тесная близость между цистеиновым номером. 43 и его гомолога гомоцистеина №. 2 и аналогично между серином №. 34 и его гомолога гомоцистеина №. 1. Нет немедленного объяснения со стороны сложности (например): гомоцистеин был обнаружен в mllr , а синтетически более простой цистеин — нет. Это обсуждалось выше. Одна из причин этого может быть связана с доступной/требуемой структурой ротамера (обсуждается ниже) или, альтернативно, со стабильностью и/или скоростью истирания.Ситуация в отношении аналогичных соединений селена вполне может быть аналогичной.
34 и его изомер №. 30, лейцин нет. 36 и его гомолог, ни лейцин №.20 и валин нет. 33 и его изомеров нет. 19 и 29. Также заметна тесная близость между цистеиновым номером. 43 и его гомолога гомоцистеина №. 2 и аналогично между серином №. 34 и его гомолога гомоцистеина №. 1. Нет немедленного объяснения со стороны сложности (например): гомоцистеин был обнаружен в mllr , а синтетически более простой цистеин — нет. Это обсуждалось выше. Одна из причин этого может быть связана с доступной/требуемой структурой ротамера (обсуждается ниже) или, альтернативно, со стабильностью и/или скоростью истирания.Ситуация в отношении аналогичных соединений селена вполне может быть аналогичной.
Обсуждение
Утверждение здесь состоит в том, что настоящий анализ служит объяснением того, почему набор из 20 встречающихся в настоящее время в природе типов аминокислотных остатков, канонический набор, имеет свое особое членство. Тем или иным образом, по-видимому, необходимо включить достаточную сложность (сопутствующую и указывающую на необходимость сохранения важных химических функций), но при этом необходимо оставаться в пределах стабильной и синтетически доступной структурной основы. Сложность почти наверняка сильно коррелирует со склонностью к молекулярному распознаванию, что имеет решающее значение для фолдинга и функционирования белков. Необходимы лишь очень немногие высокополярные остатки ( дипм ), аспартат и глутамат, упомянутые выше, и нет. 47 аргинин. Нет необходимости в каких-либо дополнительных заряженных остатках типа, сознательно сконструированного автором для проверки границ того, что уместно и необходимо (№№ 56–58 или подобные). Существует тенденция избегать слишком высокой липофильности ( logp ), которая в любом случае может вызвать проблемы с растворимостью и избыточностью, упомянутые выше.Ароматичность уже адекватно обеспечивается фенилаланином (нет необходимости, например, в № 55 или ему подобном). Были предприняты все усилия для изучения расширенного репертуара «структурного пространства аминокислот», но не было обнаружено никаких новых или полезных функций. В каноническом наборе существует достаточный баланс между двумя крайностями полярности и липофильности (/ароматичности).
Сложность почти наверняка сильно коррелирует со склонностью к молекулярному распознаванию, что имеет решающее значение для фолдинга и функционирования белков. Необходимы лишь очень немногие высокополярные остатки ( дипм ), аспартат и глутамат, упомянутые выше, и нет. 47 аргинин. Нет необходимости в каких-либо дополнительных заряженных остатках типа, сознательно сконструированного автором для проверки границ того, что уместно и необходимо (№№ 56–58 или подобные). Существует тенденция избегать слишком высокой липофильности ( logp ), которая в любом случае может вызвать проблемы с растворимостью и избыточностью, упомянутые выше.Ароматичность уже адекватно обеспечивается фенилаланином (нет необходимости, например, в № 55 или ему подобном). Были предприняты все усилия для изучения расширенного репертуара «структурного пространства аминокислот», но не было обнаружено никаких новых или полезных функций. В каноническом наборе существует достаточный баланс между двумя крайностями полярности и липофильности (/ароматичности). Здесь действует не только намек на «принцип Златовласки». Понятие экономичности в терминах нетребования использования большей популяции строительных блоков, чем это строго необходимо, вполне может быть применимо здесь, как и во всей природе.
Здесь действует не только намек на «принцип Златовласки». Понятие экономичности в терминах нетребования использования большей популяции строительных блоков, чем это строго необходимо, вполне может быть применимо здесь, как и во всей природе.
Однако существует два основных подмножества типов аминокислотных остатков, группа 2 ( mrchsn / mllr , набор из 12) и группа 3 (оставшиеся 8, появившиеся позже в OoL), которые различаются по характеру. Для группы 3 сложность, по-видимому, является доминирующим фактором, и эта сложность может быть просто слишком велика, чтобы позволить их производство в суровых условиях космоса или в лабораторной посуде в экстремальных условиях. В контексте OoL было выдвинуто и убедительно обсуждено представление о том, что для производства этой последней группы типов остатков необходимы особые условия, включающие воду, приливы, катализ и циклы пиролиза (Bywater, 2012).Это разделение между Группой 3 и Группами 1 и 2 («разделение», упомянутое выше) напоминает о другой межфазной области, обсуждаемой в этой статье: представление о том, что пляжи служили субстратом для возникновения этих событий [30].![]() Следует также упомянуть о других предложениях, включая подводные гидротермальные источники или доставку из космоса [6], также обсуждавшуюся в [30].
Следует также упомянуть о других предложениях, включая подводные гидротермальные источники или доставку из космоса [6], также обсуждавшуюся в [30].
Возникает закономерный вопрос: почему именно 20? Этот вопрос действительно уже ставился ранее [16].Стандартный аппарат для живых систем, основанный на ДНК, обслуживает 64 возможных типа аминокислот. Но, конечно, любой «язык» нуждается не только в составляющих его «буквах»; пунктуация тоже важна. Стоп и старт кодоны, на языке ДНК. Итак, предположим, что из 64 кодонов, которыми нас снабжает ДНК, 61 «кодоновый продукт» отвечает за все структурные и функциональные потребности транслируемых и полноценных белков. Но белковый мир не принял предложение иметь 61 альтернативу.Считалось (очень рано), что 20 достаточно. Почему? Одним из ключей к решению этой головоломки является то, что для каждой молекулы с заданной структурой и с определенным набором химических функций существует смысл, в котором энергетически хорошо разделенные конформеры любой данной молекулы, особенно в окружении хорошо упакованные белковые структуры, могут рассматриваться как отдельные, индивидуальные, молекулярные виды. По крайней мере, для целей функции. Хотя существуют целые базы данных экспериментальных данных о ротамерах боковых цепей, которые скорее «размывают» эти данные [31,32] (для этого есть причины кристаллизации и упаковки ядра, а также экспериментальные ошибки), боковые цепи составляющих аминокислотные остатки действительно демонстрируют такой набор «энергически хорошо разделенных конформеров».Они основаны на классических состояниях ротамеров [33] любой алифатической цепи, конфигурациях гош+, гош- или транс-: http://www.cryst.bbk.ac.uk/PPS95/course/9_quaternary /3_geometry/conform.html
По крайней мере, для целей функции. Хотя существуют целые базы данных экспериментальных данных о ротамерах боковых цепей, которые скорее «размывают» эти данные [31,32] (для этого есть причины кристаллизации и упаковки ядра, а также экспериментальные ошибки), боковые цепи составляющих аминокислотные остатки действительно демонстрируют такой набор «энергически хорошо разделенных конформеров».Они основаны на классических состояниях ротамеров [33] любой алифатической цепи, конфигурациях гош+, гош- или транс-: http://www.cryst.bbk.ac.uk/PPS95/course/9_quaternary /3_geometry/conform.html
Этот тип модели использовался для построения теоретических библиотек ротамеров в прошлом. Первый из них [34] пришел к следующим выводам: «17 из 20 аминокислот (исключая Met, Lys и Arg) могут быть адекватно представлены 67 ротамерами боковых цепей», а в другом исследовании [35] количество Динамический кластерный анализ большой базы данных известных кристаллографических структур показал, что состояния ротамеров составляют ~ 109, но если отбросить состояния с заполненностью менее 10%, число снизится до 59. Даже «сглаженная» база данных [32] показывает отчетливую картину с 53 минимумами всего, как показано в данных гистограммы для торсионного угла χ-1. Таким образом, мы, кажется, заключаем в скобки это «желаемое число» 61. Если это желаемое число. Это означает, что в коде перевода есть некоторая избыточность, о которой мы прекрасно знаем. Необходимость заселять различные энергетически взаимодоступные, но эффективно различные ротамерные состояния по функциональным причинам и причинам упаковки, а также способность членов канонического набора делать это могли бы устранить необходимость наличия более 20 типов остатков.Здесь необходимо пояснить, что, хотя данный тип аминокислоты или любое химическое соединение в этом отношении имеет уникальную идентичность, на функциональном уровне соединение может иметь множество идентичностей с очень разными электронными, стерическими, распознаваемыми/аффинными и, конечно же, биологические свойства зависят от ротамерных состояний, особенно если они заморожены или ограничены, как в случае с аминокислотами в белках.
Даже «сглаженная» база данных [32] показывает отчетливую картину с 53 минимумами всего, как показано в данных гистограммы для торсионного угла χ-1. Таким образом, мы, кажется, заключаем в скобки это «желаемое число» 61. Если это желаемое число. Это означает, что в коде перевода есть некоторая избыточность, о которой мы прекрасно знаем. Необходимость заселять различные энергетически взаимодоступные, но эффективно различные ротамерные состояния по функциональным причинам и причинам упаковки, а также способность членов канонического набора делать это могли бы устранить необходимость наличия более 20 типов остатков.Здесь необходимо пояснить, что, хотя данный тип аминокислоты или любое химическое соединение в этом отношении имеет уникальную идентичность, на функциональном уровне соединение может иметь множество идентичностей с очень разными электронными, стерическими, распознаваемыми/аффинными и, конечно же, биологические свойства зависят от ротамерных состояний, особенно если они заморожены или ограничены, как в случае с аминокислотами в белках. Кстати, это может быть объяснением выбора, упомянутого в конце результатов : серин вместо гомосерина, цистеин перед гомоцистеином, валин и лейцин вместо их изомеров.Эти альтернативные молекулярные схемы просто не предлагали требуемого функционального репертуара. В конце концов, функция является решающим фактором в эволюции.
Кстати, это может быть объяснением выбора, упомянутого в конце результатов : серин вместо гомосерина, цистеин перед гомоцистеином, валин и лейцин вместо их изомеров.Эти альтернативные молекулярные схемы просто не предлагали требуемого функционального репертуара. В конце концов, функция является решающим фактором в эволюции.
Кроме того, могло быть больше «канонических 20» типов аминокислот, которые стали главными претендентами (для создания функциональных пептидов и белков). Эти «дополнительные» типы аминокислот могли когда-то использоваться для выполнения определенной роли с помощью того или иного ротамера и, следовательно, могут иметь отдельные кодоны. Но если бы потом оказалось, что эту функцию могла бы удовлетворительно выполнять другая (более простая) аминокислота в подходящем ротамерном состоянии, то «лишняя» могла бы стать «лишней».У нас нет записей об этом, и в любом случае вполне возможно, что такое отбраковывание расходуемых структур могло с таким же успехом происходить в пребиотических условиях и, вероятно, происходило в свете предложенной ранее протоклеточной модели [7,8].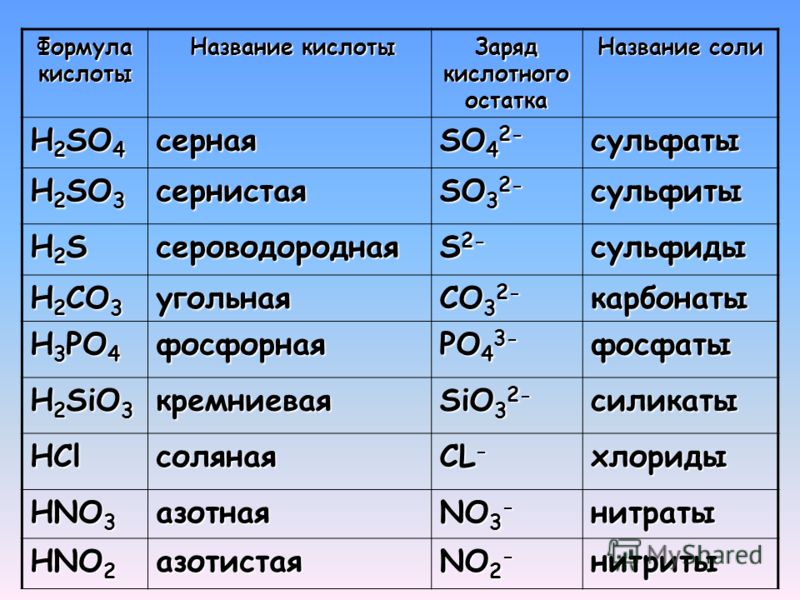 Так что, опять же, нет необходимости задействовать биохимические механизмы (белки, РНК) в этом процессе.
Так что, опять же, нет необходимости задействовать биохимические механизмы (белки, РНК) в этом процессе.
Объяснение избыточности кодонов, представленное здесь, является новым, но необходимость предоставления некоторого/какого-либо объяснения отнюдь не нова. Согласно более ранним аргументам по этому вопросу, может быть множество других причин для необходимости или просто для оппортунистического использования этой избыточности.К ним относятся вопрос о том, влияет ли на локальный процесс фолдинга белка использование синонимичных кодонов (подробно обсуждается в другом месте [27]), предположения типа «генетический код конструируется для ограничения ошибок в продукции белка» или это связано с такие элементы, как поступательная пауза, скорость роста микроорганизмов или множество других объяснений, основанных на теории эволюции. Представление о существовании некоего «второго сообщения», закодированного в последовательности ДНК, выдвигалось много раз, но единого мнения так и не было достигнуто. Всякий раз, когда такие альтернативы выносятся на обсуждение, полезно ссылаться на хорошо зарекомендовавший себя принцип Оккама: самое простое объяснение следует в первую очередь предпочесть более сложным. Все 20 типов аминокислот существовали до появления РНК и использовались в синтезе олигопептидов [36], где можно было бы использовать различные состояния ротамеров. Таким образом, самым простым объяснением может быть то, что различные состояния ротамеров уже выполняли различные функции до появления кодонов.Предпринятая здесь работа предполагает, что какой бы выбор ни был сделан, он определялся функциональными преимуществами, которые благодаря этому стали доступными, а окончательное решение было продиктовано в соответствии со стандартными эволюционными правилами элиминации/выживания сначала на химическом уровне, а затем на биологическом уровне. параметр.
Всякий раз, когда такие альтернативы выносятся на обсуждение, полезно ссылаться на хорошо зарекомендовавший себя принцип Оккама: самое простое объяснение следует в первую очередь предпочесть более сложным. Все 20 типов аминокислот существовали до появления РНК и использовались в синтезе олигопептидов [36], где можно было бы использовать различные состояния ротамеров. Таким образом, самым простым объяснением может быть то, что различные состояния ротамеров уже выполняли различные функции до появления кодонов.Предпринятая здесь работа предполагает, что какой бы выбор ни был сделан, он определялся функциональными преимуществами, которые благодаря этому стали доступными, а окончательное решение было продиктовано в соответствии со стандартными эволюционными правилами элиминации/выживания сначала на химическом уровне, а затем на биологическом уровне. параметр.
Прежде чем закончить, следует сделать несколько замечаний о том, почему вопрос о пребиотической химической эволюции так важен. Принимая во внимание весь процесс OoL, начиная с ~4,2 млрд лет назад, мы, очевидно, не можем отбрасывать «мир РНК» (начиная с ~3.9 млрд лет назад), но нам обязательно нужно учитывать, что было до этого [8]. Недавний обзор [37] отслеживает прогресс» эволюции и постэволюции системы генетической информации через появление жизни. Основные пройденные этапы включают пребиотический синтез, функциональный отбор РНК по метаболиту, мир РНК, мир пептидированной РНК, коэволюцию генетического кода и биосинтез аминокислот, последний универсальный общий предок, дарвиновскую эволюцию и синтетическую жизнь». Таким образом, обзор делает все возможное, чтобы охватить историю OoL, и охват превосходен в том, что касается периода мира РНК.Но все это подчеркнуто «пост-РНК», как заявлено в названии самой статьи («Возникновение жизни: от функционального отбора РНК к естественному отбору и далее»). Для настоящего обсуждения, которое в основном сосредоточено на добиотическом мире, описанный мир РНК не имеет значения.
Принимая во внимание весь процесс OoL, начиная с ~4,2 млрд лет назад, мы, очевидно, не можем отбрасывать «мир РНК» (начиная с ~3.9 млрд лет назад), но нам обязательно нужно учитывать, что было до этого [8]. Недавний обзор [37] отслеживает прогресс» эволюции и постэволюции системы генетической информации через появление жизни. Основные пройденные этапы включают пребиотический синтез, функциональный отбор РНК по метаболиту, мир РНК, мир пептидированной РНК, коэволюцию генетического кода и биосинтез аминокислот, последний универсальный общий предок, дарвиновскую эволюцию и синтетическую жизнь». Таким образом, обзор делает все возможное, чтобы охватить историю OoL, и охват превосходен в том, что касается периода мира РНК.Но все это подчеркнуто «пост-РНК», как заявлено в названии самой статьи («Возникновение жизни: от функционального отбора РНК к естественному отбору и далее»). Для настоящего обсуждения, которое в основном сосредоточено на добиотическом мире, описанный мир РНК не имеет значения. Автор [37] непреднамеренно признает это, ссылаясь на работу [38], в которой подчеркивается неадекватность мира РНК. Вместо этого предлагается Теория Коэволюции, которая предполагает, что из 20 канонических аминокислот в белковом алфавите G, A, S, D, E, V, L, I, P и T представляют собой аминокислоты фазы 1, которые были получены ранее. окружающей средой, а остальные десять, F, Y, R, H, W, N, Q, K, C и M, представляют собой поздние аминокислоты, полученные в результате биосинтеза, фазы 2.Интересно, что набор типов аминокислот очень похож на найденный автором ранее (Bywater, 2012) на основе расчетов сложности. Был «набор 1», состоящий из G, A, V, S, I, L, C, T, P, K, M и «набор 2» N, Q, D, E, F, R, H, Y , W. Но отличия есть, и отличия эти существенные. В последней схеме N, Q, D и E находятся во втором наборе — это отнесение сделано на основании молекулярной сложности (образование двойных связей «дорого»). Обратите внимание, что последняя схема предусматривает только химическую эволюцию — пребиотический синтез при полном отсутствии ферментов или рибозимов.
Автор [37] непреднамеренно признает это, ссылаясь на работу [38], в которой подчеркивается неадекватность мира РНК. Вместо этого предлагается Теория Коэволюции, которая предполагает, что из 20 канонических аминокислот в белковом алфавите G, A, S, D, E, V, L, I, P и T представляют собой аминокислоты фазы 1, которые были получены ранее. окружающей средой, а остальные десять, F, Y, R, H, W, N, Q, K, C и M, представляют собой поздние аминокислоты, полученные в результате биосинтеза, фазы 2.Интересно, что набор типов аминокислот очень похож на найденный автором ранее (Bywater, 2012) на основе расчетов сложности. Был «набор 1», состоящий из G, A, V, S, I, L, C, T, P, K, M и «набор 2» N, Q, D, E, F, R, H, Y , W. Но отличия есть, и отличия эти существенные. В последней схеме N, Q, D и E находятся во втором наборе — это отнесение сделано на основании молекулярной сложности (образование двойных связей «дорого»). Обратите внимание, что последняя схема предусматривает только химическую эволюцию — пребиотический синтез при полном отсутствии ферментов или рибозимов. В отличие от этого предполагаемое «раннее прибытие» (фаза 1) определяется как пребиотическое, в то время как позднее прибытие (фаза 2) требует биосинтеза (Wong, 2014). Но оснований для такого предположения нет. Например, считается, что для образования цистеина требуется фермент (сложная постРНК-конструкция, для стабильности и функционирования которой наверняка потребуются по крайней мере некоторые типы ароматических остатков («Фаза 2»)), но его близкий родственник серин не нужен. , видимо. Статья изобилует оригинальными монетами, не использовавшимися ранее или где-либо еще, такими как изобретательский биосинтез и претранс-синтез, требующий катализа либо рибозимом, либо ферментом.
В отличие от этого предполагаемое «раннее прибытие» (фаза 1) определяется как пребиотическое, в то время как позднее прибытие (фаза 2) требует биосинтеза (Wong, 2014). Но оснований для такого предположения нет. Например, считается, что для образования цистеина требуется фермент (сложная постРНК-конструкция, для стабильности и функционирования которой наверняка потребуются по крайней мере некоторые типы ароматических остатков («Фаза 2»)), но его близкий родственник серин не нужен. , видимо. Статья изобилует оригинальными монетами, не использовавшимися ранее или где-либо еще, такими как изобретательский биосинтез и претранс-синтез, требующий катализа либо рибозимом, либо ферментом.
Следует признать, что РНК является относительно поздним развитием, а ферменты, безусловно, являются таковыми. Последние построены частично из тех самых типов аминокислот, которые, как говорят, требуют ферментов для их создания. Но нет необходимости прибегать к этим механизмам, чтобы объяснить, как происходила добиотическая химическая эволюция. Просто для производства второго набора потребовалось больше времени, и им, вероятно, понадобилась помощь земных катализаторов. Существует множество катализаторов, необходимых для стимулирования этих синтетических процессов в минеральном мире, например, на пляжах [30].За повторяющимися циклами химического синтеза следовали механизмы сортировки и отбора. Естественный отбор не ограничивается миром (пост)РНК, естественный отбор путем химической эволюции был необходимым и, очевидно, достаточным предварительным условием для самой OoL.
Просто для производства второго набора потребовалось больше времени, и им, вероятно, понадобилась помощь земных катализаторов. Существует множество катализаторов, необходимых для стимулирования этих синтетических процессов в минеральном мире, например, на пляжах [30].За повторяющимися циклами химического синтеза следовали механизмы сортировки и отбора. Естественный отбор не ограничивается миром (пост)РНК, естественный отбор путем химической эволюции был необходимым и, очевидно, достаточным предварительным условием для самой OoL.
Еще один недавний обзор, в котором обсуждается охват химического пространства, утверждает [9], что «Наборы, которые охватывают химическое пространство лучше, чем генетически закодированный алфавит, чрезвычайно редки и энергетически затратны». Это очень хорошо согласуется с выводами настоящего исследования.Кроме того, эти авторы заявили: «Аминокислоты, используемые для конструирования закодированных белков, могут представлять собой в значительной степени глобальный оптимум, так что любая водная биохимия будет использовать очень похожий набор». В этой работе я смог разделить два подмножества аминокислот на примитивное подмножество, которое можно было легко создать в любом месте в пространстве, и более сложное подмножество, которое могло существовать где-то еще (но никогда не было обнаружено), но, скорее всего, могло быть найдено. были созданы тем или иным из вышеупомянутых геологических процессов, подводных жерл и приливных пляжей (как доступных на Земле, так и на экзопланетах, достаточно похожих на Землю).Хотя второе подмножество характеризуется большей сложностью, так что они, скорее всего, требуют какого-то катализа для ускорения их производства, нет необходимости предполагать, что катализаторами были ферменты или рибозимы. Минеральных катализаторов было бы достаточно для этой работы. Таким образом, «любая водная биохимия будет использовать очень похожий набор» можно заменить на «любая водная химия даст очень похожий набор», и все это может происходить пребиотически. Нет необходимости предполагать, что в этом участвовали РНК или ферменты, и действительно, ферменты по требованию должны были бы содержать типы аминокислот, такие как H, Y, W и другие во втором подмножестве.
В этой работе я смог разделить два подмножества аминокислот на примитивное подмножество, которое можно было легко создать в любом месте в пространстве, и более сложное подмножество, которое могло существовать где-то еще (но никогда не было обнаружено), но, скорее всего, могло быть найдено. были созданы тем или иным из вышеупомянутых геологических процессов, подводных жерл и приливных пляжей (как доступных на Земле, так и на экзопланетах, достаточно похожих на Землю).Хотя второе подмножество характеризуется большей сложностью, так что они, скорее всего, требуют какого-то катализа для ускорения их производства, нет необходимости предполагать, что катализаторами были ферменты или рибозимы. Минеральных катализаторов было бы достаточно для этой работы. Таким образом, «любая водная биохимия будет использовать очень похожий набор» можно заменить на «любая водная химия даст очень похожий набор», и все это может происходить пребиотически. Нет необходимости предполагать, что в этом участвовали РНК или ферменты, и действительно, ферменты по требованию должны были бы содержать типы аминокислот, такие как H, Y, W и другие во втором подмножестве.
Подводя итог вышеизложенному: любое предположение о том, что механизм отбора был основан на метаболической эволюции [9] или претранс-синтезе [37], равносильно круговому аргументу — метаболическая эволюция должна была иметь место после того, как были созданы эти типы аминокислот. Вместо этого я предложил пребиотическую химическую эволюцию. Отбор после множественных (мириад) циклов синтеза, деградации, разделения и нового синтеза [7].
Можно было бы включить намного больше аминокислот и аминокислотоподобных соединений, и это действительно было сделано другими, а также в этой работе, но эти результаты не сообщаются.Участки PCA уже очень переполнены, и простое увеличение избыточности не даст никаких преимуществ. Кроме того, как объяснялось выше, химическая эволюция требовала строгой экономии и избегания излишней сложности за счет разветвления цепи, дополнительных хиральных центров и тому подобного. Вместо этого основное внимание было уделено типам соединений, которые, как известно, важны. Четыре гипотетических соединения (№№ 55–58) были включены для того, чтобы исследовать внешнюю оболочку обсуждаемого химического пространства, и действительно, именно там находятся эти соединения, но дальнейшая «инженерия» такого рода не даст большего. .В упомянутой выше работе [9] была изучена гораздо большая библиотека соединений, включающая 1913 соединений. Эти авторы использовали только три дескриптора (размер, гидрофобность и заряд) для разделения этого большого набора. Неясно, как это распределение было распределено в химическом пространстве, за исключением утверждения о «водной биохимии», обсуждавшегося выше, которое предполагало значительную степень конвергенции с тем, что стало каноническими 20. Из этих 20 типов аминокислот 17 обладают побочными свойствами. цепи, которые могут существовать в одном или нескольких различных ротамерных состояниях.В белках, которые имеют определенную степень твердого состояния (в отличие от жидкой или газовой фазы), эти ротамерные состояния следует рассматривать как отдельные индивидуальные молекулярные виды, особенно в отношении свойств узнавания и биологической функции.
Четыре гипотетических соединения (№№ 55–58) были включены для того, чтобы исследовать внешнюю оболочку обсуждаемого химического пространства, и действительно, именно там находятся эти соединения, но дальнейшая «инженерия» такого рода не даст большего. .В упомянутой выше работе [9] была изучена гораздо большая библиотека соединений, включающая 1913 соединений. Эти авторы использовали только три дескриптора (размер, гидрофобность и заряд) для разделения этого большого набора. Неясно, как это распределение было распределено в химическом пространстве, за исключением утверждения о «водной биохимии», обсуждавшегося выше, которое предполагало значительную степень конвергенции с тем, что стало каноническими 20. Из этих 20 типов аминокислот 17 обладают побочными свойствами. цепи, которые могут существовать в одном или нескольких различных ротамерных состояниях.В белках, которые имеют определенную степень твердого состояния (в отличие от жидкой или газовой фазы), эти ротамерные состояния следует рассматривать как отдельные индивидуальные молекулярные виды, особенно в отношении свойств узнавания и биологической функции. Тот факт, что общее число доступных ротамерных состояний для этих 17 видов аминокислот вполне может составлять ~61, является выражением потребности в функциональном репертуаре, необходимом для успешных живых организмов. Таким образом, задолго до появления таких проблем, как вырожденность кода, аминокислоты были стереохимически предрасположены этими ротамерными состояниями для заполнения требуемого функционального пространства (имеющего мощность ~61), используя только канонические 20.Попутно это решает загадку, почему было необходимо (намного позже) существование триплетного кода, как в ДНК. Дуплексный код будет содержать только 16 различных химических видов, что намного меньше ~61, а также меньше 20, которые уже были доступны и позже использовались и были необходимы очень примитивным живым системам.
Выводы
Ключевым моментом, вытекающим из описанной здесь работы, является то, что существует набор фундаментальных физико-химических императивов, которые предбиотически предопределили выбор канонического набора из 20 типов аминокислотных остатков. Предполагается, что руководящий принцип на протяжении всего процесса выбора химических соединений связан с энергией и, прежде всего, основан на экономии, посредством чего сохраняются самые простые возможные структуры, которые имеют ценность с точки зрения функции. Избыточность и ненужная сложность избегаются. Именно это и лежит в основе основного постулата данной работы, выраженного в названии. Утверждение основано на тщательном квантово-химическом и хемоинформатическом исследовании большой группы веществ-кандидатов с последующим статистическим анализом оценки сложности и свойств этих веществ, который идентифицирует наиболее вероятные химические вещества, которые появились пребиотически, в первую очередь 20 типов аминокислот, которые являются все еще с нами.Если бы жизнь могла поддерживаться на платформе, состоящей всего из 16 типов аминокислот, какие из них можно было бы выбросить?
Предполагается, что руководящий принцип на протяжении всего процесса выбора химических соединений связан с энергией и, прежде всего, основан на экономии, посредством чего сохраняются самые простые возможные структуры, которые имеют ценность с точки зрения функции. Избыточность и ненужная сложность избегаются. Именно это и лежит в основе основного постулата данной работы, выраженного в названии. Утверждение основано на тщательном квантово-химическом и хемоинформатическом исследовании большой группы веществ-кандидатов с последующим статистическим анализом оценки сложности и свойств этих веществ, который идентифицирует наиболее вероятные химические вещества, которые появились пребиотически, в первую очередь 20 типов аминокислот, которые являются все еще с нами.Если бы жизнь могла поддерживаться на платформе, состоящей всего из 16 типов аминокислот, какие из них можно было бы выбросить?
Дополнительная информация
Таблица S4. Группа 4: (номера: 51–54) аминокислоты, которые не учитывались при разработке первоначального генетического кода, но которые, как теперь известно, присутствуют у многих видов во всех трех сферах жизни.

Это пирролизин (стандартная аббревиатура O, кодируемая стоп-кодоном UAG). селеноцистеин (стандартная аббревиатура U, кодируется как UGA, другой стоп-кодон) и селенометионин (не кодируется, но продуцируется ферментативно и здесь обозначается аббревиатурой J).В этот набор включен гомоселеноцистеин, который не встречается в природе (называемый здесь гомоU). Члены этой группы не были обнаружены на метеоритах или в экспериментах типа Миллера.
https://doi.org/10.1371/journal.pone.0204883.s004
(DOC)
Благодарности
Выражаем благодарность за предоставление программ моделирования по академической лицензии: В. Верязову (MOLCAS) и Э. Кригеру и Г. Вринду (YASARA). Дж. Бада выражает благодарность за ценные обсуждения и предоставление полезной литературы.Эта работа была начата во время пребывания в должности приглашенного товарищества в Колледже Магдалины в Оксфорде, и автор хотел бы выразить свою благодарность Колледжу за прекрасные условия и атмосферу, в которой велась работа. То же самое и с Институтом Фрэнсиса Крика, где работа была завершена. Несколько коллег, в частности Уилли Тейлор, внесли ценный вклад в структурную биологию. Анонимный рецензент внес ценный вклад в эту статью, предложив включить пирролизин и селеноцистеин.
То же самое и с Институтом Фрэнсиса Крика, где работа была завершена. Несколько коллег, в частности Уилли Тейлор, внесли ценный вклад в структурную биологию. Анонимный рецензент внес ценный вклад в эту статью, предложив включить пирролизин и селеноцистеин.
Каталожные номера
- 1. Миллер С.Л. (1953) Производство аминокислот в возможных примитивных земных условиях. Наука 117: 528–529. пмид:13056598
- 2. Миллер С.Л., Юри Х.К. (1959)Синтез органических соединений на примитивной Земле. Наука 130: 245–251. пмид:13668555
- 3. Оро Дж., Камат С.С. (1961)Синтез аминокислот из цианистого водорода в возможных примитивных земных условиях. Природа 190: 442–443. пмид:13731262
- 4.Reymond JL, Van Deursen R. Blum IC, Ruddigkeit L (2010) Химическое пространство как источник новых лекарств. ChemComm 1: 30–38.
- 5.
Lu Y, Freeland SJ (2008) Количественное исследование химического пространства, окружающего формирование аминокислотного алфавита.
 J Theoret Biol. 250: 349–61 пмид:18005995
J Theoret Biol. 250: 349–61 пмид:18005995 - 6. Хиггс П.Г., Пудриц Р.Э. (2009) Термодинамическая основа синтеза пребиотических аминокислот и природа первого генетического кода. Астробиология 9 (5): 483–490.пмид:19566427
- 7. Байуотер Р.П. (2009)Мембранные пептиды и происхождение жизни. J Theoret Biol. 261: 407–413. пмид:19679140
- 8. Bywater RP (2012) О датировании стадий пребиотической химической эволюции. Naturwissenschaften 99: 167–176. пмид:22349494
- 9. Илардо М., Меринджер М., Фриланд С., Расулев Б., Кливз Х.Дж. (2015) Чрезвычайно адаптивные свойства генетически кодируемых аминокислот. Научные отчеты 5: 9414. pmid:25802223
- 10.Штадтман Т. (1974) Биохимия селена. Наука 183 (4128): 915–922. пмид:4605100
- 11.
Polycarpo C, Ambrogelly A, Bérubé A, Winbush SM, McCloskey JA, Crain PF, et al (2004) Аминоацил-тРНК-синтетаза, которая специфически активирует пирролизин». Proc Nat Acad Sci USA.
 101(34): 12450–12454. pmid :15314242
101(34): 12450–12454. pmid :15314242 - 12. Юань Дж., Палиура С., Салазар Дж. К., Су Д., О’Донохью П. Хон М. Дж. и др. (2006) РНК-зависимое превращение фосфосерина в формы селеноцистеина у эукариот и архей.Proc Nat Acad Sci USA 103 (50): 18923–18927. пмид:17142313
- 13. Xu XM, Carlson BA, Mix H, Zhang Y, Saira K, Glass RS и др. (2007) Биосинтез селеноцистеина на его тРНК у эукариот». PLoS Biology 5(1):e4. pmid:17194211
- 14. Rother M, Kryzcki JA (2010)Селеноцистеин, пирролизин и уникальный энергетический метаболизм метаногенных архей. Archaea 2010, ID статьи 453642. pmid:20847933
- 15. Whanger PD (2002)Селеносоединения в растениях и животных и их биологическое значение.J Am Coll Nutr 21 (3): 223–232. пмид:12074249
- 16. Вебер А.Л., Миллер С.Л. (1981) Причины появления двадцати закодированных белковых аминокислот. Дж Мол Эвол. 17: 273–284. пмид:7277510
- 17.
Goesmann F, Rosenbauer H, Bredehöft JH, Cabane M, Ehrenfreund P, Gautier T и др.
(2015) Органические соединения на комете 67P/Чурюмова-Герасименко, обнаруженные с помощью масс-спектрометрии COSAC. Наука 349 (6247): aab0689. пмид:26228156
- 18. Квенволден К.А., Лоулесс Дж., Перинг К., Петерсон Э., Флорес Дж.Х., Поннамперума С. и др.Доказательства внеземных аминокислот и углеводородов в метеорите Мерчисон. Природа 1970; 228: 923–926. пмид:5482102
- 19. Паркер Э. Т., Кливз Х. Дж., Дворкин Дж. П., Главин Д. П., Каллахан М., Обри А. и др. (2011) Первичный синтез аминов и аминокислот в эксперименте Миллера 1958 г. с искровым разрядом, обогащенным h3S. ПНАС США 108: 5526–5531. пмид:21422282
- 20. Бада Дж. Л. (2013) Новое понимание химии пребиотиков из экспериментов Стэнли Миллера с искровым разрядом.Chem Soc Rev. 42: 2186–2196. пмид:23340907
- 21.
Cleaves HJ, Neish C, Callahan MP, Parker E, Fernández FM, Dworkin JP (2014)Аминокислоты, полученные из гидратированных толинов титана: сравнение с продуктами электрического разряда Миллера-Юри.
 Икар 237: 182–189.
Икар 237: 182–189. - 22. Кригер Э., Корайманн Г., Вринд Г. (2002) Повышение точности сравнительных моделей с помощью YASARA NOVA — самопараметризующегося силового поля. Белки 47: 393–402. пмид:11948792
- 23.Карлстрем Г., Линд Р., Мальмквист П.А., Роос Б.О., Райд У., Верязов В. и др. (2003) MOLCAS: пакет программ для вычислительной химии. Компьютерные науки. 28: 222–239.
- 24. Берц С.Х. (1983) О сложности графов и молекул. Бык Математика Биол. 45: 849–855.
- 25. Куэйл О.Р. (1953) Парахоры органических соединений. Chem Rev. 53: 439–591.
- 26. Эммерт-Штрейб Ф. (2010)Статистическая сложность: сочетание колмогоровской сложности с ансамблевым подходом.PLoS ONE 10(4):e12256.
- 27. Байуотер РП. (2015)Предсказание структурных особенностей белка на основе данных о последовательности на основе энтропии Шеннона и колмогоровской сложности. PLoS ONE 10(4):e0119306. пмид:25856073
- 28.
 Тетко И.В., Гастайгер Дж., Тодескини Р., Маури А., Ливингстон Д., Эртл П. и др. (2005) Виртуальная лаборатория вычислительной химии — проектирование и описание, J Comput Aided Mol Design 19: 453–463.
Тетко И.В., Гастайгер Дж., Тодескини Р., Маури А., Ливингстон Д., Эртл П. и др. (2005) Виртуальная лаборатория вычислительной химии — проектирование и описание, J Comput Aided Mol Design 19: 453–463. - 29. Sjöström M, Wold S (1985) Многомерное исследование взаимосвязи между генетическим кодом и физико-химическими свойствами аминокислот.Дж Мол Эвол. 22: 272–227. пмид:3935806
- 30. Bywater RP, Conde-Frieboes K (2005) Жизнь началась на пляже? Астробиология 5: 568–574. пмид:16078873
- 31. Dunbrack RL Jr, Cohen FE (1997) Байесовский статистический анализ предпочтений ротамеров боковой цепи белка. Белковая наука 6: 1661–1681. пмид:79
- 32. Шаповалов М.С., Данбрэк Р.Л. младший (2011)Сглаженная зависимая от остова библиотека ротамеров для белков, полученная на основе адаптивных оценок плотности ядра и регрессий.Структура 19: 844–858. пмид:21645855
- 33.
Мидзушима С. Структура молекул и внутреннее вращение.
 Академическая пресса, Нью-Йорк, 1954.
Академическая пресса, Нью-Йорк, 1954. - 34. Ponder JW, Richards FM (1987)Третичные матрицы для белков. Использование критериев упаковки при перечислении разрешенных последовательностей для различных структурных классов. Дж Мол Биол. 193: 775–791. пмид:2441069
- 35. Tuffery P, Etchebest C, Hazout S, Lavery R (1991)Новый подход к быстрому определению конформаций боковых цепей белков.J Biomol Struct Dyn. 8: 1267–1289. пмид:18
- 36. Роде Б.М. (1999) Пептиды и происхождение жизни. Пептиды 20: 773–786. пмид:10477135
- 37. Вонг Дж.Ф. (2014) Возникновение жизни: от функционального отбора РНК до естественного отбора и далее. Границы биологических наук 19: 1117–1150.
- 38.
Курляндия КГ. Время сна РНК. Современные клетки содержат белки, которые могли бы поддерживать мир пребиотических полипептидов, но ничто не указывает на то, что мир РНК когда-либо существовал.Bioessays 2010; 32: 866–871.
 пмид: 20806270
пмид: 20806270
Профили горячих точек взаимодействия белков рецептора SARS-CoV-2 и человеческого рецептора ACE2, полученные с помощью метода молекулярных орбиталей фрагментов плотного связывания с функциональной плотностью
1 и выполнил расчеты FMO-DFTB3/D/PCM для всех экспериментальных структур. Из-за структурных особенностей мутаций, представленных в таблице S1, мы собрали все доступные структуры, чтобы рассмотреть их вместе.Впоследствии мы выполнили анализ горячих точек с помощью инструмента FMO/3D-SPIEs.
Область горячей точки между hACE2 и RBD-SARS-CoV-1
Чтобы исследовать область горячей точки в RBD рецепторного комплекса SAR-CoV-1 и hACE2, мы выполнили расчеты FMO для 12 RBD-SARS-CoV-1. Комплексы CoV-1/hACE2 (дополнительная таблица S2-S13). Мы суммировали результаты FMO на рис. 1. В 12 комплексах RBD-SARS-CoV-1/hACE2 результаты FMO обнаружили 69 пар аминокислот как объединение членов пар аминокислот из всех 12 структур комплекса. Среди 69 пар аминокислот все 12 комплексов имеют две общие пары аминокислот: (1) взаимодействие катион-π между K353 в hACE2 и F483 в RBD-SARS-CoV-1 и (2) взаимодействие водородной связи между D355 в hACE2 и T486 в RBD-SARS-CoV-1. Десять из двенадцати комплексов имеют общую аминокислотную пару, электростатическое взаимодействие между карбоксильным кислородом K353 и T487 и Y491 в RBD-SARS-CoV-1. Еще 10 комплексов также имеют электростатическое взаимодействие между R357 в hACE2 и T487 в RBD-SARS-CoV-1.Девять из двенадцати комплексов имеют шесть общих пар аминокислот в hACE2/RBD: S19/D463, F28/Y475, Q325/R426, E329/R426, K353/Q492 и D355/G488. Восемь из двенадцати комплексов имеют три общие пары аминокислот: Q42/Y484, Y83/N473 и G354/G488. Семь из двенадцати комплексов имеют одну общую пару аминокислот: D38/Y436. Шесть из двенадцати комплексов имеют одну общую пару аминокислот: D38/G482.
Среди 69 пар аминокислот все 12 комплексов имеют две общие пары аминокислот: (1) взаимодействие катион-π между K353 в hACE2 и F483 в RBD-SARS-CoV-1 и (2) взаимодействие водородной связи между D355 в hACE2 и T486 в RBD-SARS-CoV-1. Десять из двенадцати комплексов имеют общую аминокислотную пару, электростатическое взаимодействие между карбоксильным кислородом K353 и T487 и Y491 в RBD-SARS-CoV-1. Еще 10 комплексов также имеют электростатическое взаимодействие между R357 в hACE2 и T487 в RBD-SARS-CoV-1.Девять из двенадцати комплексов имеют шесть общих пар аминокислот в hACE2/RBD: S19/D463, F28/Y475, Q325/R426, E329/R426, K353/Q492 и D355/G488. Восемь из двенадцати комплексов имеют три общие пары аминокислот: Q42/Y484, Y83/N473 и G354/G488. Семь из двенадцати комплексов имеют одну общую пару аминокислот: D38/Y436. Шесть из двенадцати комплексов имеют одну общую пару аминокислот: D38/G482.
Карта взаимодействия между антителами hACE2, SAS-CoV-1, HCoV-NL63, SARS-CoV-2 и SARS-CoV-1. Карта взаимодействия на основе 3D-SPIE состоит из доменов hACE2, RBD от SARS-CoV-1, HCoV-NL63, SARS-CoV-2, четырех антител против SARS-CoV-1 и одного антитела против SARS-CoV-2. Взаимодействия между hACE2 и доменом RBD от SARS-CoV-2 показаны слева черными стрелками. Взаимодействия между одним антителом (B38) и доменом RBD от SARS-CoV-2 показаны слева цветными полосами. Взаимодействия в домене hACE2 и RBD от SARS-CoV-1 показаны справа черными стрелками. Взаимодействия между hACE2 и HCoV-NL63 окрашены в зеленый цвет посередине.Взаимодействия между четырьмя антителами (80R, m395, S320 и F26G13) и доменом RBD из SAR-CoV-1 показаны справа цветными полосами. основная область горячей точки окрашена в светло-красный цвет, а вторичная область горячей точки в hACE2 окрашена в светло-синий цвет, и все взаимодействия, показанные на этой карте, имеют привлекательное значение PIE, более стабильное, чем − 3,0 ккал/моль, значения которого игнорируются.
Карта взаимодействия на основе 3D-SPIE состоит из доменов hACE2, RBD от SARS-CoV-1, HCoV-NL63, SARS-CoV-2, четырех антител против SARS-CoV-1 и одного антитела против SARS-CoV-2. Взаимодействия между hACE2 и доменом RBD от SARS-CoV-2 показаны слева черными стрелками. Взаимодействия между одним антителом (B38) и доменом RBD от SARS-CoV-2 показаны слева цветными полосами. Взаимодействия в домене hACE2 и RBD от SARS-CoV-1 показаны справа черными стрелками. Взаимодействия между hACE2 и HCoV-NL63 окрашены в зеленый цвет посередине.Взаимодействия между четырьмя антителами (80R, m395, S320 и F26G13) и доменом RBD из SAR-CoV-1 показаны справа цветными полосами. основная область горячей точки окрашена в светло-красный цвет, а вторичная область горячей точки в hACE2 окрашена в светло-синий цвет, и все взаимодействия, показанные на этой карте, имеют привлекательное значение PIE, более стабильное, чем − 3,0 ккал/моль, значения которого игнорируются.
Пары аминокислот, которые способствовали стабильности комплексов, хорошо коррелируют с опубликованными исследованиями сайт-направленного мутагенеза. Ву и др. сообщили, что 2 мутации (D38A и Y41F) в hACE2 и 3 мутации (Y491A, T487A и T487S) в RBD-SARS-CoV-1 снижают аффинность связывания 22 . Ли и др. . сообщили, что 10 мутаций в hACE2 повлияли на ингибирование взаимодействия с шиповидным белком SARS-CoV-1 (Q24K/K26E, K31D, Y41A, K68D, K353D, K353A, K353D, D355A, R357A и R393A) 23 . При сравнении 69 пар аминокислот в этом исследовании с экспериментальными результатами мутагенеза из двух статей было подтверждено, что 32 из 69 пар аминокислот коррелируют с экспериментальными результатами.
Ву и др. сообщили, что 2 мутации (D38A и Y41F) в hACE2 и 3 мутации (Y491A, T487A и T487S) в RBD-SARS-CoV-1 снижают аффинность связывания 22 . Ли и др. . сообщили, что 10 мутаций в hACE2 повлияли на ингибирование взаимодействия с шиповидным белком SARS-CoV-1 (Q24K/K26E, K31D, Y41A, K68D, K353D, K353A, K353D, D355A, R357A и R393A) 23 . При сравнении 69 пар аминокислот в этом исследовании с экспериментальными результатами мутагенеза из двух статей было подтверждено, что 32 из 69 пар аминокислот коррелируют с экспериментальными результатами.
Изменения аффинности связывания между белками, образующими комплекс в результате мутации, можно объяснить путем сравнения структурных изменений (т. е. изменений в парах аминокислот, которые способствуют увеличению или уменьшению аффинности связывания) мутантных белков с белков дикого типа. Ку и др. . сообщили, что мутация N479K/T487S в RBD-SARS-CoV-1 снижает аффинность связывания 24 . Один комплекс (идентификатор PDB: 3D0H) имеет мутацию T487S в RBD-SARS-CoV-1.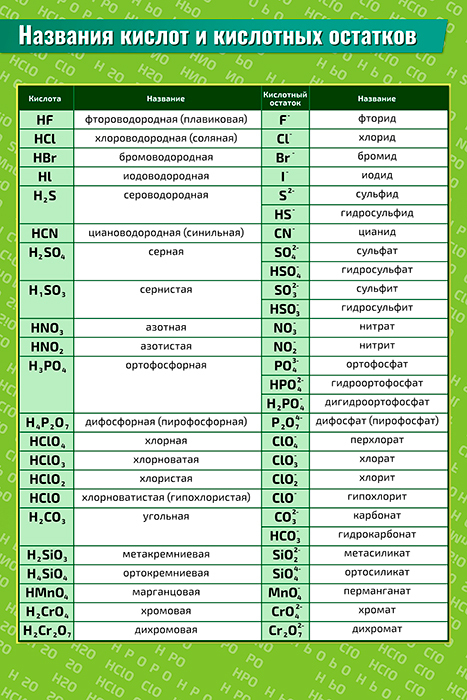 T487 в WT RBD-SARS-CoV-1 привлекательно взаимодействует с 6 аминокислотами, Y41, G326, N330, G354, F356 и R357, тогда как S487 в мутированном комплексе привлекательно взаимодействует только с 3 аминокислотами, N330, G354 и R357. . Ву и др. . сообщили, что мутация K31T в hACE2 увеличивает аффинность связывания 25 , потому что K31 в hACE2 WT (идентификатор PDB: 2AJF) взаимодействует только с Y442 RBD-SARS-CoV-1, тогда как T31 в мутированном hACE2 (идентификатор PDB : 3D0G) взаимодействует с двумя аминокислотами, Y442 и Y475.
T487 в WT RBD-SARS-CoV-1 привлекательно взаимодействует с 6 аминокислотами, Y41, G326, N330, G354, F356 и R357, тогда как S487 в мутированном комплексе привлекательно взаимодействует только с 3 аминокислотами, N330, G354 и R357. . Ву и др. . сообщили, что мутация K31T в hACE2 увеличивает аффинность связывания 25 , потому что K31 в hACE2 WT (идентификатор PDB: 2AJF) взаимодействует только с Y442 RBD-SARS-CoV-1, тогда как T31 в мутированном hACE2 (идентификатор PDB : 3D0G) взаимодействует с двумя аминокислотами, Y442 и Y475.
Общая область горячих точек в RBD-SARS-CoV-1 против антител hACE2 и SARS-CoV-1
Чтобы сузить области горячих точек между hACE2 и RBD-SARS-CoV-1, мы выполнили расчеты FMO на четырех комплексах RBD-SARS-CoV-1/антитело (дополнительная таблица S14-S19). Мы суммировали результаты FMO на рис. 1.
В комплексе RBD-SARS-CoV-1/80R (идентификатор PDB: 2GHW) результаты FMO обнаружили 30 пар аминокислот, которые обобщены в дополнительной таблице S14. Пары аминокислот согласуются с результатами, полученными ранее Hwang et al . 26 При сравнении 30 пар аминокислот в этом исследовании с ранее опубликованными результатами было подтверждено, что 17 из 30 пар аминокислот коррелируют: R426/Y53, T433/W226, N437/R162, Y440/D182, P470/D202, N479/D182, D480/R162, D480/S163, D480/N164, D480/R223, Y481/R223, Y484/Y102, T486/Y53, T487/Y53, T487/D99, G488/A33 и Y491 /Д99. В комплексе RBD-SARS-CoV-1/m395 (идентификатор PDB: 2DD8) результаты FMO обнаружили 18 пар аминокислот, которые суммированы в дополнительной таблице S15.Пары аминокислот, которые способствовали стабильности комплексов, хорошо коррелируют с опубликованным исследованием сайт-направленного мутагенеза, в котором мутация T487 существенно не влияет на нейтрализующую активность антитела 27 . Результаты FMO подтвердили, что мутация T487S изменит лишь незначительные ван-дер-ваальсовые взаимодействия между T487 и HC Y32. В комплексе RBD-SARS-CoV-1/S230 (идентификатор PDB: 6NB6, 6NB7) результаты FMO обнаружили 25 пар аминокислот, которые суммированы в дополнительной таблице S16-S18.
Пары аминокислот согласуются с результатами, полученными ранее Hwang et al . 26 При сравнении 30 пар аминокислот в этом исследовании с ранее опубликованными результатами было подтверждено, что 17 из 30 пар аминокислот коррелируют: R426/Y53, T433/W226, N437/R162, Y440/D182, P470/D202, N479/D182, D480/R162, D480/S163, D480/N164, D480/R223, Y481/R223, Y484/Y102, T486/Y53, T487/Y53, T487/D99, G488/A33 и Y491 /Д99. В комплексе RBD-SARS-CoV-1/m395 (идентификатор PDB: 2DD8) результаты FMO обнаружили 18 пар аминокислот, которые суммированы в дополнительной таблице S15.Пары аминокислот, которые способствовали стабильности комплексов, хорошо коррелируют с опубликованным исследованием сайт-направленного мутагенеза, в котором мутация T487 существенно не влияет на нейтрализующую активность антитела 27 . Результаты FMO подтвердили, что мутация T487S изменит лишь незначительные ван-дер-ваальсовые взаимодействия между T487 и HC Y32. В комплексе RBD-SARS-CoV-1/S230 (идентификатор PDB: 6NB6, 6NB7) результаты FMO обнаружили 25 пар аминокислот, которые суммированы в дополнительной таблице S16-S18. S230 связывается с RBD-SARS-CoV-1 в двух разных состояниях. Результаты FMO состояния 1 подробно описаны в дополнительной таблице S16, а результаты состояния 2 упомянуты в дополнительной таблице S17-S18. В комплексе RBD-SARS-CoV-1/F26G19 (идентификатор PDB: 3BGF) результаты FMO обнаружили 24 пары аминокислот, которые суммированы в дополнительной таблице S19.
S230 связывается с RBD-SARS-CoV-1 в двух разных состояниях. Результаты FMO состояния 1 подробно описаны в дополнительной таблице S16, а результаты состояния 2 упомянуты в дополнительной таблице S17-S18. В комплексе RBD-SARS-CoV-1/F26G19 (идентификатор PDB: 3BGF) результаты FMO обнаружили 24 пары аминокислот, которые суммированы в дополнительной таблице S19.
Чтобы найти общие аминокислоты горячих точек в RBD-SARS-CoV-1 против антител hACE2 и SARS-CoV-1, мы проиллюстрировали результаты FMO с помощью карты на основе 3D-SPIE.(см. рис. 1). Все четыре антитела (80R, m395, S230 и F26G19) и hACE2 имеют две общие аминокислоты, R426 и T487, в RBD-SARS-CoV-1. Три из четырех антител и hACE2 имеют четыре общие аминокислоты, T486, G488, I489 и Y491, в RBD-SARS-CoV-1. Два из четырех антител и hACE2 имеют две общие аминокислоты, F483 и Q492, в RBD-SARS-CoV-1. Только S230 и hACE2 имеют четыре общие аминокислоты, D463, N473, Y475 и Y442, в RBD-SARS-CoV-1. Только 80R и hACE2 имеют две общие аминокислоты, Q479 и Y484, в RBD-SARS-CoV-1. Другие взаимодействия между антителами и RBD-SARS-CoV-1 не совпадают с взаимодействиями между hACE2 и RBD-SARS-CoV-1. Учитывая возможность прогнозирования мутаций в вирусах с помощью методов FMO 28,29 , эволюционный процесс SARS-CoV-1 может быть выполнен так, чтобы избежать нейтрализации антитела путем переключения неразделенных взаимодействий между антителом и рецептором hACE2.
Другие взаимодействия между антителами и RBD-SARS-CoV-1 не совпадают с взаимодействиями между hACE2 и RBD-SARS-CoV-1. Учитывая возможность прогнозирования мутаций в вирусах с помощью методов FMO 28,29 , эволюционный процесс SARS-CoV-1 может быть выполнен так, чтобы избежать нейтрализации антитела путем переключения неразделенных взаимодействий между антителом и рецептором hACE2.
Согласно карте, между hACE2 и RBD-SARS-CoV-1 есть две области горячих точек (см. рис. 1).Основная область горячей точки на hACE2 состоит из D38, Y41, K353, D355 и нескольких остатков. Противоположная часть RBD-SARS-CoV-1 включает R426, T486, T487, I489, Y491 и так далее. Вторичная область горячей точки на рецепторе hACE2 состоит из D30, K31 и нескольких остатков. Противоположная часть этого на RBD-SARS-CoV-1 включает Y442, D463, N473, N479 и так далее. Мы обнаружили, что антитела к SARS-CoV-1 фокусируются на основной горячей точке, чтобы блокировать образование пар аминокислот между hACE2 и RBD-SARS-CoV-1.
Область горячей точки между доменами hACE2 и RBD от SARS-CoV-1, HCoV-NL63 и SARS-CoV-2
Хотя RBD HCoV-NL63 не имеет структурной гомологии с RBD SARS-CoV-1 и SARS-CoV-2, три вируса распознают один и тот же рецептор hACE2 для проникновения в клетки-хозяева. Чтобы исследовать область горячей точки между HCoV-NL63 и hACE2, мы выполнили расчеты FMO для комплекса HCoV-NL63/hACE2 (идентификатор PDB: 3KBH). Результаты FMO, в которых были обнаружены 23 пары аминокислот, обобщены в дополнительной таблице S20.Результаты FMO согласуются с шестью парами аминокислот (hACE2/RBD-HCoV-NL63), о которых ранее сообщали Wu et al. 30 : D30/S496, h44/G495, h44/S496, E37/Y498, M323/H586 и G354/G537.
Чтобы найти аминокислоты в горячих точках на интерфейсе PPI между SARS-CoV-2 и hACE2, мы выполнили расчеты FMO для четырех комплексов SARS-CoV-2/hACE2 (дополнительная таблица S21-S24), результаты которые обобщены на рис. 1. Результаты FMO обнаружили 37 пар аминокислот как объединение членов пары аминокислот из всех четырех комплексов. Среди 37 пар аминокислот все четыре комплекса имеют общие взаимодействия: 1) семь взаимодействий водородных связей (hACE2/RBD): Q24/N487, E35/Q493, E37/Y505, D38/Y449, D38/G496, K353/F497, и G354/G502, 2) амид-π-взаимодействие между G354 в hACE2 и Y505 в RBD-SARS-CoV-2 и 3) четыре электростатических взаимодействия (hACE2/RBD): K31/P491, G354/N501, D355/T500 и D355/G502. Три из четырех комплексов имеют общие взаимодействия между hACE2 и RBD-SARS-CoV-2: 1) шесть взаимодействий водородных связей (hACE2/RBD): F28/Y489, D30/K417, K31/E484, K31/Q493, Y41/Q498. , и Y83/N487, 2) π–π-взаимодействие между Y83 в hACE2 F486 и в RBD-SARS-CoV-2 и 3) четыре электростатических взаимодействия (hACE2/RBD): S19/G476, S19/S477, Y41/ N501 и R357/N501.Два из четырех комплексов имеют пять общих пар аминокислот в hACE2/RBD: D30/L455, D38/Q498, N330/N501, K353/Q498 и K353/G502.
Среди 37 пар аминокислот все четыре комплекса имеют общие взаимодействия: 1) семь взаимодействий водородных связей (hACE2/RBD): Q24/N487, E35/Q493, E37/Y505, D38/Y449, D38/G496, K353/F497, и G354/G502, 2) амид-π-взаимодействие между G354 в hACE2 и Y505 в RBD-SARS-CoV-2 и 3) четыре электростатических взаимодействия (hACE2/RBD): K31/P491, G354/N501, D355/T500 и D355/G502. Три из четырех комплексов имеют общие взаимодействия между hACE2 и RBD-SARS-CoV-2: 1) шесть взаимодействий водородных связей (hACE2/RBD): F28/Y489, D30/K417, K31/E484, K31/Q493, Y41/Q498. , и Y83/N487, 2) π–π-взаимодействие между Y83 в hACE2 F486 и в RBD-SARS-CoV-2 и 3) четыре электростатических взаимодействия (hACE2/RBD): S19/G476, S19/S477, Y41/ N501 и R357/N501.Два из четырех комплексов имеют пять общих пар аминокислот в hACE2/RBD: D30/L455, D38/Q498, N330/N501, K353/Q498 и K353/G502.
Чтобы исследовать общую горячую точку на hACE2 против RBD трех вирусов и наоборот, мы проиллюстрировали результаты FMO на рис. 1. В трех вирусах все RBD имеют общие взаимодействия с D30, K31, E37, K353. , G354 и D355 в hACE2. SARS-CoV-1 и SARS-CoV-2 имеют общие взаимодействия с S19, Q24, F28, E35, A36, D38, Y41, Q42, Y83, E329, N330 и R357 в hACE2.Только SARS-CoV-1 и hACE2 взаимодействуют с E23, A25, F32, T324, Q325, G326 и F356, тогда как только NL63-CoV и hACE2 взаимодействуют с N33, M323 и F327. Общими взаимодействиями между SARS-CoV1 и NL63-CoV были h44 и R393 в hACE2.
1. В трех вирусах все RBD имеют общие взаимодействия с D30, K31, E37, K353. , G354 и D355 в hACE2. SARS-CoV-1 и SARS-CoV-2 имеют общие взаимодействия с S19, Q24, F28, E35, A36, D38, Y41, Q42, Y83, E329, N330 и R357 в hACE2.Только SARS-CoV-1 и hACE2 взаимодействуют с E23, A25, F32, T324, Q325, G326 и F356, тогда как только NL63-CoV и hACE2 взаимодействуют с N33, M323 и F327. Общими взаимодействиями между SARS-CoV1 и NL63-CoV были h44 и R393 в hACE2.
Область горячих точек в hACE2/RBD-SARS-CoV-2, интегрированная с картой взаимодействия на основе 3D-SPIE
Мы создали карту взаимодействия на основе 3D-SPIE, чтобы найти области горячих точек по информации PPI между hACE2 и RBD- SARS-CoV-2 (см. рис.1 и 2). При сравнении взаимодействующих остатков между hACE2 и RBD трех вирусов есть две области горячих точек, состоящие из неглубоких борозд на рецепторе hACE2. Основную горячую точку образуют E37, K353, G354 и D355. Вторичная горячая точка состоит из D30 и K31. Согласно карте, ожидается, что основная горячая точка будет самой важной горячей точкой между hACE2 и RBD-SARS-CoV-2.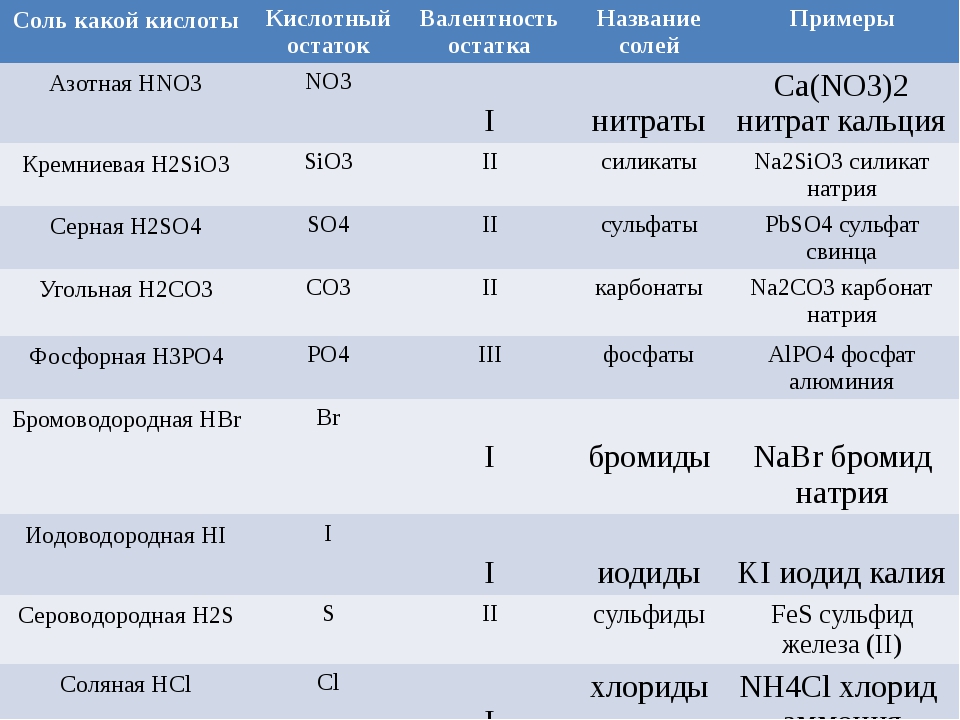 Мы заметили, что вторичная горячая точка на hACE2 взаимодействует с K417, L455, E484, P491 и Q493 в RBD-SARS-CoV-2, тогда как основная горячая точка взаимодействует с R403, F497, Q498, T500, N501, G502. , Y505 и Q506 в RBD-SARS-CoV-2.Результаты исследования общей области «горячей точки» в антителах к SARS-CoV-1 подтвердили результаты о том, что основная область «горячей точки» важна для ИЦП между RBD-SARS-CoV-1 и его антителами. В результатах SARS-CoV-2 и его антитела (B38), обобщенных в дополнительной таблице S25, антитело взаимодействовало с R403, Q498, N501, G502 и Y505 RBD-SARS-CoV-2, которые являются аналогом главная горячая точка. Его можно использовать для разработки антител и противовирусных агентов, используя информацию о горячих точках, предложенную в этой работе.
Мы заметили, что вторичная горячая точка на hACE2 взаимодействует с K417, L455, E484, P491 и Q493 в RBD-SARS-CoV-2, тогда как основная горячая точка взаимодействует с R403, F497, Q498, T500, N501, G502. , Y505 и Q506 в RBD-SARS-CoV-2.Результаты исследования общей области «горячей точки» в антителах к SARS-CoV-1 подтвердили результаты о том, что основная область «горячей точки» важна для ИЦП между RBD-SARS-CoV-1 и его антителами. В результатах SARS-CoV-2 и его антитела (B38), обобщенных в дополнительной таблице S25, антитело взаимодействовало с R403, Q498, N501, G502 и Y505 RBD-SARS-CoV-2, которые являются аналогом главная горячая точка. Его можно использовать для разработки антител и противовирусных агентов, используя информацию о горячих точках, предложенную в этой работе.
Две основные области «горячих точек» между hACE2 и шиповидным белком SARS-CoV-2. Основная первая горячая точка hACE2 состоит из D30 и K31, а основная вторая горячая точка hACE2 состоит из E37, K353, G354 и D355.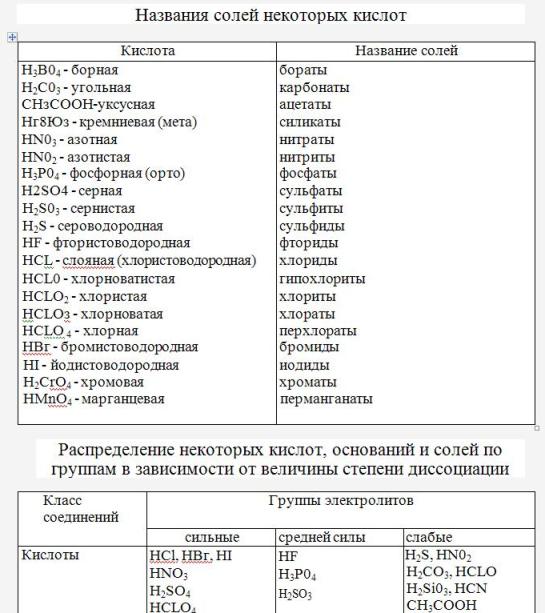 Белок hACE2 представлен зеленой лентой и поверхностью, тогда как RBD шиповидного белка SARS-CoV-2 представлен оранжевой лентой и поверхностью (идентификатор PDB: 6M0J). Ключевые сайты связывания на поверхности hACE2 окрашены в темно-зеленый цвет, а сайты RBD-SARS-CoV-2 — в малиновый.
Белок hACE2 представлен зеленой лентой и поверхностью, тогда как RBD шиповидного белка SARS-CoV-2 представлен оранжевой лентой и поверхностью (идентификатор PDB: 6M0J). Ключевые сайты связывания на поверхности hACE2 окрашены в темно-зеленый цвет, а сайты RBD-SARS-CoV-2 — в малиновый.
Границы | Одноклеточный белок — современное состояние, промышленный ландшафт и патенты, 2001–2016 гг.
Введение
Люди и животные потребляют белок как источник азота и незаменимых аминокислот, из которых они строят новые структурные и функциональные (например, ферменты и гормоны) белки, которые позволяют им выживать. В экстремальных условиях белки также могут использоваться в качестве источника энергии. Пищевая ценность белка определяется аминокислотным составом; В пищевом белке обычно содержится 20 аминокислот, из которых несколько (т.например, фенилаланин, валин, треонин, триптофан, метионин, лейцин, изолейцин, лизин и гистидин, а также полезны аргинин, цистеин, глицин, глутамин, пролин и тирозин) не могут быть синтезированы людьми или животными и поэтому необходимы и должны поступать с пищей (см. обзор Wu, 2009).
обзор Wu, 2009).
Боланд и др. (2013) исследовали, как растущий спрос на мясной и молочный белок потребует улучшения животноводства, а также открытости для новых источников белка, как в качестве корма для животных, так и для непосредственного потребления человеком.Производство животных и молочных продуктов неуклонно росло в течение последних десятилетий и теоретически может продолжать расти, чтобы удовлетворить ожидаемый спрос, даже к 2050 году, когда спрос на мясо превысит 400 млн тонн, а на молочные продукты — 800 млн тонн (Boland et al., 2013). Однако, поскольку растительный белок преобразуется в мясной белок довольно неэффективно (для производства 1 кг мясного белка необходимо около 6 кг растительного белка), увеличение производства мяса для удовлетворения растущего спроса в конечном итоге не является устойчивым (ВОЗ, 2015).Западный мир также заинтересован в разработке более здоровой пищи с оптимальным аминокислотным составом и низким содержанием жиров хорошего качества в сочетании с этически устойчивым производством. Как правило, это безвредные для окружающей среды процессы, не связанные с животными, но они могут включать новые процессы, такие как производство «культивируемого» мяса, при котором мясной белок более эффективно производится in vitro , а не путем выращивания всего животного (Kadim et al. ., 2015). Растительные источники белка, такие как бобы, являются питательно ценными источниками белка, но требуют пахотных земель и воды, и оба этих фактора станут ограничивающими, поскольку мы стремимся удовлетворить глобальный спрос на белок.Содержание белка в мясе обычно составляет около 45 %, в молоке — около 25 %, а в сое — около 35 % (Ghasemi et al., 2011).
Как правило, это безвредные для окружающей среды процессы, не связанные с животными, но они могут включать новые процессы, такие как производство «культивируемого» мяса, при котором мясной белок более эффективно производится in vitro , а не путем выращивания всего животного (Kadim et al. ., 2015). Растительные источники белка, такие как бобы, являются питательно ценными источниками белка, но требуют пахотных земель и воды, и оба этих фактора станут ограничивающими, поскольку мы стремимся удовлетворить глобальный спрос на белок.Содержание белка в мясе обычно составляет около 45 %, в молоке — около 25 %, а в сое — около 35 % (Ghasemi et al., 2011).
Белок также может быть обеспечен за счет выращивания различных микробов и водорослей, предпочтительно таких, которые содержат более 30% белка в своей биомассе и которые могут обеспечить здоровый баланс незаменимых аминокислот. Микробный белок обычно называют одноклеточным белком (SCP), хотя некоторые микробы-продуценты, такие как нитчатые грибы или нитчатые водоросли, могут быть многоклеточными. В дополнение к прямому использованию в качестве SCP, микробы вносят свой вклад в потребность в белке, когда они используются для повышения содержания белка или качества ферментированных пищевых продуктов (Bourdichon et al., 2012). Хотя микробный белок обеспечивает относительно небольшую долю современного питания человека, растущий глобальный спрос на белок, вероятно, сделает SCP все более важным (Boland et al., 2013). Высокие темпы роста или способность использовать уникальные субстраты, такие как CO 2 или метан, приводят к процессам, которые обеспечивают гораздо более высокую эффективность и / или устойчивость, чем это возможно в традиционном сельском хозяйстве.
В дополнение к прямому использованию в качестве SCP, микробы вносят свой вклад в потребность в белке, когда они используются для повышения содержания белка или качества ферментированных пищевых продуктов (Bourdichon et al., 2012). Хотя микробный белок обеспечивает относительно небольшую долю современного питания человека, растущий глобальный спрос на белок, вероятно, сделает SCP все более важным (Boland et al., 2013). Высокие темпы роста или способность использовать уникальные субстраты, такие как CO 2 или метан, приводят к процессам, которые обеспечивают гораздо более высокую эффективность и / или устойчивость, чем это возможно в традиционном сельском хозяйстве.
SCP в настоящее время производится из ограниченного числа видов микробов, особенно с учетом потребления человеком. Диапазон источников SCP, используемых в кормах для животных, шире, чем одобренные для потребления человеком, и расширяется. Как показано ниже, продукты, полученные из водорослей, грибков (включая дрожжи) и бактерий, уже используются или разрабатываются. Производственные этапы обычно включают (а) приготовление питательных сред, возможно, из отходов, (б) культивирование, включая ферментацию в твердой фазе, (в) разделение и концентрирование ТЦ, в некоторых случаях сушку, и (г) окончательную переработку ТЦ в ингредиенты и продукты.
Производственные этапы обычно включают (а) приготовление питательных сред, возможно, из отходов, (б) культивирование, включая ферментацию в твердой фазе, (в) разделение и концентрирование ТЦ, в некоторых случаях сушку, и (г) окончательную переработку ТЦ в ингредиенты и продукты.
SCP для потребления человеком, как правило, производится из пищевых субстратов, но есть надежда, что будут разработаны процессы для производства SCP из недорогих отходов пищевой промышленности и производства напитков, а также непосредственно из лесных и сельскохозяйственных источников (Anbuselvi et al. ., 2014). Регуляторные вопросы должны всегда приниматься во внимание. С появлением водорослей в качестве поставщиков микробного белка производство CO 2 стало возможным, в то время как парниковый газ метан обеспечивает новый источник углерода для SCP из бактерий.
В следующем обзоре будет представлено введение в производство SCP и организмы, используемые в качестве SCP, с акцентом на коммерчески реализованные разработки в этой области. Более подробные обзоры исследований конкретных организмов, используемых для производства SCP, предоставлены Anupama and Ravindra (2000), Ugalde and Castrillo (2002), Rudravaram et al. (2009), Гасеми и др. (2011) и Nasseri et al. (2011). Здесь мы представляем обновленную информацию о последних достижениях в области патентов (2001–2016 гг.) и текущих промышленных игроках на основе профилей компаний, найденных в Интернете, литературе и патентных базах данных.
Более подробные обзоры исследований конкретных организмов, используемых для производства SCP, предоставлены Anupama and Ravindra (2000), Ugalde and Castrillo (2002), Rudravaram et al. (2009), Гасеми и др. (2011) и Nasseri et al. (2011). Здесь мы представляем обновленную информацию о последних достижениях в области патентов (2001–2016 гг.) и текущих промышленных игроках на основе профилей компаний, найденных в Интернете, литературе и патентных базах данных.
Производственные системы SCP с различными субстратами и процессами
Водоросли, грибы (мицелиальные грибы и дрожжи) и бактерии могут использоваться в качестве SCP (Anupama and Ravindra, 2000). В будущем пищевые белки также могут быть получены из белков, секретируемых искусственными микробными клетками (например, белки молока или яичного белка), и из культур клеток животных и растений, в которых клетки больше не являются микробами, но не являются животными или растениями. либо. Таким образом, различие между SCP и другим белком становится размытым.
SCP из водорослей
Микроводоросли, которые производятся для потребления человеком или животными, обычно имеют высокое содержание белка (например, 60–70%; таблица 1). Они также содержат жиры (особенно интересны ω-3 жирные кислоты и каротиноиды), витамины A, B, C и E, минеральные соли и хлорофилл (Gouveia et al., 2008). Они имеют относительно низкое содержание нуклеиновых кислот (3–8%; Nasseri et al., 2011).
Таблица 1 . Недавние сообщения о содержании белка в некоторых водорослях, представляющих интерес как SCP*.
Микроводоросли в настоящее время используются в основном в виде добавок, доступных в виде таблеток, капсул или жидкости, но они все чаще также перерабатываются в качестве ингредиентов, которые могут быть включены в макаронные изделия, выпечку, закуски и т. д. (Gouveia et al., 2008; Зимберофф, 2017). Наиболее доступные коммерческие продукты получены в основном из Arthrospira platensis и Arthrospira maxima (продается как спирулина, продается, например, Hainan Simai Pharmacy Co. , Earthrise Nutritionals, Cyanotech Corp., FEBICO и Mayanmar Spriulina Factory) , Chlorella (продается, например, Taiwan Chlorella Manufacturing Co., FEBICO и Roquette Klötze GmbH & Co), Dunaliella salina (продается, например, Qianqiu Biotechnology Co., Ltd., в первую очередь для β-каротина) и Aphanizomenon flos-aquae (продаваемый, например, Blue Green Foods, Klamath Valley Botanicals LLC и E3Live; Gouveia et al., 2008). Euglena Co. Ltd. (Suzuki, 2017) и Algaeon (http://algaeon-inc.com/#products) продают продукты из Euglena , в основном из-за содержания β-глюкана, но включая продукты из цельных клеток.TerraVia не указывает, какие водоросли входят в состав пищевых ингредиентов AlgaVia ® . Энзинг и др. (2014) и Vigani et al. (2015) предоставляют полезные обзоры компаний и стран, занимающихся производством микроводорослей в качестве продуктов питания или кормов. Оба обзора сосредоточены на Европейском союзе, но отмечают участие в отрасли многочисленных компаний из Азии и Северной Америки.
, Earthrise Nutritionals, Cyanotech Corp., FEBICO и Mayanmar Spriulina Factory) , Chlorella (продается, например, Taiwan Chlorella Manufacturing Co., FEBICO и Roquette Klötze GmbH & Co), Dunaliella salina (продается, например, Qianqiu Biotechnology Co., Ltd., в первую очередь для β-каротина) и Aphanizomenon flos-aquae (продаваемый, например, Blue Green Foods, Klamath Valley Botanicals LLC и E3Live; Gouveia et al., 2008). Euglena Co. Ltd. (Suzuki, 2017) и Algaeon (http://algaeon-inc.com/#products) продают продукты из Euglena , в основном из-за содержания β-глюкана, но включая продукты из цельных клеток.TerraVia не указывает, какие водоросли входят в состав пищевых ингредиентов AlgaVia ® . Энзинг и др. (2014) и Vigani et al. (2015) предоставляют полезные обзоры компаний и стран, занимающихся производством микроводорослей в качестве продуктов питания или кормов. Оба обзора сосредоточены на Европейском союзе, но отмечают участие в отрасли многочисленных компаний из Азии и Северной Америки.
Водоросли обычно питаются CO 2 и светом, хотя некоторые продукты, такие как AlgaVia ® , производятся путем традиционной ферментации, а не фотосинтеза.Выращивание водорослей на открытом воздухе в открытых водоемах распространено, но подвержено загрязнению (не только биологическому, но и минеральному, что влияет на качество конечного продукта) и погодным условиям (Harun et al., 2010). Внутренние фотобиореакторы также используются, чтобы гарантировать поставку свежих водорослей в качестве корма для аквакультуры (моллюски, креветки, рыба; Henrikson, 2013; Mahmoud et al., 2016). Водоросли в основном используются в аквакультуре как источник омега-жирных кислот и каротиноидных пигментов, но их белок также способствует питанию животных (Muller-Feuga, 2000).
SCP от Fungi
Согласно обзору Anupama and Ravindra (2000), Rudravaram et al., для использования в качестве SCP рассматривался широкий спектр грибов. (2009) и Nasseri et al. (2011). В таблице 2 перечислены некоторые из видов, которые были исследованы в последние годы, с указанием содержания белка, наблюдаемого в условиях, в которых они выращивались. Продукты из Saccharomyces, Fusarium и Torulopsis коммерчески доступны.
Продукты из Saccharomyces, Fusarium и Torulopsis коммерчески доступны.
Таблица 2 .Недавние сообщения о содержании грибкового белка, полученного из конкретных субстратов, для видов, исследованных в качестве потенциальных источников SCP.
Грибы, выращиваемые как SCP, обычно содержат 30–50% белка (Anupama and Ravindra, 2000; Nasseri et al., 2011). Аминокислотный состав выгодно отличается от руководства ФАО; Содержание треонина и лизина обычно высокое, а содержание метионина относительно низкое, хотя все еще соответствует рекомендациям ФАО/ВОЗ (Anderson et al., 1975). Содержание метионина в некоторых грибковых продуктах, таких как Marmite ® , еще ниже.Серосодержащие аминокислоты были обогащены SCP из K. fragilis путем культивирования на сыворотке (Willetts and Ugalde, 1987).
В дополнение к белку, SCP, полученные из грибов, как ожидается, содержат витамины, в первую очередь из группы B-комплекса (тиамин, рибофлавин, биотин, ниацин, пантотеновая кислота, пиридоксин, холин, стрептогенин, глутатион, фолиевая кислота и п-аминобензойная кислота). кислота). Клеточные стенки грибов богаты глюканами, которые вносят в рацион клетчатку. Холестерин липопротеинов низкой плотности был снижен у добровольцев, которые потребляли микопротеин из Fusarium venenatum (Turnbull et al., 1992), а также могут благоприятно влиять на уровни глюкозы и инсулина в крови (Lang et al., 1999). Ожидается, что грибы будут иметь умеренное содержание нуклеиновых кислот (7–10%; Nasseri et al., 2011), которое, однако, слишком велико для потребления человеком и требует обработки для его снижения (Edelman et al., 1983).
кислота). Клеточные стенки грибов богаты глюканами, которые вносят в рацион клетчатку. Холестерин липопротеинов низкой плотности был снижен у добровольцев, которые потребляли микопротеин из Fusarium venenatum (Turnbull et al., 1992), а также могут благоприятно влиять на уровни глюкозы и инсулина в крови (Lang et al., 1999). Ожидается, что грибы будут иметь умеренное содержание нуклеиновых кислот (7–10%; Nasseri et al., 2011), которое, однако, слишком велико для потребления человеком и требует обработки для его снижения (Edelman et al., 1983).
Торговая марка Quorn™ (http://www.quorn.com/) была запущена в 1985 году компанией Marlow Foods (Великобритания). Продукты Quorn™ содержат микопротеин нитчатого гриба F. venenatum . Грибковая биомасса обеспечивает текстуру, напоминающую мясные продукты.Quorn™ может быть единственным SCP-продуктом, используемым исключительно для питания человека, и для этой цели он широко рекламируется, продается и продается. Недавно (2015 г. ) компания была приобретена филиппинским производителем лапши быстрого приготовления Monde Nissin Corp за 550 миллионов фунтов стерлингов (http://www.reuters.com/article/quorn-ma-idUSL5N1204C720151001).
) компания была приобретена филиппинским производителем лапши быстрого приготовления Monde Nissin Corp за 550 миллионов фунтов стерлингов (http://www.reuters.com/article/quorn-ma-idUSL5N1204C720151001).
Отработанные пивные дрожжи ( Saccharomyces cerevisiae ) уже более века продаются в виде дрожжевых экстрактов, таких как Marmite ® (Unilever and Sanitarium Health Food), Vegemite ® (Bega Cheese Ltd.), Cenovis ® (Gustav Gerig AG) и Vitam-R ® (VITAM Hefe-Produkt GmbH). Экстракты дрожжей являются хорошим источником пяти важных витаминов группы В, а также белка. Другие имеющиеся в продаже дрожжи, Torula ( Candida utilis , переименованные в Pichia jadinii ), широко используемый ароматизатор, также содержат большое количество белка. Torula использовался в Proveteen ® T, произведенном корпорацией Provesta в 1980-х годах, наряду с аналогичными продуктами с использованием дрожжей Pichia и Kluyveromyces (Hitzman, 1986). Торула богат аминокислотой глутаминовой кислотой, и по этой причине она используется для замены усилителя вкуса глутамата натрия (MSG).
Торула богат аминокислотой глутаминовой кислотой, и по этой причине она используется для замены усилителя вкуса глутамата натрия (MSG).
В Финляндии был разработан процесс под названием «Pekilo» для производства SCP для кормления животных из сахаров, присутствующих в сульфитном растворе сточных вод бумажной фабрики (рассмотрено в Ugalde and Castrillo, 2002). Мицелиальный гриб Paecilomyces varioti выращивали на сахарах, в том числе пентозах, в сульфитных отходах или гидролизатах древесины. В Финляндии в 1982–1991 годах работали две фабрики в Мянття и Ямсянкоски, но когда целлюлозные фабрики прекратили работу, эти фабрики также были закрыты.Хотя продукт продавался в качестве корма для животных, его также исследовали в качестве добавки к мясным продуктам, таким как колбасы и фрикадельки (Koivurinta et al., 1979). Технологический штамм Pekilo доступен в коллекции культур VTT Ltd. (www.culturecollection.vtt.fi/).
Quorn™ и дрожжевые спреды, такие как Marmite ® , производятся из глюкозы, полученной из крахмала, в то время как в процессе Pekilo используются лигноцеллюлозные сахара. В дополнение к этим источникам углерода дрожжи и мицелиальные грибы использовали для производства SCP алканы и метанол.Метилотрофные дрожжи, например Komagataella pastoris (ранее Pichia pastoris ), производят биомассу и белок из метанола (Rashad et al., 1990). Производство в промышленных масштабах осуществлялось, например, компанией Phillips Petroleum Company. Их дрожжи производили 130 г (DW)/л биомассы при продуктивности более 10 г л -1 ч -1 (Johnson, 2013).
В дополнение к этим источникам углерода дрожжи и мицелиальные грибы использовали для производства SCP алканы и метанол.Метилотрофные дрожжи, например Komagataella pastoris (ранее Pichia pastoris ), производят биомассу и белок из метанола (Rashad et al., 1990). Производство в промышленных масштабах осуществлялось, например, компанией Phillips Petroleum Company. Их дрожжи производили 130 г (DW)/л биомассы при продуктивности более 10 г л -1 ч -1 (Johnson, 2013).
British Petroleum стала пионером в производстве Yarrowia lipolytica SCP для кормления животных из воскообразных н-парафинов на нефтеперерабатывающем заводе в 1970-х годах, построив экспериментальный завод с годовой производственной мощностью до 100 тыс. тонн (Groenewald et al., 2014). Хотя сам продукт считался безопасным, завод не получил необходимых разрешений на производство из-за экологических соображений (Бамберг, 2000). В сочетании с высокой ценой на субстрат, возникшей в результате нефтяного кризиса 1973 года, это привело к тому, что British Petroleum отказалась от своего интереса к SCP (Groenewald et al. , 2014). Yarrowia SCP теперь доступен в меньшем количестве в качестве продуктов Yarrowia Technology (продукты Yarrowia Equinox и Yarrowia GoodStart) от Skotan S.A. в Польше (http://www.yarrowiatechnology.com/?lang=3). Хотя масла и каротиноиды являются наиболее распространенными продуктами Yarrowia для использования человеком (Groenewald et al., 2014), американская компания Nucelis также предлагает богатую белком муку тысячелистника (https://www.nucelis.com/products. php?product=масла#круги).
, 2014). Yarrowia SCP теперь доступен в меньшем количестве в качестве продуктов Yarrowia Technology (продукты Yarrowia Equinox и Yarrowia GoodStart) от Skotan S.A. в Польше (http://www.yarrowiatechnology.com/?lang=3). Хотя масла и каротиноиды являются наиболее распространенными продуктами Yarrowia для использования человеком (Groenewald et al., 2014), американская компания Nucelis также предлагает богатую белком муку тысячелистника (https://www.nucelis.com/products. php?product=масла#круги).
Исследования и разработки в области SCP с различными видами грибов являются активными и продолжаются и могут привести к созданию новых продуктов или производственных процессов. Например, Чжао и др. (2013) описали процесс, в котором антибактериальные пептиды будут продуцироваться и секретироваться Y.lipolytica с получением высокоценного продукта, тогда как отработанные дрожжи можно было использовать в качестве СЦ, поскольку содержание в них белка было высоким. Большая часть текущих исследований сосредоточена на использовании отходов субстратов, таких как багасса сахарного тростника (например, Penicillium janthinellum с содержанием белка 46%, Rao et al. , 2010), пивоваренная дробина, гемицеллюлозный гидролизат (например, Debaryomyces hansenii , White et al., 2008; Kluyveromyces marxianus , Aggelopoulos et al., 2014), сыворотка (смешанные культуры дрожжей, Yadav et al., 2014, 2016; K. marxianus , Aggelopoulos et al., 2014), и смеси других обычных отходов пищевой промышленности, таких как остатки апельсинов и картофеля, патока и отработанные корешки солода ( K. marxianus , Aggelopoulos et al., 2014). Ангелопулос и др. (2014) использовали твердофазную ферментацию (SSF), а не глубинное культивирование, а также отметили, что более ценные продукты могут быть извлечены до использования обогащенных белком остатков в качестве корма для животных.
, 2010), пивоваренная дробина, гемицеллюлозный гидролизат (например, Debaryomyces hansenii , White et al., 2008; Kluyveromyces marxianus , Aggelopoulos et al., 2014), сыворотка (смешанные культуры дрожжей, Yadav et al., 2014, 2016; K. marxianus , Aggelopoulos et al., 2014), и смеси других обычных отходов пищевой промышленности, таких как остатки апельсинов и картофеля, патока и отработанные корешки солода ( K. marxianus , Aggelopoulos et al., 2014). Ангелопулос и др. (2014) использовали твердофазную ферментацию (SSF), а не глубинное культивирование, а также отметили, что более ценные продукты могут быть извлечены до использования обогащенных белком остатков в качестве корма для животных.
SCP от бактерий
Бактерии также имеют долгую историю использования в качестве SCP, особенно в кормах для животных.Некоторые из наиболее часто изучаемых видов были рассмотрены Anupama and Ravindra (2000), Rudravaram et al. (2009) и Nasseri et al. (2011) и в Таблице 3 представлен список последних исследований бактериальных SCP.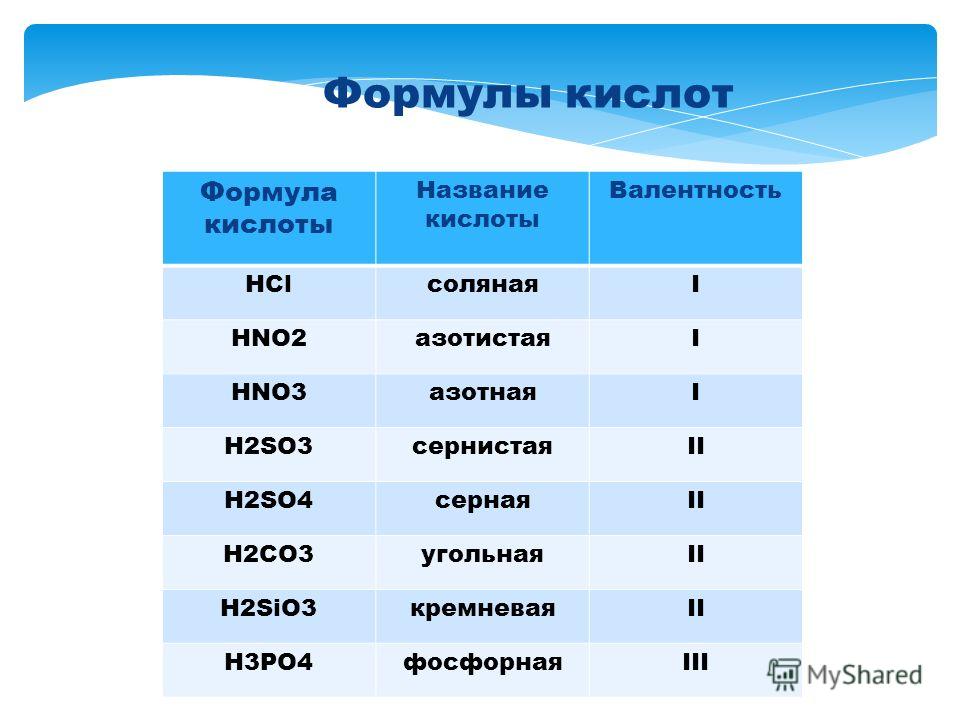
Таблица 3 . Недавние сообщения о содержании бактериального белка на определенных субстратах для видов, исследованных в качестве потенциальных источников SCP.
Bacterial SCP обычно содержит 50–80% белка в пересчете на сухую массу (Anupama and Ravindra, 2000), и ожидается, что содержание незаменимых аминокислот будет сравнимо с рекомендациями ФАО или превысит их (Erdman et al., 1977). Сообщалось о содержании метионина до 3,0% (Schulz and Oslage, 1976), что выше, чем обычно получаемое в SCP водорослей или грибов. Аналогичный аминокислотный состав наблюдается у бактерий, выращенных на метаноле или метане (Øverland et al., 2010). Как и грибы, бактериальные SCP имеют высокое содержание нуклеиновых кислот (8–12%), особенно РНК, и поэтому требуют обработки перед использованием в качестве пищи/корма (Kihlberg, 1972; Nasseri et al., 2011; Strong et al., 2015). ). В дополнение к белку и нуклеиновой кислоте, бактериальные SCP содержат некоторые липиды и витамины группы B.
Imperial Chemical Industries разработала SCP (Pruteen) для кормления животных из метанола с использованием бактерии Methylophilus methylotrophus . Прутин содержал до 70% белка и использовался в кормах для свиней (Johnson, 2013). Однако Pruteen не мог конкурировать с более дешевыми кормами для животных, которые были доступны в конце 1970-х годов, и производство было прекращено. Прутин был произведен из метанола, но в настоящее время метан вызывает интерес в качестве субстрата для SCP. UniBio A/S (с использованием знаний, полученных Dansk BioProtein A/S) и Calysta Inc.обе компании разработали технологию ферментации для преобразования природного газа в кормовой белок с использованием метанотрофных бактерий. UniBio A/S использует ферментер с U-образным контуром для достижения производительности 4 кг м -3 ч -1 , производя UniProtein ® с ~ 70% белка, который был одобрен для использования в кормах для животных ( http://www.unibio.dk/company/subpage-1/). Ферментер с U-образным контуром предназначен для повышения скорости массопереноса метана из газообразной фазы в жидкую, что делает больше метана доступным для бактерий (Petersen et al., 2017). Calysta Inc. открыла производственное предприятие для своего продукта FeedKind ® в Великобритании в 2016 году и в партнерстве с Cargill строит более крупное производственное предприятие в США (http://calysta.com/commercialization/). FeedKind ® , как и UniProtein ® , используется в кормах для животных. Метан является интересным субстратом, поскольку он является основным побочным продуктом животноводства и свиноводства (Philippe and Nicks, 2015), а также доступен при производстве биогаза (свалки, отходы).В настоящее время излишки метана сжигаются. VTT Ltd. исследует конструкцию реактора и варианты сочетания производства метана на фермах с производством микробного масла и кормового белка (http://www.vttresearch.com/media/news/protein-feed-and-bioplastic-from-farm).
Ферментер с U-образным контуром предназначен для повышения скорости массопереноса метана из газообразной фазы в жидкую, что делает больше метана доступным для бактерий (Petersen et al., 2017). Calysta Inc. открыла производственное предприятие для своего продукта FeedKind ® в Великобритании в 2016 году и в партнерстве с Cargill строит более крупное производственное предприятие в США (http://calysta.com/commercialization/). FeedKind ® , как и UniProtein ® , используется в кормах для животных. Метан является интересным субстратом, поскольку он является основным побочным продуктом животноводства и свиноводства (Philippe and Nicks, 2015), а также доступен при производстве биогаза (свалки, отходы).В настоящее время излишки метана сжигаются. VTT Ltd. исследует конструкцию реактора и варианты сочетания производства метана на фермах с производством микробного масла и кормового белка (http://www.vttresearch.com/media/news/protein-feed-and-bioplastic-from-farm). -биогаз) из метанотрофных бактерий Methylococcus capsulatus (группа I), Methylosinus trichosporium (группа II) и Methylocystis parvus (группа II).
-биогаз) из метанотрофных бактерий Methylococcus capsulatus (группа I), Methylosinus trichosporium (группа II) и Methylocystis parvus (группа II).
Как и в случае SCP из грибов, другие разработки в области производства бактериальных SCP сосредоточены на улучшении различных субстратов отходов или повышении ценности очистки сточных вод.Примеры включают обработку отходов переработки картофельного крахмала в двухстадийном процессе с использованием Aspergillus niger для разложения волокон в картофельных остатках и Bacillus licheniformis для производства белка (Liu et al., 2014). Экономический анализ показал, что этот процесс может решить не только проблему загрязнения крахмальной промышленности, но и нехватку белка для корма для животных в Китае (Liu et al., 2014). Другой пример одновременного управления сточными водами и производства SCP был описан Kornochalert et al.(2014) для отходов завода по производству листового каучука. Они продемонстрировали, что химическая потребность в кислороде, взвешенные твердые частицы и общее количество сульфидов в сточных водах были снижены пурпурной несерной бактерией Rhodopseudomonas palustris до уровней, которые соответствовали рекомендациям по использованию воды для орошения в Таиланде, и что полученная биомасса была подходящей. для SCP (Kornochalert et al., 2014).
для SCP (Kornochalert et al., 2014).
Соевая шелуха была ферментирована B. subtilis для повышения ее питательной ценности в качестве корма для животных с однокамерным желудком (Wongputtisin et al., 2014).
Кунасундари и др. (2013) описывают новый вторичный продукт, производимый совместно с бактериальными SCP. Они культивировали Cupriavidus necator в больших масштабах для получения биомассы с высоким содержанием как белка, так и полигидроксиалканоата (PHA). Эту биомассу скармливали крысам. Корм был не только хорошо переносимым и безопасным для крыс, но крысы также производили фекальные шарики, содержащие гранулы ПГА, что позволяло очищать значительные количества ПГА без использования сильных растворителей (Kunasundari et al., 2013).
Обработка SCP
В зависимости от материала субстрата и предполагаемого применения в качестве пищевых продуктов/кормов, перед приготовлением конечного продукта SCP требуются различные этапы обработки. В следующем разделе мы рассмотрим наиболее важные потребности в обработке для SCP.
Деградация клеточной стенки в белковых продуктах одиночных клеток
Некоторые SCP используются в качестве препаратов цельных клеток, в то время как в других клеточная стенка может быть разрушена, чтобы сделать белок более доступным.SCP, такие как Quorn™, можно употреблять без деградации клеточной стенки, и в этом случае хитин и глюкан из клеточных стенок грибов добавляют клетчатку в рацион (Wiebe, 2004). SCP, полученный из Euglena , не требует разрушения, поскольку клетки имеют белковые оболочки, а не клеточные стенки, что делает его более легко усваиваемым.
Для разрушения клеточной стенки использовались различные методы, в том числе механические воздействия (раздавливание, крошение, измельчение, гомогенизация под давлением или обработка ультразвуком), гидролитические ферменты (эндогенные или экзогенные), химическое разрушение детергентами или комбинации этих методов ( рассмотрено в Nasseri et al., 2011). Разрушение клеток может повлиять на качество и количество белка и других компонентов SCP. Такие продукты, как Marmite ® и Vegemite ® , представляют собой клеточные экстракты, полученные путем нагревания клеток до 45–50°C, достаточного для того, чтобы внутриклеточные ферменты частично гидролизовали клеточную стенку; белки также восстанавливаются до более мелких пептидов (Trevelyan, 1976; Ugalde and Castrillo, 2002).
Такие продукты, как Marmite ® и Vegemite ® , представляют собой клеточные экстракты, полученные путем нагревания клеток до 45–50°C, достаточного для того, чтобы внутриклеточные ферменты частично гидролизовали клеточную стенку; белки также восстанавливаются до более мелких пептидов (Trevelyan, 1976; Ugalde and Castrillo, 2002).
Удаление нуклеиновой кислоты в продуктах одноклеточного белка
Хотя водоросли обычно имеют низкое содержание нуклеиновой кислоты, быстро размножающиеся виды бактерий и грибов имеют высокое содержание нуклеиновой кислоты (РНК).На содержание и деградацию РНК влияют условия роста, скорость роста и соотношение углерода и азота (Trevelyan, 1976). Когда SCP производится для потребления человеком, высокое содержание нуклеиновой кислоты представляет собой проблему, поскольку прием внутрь пуриновых соединений, образующихся в результате распада РНК, увеличивает концентрацию мочевой кислоты в плазме, что может вызвать подагру и образование камней в почках (Edelman et al. , 1983). SCP с высоким содержанием нуклеиновых кислот, предназначенные для кормления животных, рекомендуются только для кормления животных с короткой продолжительностью жизни (Strong et al., 2015). Gao and Xu (2015) и Xu (2015) недавно описали методы измерения содержания нуклеотидов в сложных продуктах SCP.
, 1983). SCP с высоким содержанием нуклеиновых кислот, предназначенные для кормления животных, рекомендуются только для кормления животных с короткой продолжительностью жизни (Strong et al., 2015). Gao and Xu (2015) и Xu (2015) недавно описали методы измерения содержания нуклеотидов в сложных продуктах SCP.
Были разработаны и продолжают использоваться различные методы снижения содержания РНК в SCP (Sinskey and Tannenbaum, 1975). Эндогенные ферменты, расщепляющие РНК (рибонуклеазы), могут быть использованы для деградации РНК после активации термической обработкой (60–70°C), используемой при производстве Quorn™ (Anderson and Solomons, 1984). Рибонуклеазы также могут быть добавлены в процесс или использованы в качестве иммобилизованных ферментов (Martinez et al., 1990; Хамеш и Демир, 2015 г.). Деградированные компоненты РНК диффундируют из клеток, но также происходит потеря биомассы (35–38%). Процесс был улучшен за счет использования более высоких температур (72–74°C) в течение 30–45 мин с меньшей потерей биомассы (потеря 30–33%; Ward, 1998). Повышение температуры требует подачи пара, что является фактором стоимости, но тепло также необходимо для окончательной обработки биомассы при 90°C после активации РНКазы (Knight et al., 2001).
Повышение температуры требует подачи пара, что является фактором стоимости, но тепло также необходимо для окончательной обработки биомассы при 90°C после активации РНКазы (Knight et al., 2001).
Также изучались методы щелочного гидролиза и химической экстракции.Viikari и Linko (1977) использовали обработку щелочью для снижения содержания РНК в биомассе P. varioti , используемой в процессе Pekilo, до уровня ниже 2%. Обработка при 65°С, рН 7,5-8,5 для активации эндогенной рибонуклеазы также снижала содержание РНК до <2%, в то время как содержание белка оставалось на уровне 50%.
Безопасность SCP
Как и любой пищевой продукт или корм, SCP должен быть безопасным в производстве и использовании. В большинстве регионов существуют правила, обеспечивающие безопасность пищевых продуктов или кормов для потребления (Багчи, 2006 г.).Как правило, они различают не только пищу (для людей) и корм (для животных), но также пищу (обеспечивающую питание и потенциально вкус и аромат) и пищевые добавки (консерванты, красители, модификаторы текстуры и т. д.) или корм и корм. добавки. Точные определения могут различаться в зависимости от региона, но международные стандарты, регулируемые Объединенным комитетом экспертов ФАО/ВОЗ по пищевым добавкам, применяются к продуктам, поступающим в международную торговлю (ВОЗ, 2017 г.). Правила различаются в зависимости от предполагаемого назначения продукта, и, хотя ожидается, что SCP будет либо пищевым продуктом, либо кормом (обеспечивающим питание), некоторые продукты могут поступать на рынок в качестве добавок (например,g., обеспечивающие цвет), а не в качестве SCP, даже несмотря на то, что в продукте присутствует белок, что ограничивает степень их добавления и их ценность в качестве SCP. Коппенс и др. (2006) резюмировали европейские правила, касающиеся продуктов питания и пищевых добавок, и пришли к выводу, что «процесс подготовки «функциональных пищевых продуктов» к рынку, безусловно, является дорогостоящей и трудоемкой задачей», но также и то, что этот процесс может быть успешным.
д.) или корм и корм. добавки. Точные определения могут различаться в зависимости от региона, но международные стандарты, регулируемые Объединенным комитетом экспертов ФАО/ВОЗ по пищевым добавкам, применяются к продуктам, поступающим в международную торговлю (ВОЗ, 2017 г.). Правила различаются в зависимости от предполагаемого назначения продукта, и, хотя ожидается, что SCP будет либо пищевым продуктом, либо кормом (обеспечивающим питание), некоторые продукты могут поступать на рынок в качестве добавок (например,g., обеспечивающие цвет), а не в качестве SCP, даже несмотря на то, что в продукте присутствует белок, что ограничивает степень их добавления и их ценность в качестве SCP. Коппенс и др. (2006) резюмировали европейские правила, касающиеся продуктов питания и пищевых добавок, и пришли к выводу, что «процесс подготовки «функциональных пищевых продуктов» к рынку, безусловно, является дорогостоящей и трудоемкой задачей», но также и то, что этот процесс может быть успешным.
Smedley (2013) содержит полезные ссылки на конкретные правила, касающиеся кормов и кормовых добавок в Бразилии, Канаде, Китае, Европейском союзе, Японии, Южной Африке и США, а также различия между правилами в этих регионах.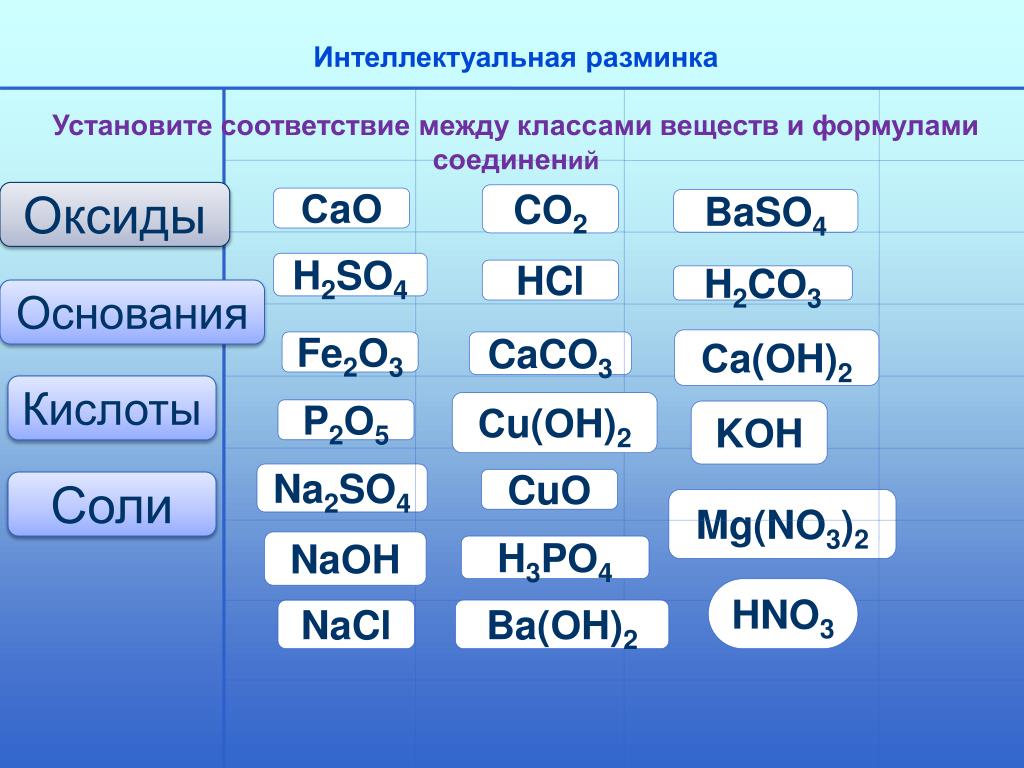 Следует отметить, что не все животные считаются одинаковыми во всех регионах, поэтому корм для домашних животных регулируется как корм в одних регионах, но не в других. Перед продажей нового корма или добавок требуется разрешение (Smedley, 2013).
Следует отметить, что не все животные считаются одинаковыми во всех регионах, поэтому корм для домашних животных регулируется как корм в одних регионах, но не в других. Перед продажей нового корма или добавок требуется разрешение (Smedley, 2013).
Основные проблемы связаны с содержанием РНК, токсинами, продуцируемыми микробами (производителями или загрязнителями), потенциальными симптомами аллергии и вредными веществами, полученными из исходного сырья, такими как тяжелые металлы. Были разработаны и используются в промышленности способы снижения содержания РНК до приемлемых уровней, как обсуждалось выше.
Проблема токсинов решается путем тщательного выбора производственных организмов, условий процесса и рецептуры продукта. Некоторые грибы продуцируют микотоксины, что делает их нежелательными источниками SCP (Anupama and Ravindra, 2000). Эффекты грибковых токсинов варьируются от аллергических реакций до канцерогенеза и смерти. Поражаются как люди, так и животные, поэтому микотоксины недопустимы в SCP для потребления людьми или животными. Микопротеин Quorn™ прошел тщательное тестирование на наличие микотоксинов или других токсичных соединений, прежде чем был одобрен для употребления человеком (Wiebe, 2004).Конкретный штамм F. venenatum не продуцирует микотоксины в производственных условиях, но процесс по-прежнему контролируется, чтобы убедиться, что они отсутствуют. Первоначальное тестирование безопасности микопротеина Quorn™ заняло 16 лет, и еще много лет потребовалось, чтобы получить разрешение на продажу за пределами Великобритании (Solomons, 1986). Y. lipolytica — еще один грибок, безопасность которого была тщательно оценена, продемонстрировав, что его можно безопасно использовать в различных пищевых продуктах, в том числе в качестве SCP (Groenewald et al., 2014).
Микопротеин Quorn™ прошел тщательное тестирование на наличие микотоксинов или других токсичных соединений, прежде чем был одобрен для употребления человеком (Wiebe, 2004).Конкретный штамм F. venenatum не продуцирует микотоксины в производственных условиях, но процесс по-прежнему контролируется, чтобы убедиться, что они отсутствуют. Первоначальное тестирование безопасности микопротеина Quorn™ заняло 16 лет, и еще много лет потребовалось, чтобы получить разрешение на продажу за пределами Великобритании (Solomons, 1986). Y. lipolytica — еще один грибок, безопасность которого была тщательно оценена, продемонстрировав, что его можно безопасно использовать в различных пищевых продуктах, в том числе в качестве SCP (Groenewald et al., 2014).
Бактерии также могут производить токсины, что ограничивает их использование в качестве SCP. Токсины могут быть внеклеточными (экзотоксины) или связанными с клетками (эндотоксины). Например, как Pseudomonas spp. и Methylomonas methanica продуцируют высокие уровни белка и были оценены для использования в качестве SCP. Оба также производят эндотоксины, вызывающие лихорадочные реакции (Rudravaram et al., 2009). Они могут быть уничтожены нагреванием. Кроме того, исследование иммуногенности SCP из M. capsulatus показало, что бесклеточный препарат (т.е., клеточная стенка удалена) не вызывали иммунных ответов у мышей, хотя препараты цельных клеток вызывали (Steinmann et al., 1990).
Оба также производят эндотоксины, вызывающие лихорадочные реакции (Rudravaram et al., 2009). Они могут быть уничтожены нагреванием. Кроме того, исследование иммуногенности SCP из M. capsulatus показало, что бесклеточный препарат (т.е., клеточная стенка удалена) не вызывали иммунных ответов у мышей, хотя препараты цельных клеток вызывали (Steinmann et al., 1990).
Использование различных типов отходов сырья для производства SCP привлекательно с точки зрения стоимости и устойчивости, но может быть проблематичным с точки зрения безопасности, и необходимо тщательно учитывать происхождение сырья. Например, Quorn™ производится в среде определенного химического состава из глюкозы (гидролизованный крахмал) в четко определенном процессе, соответствующем стандартам GLP (Wiebe, 2002, 2004).Любой продукт для потребления человеком, который будет производиться из гидролизатов биомассы или потоков отходов, должен обеспечить эквивалентные показатели безопасности, прежде чем будет одобрен в Европе или Северной Америке. В дополнение к требованиям безопасности, связанным с использованием субстратов, полученных из отходов, для SCP, общественное восприятие и принятие пищевых продуктов, полученных из отходов, будет ключевым элементом, который следует учитывать при внедрении SCP в рацион человека.
В дополнение к требованиям безопасности, связанным с использованием субстратов, полученных из отходов, для SCP, общественное восприятие и принятие пищевых продуктов, полученных из отходов, будет ключевым элементом, который следует учитывать при внедрении SCP в рацион человека.
Генетически модифицированные организмы в производстве SCP — будущие возможности
Использование генетически модифицированных организмов (ГМО) в продуктах питания и кормах еще не получило общественного признания в Европе, хотя в других странах мира оно получило большее признание.По мере накопления данных о потреблении ГМО они могут получить дальнейшее признание, поскольку источники белка становятся все более дефицитными, особенно если развивается рынок здорового или персонализированного питания. ГМО-дрожжи с заводов по производству биоэтанола уже можно использовать в качестве корма для скота в некоторых странах. Использование генетических элементов самого хозяина (самоклонирование) часто означает отсутствие введения чужеродной ДНК.
Хотя Голдберг (1988) обсуждал перспективу использования генно-инженерных микробов в качестве SCP в 1980-х годах как средство улучшения экономики процесса за счет производства побочных продуктов (например,g., фермент, органическая кислота или антибиотик), эта концепция не получила дальнейшего развития и в последние годы приобрела все больший интерес и признание. Был рассмотрен широкий спектр преимуществ продуктов SCP от генетической модификации. Например, компания DuPont с помощью генной инженерии разработала дрожжи для производства жирных кислот омега-3 с длинной цепью, необходимых для здоровья человека (Xie et al., 2015). Секвенирование генома и генная инженерия также позволяют разрушить гены, участвующие в производстве токсинов, и, таким образом, повысить безопасность некоторых продуктов SCP.Нарушение генов может быть достигнуто с помощью традиционного мутагенеза и скрининга, но этот процесс может привести к нежелательным мутациям в продукте, тогда как генетическая модификация является более быстрой и специфичной. Этому будут способствовать новые технологии, такие как кластеризованные короткие палиндромные повторы с регулярными интервалами (CRISPR), которые позволяют проводить специальное редактирование генома без введения новой ДНК. Штаммы, модифицированные с помощью CRISPR, не обязательно считаются ГМО. Методология CRISPR также может исключить введение в организм генов устойчивости к антибиотикам, избегая беспокойства по поводу распространения генов устойчивости к антибиотикам за счет использования ГМО.
Метаболизм источников углерода является еще одной целью улучшения процессов производства SCP, поскольку источник углерода может быть основной статьей расходов при производстве SCP (Ugalde and Castrillo, 2002). Генная инженерия может расширить спектр субстратов, используемых продуктивным организмом, или повысить эффективность их использования, позволяя использовать несколько исходных материалов и гарантируя использование всего потенциального углерода в сырье. Например, Рен и др. (2016) представили возможность ферментации ксилозы от Candida intermedia до S.cerevisiae путем вставки генома, чтобы обеспечить производство этанола из глюкозы и производство SCP из ксилозы, в то время как Cui et al. (2011) ввели инулазу в Y. lipolytica . Точно так же экспрессия одного или нескольких гидролитических ферментов улучшила использование полимерных субстратов (Song et al., 2017). Целлюлоза, крахмал или сыворотка могут быть использованы в консолидированных биопроцессах организмом, модифицированным для производства индивидуального ферментного коктейля, подходящего для конкретного сырья. Организмы также могут быть сконструированы так, чтобы они обладали повышенной устойчивостью к кислоте, щелочи или другим соединениям, связанным с конкретными субстратами.
Генетические модификации могут также повысить нутрицевтическую ценность биомассы либо за счет оптимизации аминокислотного состава, либо за счет увеличения содержания определенных витаминов (например, витамина D, витамина B, биотина), жирных кислот, глутатиона и т. д. с белком. Существуют широкие возможности для создания SCP с индивидуально подобранным персонализированным питательным составом.
Генная инженерия также может предоставить новые способы сбора белков для включения в продукты питания или корма.Например, модификация для улучшения флокуляции может снизить затраты на сбор клеток, или клетки могут быть модифицированы, чтобы иметь набор ферментов, разрушающих клеточную стенку, которые будут активироваться специфическими внеклеточными стимулами для получения белков без клеточных стенок. Точно так же рибонуклеазы можно сконструировать так, чтобы они активировались в определенное время в условиях, при которых протеазы не активируются. Морфологические характеристики также потенциально могут быть изменены для обеспечения определенных органолептических свойств.
Экономические аспекты
Развитие процессов SCP всегда было вызвано потребностью в белке, и это продолжает оставаться важной движущей силой в развитии как старых, так и новых процессов. Повышение ценности легкодоступных субстратов и потоков отходов также было и остается сильным фактором. УПП часто рассматривается как потенциальный побочный продукт, который может усилить экономический потенциал убыточного в других отношениях процесса биопереработки, а также как средство снижения затрат на последующую переработку, необходимых для удаления технологических отходов.Продажа остаточной биомассы в качестве корма предпочтительнее продажи в качестве удобрения. Это видно из многочисленных публикаций и патентов (не рассмотренных в данном обзоре), в которых конкретные продукты жизнедеятельности превращаются в ТП и оцениваются как корм для конкретных животных. Тем не менее, экологические проблемы теперь также играют важную роль в разработке новых продуктов SCP. Это особенно заметно в процессах, использующих парниковые газы: SCP водорослей из CO 2 и SCP бактерий из метана.Такие процессы вряд ли будут экономически жизнеспособными в краткосрочной перспективе, поскольку при крупномасштабном выращивании еще предстоит решить много проблем, но они могут выжить там, где они могут получить выгоду от «зеленой премии». Кроме того, экологические, а также экономические соображения помогают стимулировать разработку продуктов из потоков отходов.
Помимо экологических преимуществ, ключевыми элементами при оценке экономической эффективности процесса производства SCP являются общая стоимость продукта, капиталовложения и прибыльность.Угальде и Кастрилло (2002) подсчитали, что при производстве грибковых SCP 62% общей стоимости продукта приходится на сырье и 19% на производственный процесс. Согласно Aggelopoulos et al. (2014), стоимость сырья варьируется от 35 до 55% производственных затрат, тогда как эксплуатационные расходы, включая рабочую силу, энергию и расходные материалы, составляют 45–55%. Использование побочных потоков и отходов биомассы иногда рассматривается как средство снижения затрат на субстрат в тех случаях, когда субстрат не ставит под угрозу удобство использования конечного продукта.
Масштаб также важен для экономической жизнеспособности производства SCP. Между затратами и масштабами производства существует эмпирическая зависимость. Было доказано, что непрерывные операции являются наиболее прибыльными, и большинство процессов SCP, которые были реализованы в промышленных масштабах, были адаптированы к непрерывному дизайну (Ugalde and Castrillo, 2002). С другой стороны, производство некоторых продуктов в домашних условиях в небольших масштабах может стать возможным, во многом так же, как домашнее производство йогуртов или грибов, и как было предложено для питания растительных клеток без растений (Poutanen et al., 2017).
Обновленная информация о промышленном производстве SCP — игроки и мощности
В Таблице 4 перечислены компании, которые, как сообщается, производят SCP или проявляют к ним интерес, с веб-сайтами и информацией о патентах, если таковые имеются. Ниже приводится краткое описание некоторых действующих компаний.
Алгеон Инк . продуцирует β-глюкан и продукты целых клеток из фотосинтезирующих простейших Euglena gracillis . Компания Algaeon была запущена в 2011 году и базируется в США
.BlueBioTech Int.GmbH , компания по биотехнологии микроводорослей, которая работает более 10 лет и производит большое количество Spirulina и Chlorella .
Калиста Инк . была основана как частная компания в 2011 году. Она производит FeedKind ® из метана на пилотной установке в Великобритании и начала распространять коммерческие образцы в 2017 году. США в 2019 году.
Cangzhou Tianyu Feed Additive Co., Ltd — производитель и торговая компания, расположенная в провинции Хэбэй, Китай, с 2004 года. Их основными продуктами являются дрожжевой порошок, хлорид холина, бетаин и аллицин, которые продаются в Юго-Восточной Азии, Восточной Азии, Океании, Южной Азии и Южной Америке. В компании работает 50 человек, а их общий доход составляет 5–10 млн долларов США.
CBH Qingdao Co., Ltd уже несколько десятилетий занимается поставкой ряда ингредиентов и добавок для кормовой и пищевой промышленности. Они могут поставлять продукцию, соответствующую стандартам FAMI-QS, ISO, GMP, KOSHER и HALAL.
Cyanotech Corporation является одним из ведущих мировых производителей Spirulina с продажами в США и 30 других странах. Их оборот в 2016 году составил почти 32 миллиона долларов США. FDA присвоило компании Cyanotech Spirulina статус GRAS в качестве пищевого ингредиента.
Прародитель Earthrise , Proteus Corporation была основана в 1976 году. Они производят Spirulina со статусом GRAS. Они сертифицированы GMP и имеют сертификат системы безопасности пищевых продуктов (FSSC) 22000:2011.
EID Parry Ltd., Parry Nutraceuticals Division является частью группы Murugappa Group стоимостью 4,4 миллиарда долларов США. Они используют технологию микроводорослей для производства нутрицевтиков, таких как Spirulina и Chlorella . Их продукция продается более чем в 40 странах, а их основные рынки находятся в Северной Америке, Европе, Юго-Восточной Азии и на Дальнем Востоке.
Euglena Co. Ltd . была основана в Японии в 2005 году. Среди других продуктов, полученных из Euglena gracillis , Euglena Co.Ltd. разрабатывает обезжиренную эвглену как источник богатого белком корма для животных.
Компания KnipBio была основана в 2013 году в США с целью предоставления доступных кормов для аквакультуры. Они производят KnipBio Meal из метанола с использованием метилотрофной бактерии и планируют начать коммерческое производство в 2018 году.
Лаллеманд Инк . — канадская компания, специализирующаяся на разработке, производстве и продаже дрожжей и бактерий. В компании есть две основные группы: Yeast Group (базируется в Монреале, Канада) и Specialties Group (базируется в Тулузе, Франция).Они производят SCP для потребления человеком (LBI, Lake States ® , Engevita™) из дрожжей S. cerevisiae и Torula .
LeSaffre производит дрожжи ( S. cerevisiae ) и продукты на их основе, включая SCP, такие как Lynside ® Nutri, Lynside ® ProteYn и родственные продукты (Lesaffre Human Care products), а также вкусовые ингредиенты на основе дрожжей. (продукция Биоспрингер). Компания насчитывает 7700 сотрудников и более 80 дочерних компаний в более чем 40 странах.Их продукты и услуги продаются более чем в 180 странах, а их оборот в 2013 году составил около 1,6 миллиарда евро.
Marlow Foods Ltd производит микопротеин Quorn™. Проект разработки Quorn начался еще в 1960-х годах, когда они начали искать источник микробного белка, который был бы полезен людям. Quorn классифицируется регулирующими органами по всему миру, включая FDA и Агентство по пищевым стандартам Великобритании (FSA), как безопасный, хорошо переносимый продукт питания. В 2015 году компания была приобретена корпорацией Monde Nissin на Филиппинах за 831 миллион долларов США.
Nucelis Inc . была основана в 2010 году в США, но стала дочерней компанией Cibus Global в 2014 году. Наряду со скваленом, витамином D и пищевыми маслами Nucelis Inc. разрабатывает муку с высоким содержанием белка из дрожжей Yarrowia .
Компания Nutrinsic базируется в США и имеет дочерние компании в Китае. Nutrinsic специализируется на использовании сточных вод пищевой промышленности, производства напитков и производства биотоплива для производства кормов и удобрений. Они продают SCP для корма для животных под названием ProFloc™, содержание белка в котором составляет около 60%.Они открыли свое первое производственное предприятие в США в 2015 году, используя сточные воды местного пивоваренного завода.
Tangshan Top Bio-Technology Co., Ltd является производителем и торговой компанией, расположенной в провинции Хэбэй, Китай (материк). Их основная продукция: пивные дрожжи, автолизированные дрожжи, клеточная стенка дрожжей и дрожжевой экстракт, в том числе 100% натуральный, не содержащий ГМО, чистый дрожжевой порошок в качестве кормовой добавки для животных по цене 1 100–1 250 долларов США за тонну и производственная мощность 15 000 тонн. в год на одну производственную линию.Компания была основана в 2009 году и насчитывает около 200 сотрудников. Их основные рынки сбыта находятся в Китае, Восточной Азии, Западной Европе, Юго-Восточной Азии и Среднем Востоке, при этом 40–50% их продукции экспортируется.
TerraVia Holdings, Inc . — публичная американская компания, специализирующаяся на производстве ингредиентов для продуктов питания и средств по уходу из эукариотических водорослей. TerraVia появилась в 2016 году, но является производной от Solazyme Inc., которая была основана в 2003 году. TerraVia использует традиционные реакторы с мешалкой для выращивания водорослей.
UniBio A/S, Дания — это МСП, владеющее правами на уникальную технологию ферментации — технологию U-Loop, которая позволяет преобразовывать природный газ в продукт с высоким содержанием белка — UniProtein ® . UniProtein ® имеет содержание белка около 71% и может использоваться в кормах для животных. Компания UniBio A/S была создана в 2001 году.
Unilever производит дрожжевой экстракт Marmite ® из пивоваренной дробины. Количество сотрудников составляет около 169 000 человек, а оборот компании составил 52 доллара США.7 миллиардов в 2016 году.
Vega Pharma Ltd расположена в Чжэцзяне, Китай. Vega Group занимается разработкой, производством и продажей фармацевтических препаратов, пищевых ингредиентов, продуктов для здоровья животных и пробиотиков. Они предлагают SCP с содержанием белка до 65% и относительно высоким уровнем треонина для кормления животных в качестве побочного продукта производства глутамата натрия.
Таблица 4 . Промышленные предприятия, занимающиеся производством SCP.
Последние патенты (2001–2016 гг.)
Недавние патенты (2001–2016 гг.), связанные с производством SCP с использованием водорослей, грибков, бактерий и смешанных микробных популяций, перечислены в таблицах 5–8.Некоторые из патентов, принадлежащих промышленным операторам, также показаны в Таблице 4. Количество патентов, связанных с использованием водорослей, бактерий, дрожжей или смешанных популяций, распределяется относительно равномерно. Также было подано множество патентов, в которых микробная биомасса образует компонент кормовой смеси, предназначенной для обеспечения белком и другими питательными веществами рыб или сельскохозяйственных животных. Они не были включены в таблицы 5–8, поскольку неясно, сколько белка обеспечивается микробом, а сколько другими компонентами, такими как соевая, бобовая или рыбная мука.
Таблица 5 . Патенты, связанные с производством SCP из водорослей в течение 2001–2016 гг.*.
Таблица 6 . Патенты, связанные с производством SCP из дрожжей или мицелиальных грибов в течение 2001–2016 гг.*.
Таблица 7 . Патенты, связанные с производством SCP из бактерий в 2001–2016 гг.*.
Таблица 8 . Патенты, связанные с производством SCP из смешанных микробных популяций (бактерий и/или дрожжей и/или водорослей) или в которых микроорганизм не указан в течение 2001–2016 гг.*.
Промышленность и университеты Китая в последние годы проявляли особую активность в подаче заявок на патенты, связанные с УПП, при этом около 70% патентов, выданных с 2001 г., были поданы в Китае. В Китае большое внимание уделялось производству SCP путем ферментации сельскохозяйственных или пищевых остатков бактериями, дрожжами и смешанными популяциями. Таким образом, производство SCP часто сочетается с биоремедиацией и переработкой отходов.
Несколько важных патентов, связанных с использованием соединений C1, таких как метанол и метан, были поданы до 2001 г. и не были включены в этот обзор.Однако было выдано два новых патента на производство СХД из метанола и шесть на производство СХД из метана (табл. 7). SCP из водорослей также продолжает генерировать патенты, при этом внимание привлекает рецептура продуктов, а также постоянные разработки в методах культивирования (таблица 5).
Заключительные замечания
Как видно из Таблицы 4, производством SCP занимается множество отраслей, некоторые из которых производят SCP как побочный продукт других процессов, а другие сосредоточены в основном на SCP.SCP из мицелиальных грибов и дрожжей продолжают доминировать на устоявшихся рынках, особенно при рассмотрении SCP для потребления человеком. Дрожжевые SCP имеют долгую историю использования, что способствует их дальнейшему признанию на рынке. Однако SCP для человека из мицелиальных грибов, вероятно, останется ограниченным F. venenatum (Quorn™) и твердофазной ферментацией с другими пищевыми грибами из-за риска микотоксинов и долгого пути к одобрению регулирующими органами. Дрожжи также имеют долгую историю использования в качестве добавок в кормовой промышленности.Большая часть грибковых SCP, поставляемых в корм для животных, является побочным продуктом производства продуктов питания и напитков, а также биоперерабатывающих заводов, в которых гриб сначала действует как биокатализатор для создания основного продукта, а затем обеспечивает обогащенные белком остатки, которые продаются в качестве корма. Грибковые SCP предлагают преимущества знакомости, хорошо зарекомендовавших себя подходов к обработке и доступности. Основной барьер заключается во внедрении SCP новых видов, которые вызывают академический и патентный интерес, но которые трудно вывести на рынок.
Водоросли также имеют хорошо зарекомендовавшие себя рынки как продуктов питания, так и кормов, хотя они традиционно ориентированы не на водоросли в качестве SCP, а скорее как пищевые добавки, содержащие омега-3 жирные кислоты, каротиноиды и витамины, а также белок в качестве дополнительного преимущества. Поскольку продукты рассматривались как добавки или красители, нормативные требования отличаются от требований для непосредственного использования в пищевых продуктах или кормах, что облегчает введение новых видов для потенциальных продуктов. Продукты из водорослей обычно имеют ароматизаторы, которые могут ограничивать количество, которое человек хотел бы потреблять, уменьшая потребность в обширной обработке для уменьшения количества РНК, но также ограничивая количество белка, вводимого в рацион.Тем не менее, несколько молодых МСП, вышедших на рынок, разрабатывают процессы производства продуктов со слабым запахом, которые могли бы увеличить долю белка водорослей в рационе человека. Algal SCP предлагает преимущества, заключающиеся в обеспечении здоровых липидов вместе с белком при потенциальном потреблении CO 2 . Его преимущество заключается в том, что он считается экологически чистым и очень «зеленым». Основными препятствиями являются стоимость производства и необходимость в новой рецептуре, чтобы сделать ее приемлемой для человека.Algal SCP, вероятно, будет сильна в кормовой промышленности, если удастся снизить производственные затраты.
Бактериальный SCP в первую очередь ограничивается кормовой промышленностью, если не включает цианобактериальные продукты с нефотосинтезирующими бактериями. Некоторые бактериальные SCP в настоящее время являются побочным продуктом других отраслей, таких как производство глутамата натрия, и ожидается, что этот тип кормового продукта будет увеличиваться с расширением биоперерабатывающих заводов, как и в случае с дрожжами. Однако наиболее интересные современные разработки бактериальных SCP связаны с использованием метана в качестве источника углерода.Хотя использование метана для производства бактериальной биомассы не ново, движущие силы, продвигающие разработки, сместились с метана как дешевого источника углерода на бактерии как средство сокращения выбросов парниковых газов и потенциальную интеграцию производства кормов с животноводством. . Низкая растворимость метана в сочетании с низкой скоростью роста бактерий представляет собой серьезное препятствие для успеха в этой области. Однако молодые МСП, такие как UniBio и Calysta Inc., считают, что барьеры можно преодолеть.Бактериальный SCP, отличный от метанового, предлагает преимущества в высокой производительности, но имеет недостатки из-за низкой известности и высокого содержания нуклеиновой кислоты, что увеличивает затраты на обработку.
SCP изначально приобрел значение в питании человека во время войны, когда традиционные источники белка стали дефицитными. Он снова вызвал интерес во второй половине двадцатого века из-за беспокойства по поводу удовлетворения потребностей в белке постоянно растущего населения мира. Эти опасения были глобальными, но когда мы рассматриваем нынешний интерес к УПП, мы видим, что в настоящее время исследования и разработки новых УПП проводят страны с большим населением (например,г., Китай и Индия) и проблемы с недоеданием. Самые последние патенты, связанные с УПП, были поданы в Китае, что указывает на важность УПП для будущих продуктов питания и кормов. Можно ожидать быстрого роста продуктов SCP в Китае и, возможно, во всей Азии. Разработка SCP из водорослей является исключением из этого наблюдения, поскольку в последние годы по всему миру было создано множество компаний для разработки продуктов, которые могут использовать текущий избыток CO 2 . Таким образом, движущие силы развития SCP водорослей несколько отличаются от движущих сил развития SCP бактерий и грибов.Производство SCP из метана разделяет эту экологическую проблему и возможности с развитием водорослей.
Увеличение количества процессов биопереработки в рамках расширения концепций биоэкономики и экономики замкнутого цикла также выступает в качестве движущей силы для разработки SCP для использования в качестве корма для животных, поскольку преобразование отходов в корм для животных обеспечивает более высокую отдачу от инвестиции, чем сжигание остаточной микробной биомассы или использование ее в качестве удобрения. Для использования новых продуктов в кормах для животных по-прежнему требуется разрешение регулирующих органов, но оно отличается от разрешения, необходимого для использования в пищу человеком, и более широкий диапазон субстратов считается приемлемым, когда продукт предназначен для использования животными.Таким образом, можно ожидать большего расширения доступных SCP для корма для животных, чем для пищи человека. Тем не менее, растет понимание неэффективности преобразования растительной биомассы в SCP, которые скармливаются животным, а не непосредственно людям, что также подтолкнет к разработке безопасных SCP в качестве пищи.
На западе интерес к здоровому питанию и новой еде помогает стимулировать новый интерес к SCP, а также стирает границы того, какие продукты могут быть включены в SCP. Клеточные культуры как растительных, так и животных клеток могут в будущем способствовать обеспечению продовольствием (Poutanen et al., 2017), но не соответствуют определению SCP как полученного из микробных клеток. Кроме того, формы, в которых можно употреблять SCP, продолжают развиваться. SCP-дрожжи десятилетиями потреблялись в виде клеточного экстракта в виде пасты, которую можно намазывать на хлеб, в то время как SCP-гриб, используемый в Quorn™, был преднамеренно разработан как продукт, который можно приготовить в виде кусочков и ломтиков, которые будут более очень похоже на мясо. Недавно разработанные продукты часто изготавливаются в виде сухих порошков или муки, которые предназначены для смешивания с другими ингредиентами для создания продуктов, в которых отдельные компоненты не воспринимаются.Такие продукты подходят для включения в популярные в настоящее время протеиновые батончики и напитки, такие как смузи. Кроме того, продолжается разработка ферментации в твердом состоянии, в которой используются микробы для повышения качества белка и вкусовых качеств растительных продуктов или ингредиентов с низким содержанием питательных веществ. Строго говоря, это не SCP, поскольку и микроб, и исходный субстрат вносят свой вклад в конечный продукт, но они также будут вносить свой вклад в поставку белка в будущем. Наличие широкого ассортимента пищевых продуктов, содержащих УПП, должно способствовать дальнейшему расширению рынка.
Вклад авторов
AR, SH и MT в равной степени участвовали в исследовании и написании этой статьи. MW предоставил информацию о SCP водорослей и грибов, участвовал в написании статьи, а также рассмотрел и отредактировал рукопись.
Финансирование
Авторы благодарят ООО «ВТТ» за финансовую поддержку.
Заявление о конфликте интересов
Авторы являются сотрудниками VTT Technical Research Center of Finland Ltd. и заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.MW получала финансовую поддержку от Marlow Foods в 1986–1989 годах и работала в проектах, поддерживаемых Marlow Foods с 1989 по 1994 год, но не сотрудничала с ними на постоянной основе.
Другие авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят Drs. Johanna Buchert, Laura Ruohonen и Tiina Nakari-Setälä за запрос на обзор и поддержку его публикации.
Сокращения
DSP, нисходящая обработка; ГМО, генетически модифицированный организм; GRAS, общепризнанный безопасный; SCP, одноклеточный белок; QPS, Квалифицированная презумпция безопасности микроорганизмов в пищевых продуктах и кормах.
Каталожные номера
Ангелопулос, Т., Кациерис, К., Бекатору, А., Пандей, А., Банат, И. М., и Кутинас, А. А. (2014). Твердофазная ферментация смесей пищевых отходов для производства одноклеточного белка, ароматических летучих веществ и жира. Пищевая хим. 145, 710–716. doi: 10.1016/j.foodchem.2013.07.105
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ахмади, А. Р., Гурчиан, Х., Хаджихосайни, Р., и Ханифар, Дж. (2010). Определение количества белка и аминокислот, выделенных из микробного белка (БББ) лигноцеллюлозных отходов. Пакистан J. Biol. Наука . 13, 355–361. doi: 10.3923/pjbs.2010.355.361
Полнотекстовая перекрестная ссылка
Анбусельви, А., Махаланобис, С., и Джха, М. (2014). Оптимизация одноклеточного белка с использованием шелухи зеленого грамма и шелухи бенгальского грамма с использованием дрожжей. Междунар. Дж. Фарм. науч. Ред. рез. . 28, 188–190.
Андерсон, К., и Соломонс, Г.Л. (1984). «Первичный метаболизм и производство биомассы из Fusarium», в Прикладная микология Fusarium , ред. М. О. Мосс и Дж. Э. Смит (Кембридж: Издательство Кембриджского университета), 231–250.
Андерсон, К., Лонгтон, Дж., Мэддикс, К., Скаммелл, Г.W. и Соломонс, Г.Л. (1975). «Рост микрогрибов на углеводах», в Single-Cell Protein II , eds S.R. Tannenbaum and DIC Wang (Cambridge, MA: MIT Press), 314–329.
Академия Google
Апанди, Н.М., Мохамед, Р.М.С.Р., Латиффи, Н.А.А., Розлан, Н.Ф.М., и Аль-Гити, А.А.С. (2017). Содержание белков и липидов в микроводорослях Scenedesmus sp. биомасса, выращенная во влажных рыночных сточных водах. Веб-конференция MATEC. 103:06011. дои: 10.1051/matecconf/201710306011
Полнотекстовая перекрестная ссылка | Академия Google
Багчи, Д. (2006). Регулирование нутрицевтиков и функциональных пищевых продуктов в США и во всем мире. Токсикология 221, 1–3. doi: 10.1016/j.tox.2006.01.001
Реферат PubMed | Полный текст перекрестной ссылки
Baldensperger, J., Le Mer, J., Hannibal, L., and Quinto, P.J. (1985). Твердофазная ферментация банановых отходов. Биотехнология. Письмо . 7, 743–748. дои: 10.1007/BF01032289
Полнотекстовая перекрестная ссылка | Академия Google
Бамберг, Дж. (2000). British Petroleum и Global Oil 1950-1975: вызов национализма . Кембридж: Издательство Кембриджского университета.
Академия Google
Бхалла, Т.С., и Джоши, М. (1994). Обогащение белком яблочных выжимок путем совместного культивирования целлюлозолитических плесеней и дрожжей. World J. Microbiol. Биотехнолог . 10, 116–117. дои: 10.1007/BF00357577
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Боланд, М.J., Rae, A.N., Vereijken, J.M., Meuwissen, M.P.M., Fischer, A.R.H., van Boekel, M.A.J.S., et al. (2013). Будущие поставки белка животного происхождения для потребления человеком. Trends Food Sci. Технол . 29, 62–73. doi: 10.1016/j.tifs.2012.07.002
Полнотекстовая перекрестная ссылка | Академия Google
Бурдишон, Ф., Касарегола, С., Фаррох, К., Фрисвад, Дж. К., Гердс, М. Л., Хаммес, В. П., и соавт. (2012). Пищевые ферментации: микроорганизмы с технологической полезной пользой. Междунар. J. Food Microbiol . 154, 87–97. doi: 10.1016/j.ijfoodmicro.2011.12.030
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Chiou, P.W.S., Chiu, S.W., and Chen, C.R. (2001). Значение продукта ферментации Aspergillus niger в качестве диетического ингредиента для цыплят-бройлеров. Научный корм для животных. Технол . 91, 171–182. doi: 10.1016/S0377-8401(01)00224-3
Полнотекстовая перекрестная ссылка | Академия Google
Коппенс, П., да Силва, М.Ф., и Петтман, С. (2006). Европейские правила по нутрицевтикам, диетическим добавкам и функциональным продуктам питания: основа, основанная на безопасности. Токсикология 221, 59–74. doi: 10.1016/j.tox.2005.12.022
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цуй, В., Ван, К., Чжан, Ф., Чжан, С.-К., Чи, З.-М., и Мадзак, К. (2011). Прямое превращение инулина в белок одной клетки с помощью сконструированного штамма Yarrowia lipolytica , несущего ген инулиназы. Процесс Биохим . 46, 1442–1448. doi: 10.1016/j.procbio.2011.03.017
Полнотекстовая перекрестная ссылка | Академия Google
Де Грегорио, А., Мандалари, Г., Арена, Н., Нучита, Ф., Триподо, М.М., и Ло Курто, Р.Б. (2002). Производство SCP и сырой пектиназы путем суспензионной ферментации лимонной мякоти. Биоресурс. Технол . 83, 89–94. doi: 10.1016/S0960-8524(01)00209-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Де Оливейра, М.A.C.L., Monteiro, M.P.C., Robbs, P.G., and Leite, S.G.F. (1999). Рост и химический состав биомассы Spirulina maxima и Spirulina platensis при различных температурах. Аквакульт. Интервал . 7, 261–275. дои: 10.1023/A:100
Полнотекстовая перекрестная ссылка | Академия Google
Дуарте, Л. К., Карвальейро, Ф., Лопес, С., Невес, И., и Гирио, Ф. М. (2008). Производство дрожжевой биомассы в гемицеллюлозном гидролизате пивоваренной дробины. Заяв.Биохим. Биотехнолог . 148, 119–129. doi: 10.1007/s12010-007-8046-6
Полнотекстовая перекрестная ссылка | Академия Google
Дуонг, В. Т., Ахмед, Ф., Томас-Холл, С. Р., Куигли, С., Новак, Э., и Шенк, П. М. (2015). Микроводоросли с высоким содержанием белка и липидов из северной Австралии в качестве потенциального сырья для кормов для животных и биодизеля. Фронт. биоинж. Биотехнолог. 3:53. doi: 10.3389/fbioe.2015.00053
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эдельман, Дж., Фьюэлл, А., и Соломонс, Г.Л. (1983). Микопротеин – новая еда. Нутр. Абстр. Преподобный Клин. Нутр . 53, 471–480.
Enzing, C., Ploeg, M., Barbosa, M., и Sijtsma, L. (2014). Продукты на основе микроводорослей для пищевой и кормовой промышленности: перспективы для Европы . Научные и политические отчеты JRC (JRC85709), редакторы М. Вигани, К. Паризи и Э. Родригес-Сересо (Отдел публикаций Европейского Союза).
Академия Google
Эрдман, доктор медицинских наук, Берген, В.Г. и Редди, Калифорния (1977). Аминокислотные профили и предполагаемая оценка питания одноклеточного белка некоторых лактобацилл. Заяв. Окружающая среда. Микробиол . 33, 901–905.
Реферат PubMed | Академия Google
Гао, Х., и Сюй, Дж. Г. (2015). Метод измерения общего количества нуклеотидов в белковых продуктах . Патент № CN104316621A. Государственное ведомство интеллектуальной собственности Китайской Народной Республики.
Гао Ю., Ки Д. и Лю Ю. (2012).Производство одноклеточного белка из соевой патоки с использованием Candida tropicalis. Энн. Микробиол . 62, 1165–1172. doi: 10.1007/s13213-011-0356-9
Полнотекстовая перекрестная ссылка | Академия Google
Гасеми, Ю., Расул-Амини, С., и Моровват, М. Х. (2011). «Водоросли для производства SCP», в тенденциях биохимических исследований. Биотехнологические науки и технологии , изд. М.-Т. Лионг (Нью-Йорк: Hauppage) 163–184.
Академия Google
Гольдберг И.(1988). Будущие перспективы генно-инженерного одноклеточного белка. Тенденции биотехнологии. 6, 32–34. дои: 10.1016/0167-7799(88)
Полнотекстовая перекрестная ссылка | Академия Google
Гувейя, Л., Батиста, А.Б., Соуза, И., Раймундо, А., и Бандарра, Н.М. (2008). «Микроводоросли в новых пищевых продуктах», в Food Chemistry Research Developments , ed. К.Н. Пападопулос (Нью-Йорк, штат Нью-Йорк: Nova Science Publishers), 75–111.
Академия Google
Грёневальд, М., Boekhout, T., Neuveglise, C., Gaillardin, C., van Dijck, PWM, and Wyss, M. (2014). Yarrowia lipolytica : оценка безопасности масличных дрожжей с большим промышленным потенциалом. Крит. обр. Микробиол . 40, 187–206. дои: 10.3109/1040841X.2013.770386
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хамеш, Э. Э., и Демир, Т. (2015). Микробные рибонуклеазы (РНКазы): возможности производства и применения. World J. Microbiol.Биотехнолог . 31, 1853–1862 гг. doi: 10.1007/s11274-015-1945-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Харун, Р., Сингх, М., Форде, Г.М., и Данкуах, М.К. (2010). Биотехнологическая разработка микроводорослей для производства различных потребительских товаров. Продлить. Суст. Энергетическая версия . 14, 1037–1047. doi: 10.1016/j.rser.2009.11.004
Полнотекстовая перекрестная ссылка | Академия Google
Хашем, М., Хешам, А.Э.-Л., Аламри, С.А., и Альрумман, С.А. (2014). Производство одноклеточного белка из плодов финиковой гнили Hanseniaspora uvarum KKUY-0084 и Zygosaccharomyces rouxii KKUY-0157. Энн. Микробиол . 64, 1505–1511. doi: 10.1007/s13213-013-0793-8
Полнотекстовая перекрестная ссылка | Академия Google
Хитцман, Д. О. (1986). «Процесс Proveteen — ферментация сверхвысокой плотности», в Microbial Biomass Proteins , eds. М. Му-Янг и К. Ф. Грегори (Лондон: Elsevier Applied Science), 27–32.
Академия Google
Джаласутрам, В., Катарам, С., Ганду, Б., и Ануподжу, Г. Р. (2013). Производство белка отдельными клетками из переваренного и непереваренного птичьего помета с помощью Candida utilis : оптимизация параметров процесса с использованием методологии поверхности отклика. Чистая технология. Окружающая среда. Политика 15, 265–273. doi: 10.1007/s10098-012-0504-3
Полнотекстовая перекрестная ссылка | Академия Google
Кадим, И. Т., Махгуб, О., Бакир, С., Фэй, Б., и Закупки, Р.(2015). Культивированное мясо из мышечных стволовых клеток: обзор проблем и перспектив. Дж. Интегр. Агро . 14, 222–233. дои: 10.1016/S2095-3119(14)60881-9
Полнотекстовая перекрестная ссылка | Академия Google
Кам, С., Абедиан Кенари, А., и Юнеси, Х. (2012). Производство одноклеточного белка в липовой воде с помощью Lactobacillus acidophilus и Aspergillus niger . Дж. Аква. Пищевая прод. Технол . 21, 403–417. дои: 10.1080/10498850.2011.605539
Полнотекстовая перекрестная ссылка | Академия Google
Найт, Н., Робертс Г. и Шелтон Д. (2001). Термическая стабильность деталей QuornTM. Междунар. Дж. Пищевая наука. Технол . 36, 47–52. doi: 10.1046/j.1365-2621.2001.00424.x
Полнотекстовая перекрестная ссылка | Академия Google
Койвуринта Дж., Куркела Р. и Койвистойнен П. (1979). Использование Pekilo, биомассы микрогрибов из Paecilomyces varioti , в колбасах и мясных шариках. Междунар. Дж. Пищевая наука. Технол . 14, 561–570.
Академия Google
Корночалерт, Н., Kantachote, D., Chaiprapat, S., и Techkarnjanaruk, S. (2014). Использование Rhodopseudomonas palustris P1 стимулировало рост с помощью ферментированного экстракта ананаса для обработки сточных вод из листового латексного каучука для получения одноклеточного белка. Энн. Микробиол . 64, 1021–1032. doi: 10.1007/s13213-013-0739-1
Полнотекстовая перекрестная ссылка | Академия Google
Кунасундари, Б., Муругайя, В., Каур, Г., Маурер, Ф. Х. Дж., и Кумар, С. (2013). Пересмотр применения белка одиночных клеток Cupriavidus necator h26 и одновременное получение биопластических гранул. PLoS ONE 8:e78528. doi: 10.1371/journal.pone.0078528
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Курбаноглу, Э.Б., и Алгур, О.Ф. (2002). Производство одноклеточного белка из гидролизата бараньего рога бактериями. Биоресурс. Технол . 85, 125–129. doi: 10.1016/S0960-8524(02)00094-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ланг, В., Беллисл, Ф., Аламович, К., Краплет, К., Борнет, Ф. Р. Дж., Слама Г. и др. (1999). Изменение источника белка в смешанной пище изменяет кинетику глюкозы, инсулина и глюкагона у здоровых мужчин, оказывает слабое влияние на субъективное ощущение сытости и не влияет на потребление пищи. евро. Дж. Клин. Нутр . 53, 959–965. doi: 10.1038/sj.ejcn.1600881
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли, Дж. З., Логан, А., Терри, С., и Спир, Дж. Р. (2015). Микробная реакция на производство одноклеточного белка и очистку сточных вод пивоваренного завода. Микробная биотехнология . 8, 65–76. дои: 10.1111/1751-7915.12128
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли, К., Ян, Х., Ли, Ю., Ченг, Л., Чжан, М., Чжан, Л., и соавт. (2013). Новые способы биоконверсии городских сточных вод и CO2 в богатую белком биомассу Chlorella vulgaris. Биоресурс. Технол . 132, 171–177. doi: 10.1016/j.biortech.2012.12.017
Полнотекстовая перекрестная ссылка | Академия Google
Лю Б., Ли Ю., Сонг Дж., Чжан, Л., Донг, Дж., и Ян, К. (2014). Производство одноклеточного белка с двухстадийной ферментацией для переработки отходов переработки картофельного крахмала. Целлюлоза 21, 3637–3645. doi: 10.1007/s10570-014-0400-6
Полнотекстовая перекрестная ссылка | Академия Google
Лю Б., Сонг Дж., Ли Ю., Ню Дж., Ван З. и Ян К. (2013). К промышленно целесообразной переработке отходов переработки картофельного крахмала смешанными культурами. Заяв. Биохим. Биотехнолог . 171, 1001–1010.doi: 10.1007/s12010-013-0401-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Махмуд, Р., Ибрагим, М., и Али, Г. (2016). Закрытый фотобиореактор для производства биомассы микроводорослей в условиях выращивания в помещении. J. Биомасса водорослей Utln . 7, 86–92.
Академия Google
Martinez, M.C., Sanchez-Montero, J.M., Sinisterra, J.V., and Ballesteros, A. (1990). Новые нерастворимые производные рибонуклеазы и эндонуклеазы для элиминации нуклеиновых кислот в концентратах одноклеточных белков. Биотехнология. заявл. Биохим . 12, 643–652.
Реферат PubMed | Академия Google
Мюллер-Фега, А. (2000). Роль микроводорослей в аквакультуре: ситуация и тенденции. J. Appl. Фикол . 12, 527–534. дои: 10.1023/A:1008106304417
Полнотекстовая перекрестная ссылка | Академия Google
Нассери, А. Т., Расул-Амини, С., Моровват, М. Х., и Гасеми, Ю. (2011). Одноклеточный белок: производство и процесс. Ам. Дж. Фуд Технол . 6, 103–116.doi: 10.3923/ajft.2011.103.116
Полнотекстовая перекрестная ссылка | Академия Google
Оверланд, М., Таусон, А. Х., Ширер, К., и Скреде, А. (2010). Оценка продуктов метан-утилизирующих бактерий в качестве кормовых ингредиентов для животных с однокамерным желудком. Арх. Аним. Нутр . 64, 171–189. дои: 10.1080/174503
6
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Параскевопулу А., Атанасиадис И., Канеллаки М., Бекатуру А., Блекас Г. и Киоссеоглу В.(2003). Функциональные свойства одноклеточного белка, продуцируемого кефирной микрофлорой. Еда Рез. Интервал . 36, 431–438. doi: 10.1016/S0963-9969(02)00176-X
Полнотекстовая перекрестная ссылка | Академия Google
Пессоа, А. мл., Мансилха, И. М., и Сато, С. (1996). Культивирование Candida tropicalis в гемицеллюлозном гидролизате сахарного тростника для производства микробного белка. Дж. Биотехнология . 51, 83–88. дои: 10.1016/0168-1656(96)01572-6
Полнотекстовая перекрестная ссылка | Академия Google
Петерсен, Л.А. Х., Вилладсен Дж., Йоргенсен С. Б. и Герней К. В. (2017). Смешивание и массоперенос в пилотном биореакторе с U-образным контуром. Биотехнология. Биоэнг . 114, 344–354. дои: 10.1002/бит.26084
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Филипп, Ф.-К., и Никс, Б. (2015). Обзор выбросов парниковых газов из свинарников: производство двуокиси углерода, метана и закиси азота животными и навозом. С/х. Экосистем. Окружающая среда . 199, 10–25.doi: 10.1016/j.agee.2014.08.015
Полнотекстовая перекрестная ссылка
Поутанен, К., Нордлунд, Э., Пааси, Дж., Вехмас, К., и Окерман, М. (2017). Продовольственная экономика 4.0: видение VTT эпохи разумного производства продуктов питания, ориентированного на потребителя . Хельсинки: VTT Technical Research Center of Finland Ltd. Доступно в Интернете по адресу: http://www.vtt.fi/inf/pdf/visions/2017/V10.pdf) VTT VISIONS 10
Рафикул, И.М., Джалал, К.С.А., и Алам, М.З. (2005). Факторы окружающей среды для оптимизации биомассы спирулины в лабораторной культуре. Биотехнология 4, 19–22. doi: 10.3923/biotech.2005.19.22
Полнотекстовая перекрестная ссылка
Рао, М., Варма, А.Дж., и Дешмукх, С.С. (2010). Производство одноклеточного белка, незаменимых аминокислот и ксиланазы Penicillium janthinellum. BioResource 5, 2470–2477.
Академия Google
Рашад М.М., Мохариб С.А. и Джванни Э.В. (1990). Дрожжевое преобразование отходов манго или метанола в одноклеточный белок и другие метаболиты. биол. Отходы 32, 277–284. дои: 10.1016/0269-7483(90)
Полнотекстовая перекрестная ссылка | Академия Google
Равиндер Р., Венкатешвар Рао Л. и Равиндра П. (2003). Исследования мутантов Aspergillus oryzae для производства одноклеточных белков из обезжиренных рисовых отрубей. Пищевая технология. Биотехнолог . 41, 243–246.
Академия Google
Ren, X., Wang, J., Yu, H., Peng, C., Hu, J., Ruan, Z., et al. (2016). Анаэробное и последовательное аэробное производство этанола с высоким титром и белка отдельных клеток из кукурузной соломы, предварительно обработанной NaOH, штаммом Saccharomyces cerevisiae с модифицированным перетасовкой генома. Биоресурс. Технол . 218, 623–630. doi: 10.1016/j.biortech.2016.06.118
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ришипал Р. и Филип Р. (1998). Селекция морских дрожжей для получения одноклеточного белка из отходов панциря креветок. Биоресурс Технол . 65, 255–256. doi: 10.1016/S0960-8524(97)00179-X
Полнотекстовая перекрестная ссылка | Академия Google
Родригес, Дж., Феррас, А., Ногейра, Р.Ф.П., Феррер, И., Эспозито, Э., и Дюран, Н. (1997). Биодеградация лигнина аскомицетом Chrysondia sitophila. Заяв. Биохим. Биотехнолог . 62, 233–242. дои: 10.1007/BF02787999
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Родригес-Завала, Дж. С., Ортис-Крус, Массачусетс, Мендоса-Эрнандес, Г., и Морено-Санчес, Р. (2010). Повышенный синтез а-токоферола, парамилона и тирозина у Euglena gracilis в условиях высокой продукции биомассы. Дж.заявл. Микробиол . 109, 2160–2172. doi: 10.1111/j.1365-2672.2010.04848.x
Полнотекстовая перекрестная ссылка | Академия Google
Рудраварам Р., Чандел А.К., Рао Л.В., Хуэй Ю.З. и Равиндра П. (2009). «Био (одноклеточный) белок: вопросы производства, токсины и статус коммерциализации», в Сельскохозяйственные отходы , под редакцией Г. С. Эшворта и П. Азеведо (Нью-Йорк, штат Нью-Йорк: Hauppage), 129–153.
Академия Google
Сафафар, Х., Норрегаард, П.У., Любич, А., Меллер, П., Холдт, С.Л., и Якобсен, К. (2016). Повышение содержания белка и пигмента в двух видах хлореллы, культивируемых на технологической воде. J. Mar. Sci. Eng . 4:84. дои: 10.3390/jmse4040084
Полнотекстовая перекрестная ссылка | Академия Google
Шульц, Э., и Ослейдж, Х. Дж. (1976). Состав и пищевая ценность одноклеточного белка (SCP). Аним. Кормовая наука. Технол . 1, 9–24. дои: 10.1016/0377-8401(76)
-1
Полнотекстовая перекрестная ссылка | Академия Google
Сински, А.Дж. и Танненбаум С.Р. (1975). «Удаление нуклеиновых кислот в SCP» в Single-Cell Protein II , eds S.R. Tannenbaum and D.I.C. Wang (Cambridge, MA: MIT Press), 158–178.
Академия Google
Сисман Т., Озлем Г., Доган Н., Оздал М., Алгур О. Ф. и Эргон Т. (2013). Одноклеточный белок как альтернативный корм для рыбок данио Danio rerio : токсикологическая оценка. Токсикол. Индиана здравоохранения 29, 792–799. дои: 10.1177/0748233712442711
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Смедли, К.О. (2013). Сравнение нормативного управления разрешенными ингредиентами, процессов утверждения и процедур оценки рисков для кормовых ингредиентов . Охваченные юрисдикции: Бразилия, Канада, Китай, Европейский Союз, Япония, Южная Африка и США. Международная федерация кормовой промышленности, 12 июля 2013 г.
Академия Google
Соломоновы острова, GL (1986). «Микробные белки и нормативное разрешение для микопротеина RHM», в Microbial Biomass Proteins , eds M.Му-Янг и К. Ф. Грегори (Лондон: Elsevier Applied Science), 19–26.
Академия Google
Song, H.T., Yang, Y.M., Liu, D.K., Xu, X.Q., Xiao, W.J., Liu, Z.L., et al. (2017). Конструирование рекомбинантного Yarrowia lipolytica и его применение в биотрансформации лигноцеллюлозы. Биоинженерия 17, 1–6. дои: 10.1080/21655979.2017.1293219
Полнотекстовая перекрестная ссылка | Академия Google
Steinmann, J., Wottge, H. U., и Müller-Ruchholtz, W.(1990). Тестирование иммуногенности пищевых белков: in vitro и in vivo испытания на крысах. Междунар. Арка Аллергия Иммунол . 91, 62–65. дои: 10.1159/000235091
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Таран, М., и Асади, Н. (2014). Новый подход к экологически безопасному производству одноклеточного белка из нефтехимических сточных вод с использованием галофильных микроорганизмов в различных условиях. Нефтяные науки. Технол .32, 625–630. дои: 10.1080/10
6.2011.596888Полнотекстовая перекрестная ссылка | Академия Google
Тревельян, У. Э. (1976). Химические методы снижения содержания пуринов в пекарских дрожжах, форме одноклеточного белка. J. Sci. Фуд Агрик . 27, 225–230. doi: 10.1002/jsfa.2740270305
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тернбулл, У. Х., Лидс, А. Р., и Эдвардс, Г. Д. (1992). Микопротеин снижает уровень липидов в крови у свободноживущих субъектов. Ам. Дж. Клин. Нутр. 55, 415–419.
Реферат PubMed | Академия Google
Угальде, У., и Кастрильо, Дж. И. (2002). «Одноклеточные белки дрожжей и грибов», в Applied Mycology and Biotechnology, Vol II Agriculture and Food Production 2002 , eds GG Khachatourians and DK Arora (Amsterdam: Elsevier Science BV) 123–149.
Валентино, М.Дж.Г., Ганадо, Л.С., и Ундан, Дж.Р. (2016). Белковый потенциал одиночных клеток эндофитных грибов, связанных с бамбуком, использующих рисовые отруби в качестве субстрата. Доп. заявл. науч. Рез . 7, 68–72.
Вигани М., Паризи К., Родригес-Сересо Э., Барбоза М. Дж., Сийтсма Л., Плоэг М. и Энцинг К. (2015). Пищевые продукты и корма из микроводорослей: рыночные возможности и вызовы для ЕС. Trends Food Sci. Технол . 42, 81–92. doi: 10.1016/j.tifs.2014.12.004
Полнотекстовая перекрестная ссылка | Академия Google
Вийкари, Л., и Линко, М. (1977). Снижение содержания нуклеиновых кислот в SCP. Процесс Биохим .12, 35.
Академия Google
Waghmare, A.G., Salve, M.K., LeBlanc, JG, and Arya, S.S. (2016). Концентрация и характеристика белков микроводорослей из Chlorella pyrenoidosa . Биоресурс. Биопроцесс . 3, 16. doi: 10.1186/s40643-016-0094-8
Полнотекстовая перекрестная ссылка | Академия Google
Ван, Дж. П., Ким, Дж. Д., Ким, Дж. Э., и Ким, И. Х. (2013). Усвояемость аминокислот одноклеточного белка из Corynebacterium ammoniagenes у растущих свиней. Аним. Кормовая наука. Технол . 180, 111–114. doi: 10.1016/j.anifeedsci.2012.12.006
Полнотекстовая перекрестная ссылка | Академия Google
Уорд, Пенсильвания (1998). Производство продуктов питания. Патент США № 5739030. Вашингтон, округ Колумбия: Бюро по патентам и товарным знакам США.
Wiebe, MG (2002). Микопротеин из Fusarium venenatum : хорошо зарекомендовавший себя продукт для потребления человеком. Заяв. микробиол. Биотехнолог . 58, 421–427. doi: 10.1007/s00253-002-0931-x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вибе, М.Г. (2004). QuornTM Myco-protein – обзор успешного противогрибкового препарата. Миколог 18, 17–20. дои: 10.1017/S0269915X04001089
Полнотекстовая перекрестная ссылка | Академия Google
Уиллеттс, А., и Угалде, У. (1987). Производство одноклеточного белка из сыворотки. Биотехнология. Письмо . 9, 795–800. дои: 10.1007/BF01028286
Полнотекстовая перекрестная ссылка | Академия Google
Вонгпуттисин П., Ханонгнуч К., Хонгбантад В., Ниамсуп П. и Лумён С.(2012). Скрининг и отбор Bacillus spp. для производства ферментированного кортикированного соевого шрота. J. Appl. Микобиол . 113, 798–806. doi: 10.1111/j.1365-2672.2012.05395.x
Полнотекстовая перекрестная ссылка | Академия Google
Wongputtisin, P., Khanongnuch, C., Kongbuntad, W., Niamsup, P., Lumyong, S., and Sarkar, P.K. (2014). Использование изолятов Bacillus subtilis из Туа-нао для улучшения питательности шелухи соевых бобов при однокамерном кормлении. Письмо. заявл. Микробиол . 59, 328–333. doi: 10.1111/lam.12279
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Се, Д., Джексон, Е. Н., и Чжу, К. (2015). Устойчивый источник омега-3 эйкозапентаеновой кислоты из метаболически модифицированного Yarrowia lipolytica : от фундаментальных исследований до коммерческого производства. Заяв. микробиол. Биотехнолог . 99, 1599–1610. doi: 10.1007/s00253-014-6318-y
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сюй, Дж.Г. (2015). Метод оценки степени разрушения нуклеотидов Метод определения и технология производства гидролизата свободной нуклеиновой кислоты в белковом продукте . Патент № CN104515817A. Государственное ведомство интеллектуальной собственности Китайской Народной Республики.
Ядав, Дж. С. С., Безавада, Дж., Аджила, К. М., Ян, С., Тьяги, Р. Д., и Сурампалли, Р. Ю. (2014). Смешанная культура Kluyveromyces marxianus и Candida krusei для производства одноклеточного белка и удаления органических веществ из сыворотки. Биоресурс. Технол . 164, 119–127. doi: 10.1016/j.biortech.2014.04.069
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ядав, Дж. С. С., Ян, С., Аджила, К. М., Безавада, Дж., Тьяги, Р. Д., и Сурампалли, Р. Ю. (2016). Производство пищевого одноклеточного белка, определение характеристик и ультрафильтрация остаточных ферментированных сывороточных белков из сыворотки. Пищевые биопрод. Процесс 99, 156–165. doi: 10.1016/j.fbp.2016.04.012
Полнотекстовая перекрестная ссылка | Академия Google
Яздян, Ф., Гаджизаде С., Шоджаосадати С.А., Халилзаде Р., Джаханшахи М. и Носрати М. (2005). Производство одноклеточного белка из природного газа: оптимизация параметров и оценка РНК. Иранский J. Биотех . 3, 235–242.
Академия Google
Зепка, Л. К., Джейкоб-Лопес, Э., Гольдбек, Р., Соуза-Соарес, Л. А., и Кейрос, М. И. (2010). Пищевая оценка одноклеточного белка, продуцируемого Aphanothece microscopica Nägeli. Биоресурс. Технол .101, 7107–7111. doi: 10.1016/j.biortech.2010.04.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zhang, H.Y., Piao, X.S., Li, P., Yi, J.Q., Zhang, Q., Li, Q.Y., et al. (2013). Влияние одноклеточного белка, заменяющего рыбную муку в рационе, на показатели роста, усвояемость питательных веществ и морфологию кишечника у поросят-отъемышей. Азиатско-Австралийский J. Anim. Наука . 26, 1320–1328. doi: 10.5713/ajas.2013.13200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжао, Г., Чжан В. и Чжан Г. (2010). Производство одноклеточного белка с использованием порошка стручкового перца, полученного при экстракции капсантина. Письмо. заявл. Микробиол . 50, 187–191. doi: 10.1111/j.1472-765X.2009.02773.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжао, М.-Х., Чи, З., Чи, З.-М., и Мадзак, К. (2013). Одновременное производство одноклеточного белка и рекомбинантного антибактериального пептида путем экспрессии гена антибактериального пептида в Yarrowia lipolytica . Процесс Биохим . 48, 212–217. doi: 10.1016/j.procbio.2013.01.003
Полнотекстовая перекрестная ссылка | Академия Google
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Учебное пособие по аминокислотам: структура и функция
В биохимии ДНК содержит генетический код жизни. Когда гены экспрессируются, ДНК транскрибируется в мРНК, которая затем транслируется в белки. Белки представляют собой сложные биомолекулы, играющие важную роль в клетке. Эти белки состоят из более мелких строительных блоков, называемых аминокислотами (АА). АА связаны между собой рибосомами, которые считывают инструкции, данные им мРНК.Ошибки в размещении аминокислот действительно случаются и в некоторых случаях могут привести к гибели клеток. Всегда помните, что структура дает функцию .
Советы по обучениюБольшинство курсов по биохимии требуют от вас знания следующего: название аминокислоты, структура, pKa ионизируемых атомов водорода, а также трехбуквенное и однобуквенное сокращение. Это сложная задача для 20 аминокислот.
Чтобы выучить структуры, имена и стенографию, лучший метод здесь — запоминание.Используйте флэш-карты, доски или любой другой метод повторяющегося запоминания. Таблица общих аминокислот представлена на Рисунке 1. Ее следует скачать и распечатать. Обратите внимание, что селеноцистеин (Sec, U) не является обычной аминокислотой и может быть пропущен.
Чтобы прочитать рисунок 1, AA в верхнем левом углу представляет собой аргинин. Три буквы в скобках — трехбуквенное сокращение, а буква в красном кружке — однобуквенное сокращение: например, аргинин, Arg, R. Держите таблицу при себе; подобно периодической таблице элементов в химии, вы будете обращаться к этой таблице АА на протяжении всего курса.Также обратите внимание на номенклатуру и условности, представленные вам в классе.
Рисунок 1. Таблица аминокислот. Источник изображения: ВикимедиаЗапоминание заходит так далеко. Чтобы изучить эффекты pH или физико-химические свойства отдельных аминокислот, лучше всего попытаться понять процесс и то, как изменение микроокружения повлияет на поведение АК. Кроме того, некоторые аминокислоты обладают уникальными свойствами, повышающими их функциональность
Карбоновый каркасВсе аминокислоты состоят из амина (-NH 2 ) и карбоновой кислоты (-COOH), связанных центральным а-углеродом (рис. 2).Группа R или боковая цепь уникальна для каждой аминокислоты; в результате а-углерод представляет собой хиральный центр, за исключением глицина, где R = водород. Биохимики сосредотачиваются на L-аминокислотах, как показано на рисунке 1 (клинообразные связи), но D-аминокислоты имеют отношение к фармацевтическим применениям.
Если вы запутались в стереохимии, освежитесь в проекциях Фишера из органической химии. Преподаватели курса будут рисовать структуры разными способами. Попросите инструктора предоставить стереохимию, когда это возможно.Инверсия или инвертирование структуры повлияет на облигации с маркировкой , клин или , заштрихованная (, заштрихованная ) (рис. 3).
Рисунок 2. Общая структура аминокислот. Источник изображения: Wikimedia Commons. Вновь образованная амидная связь или пептидная связь образуется в результате реакции дегидратации.Короткие последовательности менее 50 АК называются пептидами, а последовательности более 50 АК называются белками. В литературе конкретная АК может упоминаться как остаток ; например, «Остатки лизина в гистонах ацетилированы для обеспечения упаковки двухцепочечной ДНК». Рисунок 3. Аминокислоты, соединенные пептидными связями, показаны синим цветом. Источник изображения: Wikimedia Commons. На рисунке 3 четыре аминокислоты — аланин, серин, глицин и лейцин — соединены пептидными связями (синий). Группа –NH 2 первого пептида называется N-концом амина или ; группа –COOH последнего пептида представляет собой карбокси или С-конец .Пептиды и белки записываются и нумеруются слева направо, начиная с N-конца и заканчивая С-концом. Приведенная выше последовательность (в трехбуквенном коде) представляет собой Ala1-Ser2-Gly3-Leu4. В клетке белки синтезируются от амино-конца к карбокси-концу, и мы придерживаемся этого соглашения в представлении последовательностей. Об ошибках синтеза ( мутаций ) сообщается так: Ser2 ➔ Thr; это означает, что серин в положении 2 был заменен на треонин. Однобуквенное сокращение: S2T.
Рисунок 4.Перекрывающиеся p-орбитали стабилизируют плоскую геометрию. Источник изображения: Wikimedia Commons. Когда AA соединяются, образующаяся пептидная связь имеет плоскую геометрию (рис. 4). Выравнивание p-орбиталей между амидным азотом и карбонильным углеродом и кислородом облегчает совместное использование электронов, укрепляя связи, делая их жесткими псевдодвойными связями. Это известно как таутомеризация . А-углероды с обеих сторон заперты в специфической геометрии, которая позже сформирует а-спирали и b-листы в белках.
Классификация аминокислот20 распространенных аминокислот можно классифицировать по их боковым цепям. Двумя основными группами являются гидрофобных аминокислот (водобоязненных) и гидрофильных аминокислот (водолюбивых). Вездесущий растворитель в клетках — вода; Физиологические условия предполагают pH 7,4 и температуру приблизительно 37 °C. Обратите внимание, что значение рН безразмерно, и перед знаком градуса стоит пробел.
Гидрофобные аминокислоты неполярны и ограничивают воздействие воды.Эти остатки, как правило, прячутся в ядрах белков. Гидрофобные аминокислоты можно дополнительно разделить на алкильных или ароматических остатков. Алкильные боковые цепи напоминают цепи насыщенных углеводородов и включают глицин, аланин, валин, лейцин, изолейцин, метионин и пролин. Ароматические аминокислоты – фенилаланин и триптофан. Ароматические соединения могут самостабилизироваться, накладываясь друг на друга (как блины).
Гидрофильные аминокислоты полярны и будут притягиваться к любой поверхности, подверженной воздействию воды.Внешние поверхности белков и белковых каналов выстланы этими остатками. Гидрофильные аминокислоты можно разделить на три группы: нейтральные , кислые и основные аминокислоты. Нейтральными аминокислотами являются тирозин, серин, треонин, цистеин, глютамин и аспарагин. Обратите внимание, что тирозин является одновременно полярным и ароматическим. К кислым аминокислотам относятся глутаминовая кислота (глутамат) и аспарагиновая кислота (аспартат). Основными аминокислотами являются лизин, гистидин и аргинин.Полное обсуждение эффектов pH для каждого из этих типов АК приведено ниже.
Обзор аминокислотВ этой таблице приведены свойства АА и даны советы по их быстрой идентификации. Обратитесь к рисунку 1 для полных структур L-аминокислот.
| Имя | 3-буквенный код | 1 буква код | Боковая цепь | |
| Глицин | Гли | Г | Х | Оптически неактивен. |
| Аланин | Аля | А | -СН 3 | Простейшая оптически активная АК. Все остальные АА будут состоять из аланина, А как начало алфавита. |
| Валин | Вал | В | -СН(СН 3 ) 2 | Боковая цепь разветвлена как V. |
| Лейцин | Лей | л | -СН 2 [СН(СН 3 ) 2 ] | Боковая цепь разветвлена в виде буквы Y. |
| Изолейцин | Иль | я | -CH(CH 3 )(C 2 H 5 ) | Изомер лейцина. Одна ветвь длиннее другой. |
| Пролайн | Про | П | -CH 2 CH 2 CH 2 – | Единственный циклический алифатический. |
| Цистеин | Цис | С | -Ч 2 -Ш | Цистеин имеет сульфгидрильную (SH) группу. |
| Метионин | Встретил | М | -(CH 2 )-S-(CH 3 ) | Тиол является синонимом серы. Метионин представляет собой метилированную серу. |
| Фенилаланин | Фе | Ф | -CH 2 (C 6 H 5 ) | Бензольное (или фенил ) кольцо, присоединенное к аланину. F нравится его название. |
| Триптофан | Трп | Вт | -индольное кольцо | АА с наибольшей боковой цепью, двумя сросшимися кольцами (двойными). |
| Тирозин | Тыр | Д | -CH 2 (C 6 H 4 ОН) | A гидроксилированный (ОН) фенилаланин. |
| Серин | Серия | С | -СН 2 ОХ | Гидроксилированный аланин. |
| Треонин | Через | Т | — СН (ОН) (СН 3 ) | Три части этого AA: аланин, метил и гидроксил. |
| Аргинин | Арг | Р | -(CH 2 ) 3 -мочевина | Боковая цепь имеет группу мочевины (NH 2 -C (NH 2 + )(NH)) (любимая пиратами AA, аргинин). |
| Лизин | Лис | К | -(СН 2 ) 4 -NH 3 + | Основные аминокислоты с прямой цепью с аминогруппой. |
| Гистидин | Его | Х | -CH 2 -(C 3 N 2 H 4 ) + | Эта аминокислота имеет имидазол, ароматическое кольцо с двумя атомами азота, которое может быть протонировано. |
| Аспартат | Асп | Д | -СН 2 СООН | Кислый аланин. Просто помните Д. |
| Глутамат | клей | Э | -СН 2 СН 2 СООН | Более длинная версия Asp. E следует за D в алфавите. |
| Аспарагин | Асн | Н | -CH 2 CONH 2 | Амидированный Asp. |
| Глютамин | Глн | В | -CH 2 CH 2 CONH 2 | Амидатедглу. |
Некоторые аминокислоты обладают уникальными свойствами. Эти свойства могут повлиять на окончательную структуру белка, электростатические свойства белка или помочь в количественном определении концентрации белка.
Цистеин Рисунок 5.Цистеин (слева) и дисульфидный мостик (справа). Источник изображения: Wikimedia CommonsНа рисунке 5 показан цистеин в виде свободного тиола (-SH). Тиоловая группа очень реактивна к реакциям окисления и образует дисульфидный мостик с другим цистеином. Эта связь может образовываться между цистеинами в одной и той же полипептидной цепи ( внутримолекулярная ) или между двумя разными цепями ( межмолекулярная ). Эта ковалентная связь фиксирует пептидный остов в определенной ориентации и может быть разорвана только в восстановительных условиях.Метионин, другая серосодержащая АК, не может образовывать дисульфидные мостики и является стартовым кодоном для синтеза белка.
Пролин и глицин Рисунок 6. Пролин (слева) и глицин (справа). Источник изображения: Викисклад .Структурно пролин (рис. 6) уникален среди АК, поскольку его боковая цепь образует петлю вокруг пептидного остова и снова соединяется с ним. Все остальные АК имеют первичные амины, а при связывании в полипептидную цепь становятся вторичными амидами; Pro внутри цепи становится третичным амидом.Из-за заблокированной геометрии Pro в пептидную цепь вводятся перегибы. Глицин, с другой стороны, не имеет боковой цепи. Вокруг а-углерода много свободного вращения; эти точки очень гибкие в пептидной цепи. Пролин и глицин совместно разрушают вторичную структуру белков и известны как разрушители а-спирали .
Тирозин и триптофан Рисунок 7. Тирозин (слева) и триптофан (справа). Источник изображения: Викисклад .Тирозин и триптофан являются двумя ароматическими аминокислотами (рис. 7) и демонстрируют сильное поглощение УФ-излучения при 280 нм.Фенилаланин, также ароматический, поглощает на гораздо более низкой частоте. Белки и пептиды, содержащие либо Tyr, либо Trp, можно количественно определить с помощью спектроскопии в УФ-видимой области, поскольку они поглощают свет в спектре УФ-света. Молярные коэффициенты экстинкции равны Tyr = 1490 л·см -1 M -1 и Trp = 5500 л·см -1 M -1 . Эти коэффициенты являются аддитивными; например, если у вас есть белок с двумя Tyr и тремя Trp, коэффициент экстинкции этого белка = (2 x 1490) + (3 x 5500) = 19 480 L см 90 408 -1 90 409 M 90 408 -1 90 409 .
Гистидин Рисунок 8. Гистидин. Источник изображения: Wikimedia CommonsГистидин имеет имидазольную боковую цепь (рис. 8), которая имеет pKa 6,0, что близко к физиологическому pH 7,4. Это позволяет Хису действовать как буфер, который может принимать или отдавать водород, когда это необходимо. Многие активные центры используют His для опосредования реакций. Его также можно использовать конструктивно в соляном мосту.
Кислоты, основания и солевые мостики Рисунок 9. Иллюстрация солевого мостика между глутаматом и лизином.Источник изображения: Wikimedia CommonsПоследними группами являются кислоты — аспартат и глутамат — и основания — аргинин, лизин и иногда гистидин, которые образуют солевые мостики (рис. 9). Электростатические взаимодействия между положительными основаниями и отрицательными кислотами через пространство стабилизируют белковые структуры. Эти взаимодействия прочнее водородных связей (4 ккал/моль), но слабее дисульфидных связей (60 ккал/моль). Солевые мостики также обнаруживаются в местах связывания белков, часто удерживая лигандов для транспорта или субстратов для ферментативных реакций.
Влияние pHАминокислоты имеют как основной мотив, так и кислотный мотив. При физиологическом рН большинство АК будут состоять из цвиттерионов и (рис. 10), не считая боковых цепей. Карбоксильный конец депротонируется с отрицательным зарядом, а аминный конец протонируется с положительным зарядом. Суммарный заряд молекулы равен нулю. Изменяя pH системы, вы можете протонировать или депротонировать концы. Когда аминокислоты образуют пептидные связи, они больше не влияют на рН.
Рисунок 10. Цвиттер-ионы аминокислот. Источник изображения: Wikimedia Commons Неионизируемые боковые цепиБольшинство аминокислот не имеют ионизируемых боковых цепей, и при изучении эффектов pH вам нужно только интересоваться протонированием концов: это относится к Gly, Ala, Val, Leu, Ile, Met, Pro, Phe, Thr , Ser, Asn, Gln и Trp. Среднее значение pKa С-конца составляет ~2,0, что означает, что если pH больше 2, он находится в карбоксилатной (-COO – ) форме, а если pH меньше 2, он находится в протонированной форме. форма (-COOH).Для N-конца среднее значение pKa составляет ~9,5. Когда pH больше 9,5, амин депротонируется (-NH 3 ) до тех пор, пока pH не упадет ниже 9,5, затем образуется протонированный амин (-NH 4 + ). Ключевые идеи: (1) чем ниже pH, тем больше водорода (H + ) присутствует и (2) основания будут протонировать раньше, чем кислоты.
Ионизируемые боковые цепиДля аминокислот Arg, Lys, Tyr, His, Cys, Asp и Glu необходимо учитывать боковые цепи.На рисунке 1 перечислены pKa боковых цепей. Основания, Arg и Lys, имеют pKa боковой цепи 12,3 и 10,7 соответственно. В физиологических условиях они протонированы. РКа кислых АК составляет 3,7 для Asp и 4,15 для Glu. Они депротонируются в клетке. Буферная способность His была объяснена ранее; его pKa более кислый — 6,0.
Tyr и Cys ведут себя как спирты, но, в отличие от Ser и Thr, легко депротонируются. Цис предпочел бы связываться с другим Цис, но свободный тиолЦис действительно встречается в белках, иногда в активных центрах.Его pKa составляет 8,37. Tyr имеет pKa 10,1, как и Lys из-за стабилизации резонанса .
Изоэлектрическая фокусировка и электрофорезКакое значение имеет заряд аминокислоты? Оказывается, аминокислотами и, соответственно, белками можно манипулировать в зависимости от их заряда. Изоэлектрическая точка (pI) — это рН, при котором аминокислоты или белки имеют нулевой суммарный заряд. Затем смешанный образец АК можно разделить с помощью изоэлектрического фокусирования (ИЭФ) с использованием градиента рН и электрического тока (рис. 11).
Движение заряженных частиц относительно жидкости в однородном электрическом поле называется электрофорезом . Расширением IEF является Вестерн-блоттинг , где образцы сначала разделяют электрофорезом, затем переносят в связывающую среду и анализируют.
Рисунок 11. Изоэлектрическое фокусирование белков. Источник изображения: Wikimedia Commons Посттрансляционные модификацииПосле того, как рибосома завершила процессинг мРНК, некоторые аминокислоты могут быть ферментативно модифицированы.Они известны как посттрансляционные модификации (PTM). PTM встречаются на определенных аминокислотах или на остатке в определенной последовательности.
Ацетилирование может происходить на боковой цепи лизина. Добавление убиквитина, белка, осуществляется путем ацетилирования. Убиквитинирование важно для убиквитин-опосредованной деградации белков, метода пометки белков для рециркуляции. Другими распространенными типами ацетилирования являются липидирование и пренилирование цистеина и N-концевых глицинов.
Фосфорилирование добавляет -OPO 3 -2 к серину, треонину, тирозину, гистидину, аргинину или лизину. Этот тип ПТМ резко изменяет электростатику остатка; нейтральные или базовые АА получают -2 заряда. Клетки используют фосфорилирование как метод передачи сигнала для активации или деактивации метаболических путей.
Гликозилирование добавляет углевод к AA. Указанная как Asn-X-Ser или Asn-X-Thr, где X представляет собой любой остаток, эта консенсусная последовательность означает, что гликозилирование будет происходить по серину или треонину, которые находятся на расстоянии двух остатков от аспарагина.
РезюмеНужно много впитать, так что делайте это по частям. Запомните названия и структуры аминокислот как можно быстрее, но не торопитесь, чтобы понять физические процессы, влияющие на аминокислоты. Эти небольшие изменения окажут огромное влияние на структуру и функцию белков.
Была ли эта статья полезной? Мы бы хотели получить от Вас отзывы. Какой совет по изучению помогает вам больше всего?
Давайте применим все на практике. Попробуйте этот практический вопрос по биохимии: Хотите узнать больше о практике биохимии?Вы можете найти тысячи практических вопросов об Альберте.ио. Albert.io позволяет вам настроить свой учебный процесс так, чтобы он ориентировался на практику, в которой вам больше всего нужна помощь. Мы дадим вам сложные практические вопросы, которые помогут вам достичь мастерства в биохимии.
Начните тренироваться здесь .
Вы учитель или администратор, заинтересованный в повышении успеваемости учащихся по биохимии?
Узнайте больше о наших школьных лицензиях здесь .

 Включение в систему знаний и повторение
Включение в систему знаний и повторение
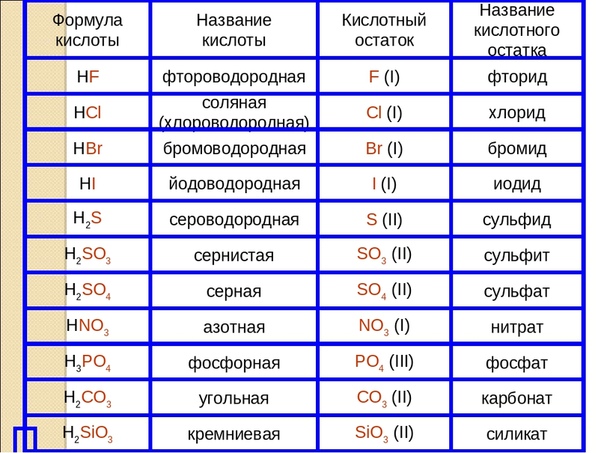
 Например: «Мы поднимемся на новую ступень знания в классификации неорганических соединений,,несмотря на некоторые затруднения».
Например: «Мы поднимемся на новую ступень знания в классификации неорганических соединений,,несмотря на некоторые затруднения».
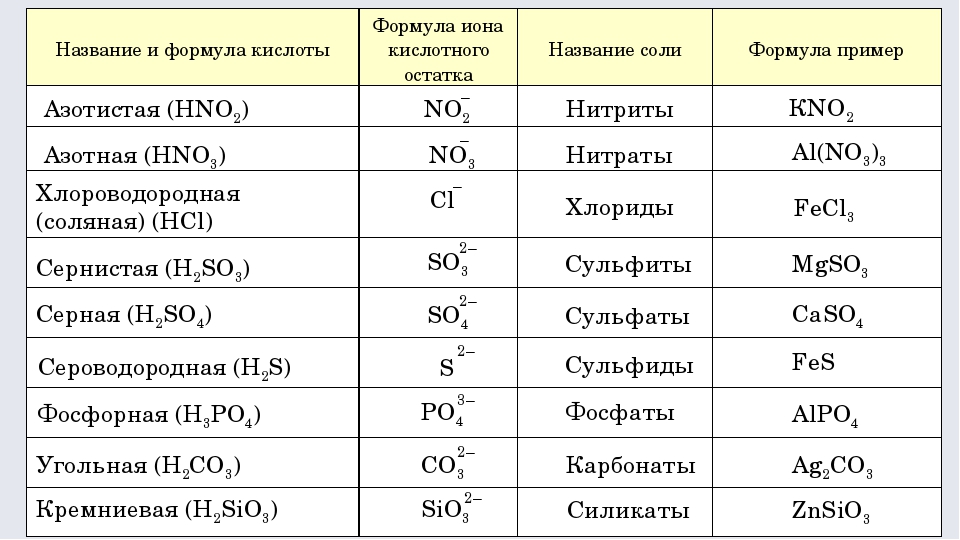

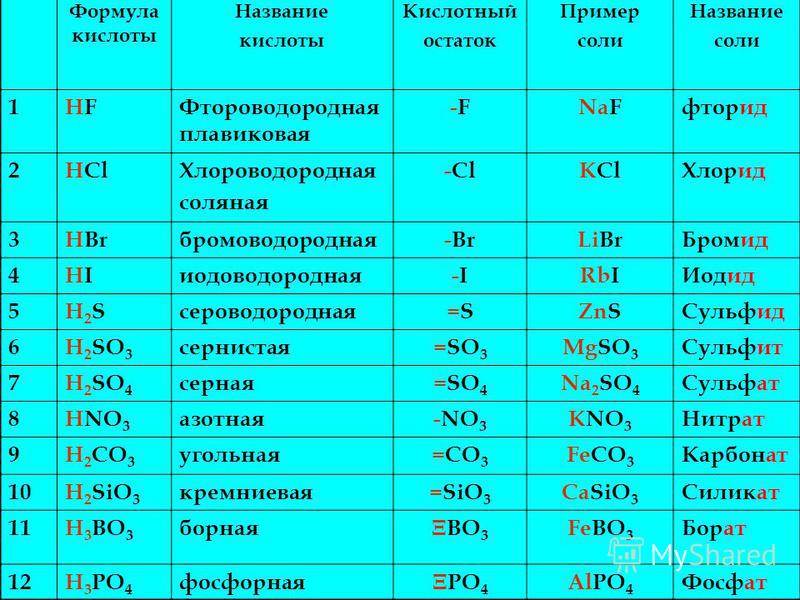
 , белый, растворим.
, белый, растворим. , серебристого цвета
, серебристого цвета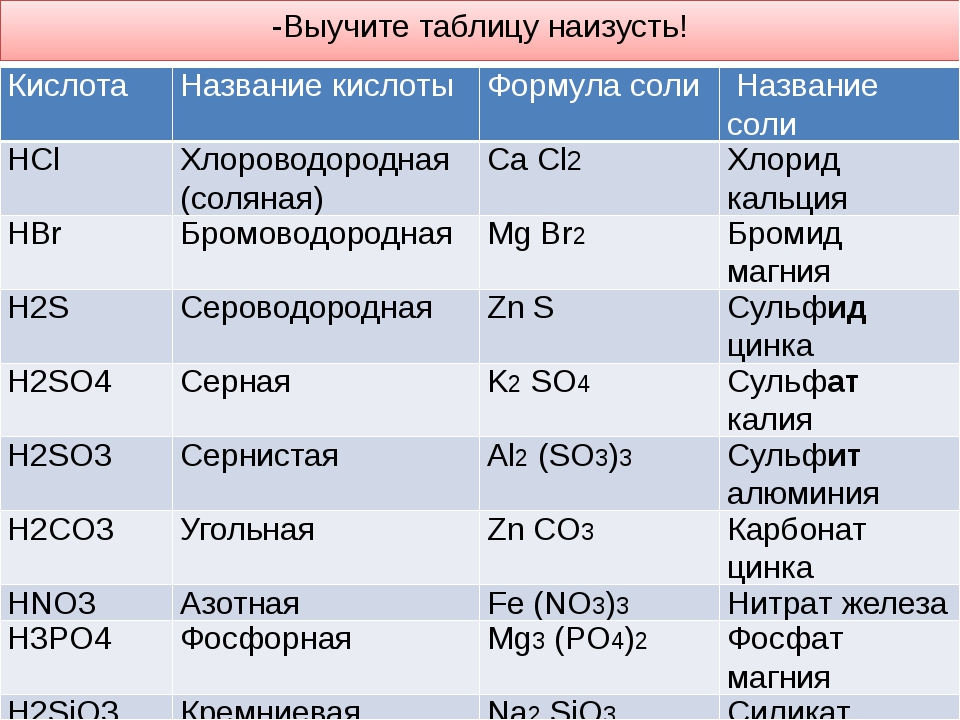 Кислотный оксид + вода = кислота
Кислотный оксид + вода = кислота  К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые.
К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ  Реакция обмена между солью и менее
летучей кислотой
Реакция обмена между солью и менее
летучей кислотой