Формы периодической таблицы
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая», «длинная», «сверхдлинная».
В «короткой» форме записи четвертый и последующие периоды занимают по 2 строчки.
В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «сверхдлинном» варианте каждый период занимает одну строчку.
В качестве основного варианта IUPAC утвердил длинный вариант Периодической таблицы. Короткая форма таблицы, содержащая восемь групп элементов, официально отменена ИЮПАК еще в 1989 г.
Нильсом Бором разработана лестничная (пирамидальная) форма периодической системы.
Существует несколько сотен вариантов, редко или вовсе не используемых, но весьма оригинальных, способов графического или табличного отображения Периодического закона, при этом учёные предлагают всё новые варианты.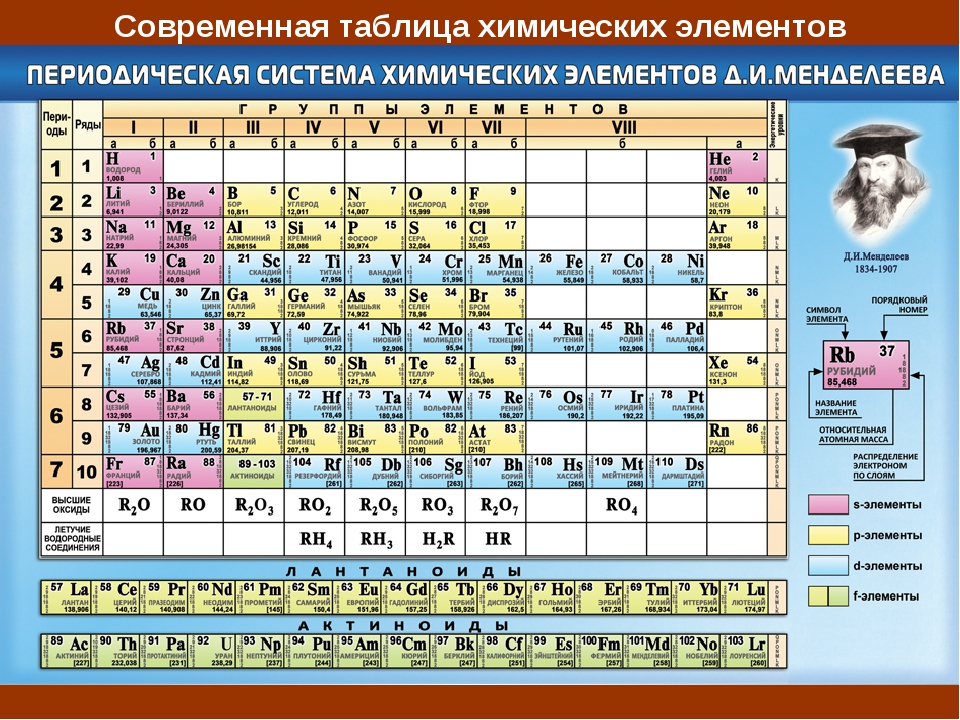
Познакомиться с разнообразием Периодических таблиц химических элементов, собранных со всего мира, можно на выставке, посвященной открытию Международного года Периодической таблицы, проводимой под эгидой ЮНЕСКО и Правительства Российской Федерации, при поддержке Российской Академии Наук, Московского государственного университета имени М.В. Ломоносова и Российского химико-технологического университета им. Д.И. Менделеева.
Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.).
Самая большая Периодическая таблица была установлена на стенах химического факультета в Университете Мурсии в Испании. В общей сложности она занимает в общей сложности 150 м2. Она состоит из 118 металлических квадратов размером 75×75 см. В неё включены все известные химические элементы, каждый из которых занимает отдельный квадрат.
В 2006 г. в Чикаго (США) временно была организована восьмиэтажная периодическая таблица выполненная с помощью плакатов.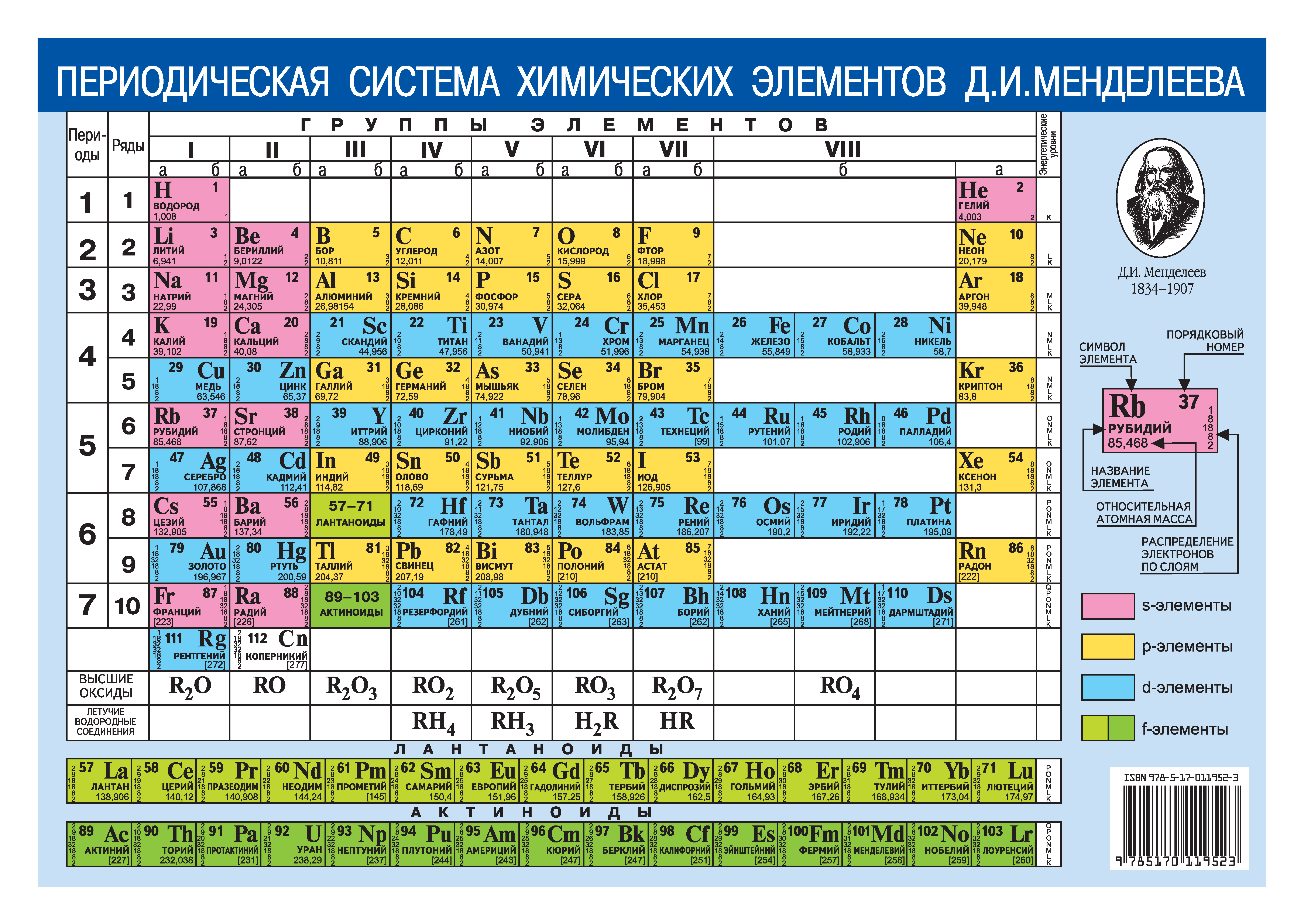
Памятник Менделееву перед химическим факультетом Словацкого технологического университета в Братиславе:
В 2003 году студенты университета Уэйк Форест спроектировали стол и скамью для пикника в форме таблицы Менделеева.
На стене ВНИИ метрологии имени Д.И. Менделева в Санкт-Петербурге размещено мозаичное панно – Периодическая таблица химических элементов. В 1932 году рядом со зданием был установлен памятник великому русскому химику.
Периодическая система химических элементов (таблица Менделеева)
https://ria.ru/20190129/1550014194.html
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. РИА Новости, 29.01.2019
2019-01-29T04:51
2019-01-29T04:51
2019-01-29T04:51
справки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.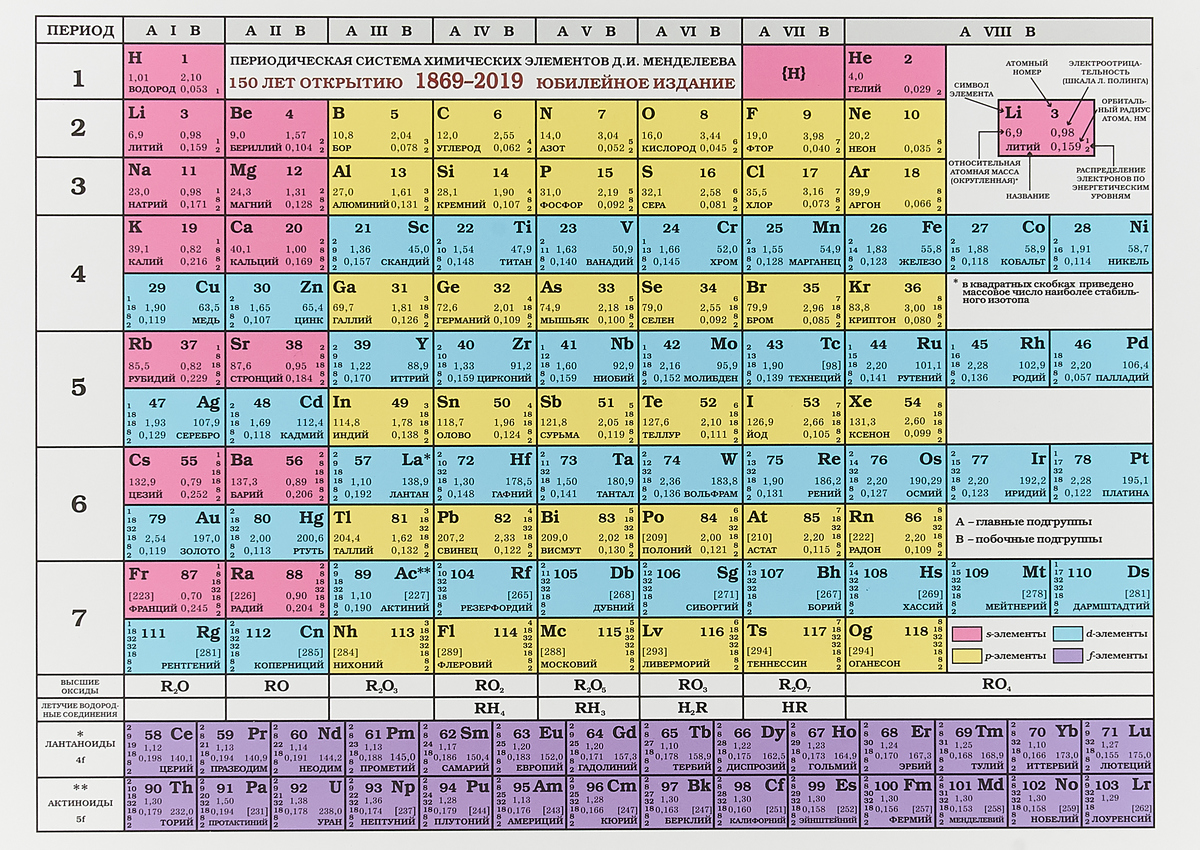 img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.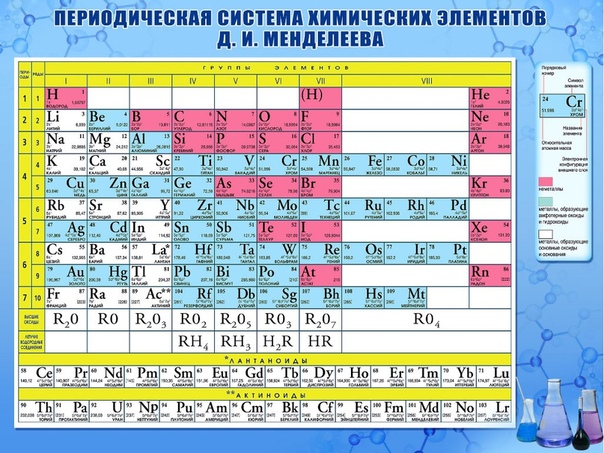 Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды..jpg) Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1920x0_80_0_0_597a34ca28aa89475eedcbd63e1a68a3.РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе.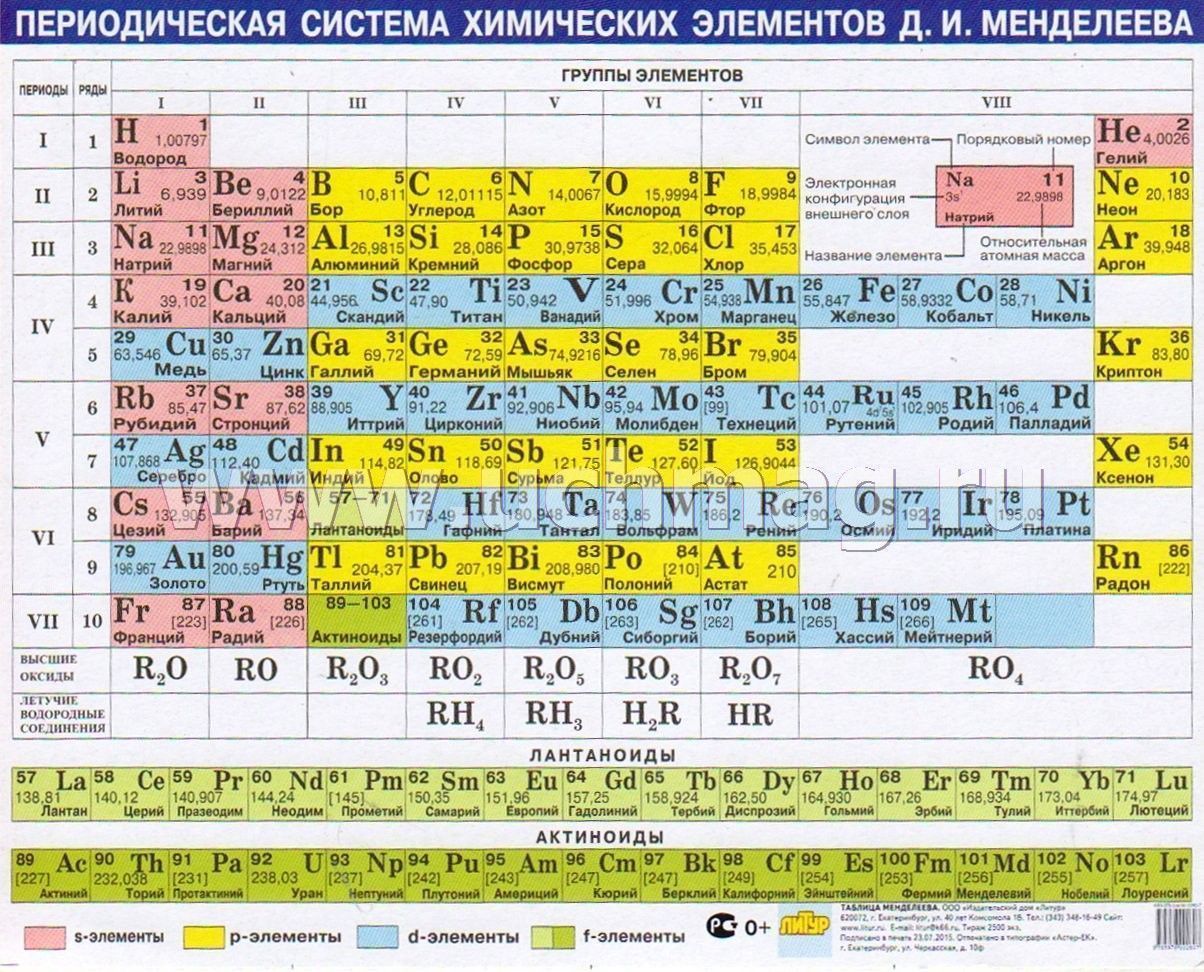 В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов.
В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов.Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры.
 Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).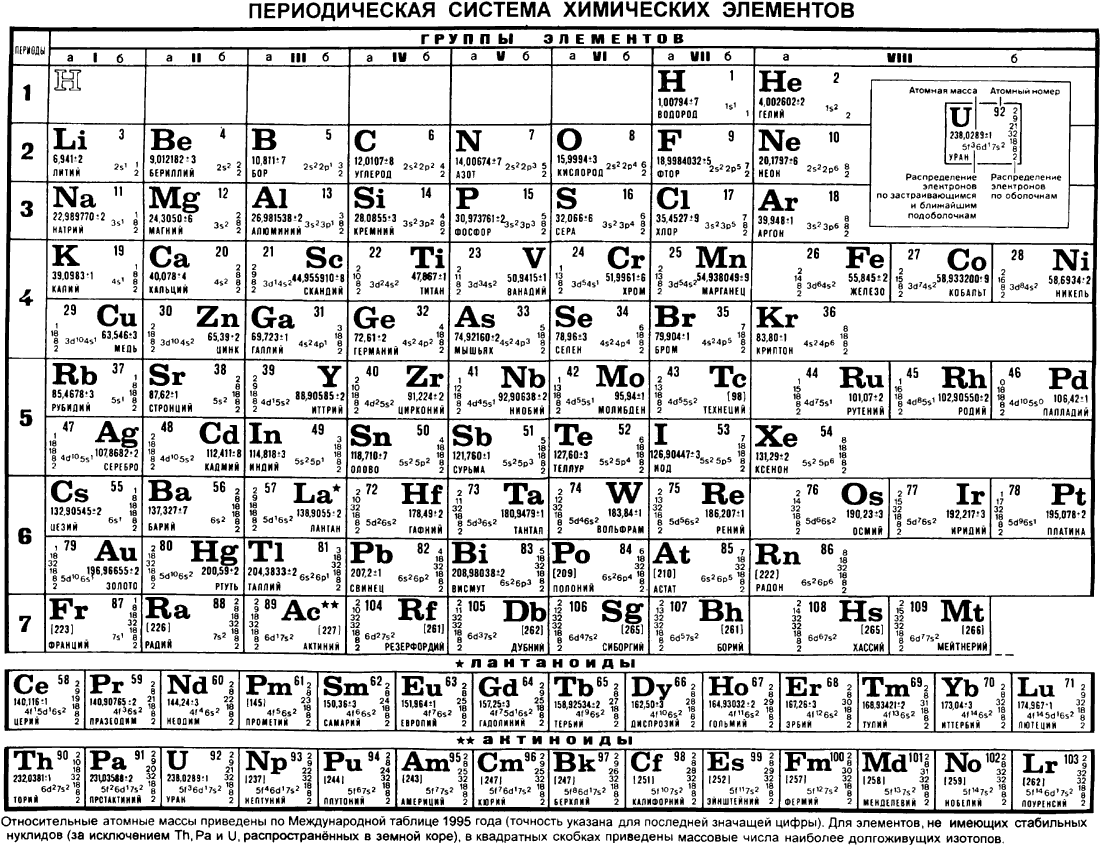
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.
С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
история открытия, интересные факты и байки – Москва 24, 24.10.2012
Фото: ИТАР-ТАСС
Открытие таблицы периодических химических элементов стало одной из важных вех в истории развития химии как науки.
Об истории открытия таблицы периодических элементов, интересных фактах, связанных с открытием новых элементов, и народных байках, которые окружали Менделеева и созданную им таблицу химических элементов, М24.RU расскажет в этой статье.
История открытия таблицы
К середине XIX века было открыто 63 химических элемента, и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию предложил химик и музыкант Джон Александр Ньюленд, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.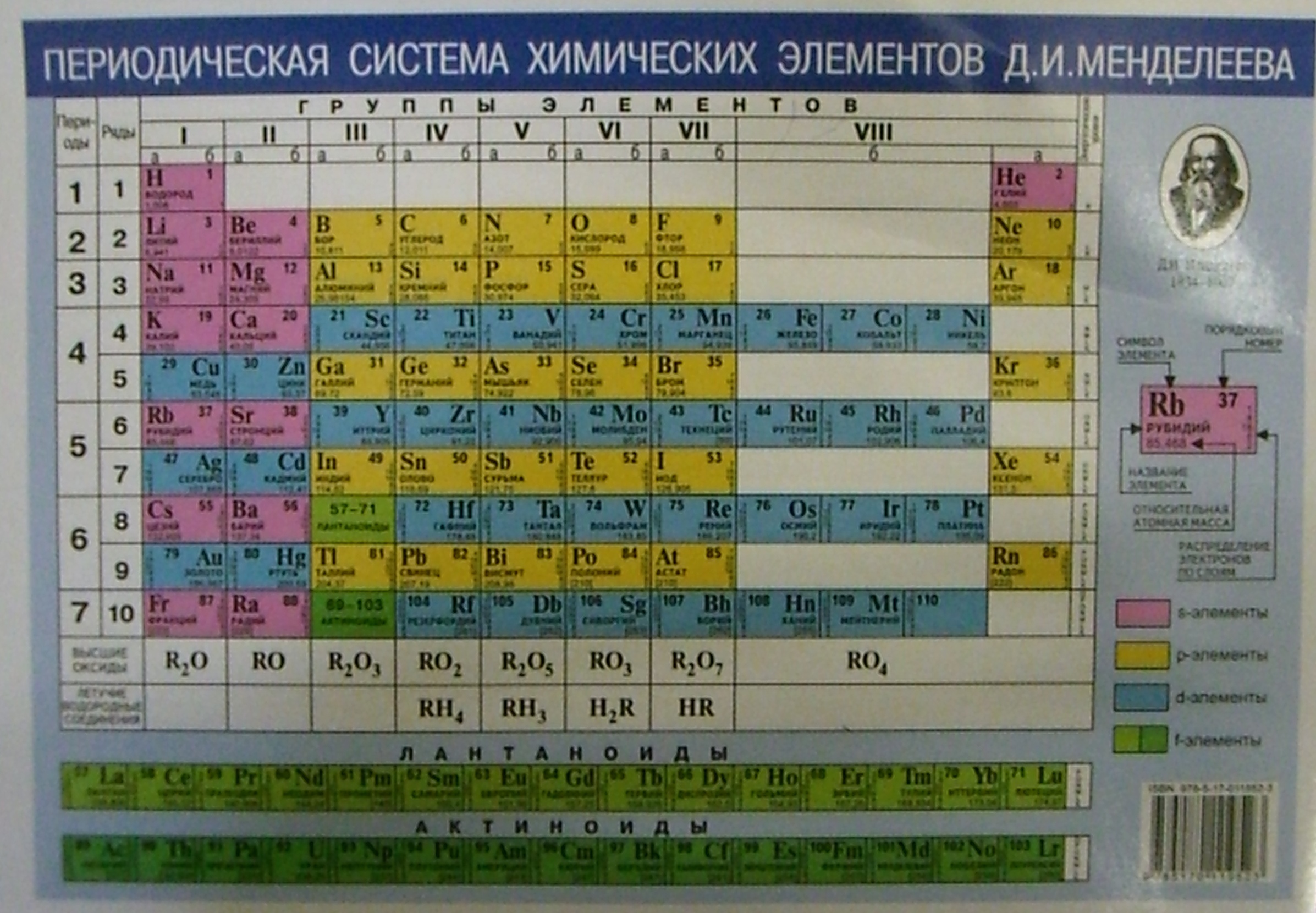
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. В дальнейшем химик не раз дорабатывал и улучшал схему, пока она не приобрела привычный вид.
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, свойства начинают повторяться. Так, калий похож на натрий, фтор — на хлор, а золото схоже с серебром и медью.
В 1871 году Менделеев окончательно объединил идеи в периодический закон. Ученые предсказал открытие нескольких новых химических элементов и описал их химические свойства. В дальнейшем расчеты химика полностью подтвердились — галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
Байки о Менделееве
Гравюра, на которой изображен Менделеев. Фото: ИТАР-ТАСС
Об известном ученом и его открытиях ходило немало баек. Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Одна из легенд гласит, что Менделеев открыл таблицу химических элементов во сне. Случай не единственный, точно также говорил о своем открытии Август Кекуле, которому приснилась формула бензольного кольца. Однако Менделеев только смеялся над критиками. «Я над ней, может быть, двадцать лет думал, а вы говорите: сидел и вдруг … готово!», — как-то сказал ученый о своем открытии.
Другая байка приписывает Менделееву открытие водки. В 1865 году великий ученый защитил диссертацию на тему «Рассуждение о соединении спирта с водою», и это сразу дало повод для новой легенды. Современники химика посмеивались, мол ученый «неплохо творит под действием спирта, соединенного с водой», а следующие поколения уже называли Менделеева первооткрывателем водки.
Посмеивались и над образом жизни ученого, а особенно над тем, что Менделеев оборудовал свою лабораторию в дупле огромного дуба.
Также современники подтрунивали над страстью Менделеева к чемоданам. Ученый в пору своего невольного бездействия в Симферополе вынужден был коротать время за плетением чемоданов. В дальнейшем он самостоятельно мастерил для нужд лаборатории картонные контейнеры. Несмотря на явно «любительский» характер этого увлечения, Менделеева часто называли «чемоданных дел мастером».
Открытие радия
Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица. Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Подобное «производство» продолжалось целых двадцать лет — до 30-х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм.
Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм.
Небулий и короний
Фото: ИТАР-ТАСС
Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические «элементы» были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона. Наиболее известна история с «открытием» новых элементов небулия и корония.
При исследовании солнечной атмосферы астрономы обнаружили спектральные линии, которые им не удалось отождествить ни с одним из известных на земле химических элементов. Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании «короны» Солнца — внешнего слоя атмосферы звезды).
Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании «короны» Солнца — внешнего слоя атмосферы звезды).
Спустя несколько лет астрономы сделали еще одно открытие, изучая спектры газовых туманностей. Обнаруженные линии, которые снова не удалось отождествить ни с чем земным, приписали другому химическому элементу — небулию.
Открытия подверглись критике, поскольку в периодической таблице Менделеева уже не оставалось места для элементов, обладающих свойствами небулия и корония. После проверки обнаружилось, что небулий является обычным земным кислородом, а короний — сильно ионизированное железо.
Отметим, что сегодня в московском Центральном доме ученых РАН торжественно присвоят имена двум химическим элементам, открытым учеными из подмосковной Дубны.
Материал создан на основе информации из открытых источников. Подготовил Василий Макагонов @vmakagonov
Таблица Менделеева — 360 Химия
Здесь Вы найдёте периодическую систему химических элементов ( ПСХЭ) Д. И. Менделеева на любой вкус, а также сможете скачать на свой компьютер многофункциональные программы с Таблицей Менделеева, которые, непременно, помогут Вам в учёбе!
И. Менделеева на любой вкус, а также сможете скачать на свой компьютер многофункциональные программы с Таблицей Менделеева, которые, непременно, помогут Вам в учёбе!
*Описание приложений:
1) Tablica NC — химический органайзер, включающий периодическую систему элементов, химический калькулятор, модуль расчёта молярной массы и перевода температур и таблицу растворимости. На данный момент программа Talbica 2004 располагает следующими данными: — Атомная масса — Плотность — Температура плавления — Температура кипения — Удельная теплоёмкость — Теплота парообразования — Период полураспада — Тип элемента — Цвет элемента — Потенциал ионизации — Сродство к электрону — Теплота распада — Электроотрицательность по Полингу — Количество электронов — Количество протонов — Количесво нейтронов — Количество нуклонов — Атомный радиус — Атомный объём — Электронная формула — Номер элемента — Группа — Период — Ряд — Подгруппа — Латинское название — Степень окисления — Год открытия — Распространённость в природе — Имя открывшего учёного — Происхождение названия.
2) PLTable — русская версия программы, включающей в себя периодическую систему элементов и химический калькулятор. Позволяет получать информацию о химических элементах таблицы Менделеева — атомная масса, потенциалы ионизации, электропроводность, электроотрицательность, плотность, место и время открытия (всего более двадцати различных типов данных для каждого элемента), а также информацию об изотопах данного элемента; уравнивать химические реакции; заносить введенные реакции в базу данных для дальнейшего использования; экспортировать информацию об элементах, сохраняя ее в таблицах формата dBASE; заносить в программу собственную — как числовую, так и текстовую — информацию о химических элементах с возможностью в дальнейшем отображать ее в таблице.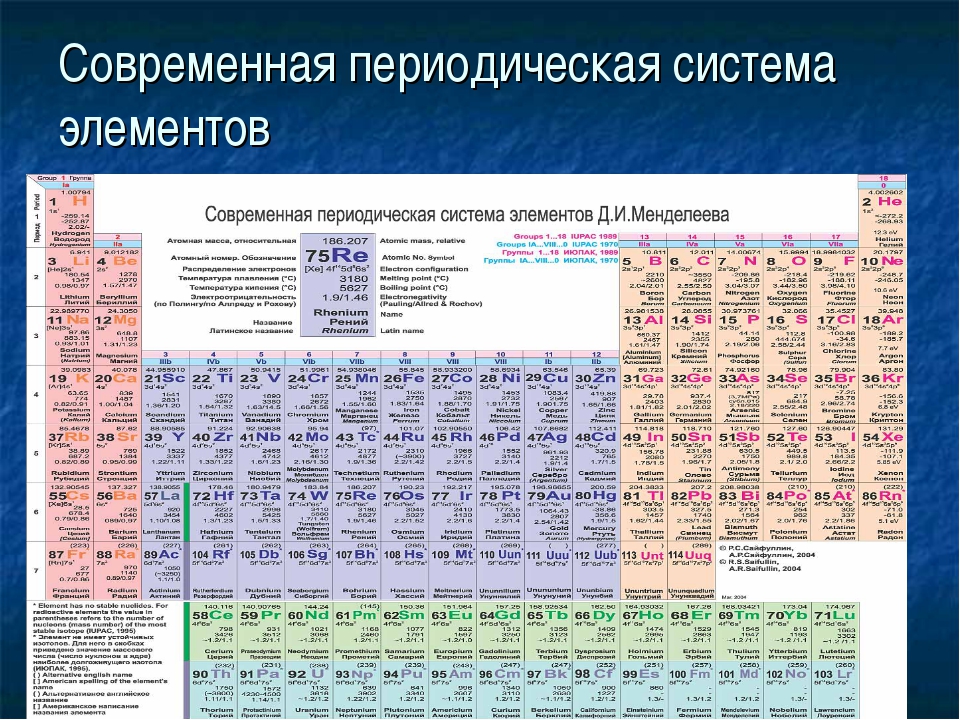 Кроме этого, Table умеет строить графики зависимостей по числовой информации об элементах (в том числе и той, что введена пользователем), переводит температуру из одной шкалы в другую, а также позволяет решать стандартные химические задачи, например, нахождение массы всех остальных веществ в реакции, зная массу одного из них.
Кроме этого, Table умеет строить графики зависимостей по числовой информации об элементах (в том числе и той, что введена пользователем), переводит температуру из одной шкалы в другую, а также позволяет решать стандартные химические задачи, например, нахождение массы всех остальных веществ в реакции, зная массу одного из них.
Современная форма таблицы Менделеева | Наука и жизнь
В этом году исполняется 170 лет со дня рождения выдающегося российского химика Дмитрия Ивановича Менделеева и 135 лет со дня создания им периодической системы элементов. За истекшее время таблица, наглядно демонстрирующая периодический закон, неоднократно дополнялась и расширялась. До последнего времени в научной и учебной литературе приводилась так называемая короткая форма таблицы. Современный, расширенный вариант таблицы Менделеева составлен авторами статьи на основании последних решений ИЮПАК — Междунаpодного союза теоpетической и пpикладной химии (International Union of Pure and Applied Chemistry — IUPAC). Эта оpганизация, созданная в 1919 году, кооpдиниpует исследования, тpебующие междунаpодного согласования, контpоля и стандаpтизации, pекомендует и утверждает химическую теpминологию, включая названия элементов. Россия, будучи полноправным членом союза, выполняет его решения и рекомендации. Новая форма таблицы была одобрена XVII Менделеевским съездом в сентябре 2003 года. В таблицу внесены самые последние характеристики всех известных на сегодняшний день элементов. Она будет полезна всем, кто изучает химию и физику или просто интересуется современной наукой.
Эта оpганизация, созданная в 1919 году, кооpдиниpует исследования, тpебующие междунаpодного согласования, контpоля и стандаpтизации, pекомендует и утверждает химическую теpминологию, включая названия элементов. Россия, будучи полноправным членом союза, выполняет его решения и рекомендации. Новая форма таблицы была одобрена XVII Менделеевским съездом в сентябре 2003 года. В таблицу внесены самые последние характеристики всех известных на сегодняшний день элементов. Она будет полезна всем, кто изучает химию и физику или просто интересуется современной наукой. ИЗ ИСТОРИИ СОЗДАНИЯ И РАЗВИТИЯ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Первого марта 1869 года Д. И. Менделеев обнародовал периодический закон и его следствие — таблицу элементов. В 1870 году он назвал систему «естественной», а спустя год — «периодической». Таблица (далекий прообраз современной), демонстрирующая закон, была представлена Менделеевым под названием «Опыт системы элементов, основанный на их атомном весе и химическом сходстве».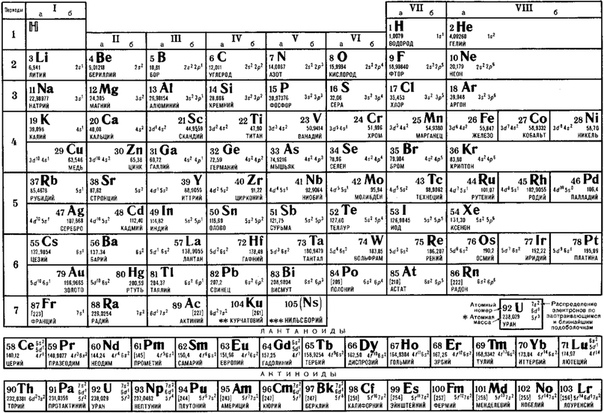 Им же была дана формулировка закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от их атомного веса». Таблица состояла из шести вертикальных групп, предшественниц будущих периодов. По горизонтали прослеживались еще не полные ряды элементов, прообразов будущих подгрупп (сегодня — групп) элементов. Она содержала 67 элементов (сейчас их около 120), в том числе три предсказанных, впоследствии открытых и названных «укрепителями периодического закона».
Им же была дана формулировка закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от их атомного веса». Таблица состояла из шести вертикальных групп, предшественниц будущих периодов. По горизонтали прослеживались еще не полные ряды элементов, прообразов будущих подгрупп (сегодня — групп) элементов. Она содержала 67 элементов (сейчас их около 120), в том числе три предсказанных, впоследствии открытых и названных «укрепителями периодического закона».
Естественно, первая таблица была несовершенной, и в последующие годы Менделеев многократно дополнял ее и вносил в ее структуру изменения. В момент представления первого варианта таблицы (март 1869 года) не были еще известны благородные («инертные») газы (Не, Ne, Ar, Kr, Xe, Rn) и отсутствовали сведения о внутреннем строении атомов. Лишь в двадцатых годах прошлого столетия, после революционных открытий в физике, применения рентгеновских лучей и обнаружения благородных газов, стало возможным дать современное определение закона о периодической зависимости свойств элементов от порядкового номера элемента, а не от атомного веса, как было вначале отмечено Д.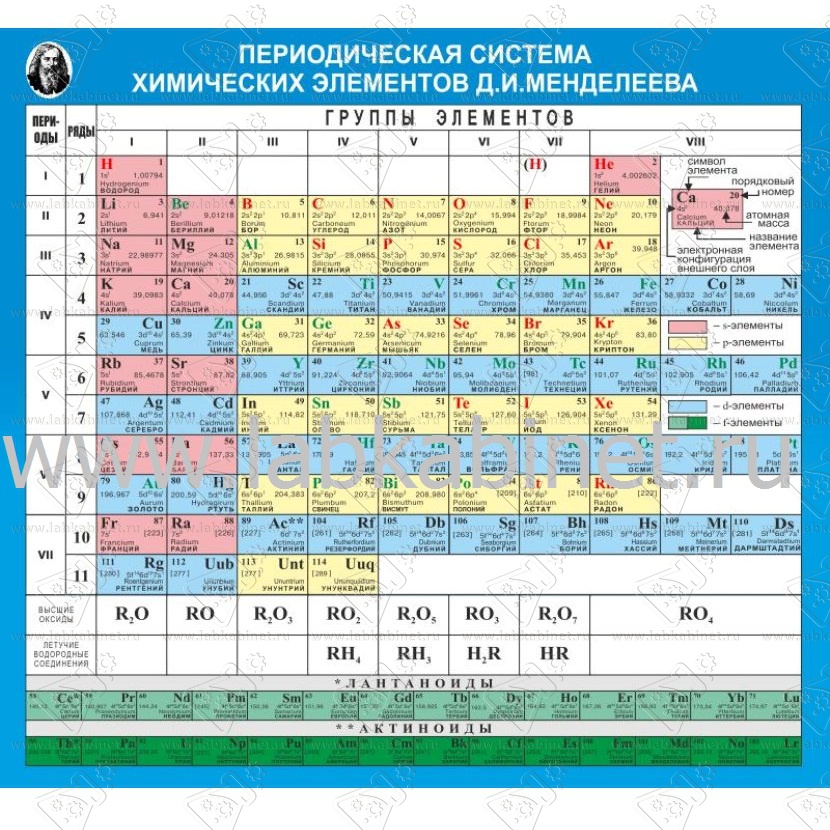 Менделеевым. Иными словами, в трактовке закона понятие «атомный вес» элемента было заменено словами «порядковый (или атомный) номер», что отвечает числу протонов в ядре атома и, соответствен но, числу электронов у нейтрального атома. Определение стало отвечать данным об электронном строении атома, диктующим периодическую повторяемость свойств атомов через 2 (s-элементы), 6 (р-элементы), 10 (d-элементы) и 14 (f-элементы) элементов. Эти цифры отвечают максимально возможному числу электронов на определенном энергетическом уровне атома. Они же соответствуют и числу возможных элементов в соответствующем периоде. На первом энергетическом уровне дозволено быть только двум электронам (на s-уровне). Они привели к наличию в первом периоде двух элементов: водорода и гелия. На втором энергетическом уровне восемь разных электронов отвечают появлению восьми новых элементов — от лития до неона. Аналогичная картина наблюдается и в третьем периоде. В нем, вместо ожидаемых восемнадцати, также восемь элементов — от натрия до аргона.
Менделеевым. Иными словами, в трактовке закона понятие «атомный вес» элемента было заменено словами «порядковый (или атомный) номер», что отвечает числу протонов в ядре атома и, соответствен но, числу электронов у нейтрального атома. Определение стало отвечать данным об электронном строении атома, диктующим периодическую повторяемость свойств атомов через 2 (s-элементы), 6 (р-элементы), 10 (d-элементы) и 14 (f-элементы) элементов. Эти цифры отвечают максимально возможному числу электронов на определенном энергетическом уровне атома. Они же соответствуют и числу возможных элементов в соответствующем периоде. На первом энергетическом уровне дозволено быть только двум электронам (на s-уровне). Они привели к наличию в первом периоде двух элементов: водорода и гелия. На втором энергетическом уровне восемь разных электронов отвечают появлению восьми новых элементов — от лития до неона. Аналогичная картина наблюдается и в третьем периоде. В нем, вместо ожидаемых восемнадцати, также восемь элементов — от натрия до аргона. Здесь произошла задержка с образованием десяти d-элементов из-за того, что 3d-электроны оказались на более высоком энергетическом уровне, чем 4s-электроны. По этой причине 3d-элементы (скандий, титан и др.) появляются лишь в четвертом периоде после двух 4s-элементов (калий и кальций). Они предшествуют 4р-элементам (от галлия до криптона). Этим объясняется возникновение обобщающего термина — «переходные элементы», «вставная декада». В пятом периоде наблюдается аналогичная картина, в него с опозданием приходят 4d-элементы; они также оказываются переходными. Описанные естественные явления были одной из причин создания таблицы из восьми групп. Однако «запаздывают» также по четырнадцать 4f— и 5f-элементов уже на два периода. Из-за их большего числа и расположения этих электронов в третьем снаружи слое (близость свойств) в обеих обсуждаемых здесь формах таблиц они выделены вне групп. Общее правило при образовании периодов системы — все они начинаются со щелочных металлов с первым ns1-электроном, образующим n-период (n — номер периода системы).
Здесь произошла задержка с образованием десяти d-элементов из-за того, что 3d-электроны оказались на более высоком энергетическом уровне, чем 4s-электроны. По этой причине 3d-элементы (скандий, титан и др.) появляются лишь в четвертом периоде после двух 4s-элементов (калий и кальций). Они предшествуют 4р-элементам (от галлия до криптона). Этим объясняется возникновение обобщающего термина — «переходные элементы», «вставная декада». В пятом периоде наблюдается аналогичная картина, в него с опозданием приходят 4d-элементы; они также оказываются переходными. Описанные естественные явления были одной из причин создания таблицы из восьми групп. Однако «запаздывают» также по четырнадцать 4f— и 5f-элементов уже на два периода. Из-за их большего числа и расположения этих электронов в третьем снаружи слое (близость свойств) в обеих обсуждаемых здесь формах таблиц они выделены вне групп. Общее правило при образовании периодов системы — все они начинаются со щелочных металлов с первым ns1-электроном, образующим n-период (n — номер периода системы). Завершает каждый период «инертный» газ с последним np6-электроном. Исключение — первый период системы, он находится всегда на особом положении.
Завершает каждый период «инертный» газ с последним np6-электроном. Исключение — первый период системы, он находится всегда на особом положении.
Таким образом, число элементов в семи известных периодах составляет 2, 8, 8, 18, 18, 32, 32. В соответствии с указанными числами будут наполняться элементами все периоды в порядке возрастания их порядковых номеров. При этом один и тот же элемент может оказаться в различных по номеру группах, что заметно при сравнении двух таблиц.
Рассмотренные цифры позволяют создать таблицы, состоящие из 2, 8, 18 или 32 групп элементов в трех вариантах — из (2+6), (2+6+10) или (2+6+10+14) групп. Исторически, как наиболее удобные, распространение получили в первую очередь таблицы, состоящие из 8 или 18 вертикальных групп:
а) Короткая форма таблицы. Она, к сожалению, до сих пор приводится в большинстве российских справочников и учебных пособий, хотя официально отменена ИЮПАК в 1989 году. Таблица состояла из VIII (+0) групп «типических» элементов, подгрупп (иногда и рядов) и периодов элементов. В современной зарубежной литературе эта форма таблицы заменена длинной формой.
В современной зарубежной литературе эта форма таблицы заменена длинной формой.
б) Длинная (реже называемая длиннопериодной или полудлинной) форма таблицы. Она была утверждена ИЮПАК в 1989 году, состоит из 18 групп, обозначенных арабскими (вместо римских) цифрами, и не содержит «типических» элементов, подгрупп, рядов и семейств. Ее упрощенные варианты появлялись гораздо раньше, но чаще всего с одним отличием — групп, обозначенных римскими цифрами, было восемь (с их растяжкой до восемнадцати за счет приставок а и b и искусственным созданием триад элементов).
в) Сверхдлинная (реже именуемая длинной) форма таблицы состояла бы из 32 групп элементов. Официально она вряд ли будет принята в предвидимом будущем, так как каждая из 14 дополнительных групп (сверх 18) содержала бы лишь два элемента (один лантаноид и один актиноид), близкие по свойствам ко всем остальным тринадцати элементам периода.
НОВАЯ ФОРМА ТАБЛИЦЫ
До 80-90-х годов прошлого века были распространены две первые формы таблицы. Первая — архаичная короткая форма с «насильственной» упаковкой элементов в восемь (I-VIII), иногда девять (+0) групп, подразделенных дополнительно еще на ряды (8 или 10) и подгруппы, содержавшие два или три «типических» элемента, предшествующих, в свою очередь, двум спорным по названиям (A, B или a, b, «главная» или «побочная»).
Первая — архаичная короткая форма с «насильственной» упаковкой элементов в восемь (I-VIII), иногда девять (+0) групп, подразделенных дополнительно еще на ряды (8 или 10) и подгруппы, содержавшие два или три «типических» элемента, предшествующих, в свою очередь, двум спорным по названиям (A, B или a, b, «главная» или «побочная»).
При выборе и утверждении длинного варианта таблицы были соблюдены «интересы» большинства элементов и принцип «золотой середины» без нарушения основы закона Менделеева — периодичности в свойствах элементов. Сорок элементов (по 10 d-элементов в каждом из периодов с 4 по 7), относимые ранее к «переходным», или «вставным» (между s- и p-элементами), и называемые «побочными», после 1989 года перестали быть таковыми. Они стали полноправными компонентами своих новых десяти групп.
С официальным принятием новой формы таблицы исчезли, став лишними, надуманные или принятые вынужденно термины: «типические элементы», «подгруппа» (главная и побочная), «триада», «ряды», «семейства» (железа или платиновых металлов). Все элементы одной группы (кроме водорода и гелия — они всегда на особом положении), расположенные вертикально в один ряд, имеют в принципе одинаковые две наружные (определяющие степень окисления) s- + p- или s- + d-орбитали электронов. Лантаноиды и актиноиды (f-элементы), как и раньше, остаются в третьей группе в соответствии с наличием в их электронных орбиталях условно s2d1-электронов. Различия в электронной структуре атомов актиноидов здесь не обсуждаются.
Все элементы одной группы (кроме водорода и гелия — они всегда на особом положении), расположенные вертикально в один ряд, имеют в принципе одинаковые две наружные (определяющие степень окисления) s- + p- или s- + d-орбитали электронов. Лантаноиды и актиноиды (f-элементы), как и раньше, остаются в третьей группе в соответствии с наличием в их электронных орбиталях условно s2d1-электронов. Различия в электронной структуре атомов актиноидов здесь не обсуждаются.
Длинная форма таблицы лишена несоответствий, недостатков и очевидных противоречий, присущих ее короткой форме, заметных при первом же взгляде на свойства элементов, искусственно собранных в одну и ту же группу. Так, например, в I группу короткой таблицы попали и металлы Cu, Ag, Au,и противоположные по активности щелочные металлы Na, K, Rb, Cs. Несовместимость свойств «одногрупповых» элементов прослеживается и по всем остальным группам. Обратим внимание лишь на бывшие конечные (VI-VIII) группы.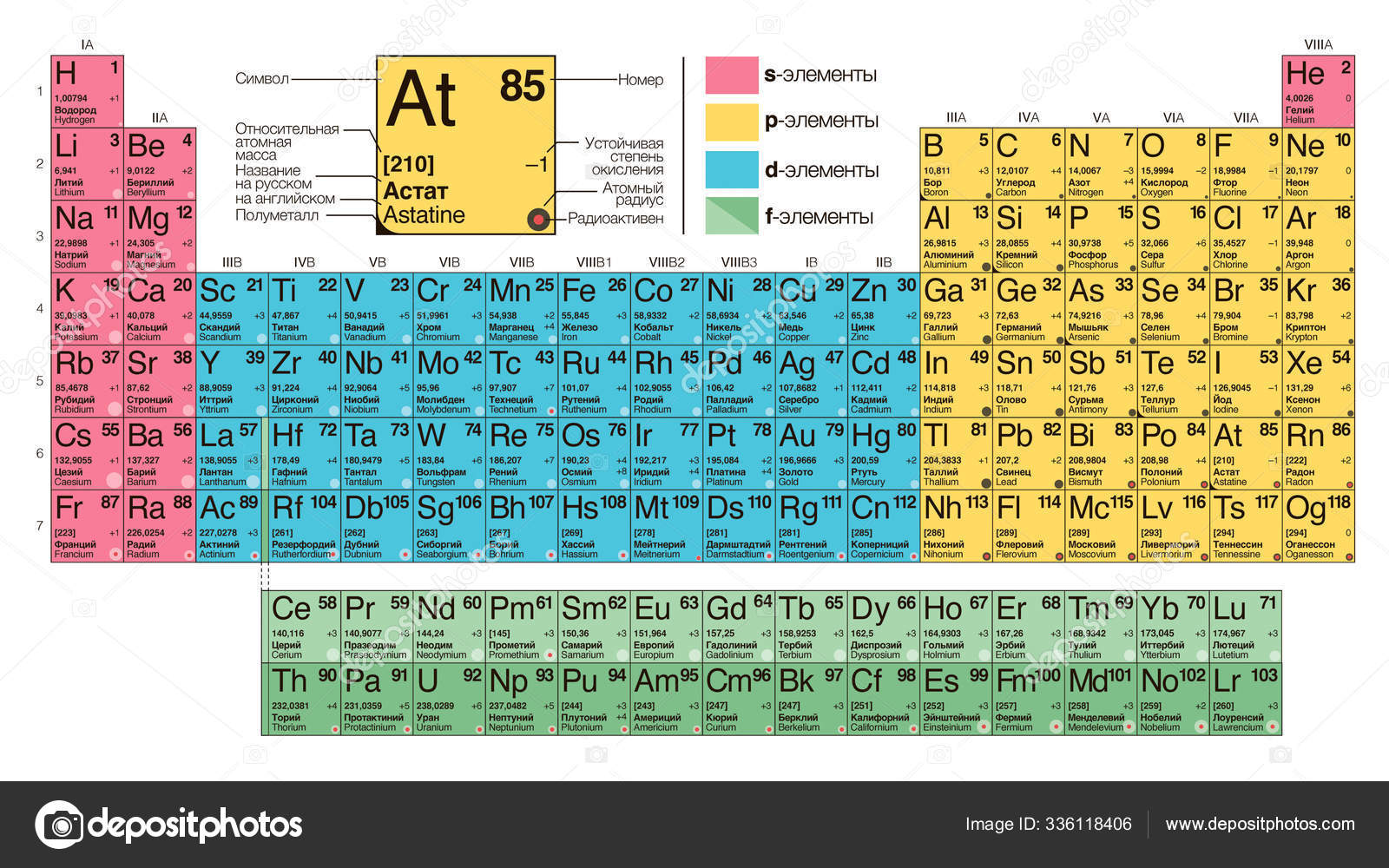 Это — соседство в VI группе двух «типических» элементов — O и S и их аналогов Se, Te, Po с тугоплавкими металлами — Cr, Mo, W; в VII группе — элементов, отвечающих агрессивным летучим галогенам F, Cl, Br, I, с не менее тугоплавкими металлами Mn, Tc, Re.
Это — соседство в VI группе двух «типических» элементов — O и S и их аналогов Se, Te, Po с тугоплавкими металлами — Cr, Mo, W; в VII группе — элементов, отвечающих агрессивным летучим галогенам F, Cl, Br, I, с не менее тугоплавкими металлами Mn, Tc, Re.
Максимально противоречива структура VIII группы. В нее включены подгруппа VIIIb с «триадой» («семейство железа» — Fe, Co, Ni) и «семейство платиновых металлов» (Ru, Rh, Pd, Os, Ir, Pt), куда, естественно, должны входить в виде трех вертикальных рядов и только что полученные элементы 108-110, которые никогда не относились к платиновым. В эту же группу входит, противореча здравому смыслу, и подгруппа VIIIa, куда отнесены благородные газы (He, Ne и другие).С уверенностью можно утверждать, что исторически эти триады-семейства были «втиснуты» в прокрустово ложе последней (VIII) группы вынужденно, вопреки логике, так как эта группа, согласно электронной структуре атомов, предназначена природой только для указанных газовых элементов. Причина образования такого «Ноева ковчега» проста: четырем триадам из 3(4) декад в каждом периоде при компоновке таблицы из восьми групп не хватило места в ее предшествующих семи группах.
Причина образования такого «Ноева ковчега» проста: четырем триадам из 3(4) декад в каждом периоде при компоновке таблицы из восьми групп не хватило места в ее предшествующих семи группах.
В официально принятой длинной форме таблицы понятия «семейство железа» и «семейство платиновых металлов» исчезают логически, так как к ним, согласно их свойствам, совместному распространению в природе, изоморфизму и последовательному изменению электронной структуры, можно было бы присоединить соседей по таблице и справа и слева. Иными словами, первое семейство можно расширить, например, до ванадия и цинка включительно, а во второе — поместить другие благородные металлы — серебро, золото, ртуть; старые понятия надуманы искусственно, будучи привязаны к структуре бывшей VIII группы.
В предложенную таблицу для каждого элемента введены также две альтернативные величины относительной электроотрицательности (ОЭО) атомов (их способности в молекуле притягивать электроны, участвующие в образовании химических связей) и основные физические параметры соответствующих простых веществ. Использовать значения ОЭО важно, в частности, для исключения и исправления устаревших ошибочных названий и написания химических формул бинарных соединений. Например, водородные соединения элементов второго периода Н4С, Н3N, H2О, НF согласно значениям ОЭО (для водорода около 2,0, для других элементов — от 2,5 для углерода до 4,0 для фтора) называются соответственно карбидом, нитридом, оксидом и фторидом водорода. В соответствии с этим приведенные написания формул аммиака и метана более справедливы, нежели традиционные (NH3 и СН4).
Использовать значения ОЭО важно, в частности, для исключения и исправления устаревших ошибочных названий и написания химических формул бинарных соединений. Например, водородные соединения элементов второго периода Н4С, Н3N, H2О, НF согласно значениям ОЭО (для водорода около 2,0, для других элементов — от 2,5 для углерода до 4,0 для фтора) называются соответственно карбидом, нитридом, оксидом и фторидом водорода. В соответствии с этим приведенные написания формул аммиака и метана более справедливы, нежели традиционные (NH3 и СН4).
Однако, несмотря на справедливое разрешение ИЮПАК давно назревшей проблемы и принятие новой системы во всем мире, ее использование в российском образовании и науке неоправданно запаздывает. Вместе с тем есть и отрадные исключения из этого. Помимо ряда изданий нового варианта таблицы, предложенного авторами настоящей статьи, можно отметить публикации простых вариантов длинной формы таблицы рядом передовых российских издательств, а современной таблицы на двух языках — в новом семитомном справочном издании. В отличие от российских, зарубежное образование и наука приняли к исполнению решение ИЮПАК 1989 года незамедлительно. Интернет также сообщает только о наличии длинной формы таблицы.
В отличие от российских, зарубежное образование и наука приняли к исполнению решение ИЮПАК 1989 года незамедлительно. Интернет также сообщает только о наличии длинной формы таблицы.
Современный вариант периодической системы, первый в российских публикациях, был создан в 1999 году. Новая форма таблицы Менделеева учебно-справочного назначения отвечает международным стандартам. Кроме русских и латинских названий элементов в ней приводятся английские и американские формы их написания. Чтобы сохранить преемственность таблиц и упростить использование ее длинной формы, новые номера групп в ней согласованы со старыми (римскими) номерами групп (I — VIII) и подгрупп (a, b), хотя зарубежные источники прежние обозначения уже не указывают. Упрощенные варианты рациональной длинной таблицы были распространены еще задолго до 1989 года, в том числе в СССР, с одним отличием — номеров групп было восемь (они обозначались римскими цифрами), но они «растягивались» до восемнадцати за счет приставок а и b и искусственного создания триад элементов.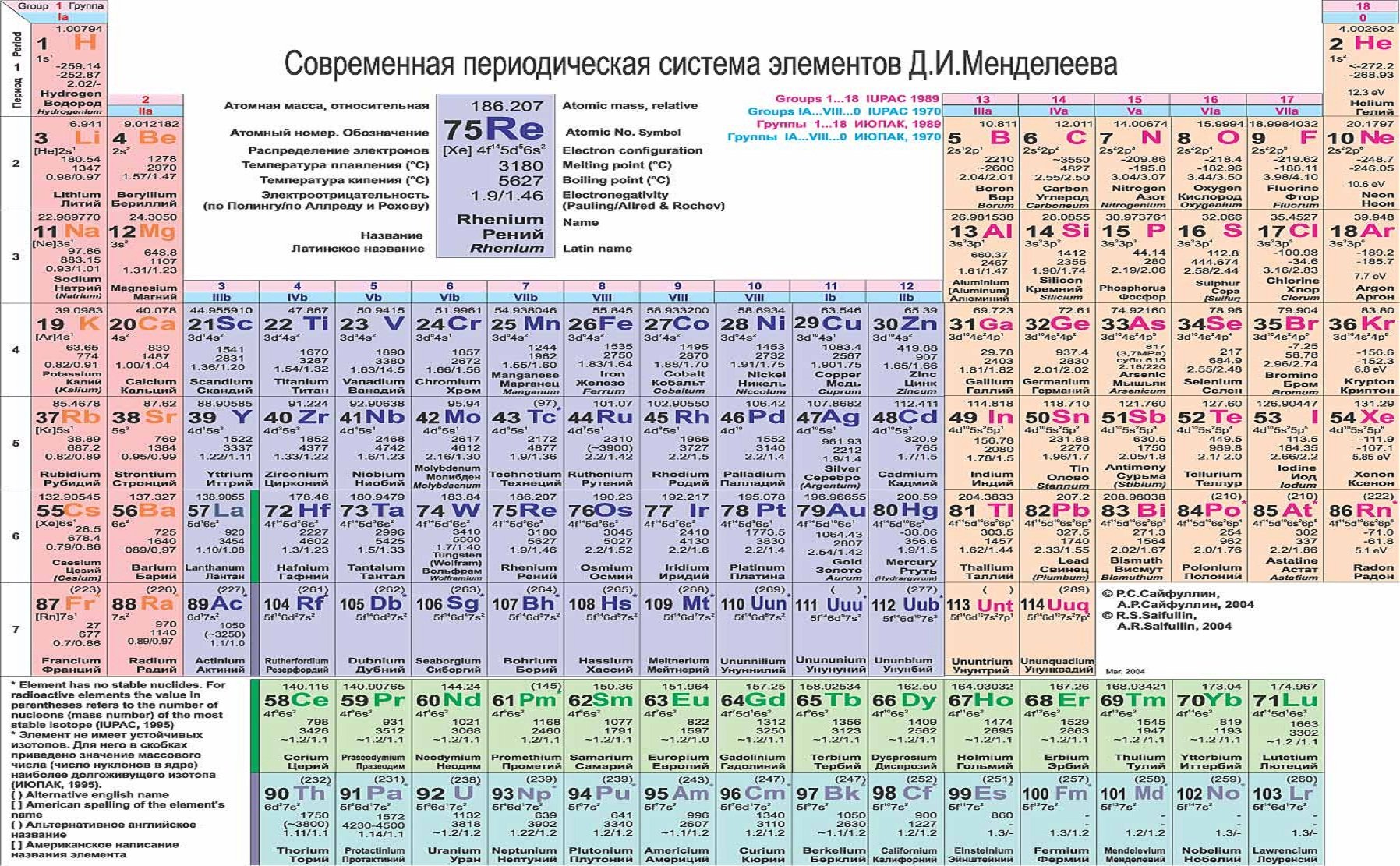 В новой таблице приведены исправленные атомные массы элементов, утвержденные ИЮПАК в 1995 году, и новые названия десяти последних элементов, окончательно утвержденные, также этой организацией, в 1997-м. Аналоги такой системы, в основном англоязычные, широко распространены в зарубежной литературе.
В новой таблице приведены исправленные атомные массы элементов, утвержденные ИЮПАК в 1995 году, и новые названия десяти последних элементов, окончательно утвержденные, также этой организацией, в 1997-м. Аналоги такой системы, в основном англоязычные, широко распространены в зарубежной литературе.
Авторы благодарныпрофессорам С. Г. Дьяконову,Н. В. Коровину, А. М. Кочневу, А. М. Кузнецову, Г. В. Лисичкину, А. И. Михайличенко, Ю. И. Сальникову, С. Н. Соловьеву, Н. А. Улаховичу, А. И. Хацринову и др., поддержавшим высказанные идеи или давшим полезные советы при оформлении современной таблицы Д. И. Менделеева.
ЛИТЕРАТУРА
Лидин Р. А. и др. Химия в помощь абитуриенту. — М.: Дрофа, 2001. 576 с.
Никольский А. Б., Суворов А. В. Химия. — СПб.: Химиздат, 2001. 512 с.
Новый справочник химика и технолога. — СПб.: НПО «Мир и семья», 2002. Т. 1, 954 с. Т. 2, 1276 с.
Сайфуллин Р. С., Сайфуллин А. Р. Универсальный лексикон: химия, физика и технология; R.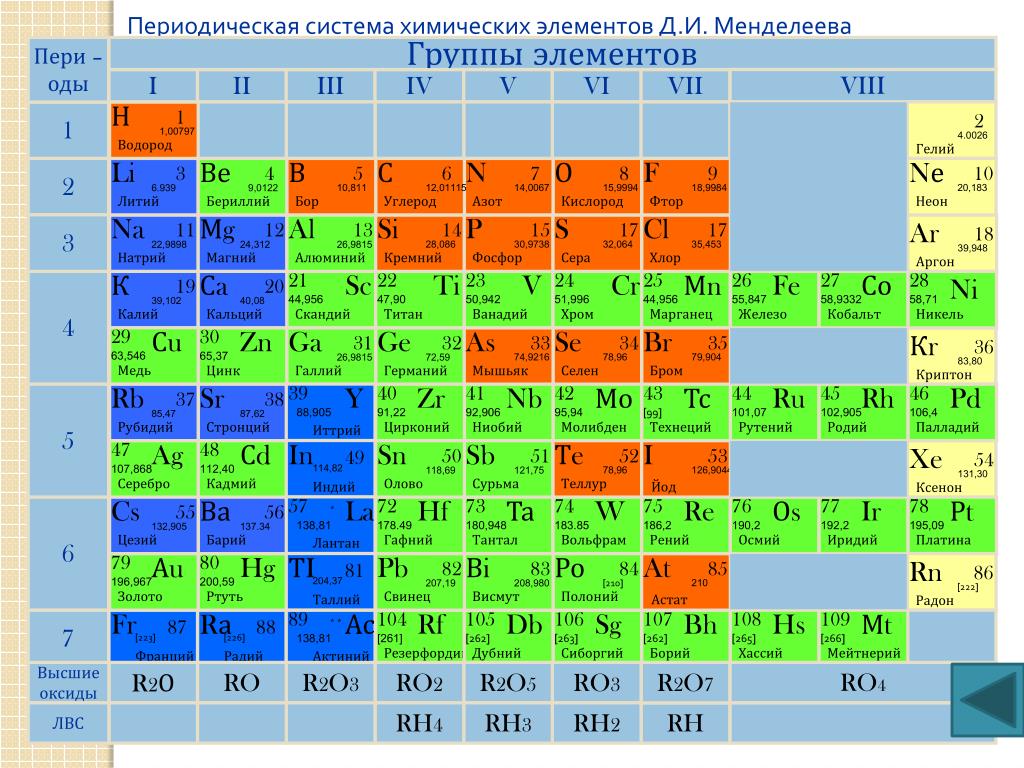 S.Saifullin, A.R.Saifullin. Universal Concise Dictionary: Chemistry, Physics andTechnology. — М.: Логос, 2001, 2002. 548 с.
S.Saifullin, A.R.Saifullin. Universal Concise Dictionary: Chemistry, Physics andTechnology. — М.: Логос, 2001, 2002. 548 с.
Хаускрофт К., Констебле Э.. Современный курс общей химии/ Пер. с англ. — М.: Мир, 2002. Т. 1, 252 с. Т. 2, 250 с.
Химия, справочник школьника и студента / Коллектив авторов. Пер. с нем. Изд. 2-е. — М.: Дрофа, 2000. 384 с.
Хисамиев Г. Г. Общая химия, задачи и упражнения (для вузов). — Казань: Магариф, 1999. 368 с.
Эмсли Дж. Элементы. — М.: Мир, 1993. 258 с.
Oxford Dictionary of Science / Ed. Isaacs A., Daintith J., Martin E. Oxford University Press, Oxford, New York, 1999. 858 p.
The New Encyclopedia Britannica, 15-th Ed., Encyclopedia Britannica, Inc. Chicago, 1974-1994.
Hawley’s Condensed Chemical Dictionary, 11-nd Ed Rev. N.I. Sax, R.J. Lewis, Sr. Van Nostrand Rheinhold Co., N.Y., 1987. 1303 p.
WebElementsTM Periodic table (professional edition) (http://www.webelements.com/. 1993-2003).
Krzysztof M.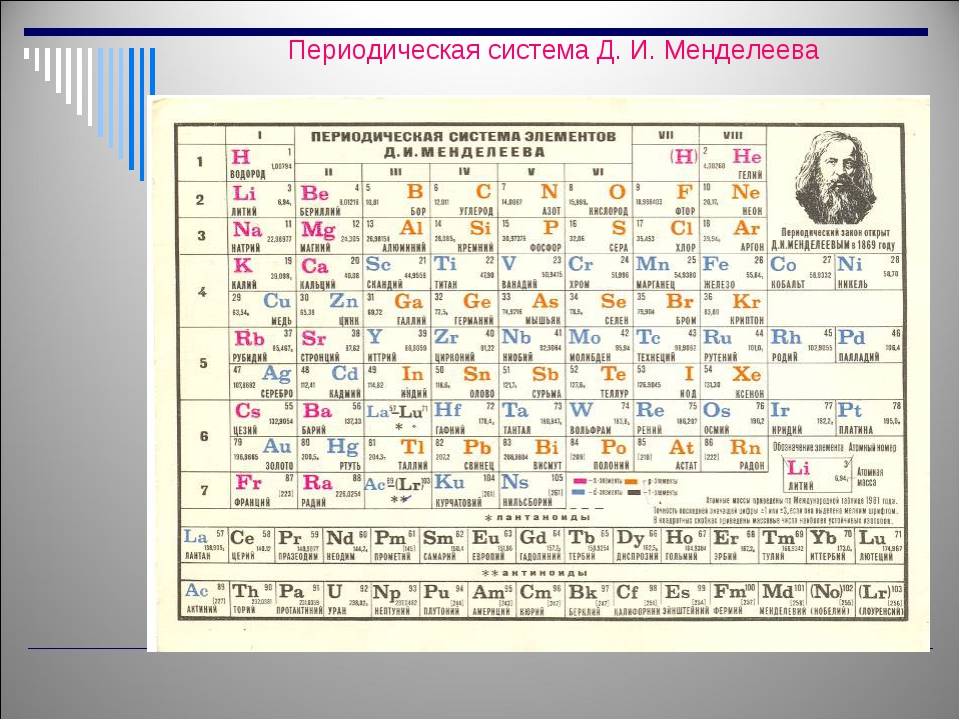 Pazdro, Chemia dla licealistov (Budowa materii w ochach chemika), Wyd. II. Oficyna Edukacyjna, Warszawa, 1996. 246 p.
Pazdro, Chemia dla licealistov (Budowa materii w ochach chemika), Wyd. II. Oficyna Edukacyjna, Warszawa, 1996. 246 p.
Подписи к иллюстрациям
Илл. 1. В современном варианте таблицы Менделеева приведены уточненные в 1995 году значения атомных масс и утвержденные в 1997 году названия девяти полученных искусственно элементов №№ 101-109.
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
‹
›
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ • Большая российская энциклопедия
ПЕРИОДИ́ЧЕСКАЯ СИСТЕ́МА ХИМИ́ЧЕСКИХ ЭЛЕМЕ́НТОВ, упорядоченное множество химич. элементов и их естеств. классификация. Является табличным представлением периодического закона, открытого Д. И. Менделеевым. Прообразом П. с. х. э. служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 (рис. 1). По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
с. х. э. служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 (рис. 1). По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).
Рис. 1. Таблица, составленная Д. И. Менделеевым 1. 3.1869.
Физич. смысл периодичности в свойствах элементов стал ясен после появления планетарной модели атома (Э. Резерфорд, 1911) и было показано (нидерл. физик А. ван ден Брук и Г.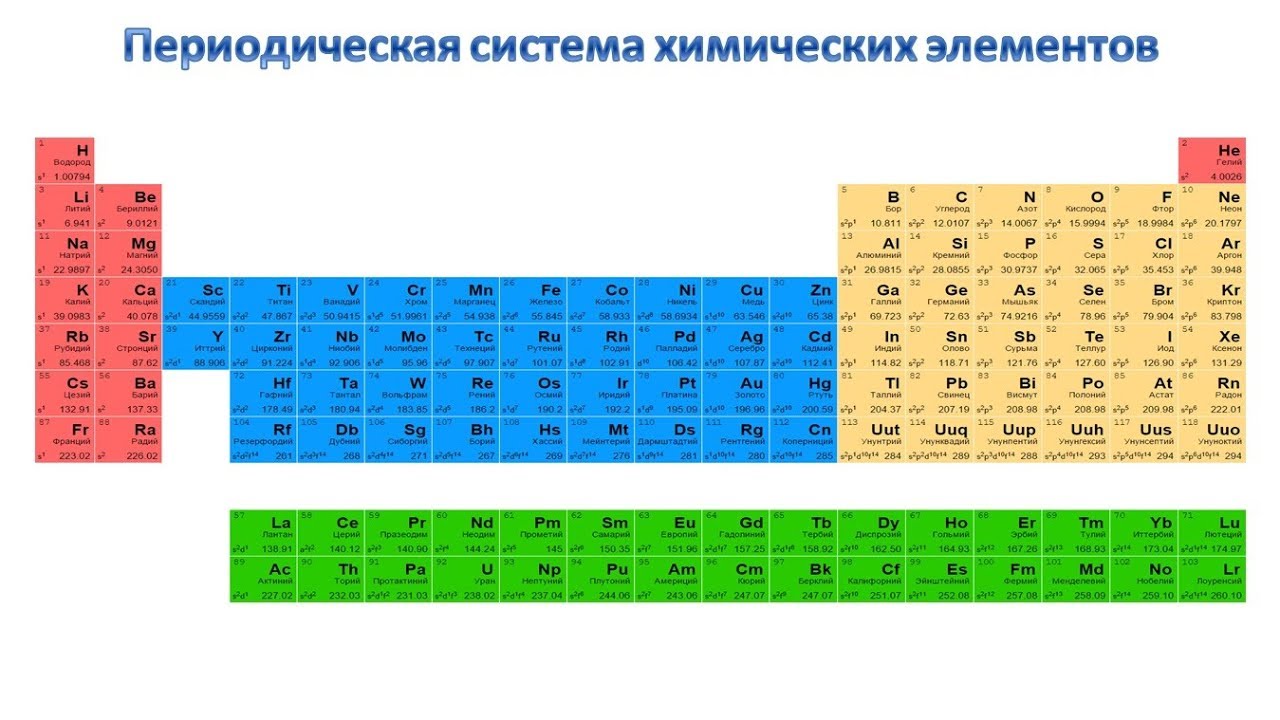 Мозли, 1913–14), что порядковый номер элемента в П. с. х. э. равен положительному заряду (Z) ядра атома. Теория П. с. х. э. в осн. создана Н. Бором (1913–21) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа Z.
Мозли, 1913–14), что порядковый номер элемента в П. с. х. э. равен положительному заряду (Z) ядра атома. Теория П. с. х. э. в осн. создана Н. Бором (1913–21) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа Z.
Совр. П. с. х. э. включает более ста химич. элементов. Наиболее тяжёлые элементы получены ядерным синтезом. Порядок заполнения электронами уровней в атомах определяется правилами, совокупность которых называют «принципом построения»: заполнение атомных орбиталей (АО) происходит в порядке увеличения энергии орбиталей: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d и т. д.; согласно Паули принципу, каждая АО (характеризуется квантовыми числами n, l, m) может содержать не более 2 электронов; АО с одинаковыми l и n заполняются так, чтобы суммарный спин электронов был максимален (т. е. заполняется макс. число АО с разными m по Хунда правилу).
е. заполняется макс. число АО с разными m по Хунда правилу).
Рис. 2. Короткий вариант периодической системы химических элементов Д. И. Менделеева (в соответствии с данными ИЮПАК на 1973).
Согласно (n+l)-правилу Клечковского, построение электронных конфигураций гл. обр. происходит в соответствии с последовательным увеличением суммы (n+l). При этом в пределах каждой такой суммы сначала заполняются подоболочки с бóльшими l и меньшими n, затем с меньшими l и бóльшими n.
Опубликовано св. 500 вариантов П. с. х. э., что связано с попытками поиска решения некоторых частных проблем её структуры. Наиболее распространены две табличные формы П. с. х. э.: короткая (рис. 2) и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером; рис. 3). В структуре П. с. х. э. выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
Рис. 3. Длинная форма периодической системы химических элементов (в соответствии с данными ИЮПАК на 2013).
Совр. форма П. с. х. э. (в 1989 ИЮПАК рекомендована длинная форма П. с. х. э.) состоит из 7 периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма П. с. х. э. – из 8 групп. Число элементов в периодах, начиная со второго, попарно повторяется: 8, 8, 18, 18, 32, 32,… (первый период содержит два элемента). Номер группы элементов короткого варианта П. с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
Первый период содержит два элемента – Н и Не. Водород имеет некоторое сходство как со щелочными элементами, так и с галогенами. В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта П.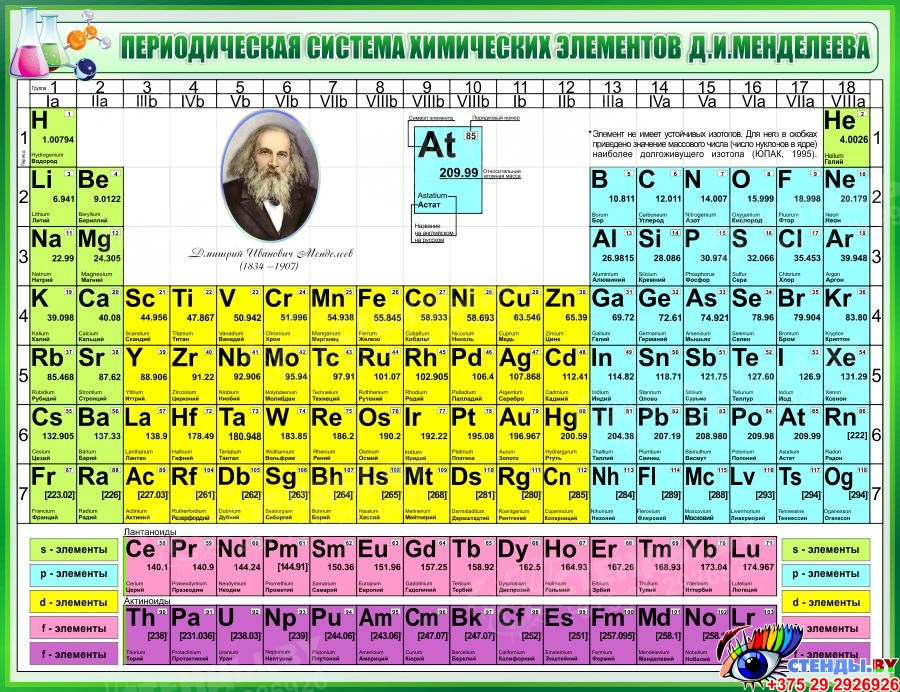 с. х. э., либо в обе одновременно.
с. х. э., либо в обе одновременно.
Второй и третий периоды (Li – Ne; Na – Ar) содержат по 8 элементов, причём характер изменения химич. свойств вертикальных аналогов во многом близок. Элементы первых трёх периодов относятся к гл. подгруппам короткого варианта периодич. системы химич. элементов.
Элементы групп 1 и 2 длинной формы называются s-элементами, групп 13–18 – p-элементами, групп 3–12 – d-элементами; d-элементы (за исключением цинка, кадмия и ртути) называют также переходными элементами.
Четвёртый период (K–Kr) содержит 18 элементов. После K и Са (s-элементы) следует ряд из десяти (Sc – Zn) 3d-элементов (побочные подгруппы короткого варианта П. с. х. э.). Переходные элементы проявляют высшие степени окисления, в осн. равные номеру группы короткого варианта П. с. х. э. (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к гл.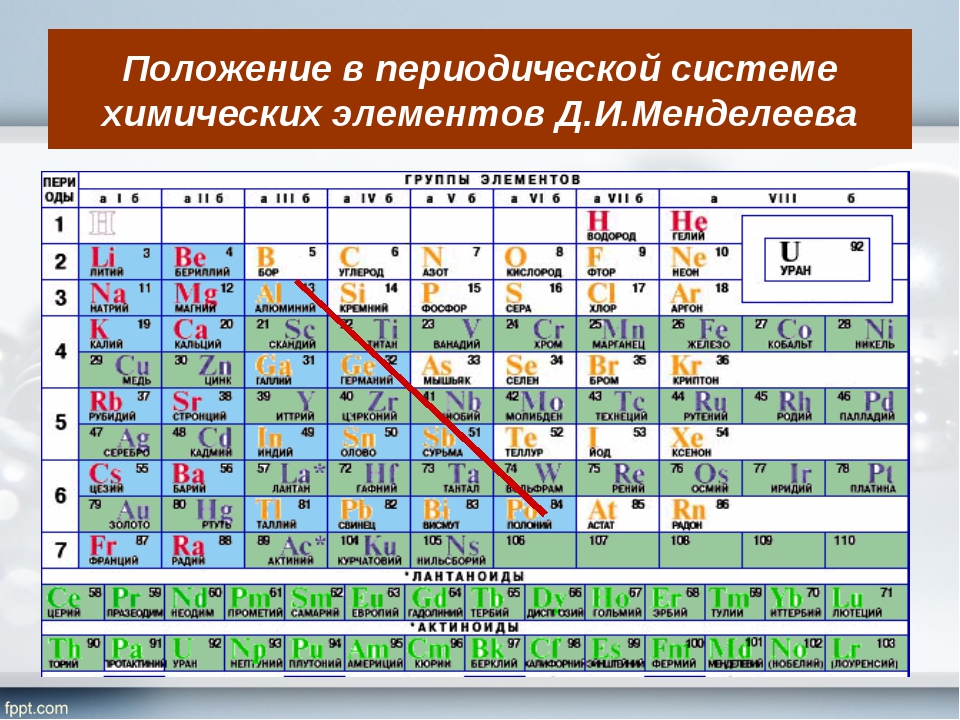 подгруппам (р-элементы).
подгруппам (р-элементы).
Пятый период (Rb – Xe) построен аналогично четвёртому; в нём также имеется «вставка» из десяти переходных 4d-элементов (Y – Cd). Особенности изменения свойств в этом периоде: в триаде Ru – Rh – Pd рутений проявляет макс. степень окисления +8, родий +6, палладий +5; все элементы гл. подгрупп, включая Хе, проявляют высшие степени окисления, равные номеру группы.
Шестой период (Сs – Rn) содержит 32 элемента. В него, помимо десяти 5d-элементов (La, Hf – Hg), входит семейство из четырнадцати 4f-элементов – лантаноидов (лантанидов, Ln). В степени окисления +3, +4 они являются химич. аналогами актиноидов, в степени окисления +2 – щёлочноземельных элементов. Лантаноиды размещены в группе 3 длинной формы, клетка La, и для удобства вынесены под таблицу. Особенностью элементов шестого периода является то, что в триаде Os – Ir – Pt два элемента – осмий и иридий – проявляют степень окисления +8, платина +6 (для Ir – данные 2010).
Седьмой период, подобно шестому, содержит 32 элемента. Актиний – аналог лантана. После Ас следует семейство из четырнадцати 5f-элементов – актиноидов (актинидов, An) (Z= 90–103). В П. с. х. э. их размещают в клетке Ас и, подобно Ln, записывают отд. строкой под таблицей. Этот приём предполагает наличие существенного химич. сходства элементов двух f-семейств. Именно на этом основывалась «актинидная концепция» Г. Сиборга (1944), сыгравшая ведущую роль при разработке методов разделения продуктов деления урана и поиске новых элементов. Однако эта концепция справедлива лишь для трёх- и четырёхвалентных An. Актиноиды же проявляют степени окисления от +2 до +7 (последняя характерна для Np, Pu, Am) и +8 (для плутония). Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Эксперим. оценки химии элементов с Z=104 (резерфордий) и Z=105 (дубний) позволили заключить, что они являются аналогами соответственно Hf и Та, т. е. 6d-элементами (должны располагаться в IVб и Vб подгруппах короткой формы). Химич. идентификация элементов с Z=106–118 не проводилась из-за слишком коротких «времён жизни» синтезированных изотопов, но в соответствии со структурой П. с. х. э. можно считать, что элементы Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn относятся к 6d-элементам, элементы c Z=113–118 близки соответственно вертикальным аналогам. Это же следует из совр. квантовохимич. расчётов.
П. с. х. э. является важным звеном эволюции атомно-молекулярного учения, способствует уточнению представлений о простых веществах и соединениях, оказала значит. влияние на разработку теории строения атомов. С П. с. х. э. связана постановка проблемы прогнозирования в химии, что проявилось в предсказании как существования неизвестных элементов и их свойств, так и особенностей химич. поведения известных элементов. П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
В периодическую таблицу Менделеева внесены четыре новых элемента, два из которых связаны с Россией
В подмосковной Дубне приступили к изучению свойств новых химических элементов: открытые совместно с зарубежными учеными, два из четырех элементов получили названия, которые напрямую говорят о связи с Россией. Сегодня таблица Менделеева уже другая.
Для большинства из нас понять, что именно открыли и как это может быть использовано в жизни, настолько трудно, что мы можем только верить исследователям, представляя, как многое вообще еще неизвестно. Это категории высшей материи!
Так выглядит таблица Менделеева, которую можно купить в магазинах сегодня: в седьмом периоде зияют дыры. Теперь это все придется перепечатывать. 113, 115, 117 и 118 элементы официально открыты и получили названия. Три из них признаны открытиями ученых из Объединенного института ядерных исследований в подмосковной Дубне.
Теперь это все придется перепечатывать. 113, 115, 117 и 118 элементы официально открыты и получили названия. Три из них признаны открытиями ученых из Объединенного института ядерных исследований в подмосковной Дубне.
«Московий – в честь земли московской; ливерморий – это наши коллеги из Ливермора, которые работали вместе с нами, приезжали сюда, все эксперименты делаются здесь; то же самое теннессин – из Теннесси наши коллеги; ну а 118 – домашний, наш, родной», — рассказывает научный руководитель Лаборатории ядерных реакций им. Г.Н. Флерова, академик РАН Юрий Оганесян.
118 элемент для Юрия Оганесяна не просто родной. Он назван в его честь – оганесон. Это второй случай в мировой истории, когда элемент периодической таблицы называется в честь ученого при жизни. Такой вариант названия предложили его коллеги из лаборатории ядерных исследований.
Больше 20 лет Юрий Цолакович стоит во главе российско-американской группы ученых, синтезирующих и исследующих сверхтяжелые элементы периодической системы.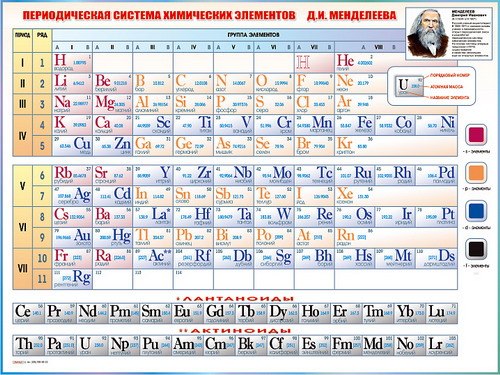
«Охота за этими элементами – это такая сегодня совершенно важная часть современной экспериментальной ядерной физики. И тут надо сказать, что наши ученые, в частности, во главе с академиком Оганесяном, они здесь занимают самые передовые позиции», — отмечает президент Российской Академии Наук Владимир Фортов.
На вопросы журналистов «каково это, когда твое имя вписывается в историю на века», ученый отвечал скромно.
«Не ищите каких-то сверхчувств, поставьте себя на мое место. Я благодарен своим коллегам, своим товарищам, с которыми прошел этот долгий путь, и очень рад, конечно, что он кончился вот этим открытием, доказательством этому является не один, а на самом деле семь элементов. Один из них вот так назван, но это уже не столь важно, как он назван, а важно то, что это есть», — говорит ученый.
Сначала считалось, что периодическая таблица вообще должна закончиться на сотом элементе. Каждое новое открытие переворачивало весь научный мир. И именно Лаборатория ядерных исследований Дубнинского института — признанный мировой лидер по заполнению таблицы Менделеева. 105 элемент назван дубнием, а 114 — флеровием в честь основателя лаборатории Георгия Флерова. Теперь — московий и оганесон.
105 элемент назван дубнием, а 114 — флеровием в честь основателя лаборатории Георгия Флерова. Теперь — московий и оганесон.
«За эти 60 лет в стенах этой Лаборатории, в стенах нашего института, усилиями многонациональных коллективов Лаборатории было открыто 11 сверхтяжелых элементов, доселе неизвестных миру, неизвестных науке, и это, конечно, я сказал бы, выдающийся результат», — сказал директор Объединенного института ядерных исследований Виктор Матвеев.
О практическом применении последних открытий речи пока не идет. Это дело науки будущего. Хотя ученые говорят: для того, чтобы синтезировать новый элемент, нужно уже совершить много технических открытий и инноваций. Ускорители, которые располагаются в Дубне, не имеют аналогов. На циклотроне У400 и были синтезированы самые тяжелые элементы.
Частицы кальция-48 проходят по каналу. Для синтеза нового элемента нужно, чтобы они попали точно в мишень. Обычно это уран, плутоний или калифорний. Мишень находится за стеной. Каждую секунду по ней выпускается 10 триллионов частиц, эксперимент идет несколько месяцев и за все это время рождается всего несколько ядер.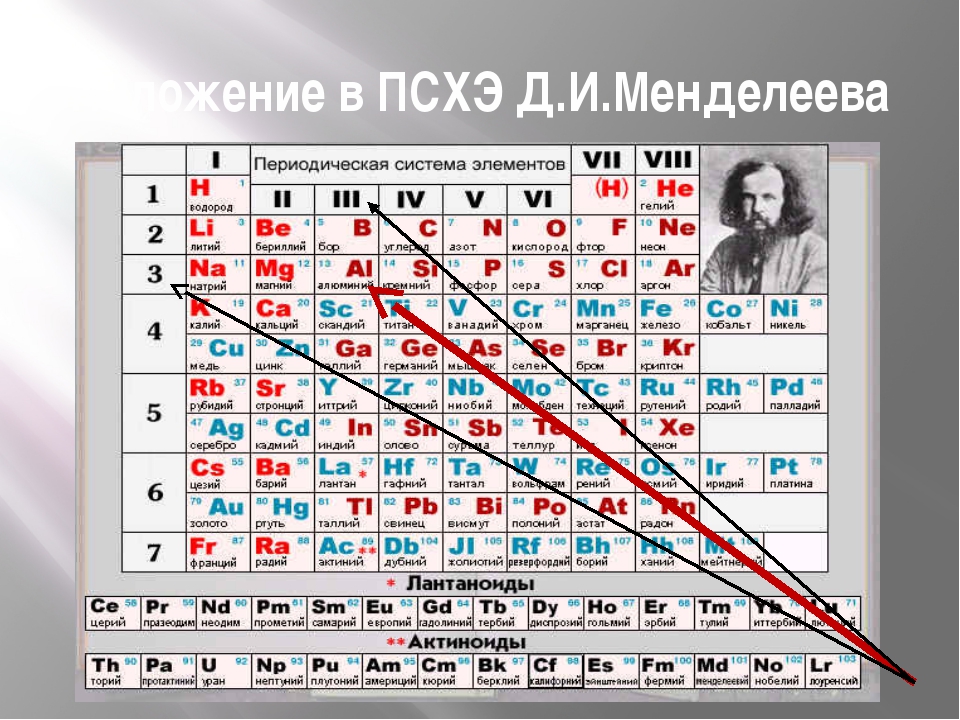
Ученые из Дубны уже поставили перед собой следующую задачу: синтез 119, 120 и последующих элементов. Специально для этого здесь строится так называемая «фабрика сверхтяжелых элементов».
Сердцем этой фабрики станет новый ускоритель, превосходящий по мощности все мировые аналоги в 10 раз. Именно в пространстве дубнинского циклотрона частицы будут разгоняться по спирали до скорости, близкой к скорости света.
Если во время предыдущих экспериментов ядра новых элементов образовывались раз в несколько месяцев, то теперь это будет происходить каждый день. Поставить научные открытия на поток – вот в чем смысл названия «фабрика». Первый запуск этого комплекса сверхтяжелых элементов намечен уже на ноябрь 2017 года.
Кислород показывает положительную степень окисления в сочетании с чем? Степень окисления Когда атом кислорода находится в положительной степени окисления
Редокс-процессы имеют большое значение для живой и неживой природы. Например, процесс горения можно отнести к ОВР с участием атмосферного кислорода. В этой окислительно-восстановительной реакции он проявляет неметаллические свойства.
Например, процесс горения можно отнести к ОВР с участием атмосферного кислорода. В этой окислительно-восстановительной реакции он проявляет неметаллические свойства.
Также примерами ОВР являются пищеварительные, дыхательные процессы, фотосинтез.
Классификация
В зависимости от того, изменяется ли величина степени окисления элементов исходного вещества и продукта реакции, принято делить все химические превращения на две группы:
- окислительно-восстановительные;
- без изменения степени окисления.
Примерами второй группы являются ионные процессы, протекающие между растворами веществ.
Реакции окисления-восстановления — это процессы, которые связаны с изменением степени окисления атомов, составляющих исходные соединения.
Что такое степень окисления
Это условный заряд, приобретаемый атомом в молекуле, когда электронные пары химических связей смещаются к более электроотрицательному атому.
Например, в молекуле фторида натрия (NaF) фтор проявляет максимальную электроотрицательность, поэтому его степень окисления отрицательная. Натрий в этой молекуле — положительный ион. Сумма степеней окисления в молекуле равна нулю.
Натрий в этой молекуле — положительный ион. Сумма степеней окисления в молекуле равна нулю.
Варианты определения
Какой ион кислород? Положительные степени окисления для него не характерны, но это не значит, что этот элемент не проявляет их в определенных химических взаимодействиях.
Само понятие степени окисления носит формальный характер; он не связан с эффективным (реальным) зарядом атома. Его удобно использовать при классификации химических веществ, а также при записи текущих процессов.
Правила определения
Для неметаллов различают самую низкую и самую высокую степени окисления. Если из номера группы вычесть восемь для определения первого показателя, то второе значение в основном совпадает с номером группы, в которой находится этот химический элемент.Например, в соединениях обычно -2. Такие соединения называют оксидами. Например, эти вещества включают диоксид углерода (диоксид углерода), формула которого CO 2.
Максимальная степень окисления неметаллов часто находится в кислотах и солях.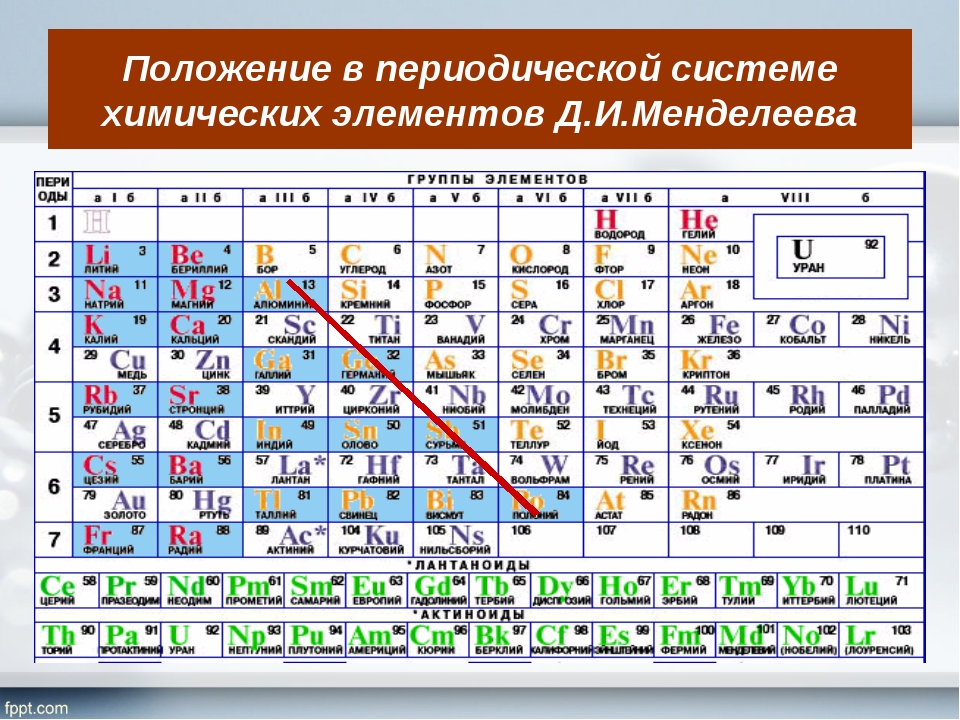 Например, в хлорной кислоте HClO 4 галоген имеет валентность VII (+7).
Например, в хлорной кислоте HClO 4 галоген имеет валентность VII (+7).
Пероксиды
Степень окисления атома кислорода в соединениях обычно составляет -2, за исключением пероксидов. Они считаются кислородными соединениями, которые содержат неполностью восстановленный ион в виде O 2 2-, O 4 2-, O 2 -.
Пероксидные соединения делятся на две группы: простые и сложные. Самыми простыми являются те соединения, в которых пероксидная группа соединяется с атомом или ионом металла посредством атомной или ионной химической связи. Такие вещества образуют щелочные и щелочноземельные металлы (кроме лития и бериллия). С увеличением электроотрицательности металла внутри подгруппы наблюдается переход от ионного типа связи к ковалентной структуре.
Помимо пероксидов типа Me 2 O 2, представители первой группы (основная подгруппа) имеют также пероксиды в виде Me 2 O 3 и Me 2 O 4.
Если кислород показывает положительную степень окисления с фтором, в сочетании с металлами (в пероксидах) этот показатель равен -1.
Комплексными пероксосоединениями считаются вещества, в которых эта группа действует как лиганды. Подобные вещества образуют элементы третьей группы (основная подгруппа), а также последующих групп.
Классификация сложных пероксогрупп
Всего таких комплексных соединений пять групп. Первый состоит из пероксокислот, которые имеют общую форму [Ep (O 2 2-) x L y] z-.В этом случае ионы пероксида входят в комплексный ион или действуют как монодентантный (E-O-O-), мостиковый (E-O-O-E) лиганд, образуя многоядерный комплекс.
Если кислород проявляет положительную степень окисления с фтором в сочетании со щелочными и щелочноземельными металлами, это типичный неметалл (-1).
Примером такого вещества является кислота Каро (пероксомономерная кислота) типа H 2 SO 5. Пероксидная группа лиганда в таких комплексах действует как мостиковая связь между атомами неметаллов, например, в пероксодисерной кислоте образуют H 2 S 2 O 8, белое кристаллическое вещество с низкой температурой плавления.
Вторая группа комплексов образована веществами, в которых пероксогруппа является частью комплексного иона или молекулы.
Они представлены формулой [E n (O 2) x L y] z.
Остальные три группы представляют собой пероксиды, которые содержат кристаллизационную воду, например Na 2 O 2 × 8H 2 O, или кристаллизационную пероксид водорода.
В качестве характерных свойств всех пероксидных веществ выделим их взаимодействие с растворами кислот, выделение активного кислорода при термическом разложении.
Хлораты, нитраты, перманганаты, перхлораты могут действовать как источник кислорода.
Дифторид кислорода
Когда кислород проявляет положительную степень окисления? В сочетании с более электроотрицательным кислородом) OF 2. Это +2. Это соединение было впервые получено Полем Лебо в начале двадцатого века, немного позже изучено Раффом.
Кислород проявляет положительную степень окисления в сочетании с фтором. Его электроотрицательность равна 4, поэтому электронная плотность в молекуле смещена в сторону атома фтора.
Свойства фторида кислорода
Это соединение находится в жидком агрегатном состоянии, неограниченно смешивается с жидким кислородом, фтором, озоном. Растворимость в холодной воде минимальная.
Как объяснить положительную степень окисления? Большая энциклопедия нефти объясняет, что вы можете определить наивысшую + (положительную) степень окисления по номеру группы в периодической таблице. Это значение определяется наибольшим числом электронов, которое нейтральный атом может отдать при полном окислении.
Фторид кислорода получают щелочным методом, который включает пропускание газообразного фтора через водный раствор щелочи.
При этом помимо фторида кислорода образуются также озон и перекись водорода.
Альтернативным вариантом получения фторида кислорода является электролиз раствора плавиковой кислоты. Это соединение также частично образуется при горении воды в атмосфере фтора.
Процесс протекает по радикальному механизму.Сначала осуществляется инициирование свободных радикалов, сопровождающееся образованием кислородного бирадикала. Следующий этап — доминирующий процесс.
Следующий этап — доминирующий процесс.
Дифторид кислорода проявляет сильные окислительные свойства. По силе его можно сравнить со свободным фтором, а по механизму окислительного процесса — с озоном. Реакция требует высокой энергии активации, так как на первой стадии образуется атомарный кислород.
Термическое разложение этого оксида, в котором кислород имеет положительную степень окисления, представляет собой мономолекулярную реакцию, начинающуюся при температурах от 200 ° C.
Отличительные характеристики
При попадании фторида кислорода в горячую воду происходит гидролиз, продуктами которого будет обычный молекулярный кислород, а также фтороводород.
Процесс значительно ускоряется в щелочной среде. Смесь воды и паров дифторида кислорода взрывоопасна.
Это соединение интенсивно реагирует с металлической ртутью и образует только тонкую пленку фторида на благородных металлах (золоте, платине). Это свойство объясняет возможность использования этих металлов при обычных температурах для контакта с фторидом кислорода.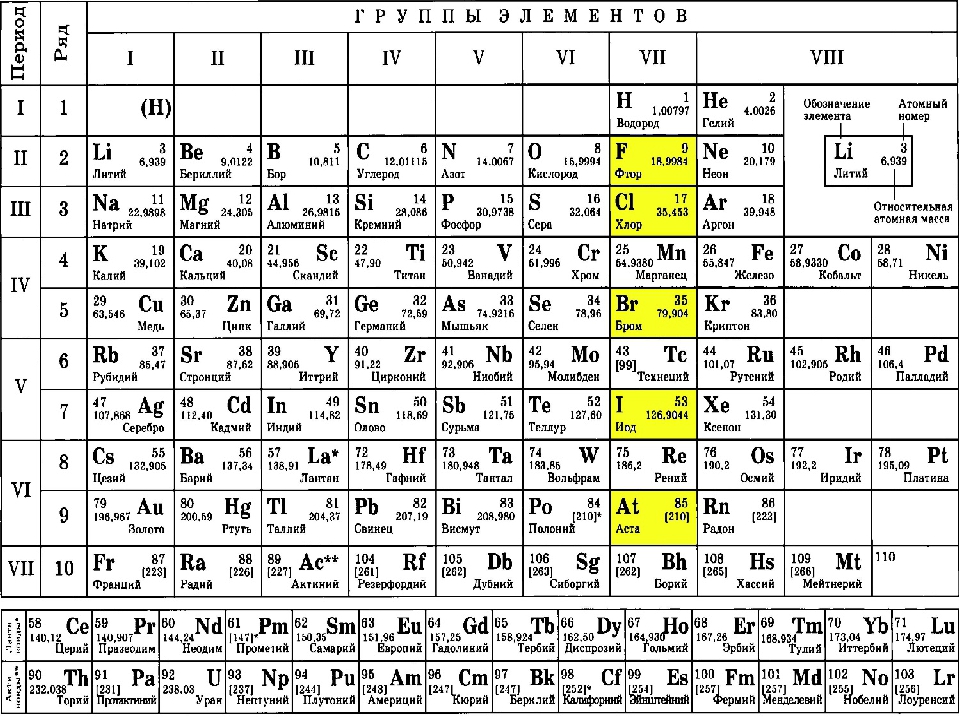
При повышении температурного показателя металлы окисляются. Наиболее подходящими металлами для работы с этим соединением фтора являются магний и алюминий.
Нержавеющие стали и медные сплавы незначительно изменяют свой первоначальный вид под действием фтористого кислорода.
Высокая энергия активации разложения этого кислородного соединения фтором позволяет безопасно смешивать его с различными углеводородами, оксидом углерода и объясняет возможность использования фторида кислорода в качестве отличного окислителя ракетного топлива.
Заключение
Химиками был проведен ряд экспериментов, подтвердивших целесообразность использования этого соединения в газодинамических лазерных установках.
Вопросы, связанные с определением степени окисления кислорода и других неметаллов, включены в школьный курс химии.
Такие навыки важны, так как позволяют старшеклассникам справляться с заданиями, предлагаемыми в тестах единого государственного экзамена.
ОПРЕДЕЛЕНИЕ
Кислород — восьмой элемент Периодической таблицы.Находится во втором периоде VI группы подгруппы А. Обозначение — О.
Природный кислород состоит из трех стабильных изотопов 16 O (99,76%), 17 O (0,04%) и 18 O (0,2%).
Наиболее стабильной является молекула двухатомного кислорода O 2. Она парамагнитна и слабо поляризована. Температуры плавления (-218,9 o C) и кипения (-183 o C) кислорода очень низкие. Кислород плохо растворяется в воде. В нормальных условиях кислород представляет собой газ без цвета и запаха.
Жидкий и твердый кислород притягивается магнитом, потому что его молекулы парамагнитны.Твердый кислород имеет синий цвет, а жидкий кислород синий. Окрашивание происходит из-за взаимного влияния молекул.
Кислород существует в форме двух аллотропных модификаций — кислорода O 2 и озона O 3.
Степень окисления кислорода в соединениях
Кислород образует двухатомные молекулы состава O 2 за счет индукции ковалентных неполярных связей, и, как известно, в соединениях с неполярными связями степень окисления элементов составляет ноль .
Кислород характеризуется достаточно высоким значением электроотрицательности, поэтому чаще всего имеет отрицательную степень окисления, равную (-2). (Na 2 O -2, K 2 O -2, CuO -2, PbO -2, Al 2 O -2 3, Fe 2 O -2 3, NO -2 2, P 2 O -2 5, CrO — 2 3, Mn 2 O -2 7).
В соединениях пероксидного типа кислород проявляет степень окисления (-1) (H 2 O -1 2).
В соединении OF 2 кислород имеет положительную степень окисления, равную (+2) , потому что фтор является наиболее электроотрицательным элементом и его степень окисления всегда (-1).
Как производное, в котором кислород проявляет степень окисления (+4) , можно рассматривать аллотропную модификацию кислорода — озон O 3 (O + 4 O 2).
Примеры решения проблем
ПРИМЕР 1
(повторение)
II … Степень окисления (новый материал)
Состояние окисления — это условный заряд, который получает атом в результате полного возврата (принятия) электронов, при условии, что все связи в соединении являются ионными.
Рассмотрим строение атомов фтора и натрия:
Ф +9) 2) 7
Na +11) 2) 8) 1
— Что вы можете сказать о полноте внешнего уровня атомов фтора и натрия?
— Какой атом легче принять, а какой легче отдать валентные электроны, чтобы завершить внешний уровень?
Есть ли у обоих атомов неполный внешний уровень?
Атому натрия легче отдавать электроны, фтору — принимать электроны до завершения внешнего уровня.
F 0 + 1ē → F -1 (нейтральный атом берет один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион — анион )
Na 0 — 1ē → Na +1 (нейтральный атом отдает один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион — катион )
Как определить степень окисления атома в ПСЧЭ Д.И. Менделеев?
Правила определения степень окисления атома в ПСХЭ Д. И. Менделеев:
И. Менделеев:
1. Водород обычно имеет степень окисления (CO) +1 (исключение, соединения с металлами (гидриды) — для водорода CO равен (-1) Me + n H n -1)
2. Кислород обычно показывает CO -2 (исключения: О +2 F 2, H 2 O 2 -1 — перекись водорода)
3. Металлы показать только + n положительный CO
4. Фтор всегда показывает CO равный -1 (F -1)
5. По позициям основные подгруппы :
Наивысший CO (+) = номер группы N группа
Низшая СО (-) = N группа — 8
Правила определения степени окисления атома в соединении:
И.Степень окисления свободных атомов и атомы в молекулах простые вещества равно ноль — Na 0, P 4 0, O 2 0
II.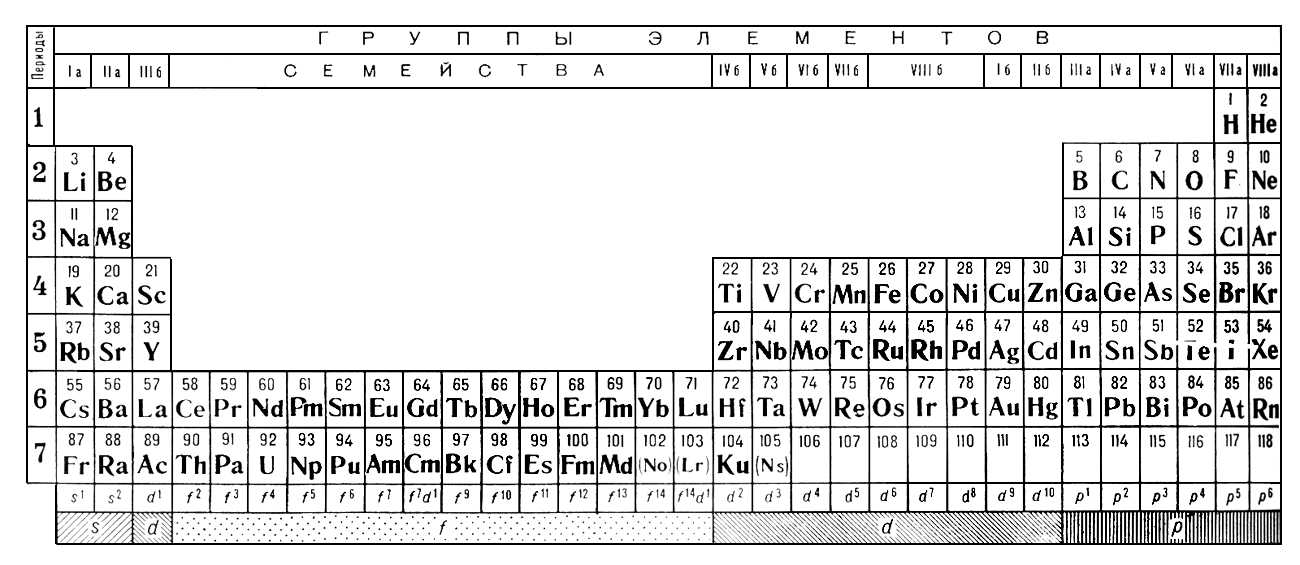 ИН комплексное вещество алгебраическая сумма СО всех атомов с учетом их индексов равна нулю = 0 и в комплексный ион его подопечный.
ИН комплексное вещество алгебраическая сумма СО всех атомов с учетом их индексов равна нулю = 0 и в комплексный ион его подопечный.
Например, H +1 № +5 О 3 -2 : (+1) * 1 + (+ 5) * 1 + (- 2) * 3 = 0
2- : (+6) * 1 + (- 2) * 4 = -2
Упражнение 1 — определить степень окисления всех атомов в формуле серной кислоты H 2 SO 4?
1.Запишем известные степени окисления водорода и кислорода и примем CO серы как «x»
H +1 S x O 4-2
(+1) * 1 + (x) * 1 + (- 2) * 4 = 0
X = 6 или (+6), следовательно, у серы C О +6, т.е. S +6
Назначение 2 — определить степень окисления всех атомов в формуле фосфорной кислоты H 3 PO 4?
1. Запишем известные степени окисления водорода и кислорода и примем CO фосфора как «x»
H 3 +1 P x O 4 -2
2.Составим и решим уравнение по правилу (II):
(+1) * 3 + (x) * 1 + (- 2) * 4 = 0
X = 5 или (+5), следовательно, фосфор C О +5, т. е. P +5
е. P +5
Отнесение 3 — определить степень окисления всех атомов в формуле иона аммония (NH 4) +?
1. Запишем известную степень окисления водорода и возьмем СО азота как «x»
Химический элемент в соединении, рассчитанный в предположении, что все связи ионного типа.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учетом количества их атомов равна 0, а в ионе — заряд иона. .
1. Степени окисления металлов в соединениях всегда положительны.
2. Наивысшая степень окисления соответствует номеру группы периодической системы, в которой находится этот элемент (за исключением: Au +3 (I группа), Cu +2 (II), из группы VIII, степень окисления +8 может быть обнаружена только у осмия Os и рутения Ru .
3. Степени окисления неметаллов зависят от того, с каким атомом они связаны:
- если с атомом металла, то степень окисления отрицательная;
- , если с атомом неметалла, то степень окисления может быть как положительной, так и отрицательной.
 Это зависит от электроотрицательности атомов элементов.
Это зависит от электроотрицательности атомов элементов.
4. Наивысшая отрицательная степень окисления неметаллов может быть определена путем вычитания из 8 номера группы, в которой находится этот элемент, т.е.е. наивысшая положительная степень окисления равна количеству электронов на внешнем слое, что соответствует номеру группы.
5. Степени окисления простых веществ равны 0, независимо от того, металл это или неметалл.
Элементы с неизменной степенью окисления.
Элемент | Типичная степень окисления | Исключения |
Гидриды металлов: LIH -1 | ||
Состояние окисления называется условным зарядом частицы в предположении, что связь полностью разорвана (имеет ионный характер). H — Класс = H + + Класс -, Связь в соляной кислоте ковалентно полярна. Электронная пара более смещена к атому Cl — , т.к. это более электроотрицательный элемент. Как определить степень окисления?Электроотрицательность — это способность атомов притягивать к себе электроны других элементов. Степень окисления указана над элементом: Br 2 0 , Na 0, O +2 F 2-1, К + Класс — и т. Д. Может быть отрицательным или положительным. Степень окисления простого вещества (несвязанное, свободное состояние) равна нулю. Степень окисления кислорода для большинства соединений составляет -2 (за исключением пероксидов H 2 O 2 , где она равна -1, а соединений с фтором — O +2 Факс 2 -1 , г. — степень окисления простого одноатомного иона равна его заряду: Na + , г. Ca +2 . Водород в своих соединениях имеет степень окисления +1 (исключение составляют гидриды — Na + H — и соединения типа C +4 H 4 -1 ). В связях «металл-неметалл» атом с наивысшим нацеливанием на электроэнергию имеет отрицательную степень окисления (данные об электроотрицательности приведены по шкале Полинга): H + Ф. — , г. Cu + Br — , г. Ca +2 ( НЕТ 3 ) — и др. Правила определения степени окисления химических соединений.Возьмем соединение KMnO 4 , г. необходимо определить степень окисления атома марганца. Рассуждение:
К + Mn X O 4 -2 Let X — неизвестная нам степень окисления марганца. Количество атомов калия — 1, марганца — 1, кислорода — 4. Было доказано, что молекула в целом электрически нейтральна, поэтому ее общий заряд должен быть равен нулю. 1 * (+ 1) + 1 * ( X ) + 4 (-2) = 0, Х = +7, Это означает, что степень окисления марганца в перманганате калия = +7. Возьмем другой пример оксида Fe 2 O 3 . Необходимо определить степень окисления атома железа. Рассуждение:
2 * (Х) + 3 * (- 2) = 0, Вывод: степень окисления железа в этом оксиде +3. Примеры. Определите степени окисления всех атомов в молекуле. 1. K 2 Cr 2 O 7 . Степень окисления K +1 , кислород Oh -2 . Учитывая индексы: О = (- 2) × 7 = (- 14), К = (+ 1) × 2 = (+ 2). Поскольку алгебраическая сумма степеней окисления элементов в молекуле с учетом числа их атомов равна 0, то число положительных степеней окисления равно количеству отрицательных.Степени окисления K + O = (- 14) + (+ 2) = (- 12). Из этого следует, что атом хрома имеет 12 положительных степеней, но в молекуле 2 атома, а значит, на один атом приходится (+12): 2 = (+ 6). Ответ: K 2 + Cr 2 +6 O 7 -2. 2. (AsO 4) 3-. В этом случае сумма степеней окисления больше не будет равна нулю, а будет равна заряду иона, то есть — 3. Составим уравнение: x + 4 × ( — 2) = — 3 . Ответ: (As +5 O 4-2) 3-. |
СТЕПЕНЬ ОКИСЛЕНИЯ — это заряд, который мог бы возникнуть от атома в молекуле или ионе, если бы все его связи с другими атомами были разорваны, а общие электронные пары остались с большим количеством электроотрицательных элементов.
В каком из соединений кислород имеет положительную степень окисления: Н2О; h3O2; СО2; OF2?
OF2. этот составной кислород имеет степень окисления + 2
Какое из веществ является только восстановителем: Fe; SO3; Cl2; HNO3?
оксид серы (IV) — SO 2
Какой элемент в III периоде периодической системы Д.И. Менделеев, находясь в свободном состоянии, является сильнейшим окислителем: Na; Al; S; Сl2?
Хлор хлор
V -часть
К каким классам неорганических соединений относятся следующие вещества: HF, PbO2, Hg2SO4, Ni (OH) 2, FeS, Na2CO3?
Сложные вещества. Оксиды
Составьте формулы: а) кислые калиевые соли фосфорной кислоты; б) основная цинковая соль угольной кислоты Н2СО3.
Какие вещества получаются при взаимодействии: а) кислоты с солью; б) кислоты с основанием; в) соль и соль; г) основания с солью? Приведите примеры реакций.
А) оксиды металлов, соли металлов.
Б) соли (только в растворе)
D) образуются новая соль, нерастворимое основание и водород
С какими из следующих веществ будет реагировать соляная кислота: N2O5, Zn (OH) 2, CaO, AgNO3, h4PO4, h3SO4? Составьте уравнения возможных реакций.
Zn (OH) 2 + 2 HCl = ZnCl + h3O
CaO + 2 HCl = CaCl2 + h3O
Укажите, к какому типу оксида принадлежит оксид меди, и подтвердите это с помощью химических реакций.
Оксид металла.
Оксид меди (II) CuO — черные кристаллы, кристаллизуются в моноклинной кристаллической системе, плотность 6,51 г / см3, температура плавления 1447 ° C (под давлением кислорода). При нагревании до 1100 ° C разлагается с образованием оксида меди (I):
4CuO = 2Cu2O + O2.
Не растворяется в воде и не вступает с ней в реакцию. Обладает мягкими амфотерными свойствами с преобладанием основных.
В водных растворах аммиака образует гидроксид тетрааммин меди (II):
CuO + 4Nh4 + h3O = (OH) 2.
Легко реагирует с разбавленными кислотами с образованием соли и воды:
CuO + h3SO4 = CuSO4 + h3O.
При слиянии со щелочами образует купраты:
CuO + 2KOH = K2CuO2 + h3O.
Восстановлено водородом, оксидом углерода и активными металлами до металлической меди:
CuO + h3 = Cu + h3O;
CuO + CO = Cu + CO2;
CuO + Mg = Cu + MgO.
Получают прокаливанием гидроксида меди (II) при 200 ° C:
Cu (OH) 2 = CuO + h3O Получение оксида и гидроксида меди (II)
или при окислении металлической меди на воздухе при 400–500 ° С:
2Cu + O2 = 2CuO.-
NaOH + Н3РО4 = Nah3PO4 + h3O FE = 1
Н3РО4 + 2NaOH = Na2HPO4 + 2h3O FE = 1/2
Н3РО4 + 3NaOH = Na3PO4 + 3H3O в первом случае
u3O3, в первом случае
ue моль фосфорной кислоты um … эквивалент 1 протону … следовательно, коэффициент эквивалентности 1
процентная концентрация — масса вещества в граммах, содержащегося в 100 граммах раствора. если в 100 г раствора содержится 5 г соли, сколько нужно на 500 г?
титр — масса вещества в граммах, содержащегося в 1 мл раствора.0,3 г хватит на 300 мл.
Ca (OH) 2 + h3CO3 = CaO + h3O 2 / характерная реакция — реакция нейтрализации Ca / OH / 2 + h3CO3 = CaCO3 + h3O 3 / реагирует с кислыми оксидами Ca / OH / 2 + CO2 = CaCO3 + h3O 4 / с кислыми солями Ca / OH / 2 + 2KHCO3 = K2CO3 + CaCO3 + 2h3O 5 / щелочь вступают в обменную реакцию с солями. если при этом образуется осадок 2NaOH + CuCl2 = 2NaCl + Cu / OH / 2 / осадок / 6 /, растворы щелочей реагируют с неметаллами, а также с алюминием или цинком.OVR.
Назовите три способа получения соли. Подтвердите ответ уравнениями реакции
A) Реакция нейтрализации .. После выпаривания воды получают кристаллическую соль. Например:
B) Реакция оснований с кислыми оксидами (см. Параграф 8.2). Это тоже вариант реакции нейтрализации:
IN) Реакция кислот с солями … Этот метод подходит, например, если образуется нерастворимая соль, которая выпадает в осадок:
Какие из следующих веществ могут реагировать друг с другом: NaOH, h4PO4, Al (OH) 3, SO3, h3O, CaO? Подтвердите ответ уравнениями реакции
2 NaOH + h4PO4 = Na2HPO4 + 2h3O
CaO + h3O = Ca (OH) 2
Al (OH) 3 + NaOH = Na (Al (OH) 4) или NaAlO2 + h3O
SO3 + h3O = h3SO4
Часть VI
Ядро атома (протоны, нейтроны).
Атом — это мельчайшая частица химического элемента, сохраняющая все свои химические свойства. Атом состоит из ядра с положительным электрическим зарядом и отрицательно заряженных электронов. Заряд ядра любого химического элемента равен произведению Z на e, где Z — порядковый номер этого элемента в периодической таблице химических элементов, e — величина элементарного электрического заряда.
Протоны — стабильные элементарные частицы с единичным положительным электрическим зарядом и массой, в 1836 раз превышающей массу электрона.Протон — это ядро самого легкого элемента, водорода. Число протонов в ядре Z. Neutron — нейтральная (не имеющая электрического заряда) элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра является суммой массы протонов и нейтронов, количество нейтронов в ядре атома равно A — Z, где A — массовое число данного изотопа (см. Периодическую таблицу химических веществ). Элементы). Протон и нейтрон, составляющие ядро, называются нуклонами.В ядре нуклоны связаны особыми ядерными силами.
Электроны
Электрон — мельчайшая частица материи с отрицательным электрическим зарядом e = 1,6 · 10 -19 кулонов, взятых за элементарный электрический заряд. Электроны, вращающиеся вокруг ядра, расположены на электронных оболочках K, L, M и т. Д. K — ближайшая к ядру оболочка. Размер атома определяется размером его электронной оболочки.
Изотопы
Изотоп — это атом того же химического элемента, ядро которого имеет такое же количество протонов (положительно заряженных частиц), но другое количество нейтронов, а сам элемент имеет тот же атомный номер, что и основной элемент.Из-за этого изотопы имеют разные атомные массы.
Когда образуются связи с менее электроотрицательными атомами (для фтора это все элементы, для хлора все, кроме фтора и кислорода), валентность всех галогенов одинакова. Степень окисления -1, заряд иона 1-. Положительные степени окисления для фтора невозможны. Хлор показывает различные положительные степени окисления до +7 (номер группы). Примеры подключений приведены в справочном разделе.
В большинстве соединений хлор, как сильно электроотрицательный элемент (ЭО = 3.0), проявляется в отрицательной степени окисления -1. В соединениях с более электроотрицательными фтором, кислородом и азотом он проявляет положительные степени окисления. Особенно разнообразны соединения хлора с кислородом, у которых степени окисления хлора +1, -f3, +5 и +7, а также +4 и H-6.
По сравнению с хлором фтор F намного активнее. Он реагирует практически со всеми химическими элементами, с щелочными и щелочноземельными металлами, даже в холодную погоду. Некоторые металлы (Mg, Al, Zn, Fe, Cu, Ni) устойчивы к воздействию фтора на холоде из-за образования фторидной пленки.Фтор — самый сильный окислитель из всех известных элементов. Это единственный галоген, который не может проявлять положительную степень окисления. При нагревании фтор реагирует со всеми металлами, включая золото и платину. Он образует ряд соединений с кислородом, и это единственные соединения, в которых кислород является электрически положительным (например, дифторид кислорода OFa). В отличие от оксидов эти соединения называются фторидами кислорода.
Элементы подгруппы кислорода существенно отличаются от кислорода по свойствам.Их главное отличие — способность проявлять положительные степени окисления, до
Наиболее заметные различия между галогенами заключаются в соединениях, в которых они проявляют положительную степень окисления. В основном это соединения галогенов с наиболее электроотрицательными элементами — фтором и кислородом, которых
Атом кислорода имеет электронную конфигурацию [He] 25 2p. Поскольку этот элемент по своей электроотрицательности уступает только фтору, он почти всегда имеет отрицательную степень окисления в соединениях.Единственными соединениями, в которых кислород имеет положительную степень окисления, являются фторсодержащие соединения Ор2 и ОР.
В 1927 году косвенно было получено кислородное соединение фтора, в котором кислород имеет положительную степень окисления два
Поскольку атомы азота в аммиаке притягивают электроны сильнее, чем в элементарном азоте, говорят, что они имеют отрицательную степень окисления. В диоксиде азота, где атомы азота притягивают электроны слабее, чем в элементарном азоте, он имеет положительную степень окисления.В элементарном азоте или элементарном кислороде каждый атом имеет нулевую степень окисления. (Нулевая степень окисления присваивается всем элементам в несвязанном состоянии.) Степень окисления — полезная концепция для понимания окислительно-восстановительных реакций.
Хлор образует целую серию оксианионов CIO, CIO, CIO3 и CIO, в которых он демонстрирует последовательный ряд положительных степеней окисления. Хлорид-ион C1 имеет электронную структуру благородного газа Ar с четырьмя парами валентных электронов.Вышеупомянутые четыре оксианиона хлора можно рассматривать как продукты реакции хлорид-иона SG как основания Льюиса с одним, двумя, тремя или четырьмя атомами кислорода, каждый из которых обладает свойствами акцептора электронов, то есть люизиновой кислоты
Химические свойства серы, селена и теллура сильно отличаются от свойств кислорода. Одно из наиболее важных отличий заключается в наличии положительных степеней окисления этих элементов до -1-6, которые обнаруживаются, например,
Электронная конфигурация ns np позволяет элементам этой группы проявлять степени окисления -I, +11, + IV и + VI.Поскольку только два электрона отсутствуют до образования конфигурации инертного газа, степень окисления -II возникает очень легко. Особенно это актуально для более легких элементов группы.
Действительно, кислород отличается от всех элементов группы тем, с какой легкостью его атом приобретает два электрона, образуя двухзарядный отрицательный ион. За исключением необычных отрицательных степеней окисления кислорода в пероксидах (-1), суперпероксидах (-Va) и озонидах (7h), соединениях, в которых есть кислородно-кислородные связи, а также в состояниях + 1 и — + II в О.Fa и кислород Кислород во всех соединениях имеет степень окисления -I. Для остальных элементов группы отрицательная степень окисления постепенно становится менее стабильной, а положительная — более стабильной. У тяжелых элементов преобладают более низкие положительные степени окисления.
В соответствии с природой элемента в положительной степени окисления природа оксидов в периоды и группы периодической системы изменяется естественным образом. Периодически отрицательный эффективный заряд на атомах кислорода уменьшается и происходит постепенный переход от основных оксидов через амфотерные к кислым, например
Нал, Mg b, AIF3, ZrBf4.При определении степени окисления элементов в соединениях с полярными ковалентными связями сравниваются значения их электроотрицательностей (см. 1.6) Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, последние имеют отрицательная степень окисления в соединениях Фтор, который характеризуется наивысшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления -1.
КислородI, также имеющий высокое значение электроотрицательности, характеризуется отрицательной степенью окисления, обычно -2, в пероксидах -1.Исключение составляет соединение OF2, у которого степень окисления кислорода 4-2. Щелочные и щелочноземельные элементы, которые характеризуются относительно низким значением электроотрицательности, всегда имеют положительную степень окисления, равную +1 и +2 соответственно. Водород имеет постоянную степень окисления (+ 1) в большинстве соединений, например,
Кислород уступает фтору по электроотрицательности. Соединения кислорода с фтором уникальны, так как только в этих соединениях кислород имеет положительную степень окисления.
Производные кислорода с положительной степенью окисления — сильнейшие энергоемкие окислители, способные при определенных условиях высвобождать химическую энергию, хранящуюся в них. Их можно использовать в качестве эффективных окислителей ракетного топлива.
И они относятся к неметаллам, это состояние у них самое обычное. Однако элементы группы 6А, за исключением кислорода, часто находятся в состояниях с положительной степенью окисления до +6, что соответствует разделению всех шести валентных электронов с атомами более электроотрицательных элементов.
Все элементы этой подгруппы, кроме полония, не являются металлами. В своих соединениях они проявляют как отрицательную, так и положительную степень окисления. В соединениях с металлами и водородом степень окисления обычно составляет -2. В соединениях с неметаллами, например кислородом, он может иметь значение +4 или -) — 6. Исключение составляет сам кислород. По величине электроотрицательности он уступает только фтору, поэтому только в сочетании с этим элементом (OPr) его степень окисления положительная (-1-2).В соединениях со всеми другими элементами степень окисления кислорода отрицательная и обычно составляет -2. В перекиси водорода и ее производных он равен -1.
Азот уступает только кислороду и фтору по электроотрицательности. Следовательно, он проявляет положительные степени окисления только в сочетании с этими двумя элементами. В оксидах и оксианионах степень окисления азота принимает значения от +1 до -L 5.
В соединениях с большим количеством электроотрицательных элементов p-элементы VI группы имеют положительную степень окисления.Для них (кроме кислорода) наиболее характерны степени окисления -2, +4, -4-6, что соответствует постепенному увеличению количества неспаренных электронов при возбуждении атома элемента.
Особенно известны комплексные анионы с кислородными лигандами — оксокомплексы. Они образованы атомами преимущественно неметаллических элементов в положительных степенях окисления (металлические только в высоких степенях окисления). Оксокомплексы получают взаимодействием ковалентных оксидов соответствующих элементов с отрицательно поляризованным атомом кислорода основных оксидов или воды, например
Оксиды и гидроксиды.Оксиды и гидроксиды p-элементов можно рассматривать как соединения с наивысшей положительной степенью окисления, p-элементов с кислородом
O, CIO, COO), в котором хлор имеет положительную степень окисления. Азот при высокой температуре соединяется непосредственно с кислородом и, следовательно, проявляет восстановительные свойства
В соединениях с кислородом элементы могут проявлять наивысшую положительную степень окисления, равную номеру группы. Оксиды элементов, в зависимости от их положения в периодической системе и от степени окисления элемента, могут проявлять основные или кислотные свойства.
Кроме того, эти элементы способны проявлять положительную степень окисления до +6, за исключением кислорода (только до +2). Элементы подгруппы кислорода — неметаллы.
Наиболее распространенные окислители включают галогены, кислород и оксианионы, такие как MPO4, CrO и NO, у которых центральный атом имеет высокую положительную степень окисления. В качестве окислителей иногда
Соединения OrPr и OPr являются сильными окислителями, поскольку кислород в них находится в положительной степени окисления — -1 и +2, и поэтому, имея большой запас энергии (высокое сродство к электрону), они будут сильно притягивать электроны за счет склонность кислорода переходить в наиболее стабильные для него состояния.
Ионизированные атомы неметаллов в положительной степени окисления и ионы металлов в высокой степени окисления с кислородом образуют нейтральные молекулы оксидов CO, COr, N0, NO2, ZOr, 5102, SnO2, комплексные кислородсодержащие ионы MnOa NO, PO4 , ZO «, Cr0, MnOr и т. Д. …
Уровень атомов этих элементов соответствует формуле pa pr Кислород является вторым по величине электроотрицательным элементом (после наиболее отрицательного фтора), ему может быть присвоена стабильная степень окисления в соединениях, равная (-I) во фторидах кислорода, его степень окисления положительная.Остальные элементы группы VIA показывают в своих соединениях степени окисления (-I), (+ IV) и (H VI), причем степень окисления (+ VI) стабильна для серы, а для остальных элементов (4 -IV). По электроотрицательности
Когда O2 взаимодействует с сильнейшим окислителем P1Pb, образуется вещество 02 [P1Pb], в котором молекулярный ион Og «» является катионом. Соединения, в которых кислород имеет положительную степень окисления, являются сильнейшими энергоемкими окислителями, способными выделять запасенную химическую энергию при определенных условиях.Их можно использовать в качестве эффективных окислителей ракетного топлива.
Однако способность присоединять электроны у них выражена гораздо слабее, чем у соответствующих элементов VI и VII групп. С кислородом они образуют оксиды типа RjOj, демонстрируя наивысшую положительную степень окисления, равную +5.
Бром и йод показывают положительное состояние окисления в сочетании с кислородом и более электроотрицательными галогенами. Кислородсодержащие кислоты (и их соли) этих элементов, как HOBr (гипобромистые, соли — гипобромиты) и HOI (гипобромные, соли — гипойодиты), HBrOz (бромные, соли — броматы) и HIO3 (йодные, соли — йод) были подвергнуты риску хорошо изучены, как и NbOb (орто-йод, соли — орто-периодаты).
Практика: ОГЭ-9-2018 ОГЭ (ГИА) по химии — экзамен по выбору, и один из самых сложных.Выбирать его, думая, что экзамен простой, не стоит. Выбирать ГИА по химии необходимо, если вы планируете в будущем сдавать ЕГЭ по этому предмету, это поможет проверить свои знания и лучше подготовиться к единичному экзамену за два года. Кроме того, GIA по химии часто требуется для поступления в медицинские колледжи. Структура GIA по химии выглядит следующим образом: Матч-очков GIA (без реального эксперимента) школьных классов следующие:
Рекомендации ФИПИ по оценке работы ОГЭ (ГИА) по химии: 27-34 балла заслуживают только те работы, в которых студент получил не менее 5 баллов за решение задач из части 2, это, в свою очередь, предполагает выполнение на минимум 2 задания.Одно задание оценивается в 4 балла, два других — по три балла. Самые большие трудности, конечно же, задачи. Именно в них можно легко запутаться. Поэтому, если вы планируете набрать те же 27-34 балла на ОГЭ (ГИА) по химии, то вам нужно решать задачи. Например, одно задание в день. Продолжительность GIA по химии составляет всего 120 минут . Во время экзамена студент может использовать:
ОГЭ по химии пользуется заслуженной славой как один из самых сложных экзаменов. К нему нужно начинать готовиться с самого начала учебного года. Инструкция по эксплуатации Экзаменационная работа состоит из двух частей, включающих 22 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 (4) задания с подробным ответом. Экзаменационная работа длится 2 часа (120 минут) (140 минут). Ответы на задания 1-15 записываются в виде одной цифры, что соответствует номеру правильного ответа. Запишите эту цифру в поле для ответа в тексте работы. Ответы на задания 16-19 записываются в виде последовательности чисел в поле ответа в тексте работы. Если вы записали неверный ответ на задания части 1, зачеркните его и запишите рядом новый. На задачи 20–22 должен быть дан полный развернутый ответ, включая необходимые уравнения реакций и расчеты. Задания выполняются на отдельном листе. Задача 23 предполагает проведение эксперимента под наблюдением эксперта. Это задание можно запустить не ранее, чем через 1 час (60 минут) после начала экзамена. При выполнении работ можно пользоваться Периодической таблицей химических элементов Д.И. Менделеева, таблица растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов и непрограммируемый калькулятор. При выполнении заданий можно использовать черновик. Черновики не засчитываются при выставлении оценок. Очки, полученные вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать как можно больше очков.
| Блок 3. Органическая химия ||||||||||||||||||||||||||||||||||||||||||||
Способы получения оксида кремния.Методы синтеза оксидов кремния. Физические свойства кремния. Аллотропные модификации кремния
Вторым представителем элементов основной подгруппы IV группы (IVA группы) Периодической таблицы Менделеева является кремний Si.
В природе кремний является вторым по распространенности химическим элементом после кислорода. Более четверти земной коры состоит из ее соединений. Наиболее распространенным соединением кремния является оксид кремния (IV) SiO 2, другое его название — кремнезем.
В природе он образует минеральный кварц (рис. 158), многие разновидности которого представляют собой горный хрусталь и его знаменитую лиловую форму — аметист, а также агат, опал, яшму, халцедон, сердолик, известные как полудрагоценные и полудрагоценные камни. -драгоценные камни. Оксид кремния (IV) также состоит из обычного и кварцевого песка.
Рисунок: 158.
Кристаллы кварца, внедренные в доломит
Из разновидностей минералов на основе оксида кремния (IV) (кремень, халцедон и др.)() Первобытные люди делали инструменты. Именно кремень, этот невзрачный и не очень прочный камень, положил начало каменному веку — веку кремневых орудий труда (рис. 159). На это есть две причины: преобладание и доступность кремня, а также его способность образовывать острые режущие кромки при сколах.
Рисунок: 159.
Инструменты каменного века
Второй тип природных соединений кремния — силикаты. Среди них наиболее распространены алюмосиликаты (очевидно, что эти силикаты содержат химический элемент алюминий).Алюмосиликаты включают гранит, различные виды глин, слюду. Силикат, не содержащий алюминия, — это, например, асбест, из которого делают огнеупорные ткани.
Оксид кремния (IV) SiO 2 необходим для жизни растений и животных. Придает прочность стеблям растений и защитным покровам животных (рис. 160). Благодаря ему камыши, камыши и хвощи стоят твердо, как штыки, острые листья осоки срезаны, как ножи, стерня на скошенном поле уколы, как иголки, а стебли злаков настолько крепкие, что не дают полям на полях ложиться от дождь и ветер.Рыбья чешуя, панцири насекомых, крылья бабочек, перья птиц и шерсть животных долговечны, так как содержат кремнезем.
Рисунок: 160.
Оксид кремния (IV) придает прочность стеблям растений и защитному покрову животных
Соединения кремния придают гладкость и прочность человеческим волосам и ногтям.
Кремний также входит в состав низших живых организмов — диатомовых водорослей и радиолярий, тончайших глыб живого вещества, которые создают свои непревзойденные по красоте скелеты из кремнезема (рис.161).
Рисунок: 161.
Скелеты диатомовых водорослей (а) и радиолярий (б) состоят из кремнезема.
Свойства кремния … Вы используете микрокалькулятор на солнечной энергии и, следовательно, имеете представление о кристаллическом кремнии. Это полупроводник. В отличие от металлов его электропроводность увеличивается с повышением температуры. На спутниках, космических кораблях, станциях и крышах домов (рис. 162) установлены солнечные панели, преобразующие солнечную энергию в электрическую.В них работают полупроводниковые кристаллы, и в первую очередь кремний. Кремниевые солнечные элементы могут преобразовывать до 10% поглощенной солнечной энергии в электричество.
Рисунок: 162.
Солнечная панель на крыше дома
Кремний горит в кислороде, образуя оксид кремния (IV), который вы уже знаете:
Как неметалл при нагревании, Кремний соединяется с металлами с образованием силицидов, например:
Силициды легко разлагаются водой или кислотами, при этом выделяется газообразное водородное соединение кремния — силан:
В отличие от углеводородов, силан самовоспламеняется на воздухе и горит с образованием кремния. (IV) оксид и вода:
Повышенная реакционная способность силана по сравнению с метаном CH 4 объясняется тем, что атомный размер кремния больше, чем у углерода, поэтому химические связи Si-H менее прочны, чем химические связи Si-H. CH облигации.
Кремний взаимодействует с концентрированными водными растворами щелочей, образуя силикаты и водород:
Кремний получают путем восстановления его из оксида кремния (IV) магнием или углеродом:
Оксид кремния (IV) или диоксид кремния, или кремнезем SiO 2, как и CO 2, представляет собой кислый оксид. Однако, в отличие от СО2, он имеет не молекулярную, а атомную кристаллическую решетку. Следовательно, SiO 2 — твердое и тугоплавкое вещество. Он не растворяется в воде и кислотах, за исключением, как известно, фтористоводородной кислоты, но при высоких температурах взаимодействует со щелочами с образованием солей кремниевой кислоты — силикатов:
Силикаты также могут быть получены путем сплавления оксида кремния (IV) с металлом. оксиды или карбонаты:
Силикаты натрия и калия называются растворимым стеклом.Их водные растворы — это хорошо известный силикатный клей.
Из растворов силикатов при действии на них более сильных кислот — соляной, серной, уксусной и даже угольной кислоты образуется кремниевая кислота H 2 SiO 3 (рис. 163):
Рисунок: 163. Качественная реакция до силикат-иона
Следовательно, H 2 SiO 3 является очень слабой кислотой. Он нерастворим в воде и выпадает из реакционной смеси в виде студенистого осадка, иногда компактно заполняя весь объем раствора, превращая его в полутвердую массу, похожую на желе, желе.При высыхании этой массы образуется высокопористое вещество — силикагель, который широко используется в качестве адсорбента — поглотителя других веществ.
Лабораторный эксперимент № 40
Получение кремниевой кислоты и изучение ее свойств
Применение кремния … Вы уже знаете, что кремний используется для получения полупроводниковых материалов, а также кислотостойких сплавов. Когда кварцевый песок сплавлен с углем при высоких температурах, образуется карбид кремния SiC, который по твердости уступает только алмазу.Поэтому его используют для заточки фрез металлорежущих станков и шлифовки драгоценных камней.
Различные кварцевые химические изделия из стекла изготавливаются из расплавленного кварца, который выдерживает высокие температуры и не трескается при резком охлаждении.
Кремниевые компаунды — основа для производства стекла и цемента.
Обычное оконное стекло имеет состав, который можно выразить формулой Na 2 O CaO 6SiO 2. Его получают в специальных стекловаренных печах путем плавления смеси соды, известняка и песка.
Отличительной особенностью стекла является способность размягчаться и в расплавленном состоянии принимать любую форму, которая сохраняется при застывании стекла. Это основа для производства посуды и других изделий из стекла.
Дополнительные качества стеклу придают различные добавки. Таким образом, при введении оксида свинца получается хрустальное стекло, оксид хрома окрашивает стекло в зеленый цвет, оксид кобальта — в синий и т.д. (рис. 164).
Рисунок: 164.
Изделия из цветного стекла
Стекло — одно из древнейших изобретений человечества.Уже 3-4 тысячи лет назад производство стекла было развито в Египте, Сирии, Финикии и Причерноморье.
Стекло — это материал не только для ремесленников, но и для художников. Мастера Древнего Рима, умевшие получать цветное стекло и делать из него мозаику, достигли высокого совершенства.
Рисунок: 165.
Цветное стекло в витражах собора Нотр-Дам, Шартр
Произведения искусства из стекла — непременный атрибут любого большого музея, а цветные витражи церквей, мозаичные панно являются яркими примерами этого (рис.165). В одном из помещений Петербургского отделения Российской академии наук находится мозаичный портрет Петра I работы М. В. Ломоносова (рис. 166).
Рисунок: 166.
Мозаичный портрет Петра I
Сферы применения стекла очень широки. Это окно, бутылка, лампа, зеркальное стекло; оптическое стекло — от очков до фотоаппаратов; линзы бесчисленных оптических инструментов — от микроскопов до телескопов.
Другим важным материалом, производным от кремниевого компаунда, является цемент.Его получают путем спекания глины и известняка в специальных вращающихся печах.
Если цементный порошок смешать с водой, образуется цементный тест, или, как его называют строители, «цементный раствор», который постепенно затвердевает. Когда в цемент добавляют песок или гравий, в качестве наполнителя получается бетон. Прочность бетона повышается, если в него вводится железный каркас, — получается железобетон, из которого изготавливают стеновые панели, блоки перекрытия, фермы мостов и т. Д.
Силикатная промышленность занимается производством стекла и цемента.Также здесь производят силикатную керамику — кирпич, фарфор (рис. 167), фаянс и изделия из них.
Рисунок: 167.
Фарфор
Открытие кремния … Хотя в древности люди широко использовали соединения кремния в повседневной жизни, сам кремний был впервые получен в 1824 году шведским химиком Дж. Берцелиусом. Однако за 12 лет до него кремний был получен Ж. Гей-Люссаком и Л. Тенаром, но он был очень загрязнен примесями.
Латинское название кремний происходит от латинского слова Silex — «кремень». Русское название «кремний» происходит от греческого kremnos — «обрыв, скала».
Новые слова и понятия
- Природные соединения кремния: кремнезем, кварц и его разновидности, силикаты, алюмосиликаты, асбест.
- Биологическое значение кремния.
- Свойства кремния: полупроводник, взаимодействие с кислородом, металлами, щелочами.
- Силан.
- Оксид кремния (IV).Его структура и свойства: взаимодействие со щелочами, основными оксидами, карбонатами и магнием.
- Кремниевая кислота и ее соли. Растворимое стекло.
- Применение кремния и его соединений.
- Стекло.
- Цемент.
Задания для самостоятельной работы
(кремний), Si — хим. элемент IV группы периодической таблицы элементов; в. п. 14, в. м. 28.086. Кристаллический кремний — это темно-серое вещество со смолистым отливом. В большинстве соединений проявляет степени окисления — 4, +2 и +4.Природный кремний состоит из стабильных изотопов 28Si (92,28%), 29Si (4,67%) и 30Si (3,05%). Получены радиоактивные 27Si, 31Si и 32Si с периодами полураспада соответственно 4,5 секунды, 2,62 часа и 700 лет. К. был впервые идентифицирован в 1811 г. французами. химик и физик Ж.Л. Гей-Люссак и Френч. химик Л.Ж. Тенар, но идентифицированный только в 1823 г. как швед, химик и минералог Я. Я. Берцелиус.
По распространенности в земной коре (27,6%) кремний является вторым (после кислорода) элементом.Он расположен прейм. в виде кремнезема SiO2 и других кислородсодержащих веществ (силикаты, алюмосиликаты и др.). При нормальных условиях образуется стабильная модификация полупроводника, характеризующаяся гранецентрированной кубической структурой типа алмаза, с периодом а = 5,4307 А. Межатомное расстояние 2,35 А. Плотность 2,328 г / см. При высоком давлении (120-150 кбар) он превращается в более плотные полупроводниковые и металлические модификации. Металлическая модификация представляет собой сверхпроводник с температурой перехода 6.7 К. При повышении давления температура плавления снижается с 1415 ± 3 ° C при давлении 1 бар до 810 ° C при давлении 15 104 бар (тройная точка сосуществования полупроводника, металла и жидкости К.) . При плавлении координационное число увеличивается и межатомные связи металлизируются. По природе ближнего порядка, который соответствует сильно искаженной объемно-центрированной кубической структуре, аморфный кремний близок к жидкому кремнию. Дебаевская т-ра близка к 645 К.Кофф. температура линейного расширения изменяется с изменением t-р по экстремальному закону, ниже t-р 100 К становится отрицательной, достигая минимума (-0,77 · 10 -6) град -1 при t-р 80 К; при t-re 310 К она равна 2,33 · 10 -6 град -1, а при t-re 1273 K -4,8 · 10 град -1. Теплота плавления 11,9 ккал / г-атом; температура кипения 3520 К.
Теплоты сублимации и испарения при температуре плавления составляют 110 и 98,1 ккал / г-атом соответственно. Теплопроводность и электропроводность кремния зависят от чистоты и совершенства кристаллов.С ростом т-рый коэфф. теплопроводность чистого К. сначала увеличивается (до 8,4 кал / см xx град при t-re 35 K), а затем уменьшается, достигая 0,36 и 0,06 кал / см с * град при t-re, соответственно, 300 и 1200 K Энтальпия, энтропия и теплоемкость К. при стандартных условиях составляют 770 кал / г-атом, 4,51 и 4,83 кал / г-атом-град соответственно. Кремний диамагнитен, магнитная восприимчивость твердого тела (-1,1 · 10 -7 ЭМЕ / г) и жидкости (-0,8 · 10 -7 ЭМЕ / г). Кремний слабо зависит от т-рого.Поверхностная энергия, плотность и кинематическая вязкость жидкости К. при температуре плавления составляют 737 эрг / см2, 2,55 г / см3 и 3 · 10 м2 / сек. Кристаллический кремний — типичный полупроводник с шириной запрещенной зоны 1,15 эВ при t-pe 0 К и 1,08 эВ — при t-re 300 К. При комнатной температуре концентрация собственных носителей заряда близка к 1,4 10 10 см — 3, эффективная подвижность электронов и дырок составляет соответственно 1450 и 480 см 2 / в · сек, а удельное электрическое сопротивление составляет 2,5 · 105 Ом · см.С увеличением t-ры они изменяются по экспоненте.
Электрические свойства кремния зависят от природы и концентрации примесей, а также от совершенства кристалла. Обычно для получения полупроводникового кремния с p- и n-типом проводимости его легируют элементами IIIb (бор, алюминий, галлий) и Vb (фосфор, мышьяк, сурьма, висмут) подгруппами, которые создают набор акцепторных и донорных уровней. , соответственно, расположенных вблизи границ полос … Для легирования также используются другие элементы (например,), образующие так называемые и.глубокие уровни, к-рые вызывают захват и рекомбинацию носителей заряда. Это позволяет получать материалы с высокой электр. сопротивление (1010 Ом · см при t-re 80 К) и небольшая продолжительность существования неосновных носителей заряда, что важно для увеличения быстродействия различных устройств. Кофф. термоЭДС кремния существенно зависит от t-ого и содержания примесей, увеличиваясь с увеличением электрического сопротивления (при p = 0,6 Ом — см, a = 103 мкВ / град). Диэлектрическая проницаемость кремния (от 11 до 15) слабо зависит от состава и совершенства монокристаллов.Закономерности оптического поглощения кремния сильно меняются при изменении его чистоты, концентрации и характера структурных дефектов, а также длины волны.
Граница непрямого поглощения электромагнитных колебаний близка к 1,09 эВ, а прямого поглощения — к 3,3 эВ. В видимой области спектра параметры комплексного показателя преломления (n — ik) очень существенно зависят от состояния поверхности и наличия примесей. Для особо чистого К.(при λ = 5461 А и t-ре 293 К) n = 4,056 и k = 0,028. Работа выхода электронов близка к 4,8 эВ. Кремний хрупкий. Его твердость (т-ра 300 К) по Моосу — 7; НВ = 240; HV u = 103; I = 1250 кгс / мм2; модуль норм, упругость (поликристалл) 10 890 кгс / мм2. Предел прочности зависит от совершенства кристалла: на изгиб от 7 до 14, на сжатие от 49 до 56 кгс / мм2; коэфф. сжимаемость 0,325 1066 см2 / кг.
При комнатной температуре кремний практически не взаимодействует с газообразными (за исключением) и твердыми реагентами, за исключением щелочей.При повышенной температуре активно взаимодействует с металлами и неметаллами. В частности, он образует карбид SiC (при температуре выше 1600 К), нитрид Si3N4 (при температуре выше 1300 К), фосфид SiP (при температуре выше 1200 К) и арсениды Si As, SiAS2 (при температуре выше 1000 К). Реагирует с кислородом при температуре выше 700 К с образованием диоксида SiO2, с галогенами — фторидом SiF4 (при температуре выше 300 К), хлоридом SiCl4 (при температуре выше 500 К), бромидом SiBr4 (при температуре 700 К) и нодидом SiI4 (при температуре 1000 К).Интенсивно реагирует со многими другими. металлы, образующие в них твердые растворы замещения или хим. соединения — силициды. Концентрационные области однородности твердых растворов зависят от природы растворителя (например, в германии от 0 до 100%, в железе до 15%, в альфа-цирконии менее 0,1%).
В твердом кремне значительно меньше металлов и неметаллов, и он обычно ретроградный. В этом случае предельное содержание примесей, создающих мелкие уровни К.достигают максимума (2 × 10 18, 10 19, 2 × 10 19, 1021, 2 × 10 21 см) в диапазоне от 1400 до 1600 К. Глубинные уровни отличаются заметно меньшей растворимостью (от 1015 для селена и 5 · От 10 16 для железа до 7 · 10 17 для никеля и 10 18 см-3 для меди). В жидком состоянии кремний бесконечно смешивается со всеми металлами, часто с очень большим тепловыделением. Чистый кремний получают из технического продукта, содержащего 99% Si и 0,03% Fe, Al и Co), полученного восстановлением кварца углеродом в электрических печах.Сначала его промывают то-тами (смесью соляной и серной, а затем плавиковой и серной) примесями, после чего полученный продукт (99,98%) обрабатывают хлором. Синтезированные очищают перегонкой.
Полупроводниковый кремний получают восстановлением хлорида SiCl4 (или SiHCl3) водородом или термическим разложением гидрида Sih5. Окончательную очистку и выращивание монокристаллов проводят методом бестигельной гладкой зоны или методом Чохральского с получением сверхчистых слитков (содержание примесей до 1010-1013 см-3) av> 10 3 Ом см.В зависимости от назначения К. в процессе получения хлоридов или при выращивании монокристаллов в них вводят дозированные количества необходимых примесей. Так получают цилиндрические слитки диаметром 2-4 и длиной 3-10 см. также производятся более крупные монокристаллы. Технический кремний и особенно его вместе с железом используют в качестве раскислителей и восстановителей стали, а также в качестве легирующих добавок. Особо чистые образцы монокристаллического кислорода, легированные различными элементами, используются в качестве основы для различных слаботочных (в частности, термоэлектрических, радио-, свето- и фототехнических) и сильноточных (выпрямители, преобразователи) устройств.
Кремний или кремнийКремний относится к неметаллам, его атомы на внешнем энергетическом уровне имеют 4 электрона. Он может отдавать их, показывая степень окисления +4, и присоединять электроны, показывая степень окисления -4. Однако способность присоединять электроны в кремнии значительно меньше, чем у углерода. Атомы кремния имеют больший радиус, чем атомы углерода.
Как найти кремний в природеКремний очень распространен в природе.на его долю приходится более 26% массы земной коры. По распространенности занимает второе место (после кислорода). В отличие от углерода, C в природе не находится в свободном состоянии. Он входит в состав различных химических соединений, в основном различных модификаций оксида кремния (IV) и солей кремниевой кислоты (силикатов).
Кремний приемныйВ промышленности кремний технической чистоты (95-98%) получают восстановлением SiO2. с коксом в электропечах при прокаливании:
SiO 2 + 2C = Si + 2CO
SiO 2 + 2Mg = Si + 2MgO
Таким образом получают кремниевый порошок коричневого цвета, аморфный с примесями.Путем перекристаллизации из расплавленных металлов (Zn, Al) он может быть переведен в кристаллическое состояние.
Для полупроводниковой технологии кремний очень высокой чистоты получают восстановлением при 1000 ° C тетрахлорида кремния SiCl4 пар цинка:
SiCl 4 + 2Zn = Si + 2ZnCl 2
и очистить его специальными методами.
Физико-химические свойства кремнияЧистый кристаллический кремний хрупкий и твердый, царапается. Как и алмаз, он имеет кубическую кристаллическую решетку с ковалентной связью.Его температура плавления составляет 1423 ° С. В обычных условиях кремний является неактивным элементом, он соединяется только с фтором, но при нагревании вступает в различные химические реакции.
Используется как ценный материал в полупроводниковой технике. По сравнению с другими полупроводниками, он обладает высокой кислотостойкостью и сохраняет высокое электрическое сопротивление до 300 ° C.Технический кремний и ферросилиций также используются в металлургии для производства жаропрочных, кислотостойких и инструментальных сталей, чугунов и многих других материалов. другие сплавы.
С металлами кремний образует химические соединения, называемые силицидами, при нагревании с магнием образуется силицид магния:
Si + 2Mg = Mg 2 Si
Силициды металлов по структуре и свойствам напоминают карбиды, поэтому металлоподобные силициды, а также металлоподобные карбиды отличаются высокой твердостью, высокой температурой плавления и хорошей электропроводностью.
При прокаливании смеси песка и кокса в электрических печах образуются кремний-углеродные соединения — карбид кремния или карборунд:
SiO 2 + 3C = SiC + 2CO
Карборунд — тугоплавкое бесцветное твердое вещество, ценное как абразивный и жаростойкий материал.Карборунд, как и он, имеет атомную кристаллическую решетку. В чистом виде это изолятор, но в присутствии примесей он становится полупроводником.
Кремний как , образует два оксида: оксид кремния (II) SiO и оксид кремния (IV) SiO2 … Оксид кремния (IV) — твердое тугоплавкое вещество, широко распространенное в природе в свободном состоянии. Это химически стабильное вещество, которое взаимодействует только с фтором и газообразным фтористым водородом или плавиковой кислотой:
SiO 2 + 2F 2 = SiF 4 + O 2
SiO 2 + 4HF = SiF 4 + 2H 2 O
Данное направление реакций объясняется тем, что кремний имеет высокое сродство к фтору.Кроме того, тетрафторид кремния является летучим веществом.
В технологии прозрачный SiO2 Используемое для изготовления стабильного тугоплавкого кварцевого стекла, хорошо пропускающего ультрафиолетовые лучи, имеет большой коэффициент расширения, а значит, выдерживает значительные мгновенные перепады температур. Аморфная модификация трипола оксида кремния (II) — обладает высокой пористостью. Он используется как тепло- и звукоизолятор, для производства динамита (носителя взрывчатых веществ) и так далее. Оксид кремния (IV) в виде обычного песка — один из основных строительных материалов… Используется при производстве огнестойких и кислотостойких материалов, стекла, в качестве флюса в металлургии и т. Д.
Если сопоставить молекулярные формулы, химические и физические свойства оксида углерода (IV) и оксида кремния (IV), легко заметить, что свойства этих соединений, сходных по химическому составу, различны. Это связано с тем, что оксид кремния (IV) состоит не просто из молекул SiO2. , и от их ассоциатов, в которых атомы кремния связаны друг с другом атомами кислорода.Оксид кремния (IV) (SiO2 ) п. Его изображение на самолете:
.¦ ¦ ¦
O O O
¦ ¦ ¦
¦ ¦ ¦
O O O
¦ ¦ ¦
— O — Si — O — Si — O — Si — O —
¦ ¦ ¦
O O O
¦ ¦ ¦
Атомы кремния расположены в центре тетраэдра, а атомы кислорода — в его углах. Связи Si — O очень прочные, что объясняет высокую твердость оксида кремния (IV).
CPU? Песок? Какие ассоциации у вас возникают с этим словом? Может, Кремниевая долина?
Как бы то ни было, кремний нам попадается каждый день, и если вам интересно узнать, что такое Si и с чем его едят, пожалуйста, под катом.
Введение
Будучи студентом одного из московских вузов, специализирующегося на наноматериалах, я хотел познакомить вас, уважаемый читатель, с важнейшими химическими элементами нашей планеты. Я долго выбирал, с чего начать, углерод или кремний, и все же решил остановиться на Si, потому что на нем, так сказать, конечно, лежит сердце любого современного гаджета.Постараюсь излагать свои мысли максимально просто и доступно, написав этот материал, рассчитывал в основном на новичков, но и более продвинутые люди смогут узнать что-то интересное, также хочу сказать, что статья написана исключительно расширить кругозор желающих. Итак, приступим.
Кремний
Кремний (лат. Silicium), Si, химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28.086.
В природе элемент представлен тремя стабильными изотопами: 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%).
Плотность (стандартная) 2,33 г / см?
Температура плавления 1688 K
Порошкообразный Si
Историческая справка
Соединения кремния, широко распространенные на Земле, известны человеку с каменного века. Использование каменных орудий труда и охоты длилось несколько тысячелетий. Использование соединений кремния, связанное с их обработкой — производством стекла — началось около 3000 г. до н.э.е. (в Древнем Египте). Самое раннее известное соединение кремния — это оксид SiO2 (кремнезем). В 18 веке кремнезем считался простым телом и назывался «землями» (что отражено в его названии). Сложность состава кремнезема установлена И.Я. Берцелиус. Впервые в 1825 году он получил элементарный кремний из фторида кремния SiF4, восстановив последний металлическим калием. Новый элемент получил название «кремний» (от латинского silx — кремень). Русское название ввел Г.И. Гесс в 1834 г.
Кремний очень часто встречается в природе в составе обычного песка
Распределение кремния в природе
Кремний — второй (после кислорода) элемент по распространенности в земной коре; его среднее содержание в литосфере 29,5% (по массе). В земной коре кремний играет такую же основную роль, как углерод в мире животных и растений. Для геохимии кремния важна его чрезвычайно прочная связь с кислородом.Около 12% литосферы составляет кремнезем SiO2 в виде минерального кварца и его разновидностей. Литосфера на 75% состоит из различных силикатов и алюмосиликатов (полевых шпатов, слюд, амфиболов и др.). Общее количество минералов, содержащих кремнезем, превышает 400.
Физические свойства кремния
Думаю, здесь не стоит останавливаться, все физические свойства находятся в свободном доступе, но я перечислю самые основные.
Температура кипения 2600 ° С
Кремний прозрачен для длинноволновых ИК-лучей
Диэлектрическая проницаемость 11.7
Твердость по Моосу Кремний 7.0
Я хотел бы сказать, что кремний — хрупкий материал; заметная пластическая деформация начинается при температурах выше 800 ° C.
Кремний — полупроводник, поэтому он находит широкое применение. Электрические свойства кремния сильно зависят от примесей.
Химические свойства кремния
Конечно, есть что сказать, но остановлюсь на самом интересном. В соединениях Si (подобных углероду) это 4-валентность.
Благодаря образованию защитной оксидной пленки кремний устойчив на воздухе даже при повышенных температурах.В кислороде он окисляется, начиная с 400 ° C, с образованием оксида кремния (IV) SiO2.
Кремний устойчив к кислотам и растворяется только в смеси азотной и плавиковой кислот, легко растворяется в горячих растворах щелочей с выделением водорода.
Кремний образует 2 группы кислородсодержащих силанов — силоксаны и силоксены. Кремний реагирует с азотом при температуре выше 1000 ° С. Большое практическое значение имеет нитрид Si3N4, который не окисляется на воздухе даже при 1200 ° С, устойчив к кислотам (кроме азотной) и щелочам, а также к расплавленным металлам и шлакам, которые являются ценным материалом для химической промышленности, а также а также для производства огнеупоров.Соединения кремния с углеродом (карбид кремния SiC) и с бором (SiB3, SiB6, SiB12) отличаются высокой твердостью, а также термической и химической стойкостью.
Получение кремния
Думаю, это самая интересная часть, здесь мы остановимся более подробно.
В зависимости от назначения различают:
1. Кремний электронного класса (так называемый «электронный кремний») — кремний высочайшего качества с содержанием кремния более 99.999% по массе, удельное электрическое сопротивление кремния электронного качества может находиться в диапазоне от примерно 0,001 до 150 Ом · см, но значение сопротивления должно обеспечиваться исключительно данной примесью, т. Е. Попаданием других примесей в кристалл, даже если они обеспечивают заданное удельное электрическое сопротивление, что, как правило, недопустимо.
2. Кремний солнечного качества (так называемый «солнечный кремний») — кремний с содержанием кремния более 99,99% по весу, используемый для производства фотоэлектрических преобразователей (солнечных элементов).
3. Кремний технический — блоки кремния поликристаллической структуры, полученные методом карботермического восстановления из чистого кварцевого песка; содержит 98% кремния, основная примесь — углерод, отличается высоким содержанием легирующих элементов — бора, фосфора, алюминия; в основном используется для получения поликристаллического кремния.
Кремний технической чистоты (95-98%) получают в электрической дуге восстановлением кремнезема SiO2 между графитовыми электродами.В связи с развитием полупроводниковой технологии были разработаны методы получения чистого и особо чистого кремния. Для этого требуется предварительный синтез чистейших исходных соединений кремния, из которых кремний восстанавливается путем восстановления или термического разложения.
Поликристаллический кремний («поликремний») — это чистейшая форма промышленного кремния — полуфабрикат, получаемый путем очистки технического кремния хлоридным и фторидным методами и используемый для производства моно- и поликристаллического кремния.
Традиционно поликристаллический кремний получают из технического кремния путем преобразования его в летучие силаны (моносилан, хлорсиланы, фторсиланы) с последующим отделением образующихся силанов, ректификационной очисткой выбранного силана и восстановлением силана до металлического кремния.
Чистый полупроводниковый кремний получают в двух формах: поликристаллический (восстановление SiCl4 или SiHCl3 цинком или водородом, термическое разложение SiI4 и Sih5) и монокристаллический (бестигельная зона плавления и «вытягивание» монокристалла из расплава. кремний — метод Чохральского).
Здесь вы можете увидеть процесс выращивания кремния по методу Чохральского.
Метод Чохральского — метод выращивания кристаллов путем вытягивания их вверх от свободной поверхности большого объема расплава с инициированием начала кристаллизации путем внесения затравочного кристалла (или нескольких кристаллов) заданной структуры и кристаллографической формы. ориентация в контакте со свободной поверхностью расплава.
Кремниевое приложение
Специально легированный кремний широко используется в качестве материала для изготовления полупроводниковых приборов (транзисторы, термисторы, силовые выпрямители, тиристоры; солнечные элементы, применяемые в космических аппаратах, а также многое другое).
Поскольку кремний прозрачен для лучей с длиной волны от 1 до 9 микрон, он используется в инфракрасной оптике.
Кремний имеет разнообразные и постоянно расширяющиеся области применения. В металлургии Si
используется для удаления кислорода, растворенного в расплавленных металлах (раскисление).
Кремний входит в состав большого количества сплавов железа и цветных металлов.
Обычно кремний придает сплавам повышенную стойкость к коррозии, улучшает их литейные свойства и увеличивает механическую прочность; однако на более высоких уровнях кремний может вызвать хрупкость.
Наиболее важными из них являются сплавы железа, меди и алюминия, содержащие кремний.
Кремнезем перерабатывается в стекольной, цементной, керамической, электротехнической и других отраслях промышленности.
Сверхчистый кремний в основном используется для производства одиночных электронных устройств (например, процессора вашего компьютера) и однокристальных микросхем.
Чистый кремний, отработанный сверхчистый кремний, рафинированный металлургический кремний в форме кристаллического кремния являются основным сырьем для солнечной энергии.
Монокристаллический кремний — помимо электроники и солнечной энергии используется для изготовления зеркал для газовых лазеров.
Сверхчистый силикон и изделия из него
Кремний в корпусе
Кремний в организме находится в форме различных соединений, в основном участвующих в формировании твердых частей и тканей скелета. Некоторые морские растения (например, диатомовые водоросли) и животные (например, кремнистые губки, радиолярии) могут накапливать много кремния, который при отмирании образует толстые отложения оксида кремния (IV) на дне океана. В холодных морях и озерах преобладают биогенные илы, обогащенные кремнием, в тропических морях — известковые илы с низким содержанием кремния.Среди наземных растений много кремния накапливают злаки, осока, пальма и хвощ. У позвоночных содержание оксида кремния (IV) в веществах золы составляет 0,1-0,5%. Наибольшее количество кремния содержится в плотной соединительной ткани, почках и поджелудочной железе. В ежедневном рационе человека содержится до 1 г кремния. При высоком содержании в воздухе пыли оксида кремния (IV) она попадает в легкие человека и вызывает заболевание — силикоз.
Заключение
Ну вот и все, если вы дочитали до конца и немного углубились, то вы на шаг ближе к успеху.Надеюсь, я не зря написал и хоть кому-то пост понравился. Спасибо за внимание.
ТЕМА: Оксид кремния ( VI ). Кремниевая кислота.
ЗАДАЧА : Студенты должны изучить свойства оксида кремния (VI) и
кремниевая кислота по аналогии с углеродом и его соединениями,
убедиться, что их свойства являются следствием структуры вещества;
ОБОР-ИЭ: Na2SiO3, HCl, сборник «Минералы и горные породы», ПСХЭ.
ВО ВРЕМЯ КЛАССОВ.
I . O организационный момент.
II .Проверка домашних заданий.
Ребята! На прошлом уроке мы изучили кремний, дали ему характеристику как химический элемент и простое вещество. Помните, где в природе встречается кремний? Кремний — один из самых распространенных элементов земной коры; занимает второе место после кислорода (26-27%).Кремний — главный элемент в царстве горных пород. Кремнезем SiO2 — основная часть песка, Al2O3 2SiO2 2h3O — каолинит, основная часть глины,
K2O Al2O3 6SiO2 — полевой шпат (ортоклаз). У большинства организмов содержание кремния невелико. Однако некоторые водоросли накапливают большое количество кремния — это диатомовые водоросли, у животных много кремния содержат кремниевые губки.
Ребята! Каковы физические свойства кремния?
Кремний известный аморфный и кристаллический.Кристаллический кремний имеет металлический блеск, тугоплавкий, очень твердый, с атомарной кристаллической решеткой и имеет низкую электропроводность. (при комнатной температуре 1000 раз
Назовите области применения кремния. (Большая часть Si идет на производство кремнистых сталей с высокой термостойкостью и кислотостойкостью. Кристаллы кремния являются полупроводниками, поэтому они используются в качестве выпрямителей и усилителей тока в фотоэлементах.)
Теперь воспроизведите на листах химические свойства кремния и его получение в лаборатории и на производстве.
III … Освоение нового материала.
1. Структура кристаллической решетки SiO2.
2. Быть на природе.
3. Физические свойства.
4. Химические свойства.
5. Заявление.
6. Кремниевая кислота.
1). Структура кристаллической решетки SiO 2 .
SiO2 — аналог углерода. Высшие оксиды — это их СО2 и SiO2.CO2 — газ, tm — 56,60C, молекулярная кристаллическая решетка, он состоит из отдельных молекул, которые не связаны друг с другом, а SiO2 — твердое тело, имеет высокую температуру плавления = 17280C, атомарную кристаллическую решетку, в которой каждая Атом кремния связан с четырьмя атомами кислорода.
Следовательно, оксид кремния имеет одну гигантскую молекулу (SiO2) n, но для простоты записи пишут SiO2.
2) Быть на природе.
Стабильное соединение кремния — это оксид кремния (VI), называемый диоксидом кремния.Он находится в кристаллическом, скрытокристаллическом и аморфном состоянии. Больше SiO2 в кристаллическом состоянии.
SiO2 — кремнезем
кристаллический скрытокристаллический аморфный
(минерал — кварц) (опал, яшма, агат, кремень) (триполи)
Кристалл — встречается в природе как минерал кварц. Кварц также входит в состав горных пород — гранита и гнейса. Обычный песок состоит из мелких песчинок кварца. Чистый песок имеет белый цвет, его называют кварцевым песком, а обычный речной песок содержит примеси железа и поэтому имеет желтый цвет.Прозрачные отдельные кристаллы кварца представляют собой горный хрусталь. Окрашенный в фиолетовый с примесями горный хрусталь называют аметистом, а коричневатый — дымчатым топазом. Это украшения. Расплавленный кварц при охлаждении превращается в прозрачное стекло. Кварцевое стекло не пропускает ультрафиолетовые лучи.
Криптокристаллический соединения кремнезема — это опал, яшма, агат и кремень. Красиво окрашены опал и агат. Им украсили московское метро. Кремень — твердый минерал, он разбивается при ударе на куски с острыми краями, и это сыграло большую роль в историческом развитии человеческого общества.Этот минерал использовался для изготовления инструментов.
Аморфный SiO2 менее распространен в природе. Раковины некоторых диатомовых водорослей построены из аморфного SiO2, и скопления этих раковин местами образуют большие отложения, их называют мерцательной землей или триполи (диатомит).
3) Физические свойства.
SiO2 — твердое кристаллическое вещество.
4) Химические свойства.
Общий:
а) реагирует со щелочами при температуре.
SiO2 + 2NaOH = Na2SiO3 + h3O
б) реагирует при температуре с основными оксидами
SiO2 + CaO = CaSiO3
Специфическая.
а) не взаимодействует с водой.
б) при повышении температуры вытесняет из солей более летучие оксиды.
CaCO3 + SiO2 = CaSiO3 + CO2
в) реагирует с плавиковой кислотой
SiO2 + 4HF = SiF4 + 2h3O
тетрафторид
5) Заявление.
1. Кварц — получение стекла, химической посуды.
2. Трепель — в строительстве, как тепло- и звукоизоляционный материал.
3. Украшения.
4. Производство силикатного кирпича.
5. Керамические изделия.
6) Кремниевая кислота.
h3SiO3 по таблице растворимости — одна нерастворимая кислота.
Может быть получен взаимодействием растворов его солей с кислотами.
Na2SiO3 + 2HCl = 2NaCl + h3SiO3 ↓
студент.осадок
2Na + + SiO32- + 2H + + 2Cl- = 2Na + + 2Cl- + h3SiO3 ↓
2H + + SiO32- = h3SiO3 ↓
Кремниевая кислота образует коллоидные растворы с водой. Это более слабая кислота, даже слабее угольной кислоты, хрупкая и постепенно разлагается при нагревании.
h3SiO3 = h3O + SiO2
Vi. Анкеровка. Просмотр первой части фильма «Оксид кремния (VI)
V. Домашнее задание — синопсис, §35.36.
Задание 1 ряд.
Сколько окиси углерода (VI) будет выделено (в литрах) при сплавлении карбоната натрия с 62 г диоксида кремния, содержащего 3% примесей соединений железа.
Дано: 1 моль x
м (SiO2) = 62г. Na2CO3 + SiO2 = Na2SiO3 + CO2
Ѡ (приблизительно) — 3% 1 моль 2 моль
В (CO2) -? M (SiO2) = 28 + 32 = 60 г / моль
мч. дюйм = Ѡ мцв / 100% = 97 62/100% = 60.14
υ (SiO2) = м / М = 60,14 / 60 = 1 моль
υ (СО2) = 1 моль
В (СО2) = Вм · υ = 22,4 · 1 = 22,4 литра.
Задание II ряд.
Сколько оксида Si (IV), содержащего 0,2 массовых доли примесей, необходимо для получения 6,1 г силиката натрия?
Дано: x 0,05
м (Na2SiO3) = 6,1г. SiO2 + 2NaOH = Na2SiO3 + h3O
Ѡ (приблизительно) = 20% 1 моль 1 моль
м (SiO2) -? M (SiO2) = 60 г / моль
M (Na2SiO3) = 122 г / моль
υ (Na2SiO3) = m / M = 6.1/122 = 0,05 моль
υ (SiO2) = 0,05 моль
м = М υ = 60 0,05 = 3 г.
100% — 20% = 80%
мтс. дюйм. = .mh. дюйм. / Ѡ 100% = 30/80 100 = 3,75 г.
Задача III ряд.
Когда 120 г SiO2 взаимодействуют с 106 г Na2CO3, выделяется CO2. Сколько этого газа образовалось?
Дано: 1 моль x
м (SiO2) = 120 г Na2CO3 + SiO2 = Na2SiO3 + CO2
m (Na2CO3) = 106 г 1 моль 1 моль 1 моль
В (CO2) -? M (Na2CO3) = 106 г / моль
M (SiO2) = 60 г / моль
М (СО2) = 44 г / моль
υ (Na2CO3) = м / М = 106/106 = 1 моль (короткий)
υ (SiO2) = 120/60 = 2 моль (г)
В (СО2) = 1 моль
м (СО2) = М υ = 44 1 = 44г.
Кремний и его соединения. Силикатная промышленность
Кремний — элемент IV A групп , как углерод. Следовательно, на внешнем энергетическом уровне у него четыре электрона. Эти четыре электрона он может отдать и проявить восстановительных свойств , при этом его степень окисления будет +4. , и может присоединять четыре электрона и проявлять окислительные свойства , в то время как его степень окисления будет -4 .
В природе кремний является вторым по распространенности химическим элементом после кислорода. В природе он встречается только в виде соединений … Наиболее распространенными соединениями кремния являются оксид кремния (IV) — SiO 2 — кремнезем … В природе он образует минерал кварц … Его разновидность — горная порода кристалл, аметист, агат, топаз, опал, яшма, халцедон, сердолик, которые используются как полудрагоценные и полудрагоценные камни.
Силикаты природные — комплексные вещества … Их состав изображен в виде нескольких оксидов. Силикаты, в состав которых входит алюминий, называются алюмосиликатами , … это каолинит, полевой шпат, слюда .
Асбест также является силикатом и используется для изготовления огнеупорных тканей.
Первобытные люди изготавливали орудия труда из различных минералов на основе оксида кремния (IV). Кремний положил начало каменному веку , то есть веку кремневых орудий, благодаря его доступности и способности образовывать острые режущие кромки.
Оксид кремния (IV) придает прочность стеблям растений и защитному покрову животных.
Благодаря этому оксиду тростник, тростник, хвощ полевой и срезаются листья осоки, стебли злаков не опадают от дождя и ветра, а чешуя рыбы, панцири насекомых, крылья бабочек, перья птиц и шерсть животных — крепкие.
Кремний содержится в диатомовых водорослях и радиоляриях.
В промышленности кремний получают восстановлением оксида кремния (IV) коксом в электропечах.
Получают в лаборатории восстановлением оксида кремния (IV) алюминием или магнием.
Кремний существует в виде двух аллотропных модификаций : аморфной и кристаллической.
Аморфный кремний — коричневый порошок.
Кремний кристаллический — твердый, темно-серого цвета с металлическим блеском. Он хрупкий и тугоплавкий. Это связано со структурой его кристаллов.Структура кремния аналогична структуре алмаза, то есть в этом кристалле каждый атом окружен четырьмя другими атомами и связан с ними ковалентными связями .
Кремний — полупроводник … С повышением температуры его электропроводность увеличивается. Например, солнечные панели устанавливают на спутники, космические корабли, станции и крыши домов. Эти батареи преобразуют солнечную энергию в электрическую с помощью полупроводниковых кристаллов, таких как кремний.
Кремний инертен при комнатной температуре , , но при нагревании он вступает в реакцию с металлами и неметаллами.
Кремний горит в кислороде с образованием оксида кремния (IV).
В этой реакции кремний увеличивает степень окисления с 0 до +4, а кислород уменьшается с 0 до -2. Таким образом, кремний действует как восстановитель, а кислород как окислитель.
Восстановительные свойства кремния используются в металлургии для получения некоторых металлов из их оксидов.
Кремний реагирует с металлами при нагревании , в этом случае образуются соединения, которые называются силицидами … Например, при реакции магния с кремнием образуется силицид магния. В этой реакции магний увеличивает степень окисления с 0 до +2, а кремний уменьшается с 0 до -4. Следовательно, магний является восстановителем, а кремний — окислителем.
Силициды легко разлагаются водой или кислотами , при этом в газе образуется силан — водородное соединение кремния.Итак, когда силицид магния взаимодействует с соляной кислотой, образуются хлорид магния и газообразный силан.
Силан самовоспламеняется на воздухе и горит с образованием оксида кремния (IV) и воды.
Кремний взаимодействует с концентрированными растворами щелочей … Например, когда кремний взаимодействует с концентрированным раствором гидроксида натрия, образуются силикат натрия и водород.
Кремний можно получить нагреванием оксида кремния (IV) с магнием или углеродом.
В реакции с магнием магний восстанавливает кремний из оксида кремния (IV), а в реакции оксида кремния (IV) с углеродом углерод восстанавливает кремний из его оксида.
Оксид кремния (IV), кремнезем — SiO 2 — твердое, очень тугоплавкое вещество, не растворимое в воде. Этот оксид имеет атомов в кристаллической решетке , узлами которой являются атомы кремния и кислорода.
Оксид кремния (IV) — это кислотный оксид , поэтому проявляет все свойства, характерные для этих оксидов.Однако этот оксид не растворяется в воде, но он реагирует с растворами щелочей … Итак, при реакции оксида кремния (IV) с гидроксидом натрия образуются силикат натрия и вода.
Оксид кремния (IV) реагирует с основными оксидами при нагревании … Итак, в реакции с оксидом кальция образуется силикат кальция.
Оксид кремния (IV) при нагревании взаимодействует с карбонатами , поэтому силикат натрия и диоксид углерода образуются в реакции с карбонатом натрия.
Силикаты натрия и калия называются растворимыми стеклами. Их водные растворы — силикатный клей .
Оксид кремния (IV) реагирует с фтористым водородом и плавиковой кислотой с образованием газообразного фторида кремния.
Это свойство используется для травления надписей, рисунков и знаков на стекле.
Состав кремниевой кислоты может быть выражен как H 2 SiO 3. Кремниевая кислота представляет собой гелеобразное нерастворимое в воде вещество.Она относится к очень слабым кислотам (даже слабее угля). Когда раствор, содержащий кремниевую кислоту, высыхает, силикагель , который используется в качестве адсорбента.
Кремниевая кислота — рыхлое соединение и при хранении или нагревании разлагается на оксид кремния (IV) и воду.
Качественная реакция на силикат-ион — реакция силикатов с растворами сильных кислот с образованием кремниевой кислоты в виде студенистого осадка.Например, при реакции силиката натрия с соляной кислотой образуется соль — хлорид натрия и кремниевая кислота в виде студенистого осадка.
Проведем эксперимент. Для этого пропустим углекислый газ через раствор силиката натрия. В этом случае мы можем наблюдать образование студенистого осадка. Это образовало кремниевую кислоту. Таким образом, кремниевая кислота очень слабая, даже слабее угольной кислоты, которая может вытеснить ее из раствора соли.
А теперь добавьте к этому студенистому осадку концентрированный раствор щелочи и нагрейте его на пламени спиртовой лампы.Осадок начинает растворяться за счет образования растворимой соли — силиката натрия.
Кремний применяется для производства полупроводниковых материалов и кислотостойких сплавов. Кремниевый состав типа карбид кремния — SiC — применяется для заточки фрез металлорежущих станков и шлифовки драгоценных камней, поскольку по твердости уступает только алмазу.
Кварцевая химическая посуда изготовлена из кварца, выдерживающего высокие температуры и резкие перепады температур.
Водорастворимые силикаты натрия и калия («Стекло растворимое , »). Применяется как огнеупорный агент для пропитки древесины и тканей. Для изготовления негорючих и электроизоляционных тканей также используются природные силикаты — асбест.
Силикатная промышленность включает производство :
· Стекло;
· Керамические изделия (фарфор, фаянс, керамика), кирпич, облицовочные плиты и кровельные материалы;
· Цемент.
Кремниевые компаунды — основа для производства стекла и цемента. Например, обычное оконное стекло изготавливается путем сплавления смеси соды, известняка и песка. Стекло имеет свойство размягчаться и в расплавленном состоянии принимать различные формы, поэтому его используют для производства посуды.
Добавки в стекло придают определенные свойства. Например, если вы замените оксид натрия оксидом калия, вы можете получить твердое богемское стекло , при добавлении оксида свинца (II) вы можете получить хрустальное стекло , добавив оксид хрома (III), вы можете получить зеленое стекло , при добавлении оксида кобальта — , синее , а при добавлении оксида марганца (II) — фиолетовое.Путем добавления солей золота и селена рубиновых стакана из которых сделаны звезды Московский Кремль .
Для улучшения механических свойств стекло подвергается закалке … Закалка заключается в том, что стекло специального состава нагревается до температуры около 600 0 С, а затем резко охлаждается. Такое упрочнение позволяет получить пуленепробиваемое стекло.
Стекло известно человеку очень давно, уже три-четыре тысячи лет назад производство стекла было Египет, Сирия, Финикия, Черное море .
Стекло — удивительный материал. В году в Древнем Риме мастеров научились получать цветное стекло и делать мозаику из кусочков. Из стекла выполнены витражи церквей, музеев, различные мозаичные панно.
Область применения стекла обширна: окна, бутылки, лампы, зеркала и оптика.
Основным сырьем при производстве керамических изделий является глина … При смешивании глины с водой образуется тестообразная масса, которая после сушки и обжига может сохранять свою форму.Некоторые керамические изделия покрывают глазурью — тонким слоем стекловидного материала. Глазурь делает керамику водонепроницаемой, защищает от загрязнений, защищает от действия кислот и щелочей, придает блеск.
Важным кремниевым соединением является цемент … Его получают путем спекания глины и известняка. Если смешать цементный порошок с водой, получается так называемый «цементный раствор », который затем постепенно затвердевает. Если добавить в цемент песок или щебень, получится бетон … Прочность бетона можно повысить, введя железный каркас, тогда получается железобетон , из которого изготавливают стеновые панели, блоки перекрытия.
Кремний был получен в 1824 г. шведский химик Берцелиус … Но за двенадцать лет до него кремний получил Гей-Люссак и Тенар , но он был очень загрязнен примесями.
Латинское название кремний от латинского silx — «кремень».Русское название «кремний» происходит от греческого flint — «обрыв, скала».
Таким образом, кремний — элемент IV А групп. Он характеризуется степенями окисления +4 и -4. В реакциях с кислородом и другими неметаллами он проявляет восстанавливающие свойства, а в реакциях с металлами — окислительные свойства. Кремний встречается в природе в виде соединений. Наиболее распространенным его соединением является оксид кремния (IV) — диоксид кремния, который является кислым оксидом и проявляет свойства, характерные для этих оксидов.Водородное соединение кремния — силан — SiH 4 , который образуется при действии кислот или воды на силициды — соединения металлов с кремнием. Оксид кремния (IV) соответствует кремниевой кислоте. Это слабая двухосновная гелеобразная нерастворимая в воде кислота. Качественной реакцией на силикат-ион является действие сильных кислот на силикаты, так как в результате этих реакций образуется студенистый осадок — кремниевая кислота. Оксид кремния (IV) и силикаты широко используются в промышленности.Силикатная промышленность включает производство стекла и цемента, керамических изделий и кирпича.
Периодический закон и периодическая система химических элементов Презентация Д. И. Менделеева к уроку химии (11 класс) по теме. Презентация «Периодический закон и периодическая система химических элементов» Презентации к уроку химии Периодический закон
Минимальные необходимые знания
при подготовке к ОГЭ по химии
Периодическая система DI.Менделеева и строение атома
учитель химии
Филиал МОУ Средняя школа села Пойма
Белинского района Пензенской области в селе Чернышево
- Проанализировать основные теоретические вопросы программы 8-го класса;
- Для закрепления знаний о причинах изменения свойств химических элементов на основании положения в Д.И. Менделеев;
- Научить разумно объяснять и сравнивать свойства элементов, а также образованных ими простых и сложных веществ в соответствии с их положением в PSCE;
- Подготовка к успешной сдаче ОГЭ по химии
Серийный номер химический элемент
показывает количество протонов в ядре атома
(ядерный заряд Z) атома этого элемента.
12 r +
мг 12
МАГНИЙ
Это
его физическое значение
12 e —
Число электронов в атоме
равно количеству протонов,
поскольку атом
электрически нейтральный
Давайте исправим!
Ca 20
КАЛЬЦИЙ
20 руб. +
20-е е —
32 руб. +
32e —
СЕРЫ
Давайте исправим!
Zn 30
ЦИНК
30 руб. +
30 e —
35 руб. +
35e —
БРОМ
Горизонтальные ряды химических элементов — периоды
малые
большие
незавершенные
Вертикальные колонны химических элементов — группы
основные
боковые
Пример записи схемы строения атома химического элемента
Количество электронных слоев
в электронной оболочке атома равно номеру периода, в котором элемент находится
Относительная атомная масса
(округлено до целого числа)
написано в верхнем левом углу над
порядковый номер
11 Na
Ядерный заряд (Z) натрия
Натрий: серийный номер 11
(пишется в нижнем левом углу
рядом с символом химического элемента)
2 ∙ 1 2
2 ∙ 2 2
11e —
11к +
Количество нейтронов рассчитывается
по формуле: N (n 0 ) = A r — N (p + )
12 n 0
Количество электронов на внешнем уровне для элементов основных подгрупп равно номеру группы , в которой находится элемент
Максимум Количество электронов
на уровне рассчитывается по формуле:
2n 2
Давайте исправим!
13 Al
Ядерный заряд (Z) алюминия
2 ∙ 1 2
2 ∙ 2 2
13e —
13к +
14 n 0
Давайте исправим!
9 F
Ядерный заряд (Z) фтора
2 ∙ 1 2
9 пол +
9e —
10 н. 0
За один период
1. Увеличение:
I II III IV V VI VII VIII
Li Be B C N OF Ne
+3 +4 +5 +5 7 +8 +9 +10
2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8
- Заряд ядра
- Число электронов во внешнем слое атомов
- Наивысшая степень окисления элементов в соединениях
Li +1 Be +2 Б +3 К +4 № +5
- Электроотрицательность
- Окислительные свойства
- Неметаллические свойства простых веществ
- Кислотные свойства высших оксидов и гидроксидов
За один период
2. Уменьшение:
I II III IV V VI VII VIII
Li Be B C N OF Ne
+3 +4 +4 +4 7 +8 +9 +10
2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8
- Радиус атома
- Металлические свойства простых веществ
- Восстановительные свойства:
Li — только восстановитель , C — и окислитель и восстановитель ,
F — только окислитель
- Основные свойства высших оксидов и гидроксидов:
LiOH — основание , Be (OH) 2 — амфотерный гидроксид,
HNO 3 — кислота
В течение одного периода
3. Не меняется:
I II III IV V VI VII VIII
Li Be B C N OF Ne
+3 +4 +4 +4 +6 +7 +8 +9 +10
2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8
Количество электронных слоев
(уровни энергии)
в атоме —
равно номер периода
Давайте исправим!
Периодически
слева справа
ядерный заряд
- Увеличивает
- Уменьшает
- Не меняется
Давайте исправим!
В периоды
справа слева
количество уровней энергии
- Увеличивает
- Уменьшает
- Уменьшает
- 12 Не меняется 9 Не изменяется 9 900
Давайте исправим!
В периодах
слева справа
восстановительные свойства элемента
- Увеличиваются
- Ослабляют
- 12 Сначала не изменяют усилить
Давайте исправим!
Атомы химических элементов
алюминий и кремний
имеют то же:
- Количество электронных слоев;
- Число электронов
Давайте исправим!
Атомы химических элементов
сера и хлор
имеют разные:
- Величина зарядов ядер атомов;
- Число электронов во внешнем слое;
- Количество электронных слоев;
- Общее количество электронов
Внутри одной группы А
1. Увеличение:
- Ядерный заряд
- Число электронных слоев в атоме
- Радиус атома
- Восстановительные свойства
- Металлик свойства
простые вещества
- Основные свойства высших оксидов и гидроксидов
- Кислотные свойства (степень диссоциации) аноксических кислот неметаллы
2 8 18 8 1
Внутри одной группы А
2. Уменьшение:
простых веществ;
- Прочность (устойчивость) летучих соединений водорода.
2 8 18 7
2 8 18 18 7
Внутри одной группы А
3. Не изменять:
- Количество электронов в внешнем электронном слое
- Степень окисления элементов в высших оксидов и гидроксидов (обычно равных номеру группы)
2 2
2 8 2
2 8 8 2
2 8 18 8 2
Давайте исправим!
снизу вверх
ядерный заряд
- Увеличивает
- Уменьшается
- Не меняется
- Сначала увеличивается, а затем уменьшается
Давайте исправим!
В основных подгруппах
снизу вверх
количество электронов на внешнем уровне
- Увеличивает
- Уменьшается
- 901 Сначала увеличивается, а затем уменьшается
Давайте исправим!
В основных подгруппах
вверх
окислительный Свойства элемента
- Увеличиваются
- Ослабляют Сначала
- не изменяются 9011
Давайте исправим!
Атомы химических элементов
углерод и кремний
имеют то же самое:
- Величина зарядов ядер атомов;
- Число электронов во внешнем слое;
- Количество электронных слоев;
- Общее количество электронов в атоме
Давайте исправим!
Атомы химических элементов
азот и фосфор
имеют разные:
- Величина зарядов ядер атомов;
- Число электронов во внешнем слое;
- Количество электронных слоев;
- Общее количество электронов
- D.И. Менделеев http://s00.yaplakal.com/pics/pics_original/7/7/0/2275077.gif
- Габриелян О.С. «Химия. 9 класс», — ДРОФА, М., — 2013, с. 267-268
- Савельев А.Е. Основные понятия и законы химии. Химические реакции … 8-9 классов. — М .: ДРОФА, 2008, — с. 6-48.
- Рябов М.А., Невская Е.Ю. «Тесты по химии» к учебнику О.С. Габриелян «Химия. 9 класс ». — М .: ЭКЗАМЕН, 2010, с. 5-7 .
Slide 1
Периодический закон Менделеева и периодическая таблица химических элементов
Slide 2
Основной закон химии — Периодический закон был открыт Д.И. Менделеева в 1869 году, когда атом считался неделимым и о его внутреннем строении ничего не было известно. В основе Периодического закона Д.И. Менделеев ставил атомные массы (ранее — атомные веса) и химические свойства элементов.
Д. И. Менделеев
Slide 3
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.Например, свойства типичного металлического лития Li были повторены в элементах натрия Na и калия K, свойства типичного неметаллического фтора F были в элементах хлора Cl, брома Br, йода I.
Discovery of the Periodic Закон
Слайд 4
Открытие Периодического закона
Некоторые элементы DI Менделеев не нашел химических аналогов (например, в алюминии Al и кремнии Si), поскольку такие аналоги в то время еще не были известны.Для них он оставил пустые места в естественных рядах и предсказал их химические свойства на основе периодической повторяемости. После открытия соответствующих элементов (аналог алюминия — галлий Ga, аналог кремния — германий Ge и др.) Д.И. Менделеев был полностью подтвержден.
Slide 5
Периодический закон в формулировке Д.И. Менделеев:
Свойства простых тел, а также формы и свойства соединений элементов периодически зависят от значения атомных весов элементов.
Slide 6
Графическим (табличным) выражением периодического закона является периодическая система элементов, разработанная Менделеевым.
Периодическая таблица элементов
Слайд 7
Слайд 8
Значение
Открытие периодического закона и создание системы химических элементов имело большое значение не только для химии, но и для философии , для всего нашего мировоззрения. Менделеев показал, что химические элементы составляют стройную систему, основанную на фундаментальном законе природы.В этом выражается позиция материалистической диалектики о взаимосвязи и взаимозависимости явлений природы. Выявив связь между свойствами химических элементов и массой их атомов, периодический закон стал блестящим подтверждением одного из универсальных законов развития природы — закона перехода количества к качеству.
Слайд 9
Памятник Д.И. Менделеева в Санкт-Петербурге
Периодический закон и периодическая система химических элементов D.И. Менделеев Выступление учителя химии Кневицкой основной школы Балалайкина Наталья Александровна 2016 В 60-е годы 20 века атом считался неделимым, о его внутреннем устройстве ничего не было известно. Открытие Д.И. Менделеева, с одной стороны, было своевременным (если учитывать попытки классифицировать элементы, сделанные предшественниками), но, с другой стороны, оно значительно опередило свое время, научное сообщество не было готово. воспринимать это.Поэтому поначалу творчество Менделеева было встречено безразлично, и только после открытия предсказанных им элементов ожидалось, что он по-настоящему восторжествует и будет признан во всем мире. В 60-х годах 20 века атом считался неделимым, о его внутреннем устройстве ничего не было известно. Открытие Д.И. Менделеева, с одной стороны, было своевременным (если учитывать попытки классифицировать элементы, сделанные предшественниками), но, с другой стороны, оно значительно опередило свое время, научное сообщество не было готово. воспринимать это.Поэтому поначалу творчество Менделеева было встречено безразлично, и только после открытия предсказанных им элементов ожидалось, что он по-настоящему восторжествует и будет признан во всем мире. Основные предшественники Менделеева и их достоинства Иоганн Вольфанг Деберейнер В 1829 году он сформулировал концепцию природных групп элементов (по три элемента в каждой) со схожими химическими свойствами. Каждые три одинаковых элемента он назвал триадами, всего набрал четыре тирады. Остальные элементы остались вне его классификации.Джон Александр Ньюлендс В 1856 году он сначала расположил элементы в порядке возрастания атомных масс, присвоил каждому элементу номер, сформулировал «закон октав», согласно которому количество одинаковых элементов различается на целое число семь или кратное числу Семь. Он первым установил определенную периодичность в изменении свойств химических элементов. Однако его октавы содержали ошибки. Юлиус Лотар Майер 1864-1865 Он опубликовал таблицы, в которых расположил элементы в соответствии с их валентностями.Недостатки работ предшественников Д. И. Менделеева
- Ученые сравнивали только схожие элементы, поэтому сходных закономерностей для всех химических элементов не обнаружено. Сам Менделеев отмечал, что его открытие Периодического закона связано с работой над книгой «Основы химии», с его размышлениями о последовательности представления информации о химических элементах. Его путь к открытию периодического закона был долгим и трудным.
- Менделеев выбрал атомную массу элемента (современный термин — атомная масса) в качестве основной характеристики атома при построении Периодической таблицы.Однако он также принимал во внимание химические свойства элементов (их валентности, формы образованных ими соединений). Расположив все известные элементы в порядке увеличения их атомных масс, Менделеев обнаружил, что в этом ряду наблюдается периодическая повторяемость химических свойств.
- Рассмотрим этот паттерн на примере элементов малых периодов (2-го и 3-го). Свойства типичного металлического лития повторяются в натрии и калии, свойства сильного неметаллического фтора — в других галогенах (хлор, бром). Такие элементы называются элементами — аналогами.
- Пример: литий — аналог калия, натрия.
- К моменту открытия ПЗ было известно 63 элемента, Менделеев расположил их в своей таблице, не допустив ни единой ошибки, несмотря на то, что атомные массы многих элементов были определены неверно! Для 1/3 всех известных на тот момент элементов он исправил атомные массы, а для двадцати девяти еще не обнаруженных элементов он оставил пустые места в таблице!
- Перемешайте карты, а затем расположите их в порядке возрастания относительных масс атомов.
- Поместите одинаковые элементы с 1 по 18 друг под другом: водород над литием и калий под натрием, соответственно, кальций под магнием, гелий под неоном.
- Сформулируйте закономерность, которую вы определили как закон
- Обратите внимание на несоответствие относительных атомных масс аргона и калия и их расположение по общим свойствам элементов
- Объясните причину этого явления.
- В таблице общие закономерности изменения свойств атомов образованных ими соединений повторяются через определенные промежутки времени — периоды, поэтому вся система называется периодической. Каждый период начинается с щелочного металла и заканчивается инертным газом (кроме 1-го и последнего 7-го незавершенного периода)
- Заряды атомных ядер увеличиваются
- Металлические свойства ослабить
- Неметаллические свойства усилить
- Степень окисления элементов в высших оксидах увеличивается с +1 до +8
- Степень окисления элементов в летучих водородных соединениях увеличивается с -4 до -1.
- Оксиды от основных до амфотерных заменены на кислые
- Гидроксиды от щелочей до амфотерных гидроксидов заменены кислородсодержащими кислотами. На основании этих наблюдений Д.И. Менделеев в 1869 г. сделал вывод — сформулировал Периодический закон
- относительные атомные массы элементов
- Свойства химических элементов и образованных ими веществ периодически зависят от зарядов их атомных ядер.
- Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних энергетических уровней атомов элементов.
- Третья формулировка фактически раскрывает смысл Периодического закона. Только теория строения атома могла объяснить периодическое изменение свойств элементов. Периодический закон был открыт в 19 веке, а объяснение ему было дано только в 20 веке, после установления строения атома.
Свойства химических элементов и образованных ими соединений периодически зависят от периодичности изменения структуры внешних электронных слоев атомов химических элементов
Свойства элементов в основном зависят от количества электронов во внешнем слой атомов щелочного металла на последнем энергетическом уровне по одному электрону каждый, поэтому они обладают схожими свойствами (например, они являются сильными восстановителями), то есть их свойства периодически повторяются (после восьми цифр для элементов с малым периодом). Атомы галогена на последнем уровне имеют по 7 электронов каждый, поэтому они также обладают схожими свойствами (являются сильными окислителями) Физический смысл периодического закона Число электронов на последнем уровне периодически повторяется, поэтому свойства элементов и их соединений периодически повторяются.Смысл периодического закона Д. И. Менделеева Периодический закон — один из основных законов природы, основа современной химии. ПЗ и ПСХЭ позволяли прогнозировать наличие новых, еще не открытых элементов. PZ позволяет ученым синтезировать новые химические элементы. Сам Менделеев писал об этом: «Будущее не грозит периодическому закону разрушением, а обещаются только надстройка и развитие».
Слайд 1
Периодический закон Д.И. Менделеева и Периодическая таблица химических элементов «Сила и сила науки в множестве фактов, цель — обобщить это множество и привести их к началу… Собрание фактов и гипотез — это еще не наука; это только его порог, за которым невозможно напрямую войти в святилище науки. На этих порогах надпись — наблюдения, предложения, опыт ». DI. МенделеевСлайд 2
Первые попытки систематизировать элементы В 1829 году немецкий химик Иоганн Вольфганг Доберейнер сформулировал закон триад. Cl — 35,5 Br — 80 I — 125 P — 31 As — 75 Sb — 122 S — 32 Se — 79 Te — 129 Ca — 41 Sr — 88 Ba — 137 Li — 7 Na — 23 K — 39Слайд 3
Доберейнеру, естественно, не удалось разбить все известные элементы на триады, тем не менее, закон триад четко указывал на наличие связи между атомной массой и свойствами элементов и их соединений.Все дальнейшие попытки систематизации основывались на расположении элементов в порядке возрастания их атомных весов.Слайд 4
Первые попытки систематизировать элементы В 1843 году Леопольд Гмелин дал таблицу химически подобных элементов, сгруппированных в группы в порядке возрастания «соединяющихся масс». Вне групп элементов вверху таблицы Гмелин поставил три «основных» элемента — кислород, азот и водород. Под ними помещены триады, а также тетрады и пятерки (группы из четырех и пяти элементов), а под кислородом — группы металлоидов (по терминологии Берцелиуса), т.е. электроотрицательные элементы; электроположительные и электроотрицательные свойства групп элементов плавно менялись сверху вниз.Слайд 5
Часть таблицы Леопольда Гмелина H = 1 Cl = 35,5 K = 39 O = 8 N = 14 Ag = 108 S = 16 C = 6 Pb = 103,5Слайд 6
Первые попытки систематизировать элементы Джон Александр Рейна Ньюлендс опубликовал в 1864 году таблицу элементов, отражающую предложенный им закон октав. Ньюлендс показал, что в серии элементов, расположенных в порядке возрастания атомных весов, свойства восьмого элемента аналогичны свойствам первого.Эта зависимость действительно существует для легких элементов, но Newlands пытается сделать ее универсальной. В таблице Newlands похожие элементы были расположены горизонтальными рядами; однако в одном ряду часто находились совершенно непохожие друг на друга элементы. Кроме того, Newlands пришлось разместить в некоторых камерах два элемента; наконец, стол Newlands не содержит свободных мест.Слайд 7
Таблица Newlands No. No. No. No. No. No. No. No. No. H 1 F 8 Cl 15 Co Ni 22 Br 29 Pd 36 I 43 Pt Ir 50 Li 2 Na 9 K 16 Cu 23 Rb 30 Ag 37 Cs 44 Tl 51 Be 3 Mg 10 Ca 17 Zn 24 Sr 31 Cd 38 Ba V 45 Pb 52 B 4 Al 11 Cr 18 Y 25 Ce La 32 U 39 Ta 46 Th 53 C 5 Si 12 Ti 19 In 26 Zr 33 Sn 40 W 47 Hg 54 N 6 P 13 Mn 20 As 27 Di Mo 34 Sb 41 Nb 48 Bi 55 O 7 S 14 Fe 21 Se 28 Rh Ru 35 Te 42 Au 49 Os 56Слайд 8
Первые попытки систематизировать элементы В 1864 году Уильям Одлинг, пересматривая предложенную им в 1857 году систематику элементов на основе эквивалентных весов, предложил следующую таблицу, не сопровождаемую какими-либо пояснениями.Слайд 9
Таблица Одлинга Триплетные группы H 1 Mo 96 W 184 Au 196,5 Pd 106,5 Pt 197 Li 7 Na 23 — Ag 108 G 9 Mg 24 Zn 65 Cd 112 Hg 200 B 11 Al 27,5 — — Tl 203 C 12 Si 28 — Sn 118 Pb 207 N 14 P 31 As 75 Sb 122 Bi 210 O 16 S 32 Se 79,5 Te 129 F 19 Cl 35 Br 80 J 127 K 39 Rb 85 Cs 133 Ca 40 Sr 87,5 Ba 137 Ti 40 Zr 89,5 — Th 231 Cr 52,5 V 138 Mn 55 и другие (Fe, Ni, Co, Cu)Слайд 10
В 1870 году Юлиус Лотар Мейер опубликовал свою первую таблицу, которая включает 42 элемента (из 63), расположенных в шесть столбцов в соответствии с их валентностью.Мейер намеренно ограничил количество элементов в таблице, чтобы подчеркнуть естественное (подобное триадам Доберейнера) изменение атомной массы в ряду подобных элементов. Первые попытки систематизировать элементыСлайд 11
Таблица Майера I II III IV V VI VII VIII IX B Al In (?) Tl C Si Ti Zr Sn Pb NPV As Nb Sb Ta Bi OS Cr Se Mo Te WF Cl Mn Fe Co Ni Br Ru Rh Pd I Os Ir Pt Li Na K Cu Rb Ag Cs Au Be Mg Ca Zn Sr Cd Ba HgСлайд 12
В марте 1869 года русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях.В том же 1869 году вышло первое издание учебника «Основы химии», в котором была приведена таблица Менделеева.Слайд 13
Первая таблица Д.И. Менделеева, 1869 г H = 1 Ti = 50 В = 51 Cr = 52 Mn = 55 Fe = 56 Co = Ni = 59 Cu = 63,4 Zr = 90 Nb = 94 Mo = 96 Rh = 104,4 Ru = 104,4 Pd = 106,6 Ag = 108? = 180 Ta = 182 Вт = 186 Pt = 197,4 Ir = 198 Os = 199 Hg = 200 Be = 9.4 Mg = 24 Zn = 65,2 Cd = 112 B = 11 Al = 27,4? = 68 Ur = 116 Au = 197 C = 12 Si = 28? = 70 Sn = 118 N = 14 P = 31 As = 75 Sb = 122 Bi = 210 O = 16 S = 32 Se = 79,4 Te = 128? F = 19 Cl = 35,5 Br = 80 Дж = 127 Li = 7 Na = 23 K = 39 Ca = 40? = 45? Er = 56? Yt = 60? В = 75,6 Rb = 85,4 Sr = 87,6 Ce = 92 La = 94 Di = 95 Th = 118? Cs = 133 Ba = 137 Tl = 204 Pb = 207Слайд 14
В конце 1870 г. Менделеев сообщил РФО статью «Элементы природных систем и ее применение для указания свойств неоткрытых элементов», в которой предсказал свойства неоткрытых элементов — аналогов бора, алюминия и кремния (экабор, экаалюминий и экасилиций. , соответственно).Расположение элементов в периодической таблице известно с 1870 года. Зеленым цветом показаны клетки, соответствующие элементам, свойства которых были предсказаны Д.И. Менделеевым.Слайд 15
В 1871 году Менделеев в своей заключительной статье «Периодическая законность химических элементов» сформулировал Периодический закон: «Свойства элементов, а следовательно, и свойства простых и сложных тел, образованных ими, периодически зависят от атомного веса». В то же время Менделеев придал своей таблице Менделеева классический вид.Слайд 16
Чаще других встречаются 3 формы таблицы Менделеева: «короткая» (короткопериодическая), «длинная» (долгопериодическая), «сверхдлинная». В «сверхдлинной» версии каждый период занимает ровно одну строку. В «длинном» варианте лантаноиды и актиниды удалены из общей таблицы, что делает ее более компактной. В «коротких» обозначениях, кроме этого, четвертый и последующие периоды занимают 2 строки; символы элементов основной и второстепенной подгрупп выравниваются относительно разных краев ячеек.Слайд 17
Периодическая таблица элементов IA IIA IIIB IVB VB VIB VIIB —- VIIIB —- IB IIB IIIA IVA VA VIA VIIA VIIIA 1 1 H 2 He 2 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 3 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr 5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo (43) Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe 6 55 Cs 56 Ba * 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po (85) At 86 Rn 7 87 Fr 88 Ra ** (104) Rf (105) Db (106) Sg (107) Bh (108) Hs (109) Mt (110) Ds (111) Rg (112) Cp (113) Uut (114) Uuq (115) Uup (116) Uuh (117) Uus (118) Uuo 8 ( 119) Uue (120) Ubn лантаноиды * 57 La 58 Ce 59 Pr 60 Nd (61) Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 71 Lu Актиниды ** 89 Ac 90 Th 91 Па 92 U (93) Np (94) Pu (95) Am (96) Cm (97) Bk (98) Cf (99) Es (100) Fm (101) Md (102) Нет (103) LrСлайд 18
Слайд 19
Вторая формулировка Периодического закона. Свойства химических элементов и образованных ими веществ периодически зависят от зарядов их атомных ядер.Слайд 20
Третья формулировка Периодического закона. Свойства химических элементов и образованных ими веществ периодически зависят от периодичности изменения конфигураций внешних электронных слов атомов химических элементов.
Периодическая система химических элементов Д.И. Менделеев
учитель химии
МБОУ «Цнинская общеобразовательная школа №2»
Тамбовская область
План лекции:
Выявление мотива, которым руководствовался Д.И. Менделеев, основывая классификацию элементов по их относительной атомной массе.
2. Периодичность изменения свойств элементов, упорядоченных по возрастанию их атомных масс.
3.PZ в постановке Д.И. Менделеева
Попытки Домена классифицировать химические элементы
- 1818 — Берцелиус разделил элементы на металлы и неметаллы;
- 1827 — Деберейнер — превратил элементы схожих свойств в «триады»
- 1864-65gg — и Английский ученый Ньюлендс сформулировал «правило октав», согласно которому свойства химических элементов упорядочиваются в порядке возрастания атомных масс, повторяются так, что каждый восьмой элемент повторяет свойства первого элемента.
- 1864 — немецкий ученый Лотар Мейер сгруппировал похожие элементы по валентности, выделив шесть таких групп.
- Заключение: ни одна из предложенных классификаций не была идеальной, поскольку были элементы, которые не были охвачены классификацией, и взаимосвязь между отдельными элементами не была установлена
«Корневое» свойство атомов химических элементов
«Должна быть связь между массой и химическими характеристиками элементов, а поскольку масса вещества хоть и не абсолютная, а только относительно, окончательно выражается в виде атомов, необходимо искать функциональные соответствия между отдельными свойствами элементов и их атомными массами.«
DI. Менделеева «Основы химии»
«Основы химии» Менделеева, воплотившие периодический закон, — это памятник, который по силе своей конструкции, совершенству исполнения и глубине мысли является таким же величайшим проявлением человеческого гения, как и Данте. «Божественная комедия», как «Страшный суд» Микеланджело, как 9-я симфония Бетховена ».
Байков А.А. Coll. сочинения, т.2, 1948, с. 505
1834-1907
« В этой таблице каждый элемент полностью занимает определенное место или клетку … Положение элемента в системе определяется совокупностью его отношений с другими элементами, всеми физическими и химическими свойствами этого элемента, изолированного в свободном состоянии (простое тело), а также ему подобных соединения. «(Чугаев Л.А.)
Свойства простых тел, также формирует
и свойства соединения элемента
находятся в периодической зависимости
о величине атомных весов элементов «
Периодический закон периодической системы представления.Периодический закон Д. И. Менделеева и Периодическая таблица химических элементов. Планетарная модель атома бериллия
1 из 18
1,301
просмотр
Текст презентации
Периодический закон и периодическая система элементов Д.И. Менделеев
Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. С открытием новых химических элементов, изучением состава и свойств их соединений появились первые попытки классифицировать элементы по каким-либо критериям.Всего до Д. Менделеева было сделано более 50 попыток классификации химических элементов. Ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов, раскрывающей природу их сходства и различия, которая носит прогнозный характер.
В основу своей работы по классификации химических элементов Д.И. Менделеев назвал две их главных и неизменных характеристики: величину атомной массы и свойства веществ, образованных химическими элементами.Он записал на карточках всю известную информацию об открытых и изученных в то время химических элементах и их соединениях. Сопоставляя эту информацию, ученый составил природные группы элементов со схожими свойствами. При этом он обнаружил, что свойства элементов в определенных пределах изменяются линейно (монотонно увеличиваются или уменьшаются), затем после резкого скачка они периодически повторяются, т.е. через определенное количество элементов появляются похожие.
Открытие Периодического закона
При переходе от лития к фтору происходит естественное ослабление металлических свойств и увеличение неметаллических свойств.При переходе от фтора к следующему элементу натрия по атомной массе происходит скачок изменения свойств (Na повторяет свойства Li). За Na следует Mg, который похож на Be — они проявляют металлические свойства. A1, следующий за Mg, похож на B. Как близкие родственники Si и C похожи; P и N; S и O; C1 и F. При переходе к следующему элементу K после C1 снова происходит скачок изменения химических свойств.
Что было обнаружено?
Если записать строки одна под другой так, чтобы под литием был натрий, а под неоном был аргон, то мы получим следующее расположение элементов: Li Be BCNOF Ne Na Mg Al Si PS Cl Ar
Li Be BCNOF Ne Na Mg Al Si PS Cl Ar При таком расположении элементы с аналогичными свойствами попадают в вертикальные колонны.
Периодический закон Д.И. Менделеев
По наблюдениям 1 марта 1869 г., Д.И. Менделеев сформулировал периодический закон, который в своей первоначальной формулировке звучал так: свойства простых тел, а также формы и свойства соединений элементов периодически зависят от значений атомных масс элементов
Первая версия Периодической таблицы
Уязвимость периодического закона сразу после его открытия была объяснением причины периодического повторения свойств элементов с увеличением относительной атомной массы их атомов.Более того, несколько пар элементов расположены в Периодической таблице с нарушением увеличения атомной массы. Например, аргон с относительной атомной массой 39,948 занимает 18 место, а калий с относительной атомной массой 39,102 имеет порядковый номер 19.
Периодическая таблица Д.И. Менделеев
Ar
аргон
18
ТО
19
калий
39,102
39,948
Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало ясно, что в Периодической таблице они расположены в порядке увеличения положительного заряда их атомных ядер.С этой точки зрения нет нарушения в последовательности элементов 18Ar — 19K, 27Co — 28Ni, 52Te — 53I, 90Th — 91Pa. Следовательно, современная интерпретация Периодического закона звучит так: свойства химических элементов и образованных ими соединений периодически зависят от величины заряда их атомных ядер.
Периодический закон Д.И. Менделеев
Закон, открытый Д.И. Менделеевым, и построенная на его основе таблица Менделеева — важнейшее достижение химической науки.
Периодическая таблица химических элементов
Периоды — горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I, II, III) и большие (IV, V, VI), VII-незавершенные. Каждый период (кроме первого) начинается с типичного металла (Li, Na, K, Rb, Cs, Fr) и заканчивается благородным газом (He, Ne, Ar, Kr, Xe, Rn), которому предшествует типичный неметалл.
Периодическая таблица химических элементов
Группы — вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы.Различают основную (А) и второстепенную подгруппы (Б). Основные подгруппы состоят из элементов второстепенного и большого периода. Боковые подгруппы состоят из элементов только больших периодов.
Поскольку окислительно-восстановительные свойства атомов влияют на свойства простых веществ и их соединений, металлические свойства простых веществ элементов основных подгрупп увеличиваются, уменьшаются по периодам, а неметаллические свойства соответственно на Напротив, уменьшение основных подгрупп и увеличение сроков.
Восстановительные свойства атомов (способность терять электроны при образовании химической связи) увеличиваются в основных подгруппах и уменьшаются в периодах. Окислительная (способность принимать электроны), наоборот, в основных подгруппах уменьшается, а в периодах увеличивается.
Редокс-свойства
Электроотрицательность в периоде увеличивается с увеличением заряда ядра химического элемента, то есть слева направо.В группе с увеличением количества электронных слоев электроотрицательность уменьшается, то есть сверху вниз. Следовательно, наиболее электроотрицательным элементом является фтор (F), а наименее электроотрицательным элементом — франций (Fr).
Электроотрицательность
Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде, потому что увеличивается притяжение ядрами электронных оболочек. В начале периода есть элементы с небольшим количеством электронов на внешнем электронном слое и большим радиусом атома.Электроны дальше от ядра легко отрываются от него, что характерно для металлических элементов
Изменение радиуса атома за период
В этой же группе с увеличением номера периода атомные радиусы увеличивать. Атомы металла относительно легко отдают электроны и не могут присоединить их, чтобы сформировать внешний электронный слой.
Изменение радиуса атома в группе
О.С. Габриелян, И.Г. Остроумов Химия.Выпускной экзамен М. Дрофа, 2008 г. П.А. Оржековский Подготовка к экзамену. Химия. Сборник заданий. М. Эксмо, 2011
Источники информации
Код для встраивания презентационного видеоплеера на свой сайт:
Минимальные необходимые знания
при подготовке к ОГЭ по химии
Периодическая система DI. Менделеева и строение атома
учитель химии
Филиал МОУ Средняя школа села Пойма
Белинского района Пензенской области в селе Чернышево
- Проанализировать основные теоретические вопросы программы 8-го класса;
- Для закрепления знаний о причинах изменения свойств химических элементов на основании положения в Д.И. Менделеев;
- Научить разумно объяснять и сравнивать свойства элементов, а также образованных ими простых и сложных веществ в соответствии с их положением в PSCE;
- Подготовка к успешной сдаче ОГЭ по химии
Серийный номер химический элемент
показывает количество протонов в ядре атома
(ядерный заряд Z) атома этого элемента.
12 r +
мг 12
МАГНИЙ
Это
его физическое значение
12 e —
Число электронов в атоме
равно количеству протонов,
, поскольку атом
электрически нейтральный
Давайте исправим!
Ca 20
КАЛЬЦИЙ
20 руб. +
20-е е —
32 руб. +
32e —
СЕРЫ
Давайте исправим!
Zn 30
ЦИНК
30 руб. +
30 e —
35 руб. +
35e —
БРОМ
Горизонтальные ряды химических элементов — периоды
малые
большие
незавершенные
Вертикальные колонны химических элементов — группы
основные
побочные
Пример записи схемы строения атома химического элемента
Количество электронных слоев
в электронной оболочке атома равно номеру периода, в котором элемент находится
Относительная атомная масса
(округлено до целого числа)
написано в верхнем левом углу над
порядковый номер
11 Na
Ядерный заряд (Z) натрия
Натрий: серийный номер 11
(пишется в нижнем левом углу
рядом с символом химического элемента)
2 ∙ 1 2
2 ∙ 2 2
11e —
11к +
Количество нейтронов рассчитывается
по формуле: N (n 0 ) = A r — N (p + )
12 n 0
Количество электронов на внешнем уровне для элементов основных подгрупп равно номеру группы , где расположен элемент
Максимум количество электронов
9 на уровне рассчитывается по формуле:
2n 2
Давайте исправим!
13 Al
Ядерный заряд (Z) алюминия
2 ∙ 1 2
2 ∙ 2 2
13e —
13к +
14 n 0
Давайте исправим!
9 F
Ядерный заряд (Z) фтора
2 ∙ 1 2
9 пол +
9e —
10 н. 0
За один период
1. Увеличение:
I II III IV V VI VII VIII
Li Be B C N OF Ne
+3 +4 +5 +5 7 +8 +9 +10
2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8
- Заряд ядра
- Число электронов во внешнем слое атомов
- Наивысшая степень окисления элементов в соединениях
Li +1 Be +2 Б +3 К +4 № +5
- Электроотрицательность
- Окислительные свойства
- Неметаллические свойства простых веществ
- Кислотные свойства высших оксидов и гидроксидов
За один период
2. Уменьшение:
I II III IV V VI VII VIII
Li Be B C N OF Ne
+3 +4 +4 +4 7 +8 +9 +10
2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8
- Радиус атома
- Металлические свойства простых веществ
- Восстановительные свойства:
Li — только восстановитель , C — и окислитель и восстановитель ,
F — только окислитель
- Основные свойства высших оксидов и гидроксидов:
LiOH — основание , Be (OH) 2 — амфотерный гидроксид,
HNO 3 — кислота
В течение одного периода
3. Не меняется:
I II III IV V VI VII VIII
Li Be B C N OF Ne
+3 +4 +4 +4 +6 +7 +8 +9 +10
2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8
Количество электронных слоев
(уровни энергии)
в атоме —
равно номер периода
Давайте исправим!
Периодически
слева справа
ядерный заряд
- Увеличивается
- Уменьшается
- Не меняется
Давайте исправим!
В периодах
справа слева
количество уровней энергии
- Увеличивается
- Уменьшается
- 12 Не меняется 9 Не изменяется 9 убавляет
Давайте исправим!
В периодах
слева справа
Восстановительные свойства элемента
- Увеличивают
- Ослабляют
- 12 Ослабляют
- 12 Сначала не изменяют затем усилить
Давайте исправим!
Атомы химических элементов
алюминий и кремний
имеют то же:
- Количество электронных слоев;
- Число электронов
Давайте исправим!
Атомы химических элементов
сера и хлор
имеют разные:
- Величина зарядов ядер атомов;
- Число электронов во внешнем слое;
- Количество электронных слоев;
- Общее количество электронов
Внутри одной группы А
1. Увеличение:
- Ядерный заряд
- Число электронных слоев в атоме
- Радиус атома
- Восстановительные свойства
- Металл свойства
простые вещества
- Основные свойства высших оксидов и гидроксидов
- Кислотные свойства (степень диссоциации) аноксических кислот неметаллы
2 8 18 8 1
Внутри одной группы А
2. Уменьшение:
простых веществ;
- Прочность (устойчивость) летучих соединений водорода.
2 8 18 7
2 8 18 18 7
Внутри одной группы А
3. Не изменять:
- Количество электронов в внешнем электронном слое
- Степень окисления элементов в высших оксидов и гидроксидов (обычно равных номеру группы)
2 2
2 8 2
2 8 8 2
2 8 18 8 2
Давайте исправим!
снизу вверх
ядерный заряд
- Увеличивается
- Уменьшается
- Не меняется
- Сначала увеличивается, а затем уменьшается
Давайте исправим!
В основных подгруппах
снизу вверх
Количество электронов на внешнем уровне
- Увеличивается
- Не уменьшается
- Сначала увеличивается, а затем уменьшается
Давайте исправим!
В основных подгруппах
вверх
окислительный Свойства элемента
- Увеличиваются
- Ослабляют Сначала
- не изменяются 9011
Давайте исправим!
Атомы химических элементов
углерод и кремний
имеют то же самое:
- Величина зарядов ядер атомов;
- Число электронов во внешнем слое;
- Количество электронных слоев;
- Общее количество электронов в атоме
Давайте исправим!
Атомы химических элементов
азот и фосфор
имеют разные:
- Величина зарядов ядер атомов;
- Число электронов во внешнем слое;
- Количество электронных слоев;
- Общее количество электронов
- D.И. Менделеев http://s00.yaplakal.com/pics/pics_original/7/7/0/2275077.gif
- Габриелян О.С. «Химия. 9 класс», — ДРОФА, М., — 2013, с. 267-268
- Савельев А.Е. Основные понятия и законы химии. Химические реакции. 8-9 классы. — М .: ДРОФА, 2008, — с. 6-48.
- Рябов М.А., Невская Е.Ю. «Тесты по химии» к учебнику О.С. Габриелян «Химия. 9 класс ». — М .: ЭКЗАМЕН, 2010, с. 5-7 .
Периодический закон и периодическая система химических элементов D.И. Менделеев Выступление учителя химии Кневицкой основной школы Балалайкина Наталья Александровна 2016 В 60-х годах 20 века атом считался неделимым, о его внутреннем устройстве ничего не было известно. Открытие Д.И. Менделеева, с одной стороны, было своевременным (если учитывать попытки классифицировать элементы, сделанные предшественниками), но, с другой стороны, оно значительно опередило свое время, научное сообщество не было готово. воспринимать это. Поэтому поначалу творчество Менделеева было встречено равнодушно, и только после открытия предсказанных им элементов его ждал настоящий триумф и признание во всем мире.В 60-х годах 20 века атом считался неделимым, о его внутреннем устройстве ничего не было известно. Открытие Д.И. Менделеева, с одной стороны, было своевременным (если учитывать попытки классифицировать элементы, сделанные предшественниками), но, с другой стороны, оно значительно опередило свое время, научное сообщество не было готово. воспринимать это. Поэтому сначала работы Менделеева были встречены безразлично, и только после открытия предсказанных им элементов ожидалось, что он по-настоящему восторжествует и будет признан во всем мире.Основные предшественники Менделеева и их достоинства Иоганн Вольфанг Деберейнер В 1829 году он сформулировал представления о природных группах элементов (по три элемента в каждой) со схожими химическими свойствами. Каждые три одинаковых элемента он назвал триадами, всего набрал четыре тирады. Остальные элементы остались вне его классификации. Джон Александр Ньюлендс. В 1856 году он сначала расположил элементы в порядке увеличения их атомных масс, присвоил каждому элементу номер, сформулировал «закон октав», согласно которому количество одинаковых элементов различается на целое число семь или кратное. из семи.Он первым установил определенную периодичность в изменении свойств химических элементов. Однако его октавы содержали ошибки. Юлиус Лотар Майер 1864-1865 Он опубликовал таблицы, в которых расположил элементы в соответствии с их валентностями. Недостатки работ предшественников Д. И. Менделеева
- Ученые сравнивали только схожие элементы, поэтому сходных закономерностей для всех химических элементов не обнаружено. Сам Менделеев отмечал, что его открытие Периодического закона связано с работой над книгой «Основы химии», с его размышлениями о последовательности представления информации о химических элементах.Его путь к открытию периодического закона был долгим и трудным.
- Менделеев выбрал атомную массу элемента (современный термин — атомная масса) в качестве основной характеристики атома при построении Периодической таблицы. Однако он также принимал во внимание химические свойства элементов (их валентности, формы образованных ими соединений). Расположив все известные элементы в порядке увеличения их атомных масс, Менделеев обнаружил, что в этом ряду наблюдается периодическая повторяемость химических свойств.
- Рассмотрим этот паттерн на примере элементов малых периодов (2-го и 3-го). Свойства типичного металлического лития повторяются в натрии и калии, свойства сильного неметаллического фтора — в других галогенах (хлор, бром).Такие элементы называются элементами — аналогами.
- Пример: литий — аналог калия, натрия.
- К моменту открытия ПЗ было известно 63 элемента, Менделеев расположил их в своей таблице, не допустив ни единой ошибки, несмотря на то, что атомные массы многих элементов были определены неверно! Для 1/3 всех известных на тот момент элементов он исправил атомные массы, а для двадцати девяти еще неоткрытых элементов он оставил пустые места в таблице!
- Перемешайте карты, а затем расположите их в порядке возрастания относительных масс атомов.
- Поместите одинаковые элементы с 1 по 18 друг под другом: водород над литием и калий под натрием, соответственно, кальций под магнием, гелий под неоном.
- Сформулируйте выявленную вами закономерность в виде закона
- Обратите внимание на несоответствие между относительными атомными массами аргона и калия и их расположением с точки зрения общих свойств элементов.
- Объясните причину этого явления.
- В таблице общие закономерности изменения свойств атомов образованных ими соединений повторяются через определенные промежутки времени — периоды, поэтому вся система называется периодической. Каждый период начинается с щелочного металла и заканчивается инертным газом (кроме 1-го и последнего 7-го незавершенного периода)
- Ядерные заряды увеличение
- Металлические свойства ослабить
- Неметаллические свойства усилить
- Степень окисления элементов в высших оксидах увеличивается с +1 до +8
- Степень окисления элементов в летучих водородных соединениях увеличивается с -4 до -1.
- Оксиды от основных до амфотерных заменены на кислые
- Гидроксиды от щелочей до амфотерных гидроксидов заменены кислородсодержащими кислотами. На основании этих наблюдений Д.И. Менделеев в 1869 г. сделал вывод — сформулировал Периодический закон
- относительные атомные массы элементов
- Свойства химических элементов и образованных ими веществ периодически зависят от зарядов их атомных ядер.
- Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних энергетических уровней атомов элементов.
- Третья формулировка фактически раскрывает смысл Периодического закона. Только теория строения атома могла объяснить периодическое изменение свойств элементов. Периодический закон был открыт в 19 веке, а объяснение ему было дано только в 20 веке, после установления строения атома.
Свойства химических элементов и образующихся из них соединений периодически зависят от периодичности изменения структуры внешних электронных слоев атомов химических элементов
Свойства элементов в основном зависят от количества электронов в Наружный слой.На последнем энергетическом уровне атомы щелочного металла имеют по одному электрону каждый, поэтому они обладают схожими свойствами (например, они являются сильными восстановителями), то есть их свойства периодически повторяются (после восьми цифр для элементов с малым периодом) Атомы галогена имеют 7 электронов на последнем уровне, поэтому они также имеют схожие свойства (они являются сильными окислителями) Физический смысл периодического закона Число электронов на последнем уровне периодически повторяется, поэтому периодически повторяются свойства элементов и их соединений .Смысл периодического закона Д. И. Менделеева Периодический закон — один из основных законов природы, основа современной химии. ПЗ и ПСХЭ позволяли прогнозировать наличие новых, еще не открытых элементов. PZ позволяет ученым синтезировать новые химические элементы. Сам Менделеев писал об этом: «Будущее не грозит периодическому закону разрушением, а обещаются только надстройка и развитие».
Slide 1
Периодический закон Менделеева и Периодическая таблица химических элементов
Slide 2
Основной закон химии — Периодический закон был открыт Д.И. Менделеева в 1869 году, когда атом считался неделимым и о его внутреннем строении ничего не было известно. В основе Периодического закона Д.И. Менделеев поместил атомные массы (ранее — атомные веса) и химические свойства элементов.
Д. И. Менделеев
Slide 3
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.Например, свойства типичного металлического лития Li были повторены для элементов натрия Na и калия K, свойства типичного неметаллического фтора F — для элементов хлора Cl, брома Br, йода I.
Discovery of the Periodic Закон
Слайд 4
Открытие Периодического закона
Некоторые элементы DI Менделеев не нашел химических аналогов (например, в алюминии Al и кремнии Si), поскольку такие аналоги в то время еще не были известны.Для них он оставил пустые места в естественных рядах и предсказал их химические свойства на основе периодической повторяемости. После открытия соответствующих элементов (аналог алюминия — галлий Ga, аналог кремния — германий Ge и др.) Д.И. Менделеев был полностью подтвержден.
Slide 5
Периодический закон в формулировке Д.И. Менделеев:
Свойства простых тел, а также формы и свойства соединений элементов периодически зависят от значения атомных весов элементов.
Slide 6
Графическим (табличным) выражением периодического закона является периодическая система элементов, разработанная Менделеевым.
Периодическая таблица элементов
Слайд 7
Слайд 8
Значение
Открытие периодического закона и создание системы химических элементов имело большое значение не только для химии, но и для философии , для всего нашего мировоззрения. Менделеев показал, что химические элементы составляют стройную систему, основанную на фундаментальном законе природы.В этом выражается позиция материалистической диалектики о взаимосвязи и взаимозависимости явлений природы. Выявив связь между свойствами химических элементов и массой их атомов, периодический закон стал блестящим подтверждением одного из универсальных законов развития природы — закона перехода количества к качеству.
Слайд 9
Памятник Д.И. Менделеева в Санкт-Петербурге
Слайд 2
Основной закон химии — Периодический закон был открыт Д.И. Менделеева в 1869 году, когда атом считался неделимым и о его внутреннем строении ничего не было известно. В основе Периодического закона Д.И. Менделеев поместил атомные массы (ранее — атомные веса) и химические свойства элементов. Менделеев Д. И.
Slide 3
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.Например, свойства типичного металлического лития Li были повторены для элементов натрия Na и калия K, свойства типичного неметаллического фтора F — для элементов хлора Cl, брома Br, йода I. Открытие Периодического закона.
Слайд 4
Открытие Периодического закона
Некоторые элементы Д.И. Менделеев не нашел химических аналогов (например, в алюминии Al и кремнии Si), поскольку такие аналоги в то время еще не были известны. Для них он оставил пустые места в естественных рядах и предсказал их химические свойства на основе периодической повторяемости.После открытия соответствующих элементов (аналог алюминия — галлий Ga, аналог кремния — германий Ge и др.) Д.И. Менделеев был полностью подтвержден.
Slide 5
Периодический закон в формулировке Д.И. Менделеева:
Свойства простых тел, а также формы и свойства соединений элементов периодически зависят от значения атомных весов элементов.
Slide 6
Графическим (табличным) выражением периодического закона является периодическая система элементов, разработанная Менделеевым.Периодическая таблица элементов
Слайд 7
Слайд 8
Значение
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для философии, для всего нашего мировоззрения. Менделеев показал, что химические элементы составляют стройную систему, основанную на фундаментальном законе природы. В этом выражается позиция материалистической диалектики о взаимосвязи и взаимозависимости явлений природы.Выявив связь между свойствами химических элементов и массой их атомов, периодический закон стал блестящим подтверждением одного из универсальных законов развития природы — закона перехода количества к качеству.
Физико-химические свойства водорода. Физические свойства водорода
Обобщающая схема «ВОДОРОД»
I … Водород — химический элемента) Положение в ПСХЭ
- порядковый номер №1
- период 1
- группа I (основная подгруппа «А»)
- относительная массаAr (H) = 1
- латинское название Hydrogenium (водородородящая) ………………………………………………………………………………………………………………………………………………………………………………………………………………..
б) Изобилие водорода в природе
Водород — химический элемент. | В земной коре (литосфера и гидросфера) — 1% по массе (10 место среди всех элементов) |
АТМОСФЕРА — 0,0001% по количеству атомов | |
Самый распространенный элемент во Вселенной — 92% всех атомов (основная составляющая звезд и межзвездного газа) |
Водород — химический элемент | В соединениях | H 2 O — вода (11% по массе) |
CH 4 — газ метан (25% по массе) | ||
Органические вещества (нефть, горючие природные газы и др.) В организмах животных и растений (то есть в составе белков, нуклеиновых кислот, жиров, углеводов и др.) В организме человека содержится в среднем около 7 килограммов водорода. |
c) Валентность водорода в соединениях
II … Водород — простое вещество (H 2)
Прием
1. Лаборатория (аппарат Киппа) А) Взаимодействие металлов с кислотами: Zn + 2HCl = ZnCl 2 + H 2 соль B) Взаимодействие активных металлов с водой: 2Na + 2H 2 O = 2NaOH + H 2 база |
2.Промышленность · Электролиз воды эл. Почта текущий 2Н 2 О = 2Н 2 + О 2 · Природный газ т, Ni СН 4 + 2Н 2 О = 4Н 2 + СО 2 |
Поиск водорода в природе.
Водород широко распространен в природе, его содержание в земной коре (литосфере и гидросфере) составляет 1% по массе и 16% по количеству атомов.Водород входит в состав самого распространенного на Земле вещества — воды (11,19% водорода по массе), в составе соединений, входящих в состав угля, нефти, природных газов, глин, а также организмов животных и растений (то есть , в составе белков, нуклеиновых кислот, жиров, углеводов и др.). В свободном состоянии водород встречается крайне редко; в небольших количествах содержится в вулканических и других природных газах. В атмосфере присутствуют следовые количества свободного водорода (0,0001% по количеству атомов).В околоземном пространстве Водород в виде потока протонов образует внутренний («протонный») радиационный пояс Земли. В космосе водород — самый распространенный элемент. В виде плазмы он составляет примерно половину массы Солнца и большинства звезд, основную массу газов межзвездной среды и газовых туманностей. Водород присутствует в атмосфере ряда планет и комет в виде свободного H 2, метана CH 4, аммиака NH 3, воды H 2 O и радикалов. В виде потока протонов Водород входит в состав корпускулярного излучения Солнца и космических лучей.
Существует три изотопа водорода:
а) легкий водород — протий,
б) тяжелый водород — дейтерий (D),
в) сверхтяжелый водород — тритий (Т).
Тритий — нестабильный (радиоактивный) изотоп; поэтому в природе он практически не встречается. Дейтерий стабилен, но его очень мало: 0,015% (от массы всего земного водорода).
Валентность водорода в соединениях
В соединениях водород проявляет валентность I.
Физические свойства водорода
Простое вещество водород (Н 2) — газ легче воздуха, бесцветный, без запаха, без вкуса, тюк = — 253 0 С, водород не растворим в воде, горюч. Водород можно собрать, вытеснив воздух из пробирки или воды. В этом случае трубку необходимо перевернуть вверх дном.
Производство водорода
В лабораторных условиях водород получают в результате реакции
Zn + H 2 SO 4 = ZnSO 4 + H 2.
Вместо цинка можно использовать железо, алюминий и некоторые другие металлы, а вместо серной кислоты можно использовать некоторые другие разбавленные кислоты. Образующийся водород собирается в пробирке путем вытеснения воды (см. Рис. 10.2 б) или просто в перевернутой колбе (рис. 10.2 а).
В промышленности водород в больших количествах получают из природного газа (в основном метана) путем его взаимодействия с водяным паром при 800 ° C в присутствии никелевого катализатора:
CH 4 + 2H 2 O = 4H 2 + CO 2 (t, Ni)
или уголь обрабатывают при высокой температуре водяным паром:
2H 2 O + C = 2H 2 + CO 2.(т)
Чистый водород получают из воды разложением ее электрическим током (электролиз):
2H 2 O = 2H 2 + O 2 (электролиз).
Водород (калька с латинского: лат. Hydrogenium — гидро = «вода», gen = «генерирующий»; Hydrogenium — «генерирующий воду»; обозначается символом H) — первый элемент периодической таблицы элементов. . Широко распространен в природе. Катион (и ядро) наиболее распространенного изотопа водорода 1 H — это протон.Свойства ядра 1 H позволяют широко использовать спектроскопию ЯМР для анализа органических веществ.
Три изотопа водорода имеют собственные названия: 1 H — протий (H), 2 H — дейтерий (D) и 3 H — тритий (радиоактивный) (T).
Простое вещество водород — H 2 — легкий бесцветный газ. Он легко воспламеняется и взрывоопасен при смешивании с воздухом или кислородом. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
Рассказ
Выделение горючего газа при взаимодействии кислот и металлов наблюдалось в 16-17 веках на заре становления химии как науки.Михаил Васильевич Ломоносов тоже прямо указал на его отделение, но уже определенно понимая, что это не флогистон. Английский физик и химик Генри Кавендиш исследовал этот газ в 1766 году и назвал его «горючий воздух». При сгорании «горючий воздух» производил воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье вместе с инженером Ж. Менье с помощью специальных газовых счетчиков в 1783 году синтезировал воду, а затем проанализировал ее, разлагая водяной пар раскаленным железом.Таким образом, он установил, что «горючий воздух» входит в состав воды и может быть получен из нее.
происхождение названия
Лавуазье дал водороду название гидроген (от древнегреческого ὕδωρ — вода и γεννάω — рожаю) — «рожаю воду». Русское название «водород» было предложено химиком М. Ф. Соловьевым в 1824 году — по аналогии с «кислородом» М. В. Ломоносова.
Распространенность
Во Вселенной
Водород — самый распространенный элемент во Вселенной.На его долю приходится около 92% всех атомов (8% — атомы гелия, доля всех остальных элементов, вместе взятых, составляет менее 0,1%). Таким образом, водород — основная составляющая звезд и межзвездного газа. В условиях звездных температур (например, температура поверхности Солнца ~ 6000 ° C) водород существует в виде плазмы; В межзвездном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, которые значительно различаются по размеру, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1% — это десятый элемент по распространенности. Однако его роль в природе определяется не массой, а количеством атомов, доля которых среди других элементов составляет 17% (второе место после кислорода, доля атомов которого составляет ~ 52%). Следовательно, значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и значение кислорода. В отличие от кислорода, который существует на Земле как в связанном, так и в свободном состоянии, практически весь водород на Земле находится в форме соединений; только очень небольшое количество водорода в виде простого вещества содержится в атмосфере (0.00005% по объему).
Водород входит в состав почти всех органических веществ и присутствует во всех живых клетках. В живых клетках водород составляет почти 50% от числа атомов.
Получение
Промышленные методы получения простых веществ зависят от формы, в которой соответствующий элемент встречается в природе, то есть от того, какое сырье может быть использовано для его производства. Итак, кислород, который имеется в свободном состоянии, получают физическим способом — путем отделения от жидкого воздуха.Практически весь водород находится в виде соединений, поэтому для его получения используются химические методы. В частности, можно использовать реакции разложения. Одним из способов получения водорода является реакция разложения воды электрическим током.
Основным промышленным способом получения водорода является реакция метана с водой, которая входит в состав природного газа. Его проводят при высокой температуре:
CH 4 + 2H 2 O = CO 2 + 4H 2 −165 кДж
Одним из лабораторных методов получения водорода, который иногда используется в промышленности, является разложение воды с помощью электрический ток.Обычно в лаборатории водород получают при взаимодействии цинка с соляной кислотой.
Распространенность в природе. В. широко распространен в природе; его содержание в земной коре (литосфере и гидросфере) составляет 1% по массе и 16% по числу атомов. В. входит в состав самого распространенного на Земле вещества — воды (11,19% В. по массе), в составе соединений, входящих в состав углей, нефти, природных газов, глин, а также организмов животных и растений ( т.е. в составе белки, нуклеиновые кислоты, жиры, углеводы и т. д.). В свободном состоянии В. встречается крайне редко; в небольших количествах он содержится в вулканических и других природных газах. Незначительные количества свободного V. (0,0001% по количеству атомов) присутствуют в атмосфере. В околоземном пространстве В. в виде потока протонов образует внутренний («протонный») радиационный пояс Земли. В космосе В. — самый распространенный элемент. В виде плазмы он составляет примерно половину массы Солнца и большинства звезд, основную массу газов межзвездной среды и газовых туманностей.В. присутствует в атмосфере ряда планет и в кометах в виде свободного h3, метана Ch5, аммиака Nh4, воды h3O, таких радикалов, как CH, NH, OH, SiH, PH и др. В виде поток протонов, В. входит в состав корпускулярного излучения Солнца и космических лучей.
Изотопы, атомы и молекулы. Обычный V. состоит из смеси двух стабильных изотопов: легкого V. или протия (1H) и тяжелого V. или дейтерия (2H или D). В природных водородных соединениях на атом 2H приходится в среднем 6800 атомов 1H.Искусственно получен радиоактивный изотоп, сверхтяжелый В., или тритий (3Н, или Т), с мягким β-излучением и периодом полураспада Т1 / 2 = 12,262 года. В природе тритий образуется, например, из атмосферного азота под действием нейтронов космических лучей; в атмосфере он незначителен (4-10-15% от общего количества атомов V.). Был получен крайне нестабильный изотоп 4H. Массовые числа изотопов 1H, 2H, 3H и 4H соответственно 1,2, 3 и 4 указывают на то, что ядро атома протия содержит только 1 протон, дейтерий — 1 протон и 1 нейтрон, тритий — 1 протон и 2 нейтрона. , 4H — 1 протон и 3 нейтрона.Большая разница в массах изотопов V. вызывает более заметное различие их физических и химических свойств, чем в случае изотопов других элементов.
Атом V. имеет самую простую структуру среди атомов всех остальных элементов: он состоит из ядра и одного электрона. Энергия связи электрона с ядром (потенциал ионизации) составляет 13,595 эВ. Нейтральный атом Б. может также присоединить второй электрон, образуя отрицательный ион H-; в этом случае энергия связи второго электрона с нейтральным атомом (сродство к электрону) равна 0.78 эВ. Квантовая механика позволяет вычислить все возможные уровни энергии атома B. и, следовательно, дать полную интерпретацию его атомного спектра. Атом V. используется как модельный при квантово-механических расчетах уровней энергии других, более сложных атомов. Молекула B. h3 состоит из двух атомов, связанных ковалентной химической связью. Энергия диссоциации (т. Е. Распада на атомы) составляет 4,776 эВ (1 эВ = 1,60210-10-19 Дж). Межатомное расстояние в положении равновесия ядер равно 0.7414-Å. При высоких температурах молекулярная В. диссоциирует на атомы (степень диссоциации 0,0013 при 2000 ° С, 0,95 при 5000 ° С). Атомарный В. также образуется в различных химических реакциях (например, при действии Zn на соляную кислоту). Однако существование В. в атомарном состоянии длится недолго; атомы рекомбинируют в молекулы h3.
Физико-химические свойства. В. — самое легкое из всех известных веществ (в 14,4 раза легче воздуха) с плотностью 0.0899 г / л при 0 ° C и 1 атм. V. кипит (сжижается) и плавится (затвердевает) при -252,6 ° C и -259,1 ° C соответственно (только гелий имеет более низкие температуры плавления и кипения). Критическая температура Б. очень низкая (-240 ° С), поэтому его разжижение сопряжено с большими трудностями; критическое давление 12,8 кгс / см2 (12,8 атм), критическая плотность 0,0312 г / см3. Из всех газов В. имеет самую высокую теплопроводность, равную 0,174 Вт / (м-К) при 0 ° С и 1 атм, то есть 4,16-0-4 кал / (с-см-° С).Удельная теплоемкость V. при 0 ° C и 1 атм Cp составляет 14,208-103 Дж / (кг-К), т.е. 3,394 кал / (г-° C). Б. слабо растворим в воде (0,0182 мл / г при 20 ° С и 1 атм), но хорошо — во многих металлах (Ni, Pt, Pd и др.), Особенно в палладии (850 объемов на 1 объем Pd). … Растворимость В. в металлах связана с его способностью диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава из-за взаимодействия углерода с углеродом (так называемая декарбонизация).Жидкость В. очень легкая (плотность при -253 ° C 0,0708 г / см3) и текучая (вязкость при -253 ° C 13,8 сПуаз).
В большинстве соединений валентность (точнее, степень окисления) +1, как у натрия и других щелочных металлов; обычно его рассматривают как аналог этих металлов, товарную позицию 1 гр. системы Менделеева. Однако в гидридах металлов ион водорода заряжен отрицательно (степень окисления -1), то есть гидрид Na + H- построен как хлорид Na + Cl-. Этот и некоторые другие факты (близость физических свойств В.и галогены, способность галогенов замещать V. в органических соединениях) дают основание отнести V. также к VII группе Периодической таблицы (подробнее см. Периодическую таблицу элементов). В обычных условиях молекулярный В. сравнительно мало активен, непосредственно соединяясь только с наиболее активными из неметаллов (с фтором, на свету и с хлором). Однако при нагревании вступает в реакцию со многими элементами. Атомная В. обладает повышенной химической активностью по сравнению с молекулярной.С кислородом Б. образует воду: h3 + 1 / 2O2 = h3O с выделением 285,937-103 Дж / моль, то есть 68,3174 ккал / моль тепла (при 25 ° С и 1 атм). При обычных температурах реакция идет крайне медленно, выше 550 ° C — со взрывом. Пределы взрываемости водородно-кислородной смеси (по объему) от 4 до 94% h3, а водородно-воздушной смеси — от 4 до 74% h3 (смесь 2-х объемов h3 и 1-го объема O2 называется детонирующий газ). В. используется для восстановления многих металлов, так как забирает кислород из их оксидов:
CuO + h3 = Cu + h3O,
Fe3O4 + 4h3 = 3Fe + 4h3O и т. Д.
С галогенами В. образует галогениды водорода, например:
h3 + Cl2 = 2HCl.
В то же время В. взрывается фтором (даже в темноте и при -252 ° С), реагирует с хлором и бромом только при освещении или нагревании, а с йодом — только при нагревании. В. взаимодействует с азотом с образованием аммиака: 3х3 + N2 = 2Nh4 только на катализаторе и при повышенных температурах и давлениях. При нагревании В. бурно реагирует с серой: h3 + S = h3S (сероводород), значительно труднее с селеном и теллуром.Б. может реагировать с чистым углеродом без катализатора только при высоких температурах: 2х3 + С (аморфный) = Ч5 (метан). В. непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и др.), Образуя гидриды: h3 + 2Li = 2LiH. Большое практическое значение имеют реакции углерода с монооксидом углерода, в которых образуются различные органические соединения, например, HCHO, Ch4OH и другие, в зависимости от температуры, давления и катализатора (см. Окись углерода). Реакция взаимодействия непредельных углеводородов и V., переходящие в насыщенные, например: Cnh3n + h3 = Cnh3n + 2 (см. Гидрирование).
Водород — самый распространенный химический элемент во Вселенной. Это своего рода отправная точка, потому что в периодической таблице ее атомный номер равен единице. Человечество надеется узнать больше об этом как об одном из наиболее возможных транспортных средств в будущем. Водород — самый простой, легкий, самый распространенный элемент, его везде много — семьдесят пять процентов от общей массы вещества.Он содержится в любой звезде, особенно много водорода в газовых гигантах. Его роль в реакциях звездного термоядерного синтеза является ключевой. Без водорода нет воды, а значит, нет жизни. Все помнят, что в молекуле воды есть один атом кислорода, а в нем два атома — водорода. Это хорошо известная формула H 2 O.
Как мы ее используем
Водород открыл в 1766 году Генри Кавендиш, когда он анализировал реакцию окисления металла. После нескольких лет наблюдений он понял, что в процессе горения водорода образуется вода.Ранее ученые выделяли этот элемент, но не считали его самостоятельным. В 1783 году водород получил название водород (в переводе с греческого «гидро» — вода, а «ген» — рожать). Элемент, образующий воду, — водород. Это газ, молекулярная формула которого H 2. Если температура близка к комнатной, а давление нормальное, этот элемент незаметен. Водород не может быть уловлен даже человеческими органами чувств — он безвкусный, бесцветный, без запаха. Но под давлением и при температуре -252.87 C (очень холодно!), Это сжиженный газ. Так он хранится, так как в виде газа занимает гораздо больше места. В качестве топлива используется жидкий водород.
Водород может стать твердым, металлическим, но для этого требуется сверхвысокое давление, и этим сейчас занимаются самые выдающиеся ученые — физики и химики. Уже сейчас этот элемент служит альтернативным топливом для транспорта. Его использование похоже на то, как работает двигатель внутреннего сгорания: при сжигании водорода выделяется много его химической энергии.Практически разработан и метод создания топливного элемента на его основе: при соединении с кислородом происходит реакция, благодаря которой образуются вода и электричество. Возможно, скоро транспорт вместо бензина «перейдет» на водород — многие автопроизводители заинтересованы в создании альтернативных горючих материалов, есть и успехи. Но чисто водородный двигатель еще впереди, здесь много сложностей. Однако преимущества таковы, что создание топливного бака с твердым водородом идет полным ходом, и ученые и инженеры не собираются отступать.
Основная информация
Водород (лат.) — водород, первый порядковый номер в периодической таблице, обозначается H. Атом водорода имеет массу 1,0079, это газ, который при нормальных условиях не имеет вкуса, ни запаха, ни цвета. Химики с шестнадцатого века описывали один горючий газ под разными названиями. Но у всех это оказалось в одинаковых условиях — когда на металл действует кислота. В течение многих лет сам Кавендиш называл водород просто «горючим воздухом».Только в 1783 году Лавуазье путем синтеза и анализа доказал сложный состав воды, а четыре года спустя дал современное название «горючему воздуху». Корень этого сложного слова широко используется, когда необходимо назвать соединения водорода и любые процессы, в которых он участвует. Например, гидрирование, гидрид и тому подобное. А русское название было предложено в 1824 году М. Соловьевым.
В природе распределение этого элемента не имеет себе равных. В литосфере и гидросфере земной коры его масса составляет один процент, а атомов водорода целых шестнадцать процентов.Самая обычная вода на Земле, и 11,19% по массе в ней — водород. Он также определенно присутствует почти во всех соединениях, из которых состоят нефть, уголь, все природные газы и глина. Водород есть во всех организмах растений и животных — в составе белков, жиров, нуклеиновых кислот, углеводов и так далее. Свободное состояние для водорода нетипично и почти не встречается — его очень мало в природных и вулканических газах. Абсолютно незначительное количество водорода в атмосфере — 0.0001%, по количеству атомов. С другой стороны, целые потоки протонов представляют собой водород в околоземном пространстве, он состоит из внутреннего радиационного пояса нашей планеты.
Космос
В космосе ни один элемент не встречается так часто, как водород. Объем водорода в составе элементов Солнца составляет более половины его массы. Большинство звезд образуют водород, который находится в форме плазмы. Основная часть различных газов в туманностях и в межзвездной среде также состоит из водорода.Он присутствует в кометах, в атмосфере ряда планет. Естественно, не в чистом виде, либо в виде свободного H 2, затем в виде метана CH 4, затем в виде аммиака NH 3, даже в виде воды H 2 O. Радикалы CH, NH, SiN, OH, PH и т.п. очень распространены. . Как поток протонов водород входит в состав корпускулярного солнечного излучения и космических лучей.
В обычном водороде смесь двух стабильных изотопов — это легкий водород (или протий 1 H) и тяжелый водород (или дейтерий — 2 H или D). Есть и другие изотопы: радиоактивный тритий — 3 H или T, иначе — сверхтяжелый водород.А также очень нестабильный 4 Н. В природе соединение водорода содержит изотопы в следующих пропорциях: на один атом дейтерия приходится 6800 атомов протия. Тритий образуется в атмосфере из азота, на который влияют нейтроны космических лучей, но в незначительном количестве. Что обозначают массовые числа изотопов? На рисунке показано, что в ядре протия есть только один протон, а у дейтерия в ядре атома есть не только протон, но и нейтрон. Тритий в ядре имеет два нейтрона на один протон.Но 4 N содержит три нейтрона на протон. Поэтому физические свойства и химические свойства изотопов водорода сильно отличаются по сравнению с изотопами всех других элементов — разница в массах слишком велика.
Строение и физические свойства
Строение атома водорода наиболее простое по сравнению со всеми остальными элементами: одно ядро - один электрон. Потенциал ионизации — энергия связи ядра с электроном — 13.595 электрон-вольт (эВ). Именно из-за простоты этой структуры атом водорода удобен в качестве модели в квантовой механике, когда необходимо вычислить уровни энергии более сложных атомов. В молекуле h3 есть два атома, которые связаны химической ковалентной связью. Энергия распада очень высока. Атомарный водород может образовываться в таких химических реакциях, как цинк и соляная кислота. Однако взаимодействия с водородом практически нет — атомарное состояние водорода очень короткое, атомы сразу рекомбинируют в молекулы h3.
С физической точки зрения водород легче всех известных веществ — более чем в четырнадцать раз легче воздуха (вспомните воздушные шары, улетающие на праздники — у них внутри только водород). Однако он умеет кипятить, разжижать, плавить, затвердевать, и только гелий кипит и плавится при более низких температурах. Его сложно разжижить, нужна температура ниже -240 градусов по Цельсию. Но у него очень высокая теплопроводность. Он почти не растворяется в воде, но взаимодействие с водородом металлов отличное — растворяется почти во всем, лучше всего в палладии (на один объем водорода уходит восемьсот пятьдесят объемов).Жидкий водород легкий и текучий, и когда он растворяется в металлах, он часто разрушает сплавы из-за взаимодействия с углеродом (например, сталью), происходит диффузия и декарбонизация.
Химические свойства
В соединениях по большей части водород имеет степень окисления (валентность) +1, как натрий и другие щелочные металлы. Он считается их аналогом, стоящим во главе первой группы системы Менделеева. Но ион водорода в гидридах металлов отрицательно заряжен со степенью окисления -1.Также этот элемент близок к галогенам, которые даже способны заменять его в органических соединениях. Это означает, что водород можно отнести к седьмой группе системы Менделеева. В нормальных условиях молекулы водорода не отличаются активностью, соединяясь только с наиболее активными неметаллами: хорошо с фтором, а если легкие — с хлором. Но при нагревании водород становится другим — вступает в реакцию со многими элементами. По сравнению с молекулярным водородом атомарный водород очень активен химически, потому что вместе с кислородом образуется вода, а энергия и тепло выделяются в процессе.При комнатной температуре эта реакция идет очень медленно, но при нагревании выше пятисот пятидесяти градусов происходит взрыв.
Водород используется для восстановления металлов, поскольку он забирает кислород из их оксидов. Вместе с фтором водород образует взрыв даже в темноте при температуре минус двести пятьдесят два градуса по Цельсию. Хлор и бром возбуждают водород только при нагревании или освещении, а йод — только при нагревании. Водород с азотом образует аммиак (именно так производится большинство удобрений).При нагревании очень активно взаимодействует с серой, и получается сероводород. Теллур и селен трудно реагировать с водородом, в то время как чистый углерод реагирует при очень высоких температурах с образованием метана. С угарным газом водород образует различные органические соединения, здесь влияют давление, температура, катализаторы, и все это имеет большое практическое значение. И вообще роль водорода, как и его соединений, чрезвычайно велика, так как он придает кислотные свойства протонным кислотам.Водородная связь образуется со многими элементами, что влияет на свойства как неорганических, так и органических соединений.
Получение и использование
Водород получают в промышленных масштабах из природных газов — горючих, коксовых, газов нефтепереработки. Его также можно получить электролизом, если электричество не слишком дорогое. Однако наиболее важным методом производства водорода является каталитическое взаимодействие углеводородов, в основном метана, с водяным паром при конверсии.Также широко используется метод окисления углеводородов кислородом. Извлечение водорода из природного газа — самый дешевый метод. Два других — это использование коксового газа и нефтеперерабатывающего газа — водород выделяется, когда остальные компоненты сжижаются. Они легче поддаются сжижению, а для водорода, как мы помним, нужно -252 градуса.
Перекись водорода очень популярна. Лечение этим раствором применяется очень часто. Молекулярную формулу H 2 O 2 вряд ли назовут все те миллионы людей, которые хотят быть блондинками и осветлить волосы, а также те, кто любит чистоту на кухне.Даже те, кто лечит царапины от игры с котенком, часто не осознают, что используют водородную обработку. Но всем известна история: с 1852 года водород долгое время использовался в воздухоплавании. Дирижабль, изобретенный Генри Джиффардом, был основан на водороде. Их называли цеппелинами. Бурное развитие авиастроения вытеснило дирижаблей с небес. В 1937 году произошла крупная авария, когда сгорел дирижабль «Гинденбург». После этого случая цеппелины больше не использовались.Но в конце восемнадцатого века воздушные шары, наполненные водородом, получили широкое распространение. Помимо производства аммиака, сегодня водород необходим для производства метилового спирта и других спиртов, бензина, гидрогенизированного тяжелого нефтяного топлива и твердого топлива. При сварке, резке металлов без водорода не обойтись — он может быть кислородно-водородным и атомарным. А тритий и дейтерий дают жизнь ядерной энергии. Как мы помним, это изотопы водорода.
Неумывакин
Водород как химический элемент настолько хорош, что не мог не иметь своих поклонников.Иван Павлович Неумывакин — доктор медицинских наук, профессор, лауреат Государственной премии, у него еще много званий и наград, в том числе. Как врач традиционной медицины он был признан лучшим народным целителем России. Именно он разработал многие методы и принципы оказания медицинской помощи космонавтам в полете. Именно он создал уникальный госпиталь — госпиталь на борту космического корабля. В то же время он был государственным координатором в области косметической медицины. Космос и косметика.Его страсть к водороду направлена не на то, чтобы заработать большие деньги, как сейчас в отечественной медицине, а, наоборот, на то, чтобы научить людей лечить что угодно буквально копеечными средствами, без дополнительных посещений аптек.
Он продвигает лечение препаратом, который есть буквально в каждом доме. Это перекись водорода. Можно сколько угодно критиковать Неумывакина, он все равно будет настаивать на своем: да, действительно, перекисью водорода можно вылечить буквально все, потому что она насыщает внутренние клетки организма кислородом, разрушает токсины, нормализует кислотную и щелочную баланс, и отсюда регенерируются ткани, весь организм.Пока никто не видел излеченных перекисью водорода, тем более исследованных, но Неумывакин утверждает, что с помощью этого средства можно полностью избавиться от вирусных, бактериальных и грибковых заболеваний, предотвратить развитие опухолей и атеросклероза, победить депрессию, омолодить организм и никогда не заболеет ОРВИ и простудными заболеваниями.
Panacea
Иван Павлович уверен, что при правильном применении этого простейшего препарата и при соблюдении всех простых инструкций можно победить многие заболевания, среди которых есть очень серьезные.Список огромен: от пародонта и тонзиллита до инфаркта миокарда, инсультов и сахарного диабета. Такие мелочи, как гайморит или остеохондроз, улетают с первых сеансов лечения. Даже раковые опухоли пугаются и спасаются от перекиси водорода, потому что стимулируется иммунитет, активизируется жизнь организма и его защитные силы.
Так можно лечить даже детей, только беременным лучше воздерживаться от перекиси водорода. Также этот метод не рекомендуется людям с пересаженными органами из-за возможной несовместимости тканей.Дозировку нужно строго соблюдать: от одной капли до десяти, добавляя по одной каждый день. Трижды в день (тридцать капель трехпроцентного раствора перекиси водорода в день, ух!) За полчаса до еды. Раствор можно вводить внутривенно и под наблюдением врача. Иногда перекись водорода комбинируют для более эффективного действия с другими лекарствами. Внутрь раствор применяют только в разбавленном виде — с чистой водой.
Внешне
Компрессы и полоскания еще до того, как профессор Неумывакин создал свои методы, были очень популярны.Всем известно, что, как и спиртовые компрессы, перекись водорода в чистом виде использовать нельзя, потому что она обожжет ткани, а бородавки или грибковые поражения смазывают местно и крепким раствором — до пятнадцати процентов.
При кожных высыпаниях, при головных болях также проводят процедуры, в которых участвует перекись водорода. Компресс следует делать хлопчатобумажной тканью, смоченной в растворе двух чайных ложек трехпроцентной перекиси водорода и пятидесяти миллиграммов чистой воды.Накройте ткань фольгой и оберните шерстью или полотенцем. Время действия компресса от четверти часа до полутора часов утром и вечером до выздоровления.
Мнение врачей
Мнения разделились, не всех удивляют свойства перекиси водорода, более того, им не только не верят, над ними смеются. Среди врачей есть и те, кто поддержал Неумывакина и даже подхватил развитие его теории, но их меньшинство.Большинство врачей считают такой план лечения не только неэффективным, но и зачастую разрушительным.
Действительно, пока нет ни одного официально доказанного случая, когда бы пациент вылечился перекисью водорода. При этом нет информации об ухудшении самочувствия в связи с применением этого метода. Но драгоценное время потеряно, и человек, получивший одно из тяжелых заболеваний и полностью положившийся на панацею Неумывакина, рискует опоздать к началу своего настоящего традиционного лечения.
Водород — самый первый элемент в Периодической таблице химических элементов, имеет атомный номер 1 и относительную атомную массу 1,0079. Каковы физические свойства водорода?
Физические свойства водорода
В переводе с латыни водород означает «рождение воды». Еще в 1766 году английский ученый Дж. Кавендиш собрал «горючий воздух», выделяющийся при действии кислот на металлы, и начал изучать его свойства. В 1787 году А. Лавуазье определил этот «горючий воздух» как новый химический элемент, входящий в состав воды.
Рис. 1. А. Лавуазье.
Водород имеет 2 стабильных изотопа — протий и дейтерий, а также радиоактивный — тритий, количество которого на нашей планете очень мало.
Водород — самый распространенный элемент в космосе. Основным элементом Солнца и большинства звезд является водород. Также этот газ входит в состав воды, нефти, природного газа. Общее содержание водорода на Земле составляет 1%.
Рис. 2. Формула водорода.
Атом этого вещества включает ядро и один электрон.Когда электрон теряется из водорода, он образует положительно заряженный ион, то есть проявляет металлические свойства. Но также атом водорода способен не только терять, но и присоединять электрон. В этом он очень похож на галогены. Следовательно, водород в Периодической таблице принадлежит как к I, так и к VII группам. В нем более ярко выражены неметаллические свойства водорода.
Молекула водорода состоит из двух атомов, связанных ковалентной связью
В нормальных условиях водород представляет собой бесцветный газообразный элемент без запаха и вкуса.Он в 14 раз легче воздуха, а его температура кипения составляет -252,8 градуса по Цельсию.
Таблица «Физические свойства водорода»
Помимо физических свойств водород также обладает рядом химических свойств. При нагревании или под действием катализаторов водород реагирует с металлами и неметаллами, серой, селеном, теллуром, а также может восстанавливать оксиды многих металлов.
Производство водорода
Из промышленных способов получения водорода (кроме электролиза водных растворов солей) следует отметить следующие:
- пропускание водяного пара через раскаленный уголь при температуре 1000 градусов:
- конверсия метана водяным паром при температуре 900 градусов:
CH 4 + 2H 2 O = CO 2 + 4H 2
Рис.3. Паровая конверсия метана.
- разложение метана в присутствии катализатора (Ni) при температуре 400 градусов:
Презентация химии по теме «Общие характеристики неметаллов и их соединений». Презентация по теме «Неметалла» скачать презентацию по химии неметаллов
Неметаллы: общие характеристики.
Ремене С.А.,
учитель химии Маура Сош №58 КГО
Образовательный портал «Мой университет» -www.moi-universitet.ru Факультет «Реформа образования» -www.edu-reformma.ru
Неметаллическая позиция в ППО
Особенности атомной структуры неметаллов
Малый атомный радиус
На внешнем уровне 4-8 электронов
Находится только в основных подгруппах
Характеризуется высоким значением ЭО
Физические свойства Простые вещества
Агрегатное состояние
Gaza
Liquid
Solid
NOT, N 2, H 2,
Cl 2, O 2, O 3
Немметалов цвет
ФИОЛЕТОВЫЙ
PHOSPHORUS
СЕРЫ
БЕСЦВЕТНЫЕ
УГЛЕРОДА
Немметалов цвет
PHOSPHORUS
PHOSPHORUS
ГРАФИТ
Желто-зеленый
ХЛОР
Типы кристаллических решеток
Молекулярная решетка
Частицы в узлах решетки
Атомная решетка
Молекулы
Связь между частицами
Слабые межмолекулярные взаимодействия
0003
0002 сера
Углерод (алмаз)
Прочность по Малайе
Низкие температуры кипения и плавления
Высокие температуры кипения и плавления
Высокая летучесть
Аллотропия
- Различные типы кристаллических решеток
P — Фосфор
Красный фосфор — атомарный
Белый фосфор — молекулярный
Аллотропия
- Различная структура кристаллических решеток
C — углерод
Тетраэдр
Слоистый
Аллотропия
- Различный состав молекул
O — кислород
Кислород
Озон
- Голубой газ с резким запахом
- Пахнет свежестью
- Появляется после грозы
Озон в природе
Содержится в воздухе сосновых лесов и морского побережья
- Задерживает ультрафиолетовые лучи, разрушительно воздействующие на клетки живых организмов
- Озоновый слой расположен на высоте 20-25 км
Самостоятельная работа
Агрегатное состояние
Название
Газообразный
Список неметаллов: около 2 , As, cl 2 , п, н 2 , Ф. 2 , Br. 2 , C, S
Цвет Nem
Название
Фиолетовый
Список неметаллов: S, P, Cl 2 , Br. 2 , И. 2
Тип кристаллической решетки
Название
Молекулярная
Список неметаллов: О КОМПАНИИ 2 , В, около 3 , C, N 2 , с.
Сравнительные характеристики аллотропных модификаций кислорода
Признаки сравнения
Аллотропные модификации кислорода
Кислород
Качественный состав
Количественный состав
Физические свойства
Химические свойства
Химические свойства
Находка в природе
Заполните таблицу
В конце 18 века А.Лавуазье
я установил тот воздух —
не простое вещество.
смесь газов
Составные части воздуха
Постоянно
Случайно
Переменные
Заполните схему
- Оксиды серы и азота
- Необходим для дыхания
- Участвует в выветривании горных пород и почвообразовании
- Азот, аргон и кислород уходят из воздуха
1. В III группу PSHE входят неметаллы:
2. Число электронов на внешнем электронном слое атомов неметаллов:
3. К неметаллам не относятся газообразные:
4. Для какого неметалла характерен красный цвет?
5. К постоянным частям воздуха не относятся:
- Пришла гостья из космоса, в воздухе она оказалась
- Он безжизненное призвание, но жизнь без него не создается
- Хотя многие вещества превращаются в яд, в химии он достоин всех наград
- Его отряды бесчисленны, которые он формирует, в них есть изменения, которым имя легиона находится в чистом виде — черный, темный, неплавкий и едва горит, как кристалл прозрачный, в котором трясется солнце.
Задачи урока: дополнить знания о распространении неметаллов в природе. Чтобы добавить знания о распространении неметаллов в природе. Рассмотрим явление аллотропии на примере кислорода, серы, углерода, фосфора. Рассмотрим явление аллотропии на примере кислорода, серы, углерода, фосфора. Выясните причины отличительных свойств аллотропных модификаций. Выясните причины отличительных свойств аллотропных модификаций.Сформировать представление о зависимости качественных и количественных характеристик веществ на примере кислорода и озона. Сформировать представление о зависимости качественных и количественных характеристик веществ на примере кислорода и озона.
Неметаллы в природе встречаются самородные неметаллы N 2 и O 2 (в воздухе), сера (в земной коре), но чаще неметаллы в природе находятся в химически родственной форме. В первую очередь это вода и растворенные в ней соли, затем минералы и горные породы (например, различные силикаты, алюмосиликаты, фосфаты, бораты, сульфаты и карбонаты).В природе есть самородные неметаллы N 2 и O 2 (в воздухе), сера (в земной коре), но чаще неметаллы находятся в природе в химически родственной форме. В первую очередь это вода и растворенные в ней соли, затем минералы и горные породы (например, различные силикаты, алюмосиликаты, фосфаты, бораты, сульфаты и карбонаты). По преобладанию в земной коре неметаллы занимают самые разные места: от трех самых распространенных элементов (O, Si, H) до очень редких (AS, SE, I, TE). По преобладанию в земной коре неметаллы занимают самые разные места: от трех самых распространенных элементов (O, Si, H) до очень редких (AS, SE, I, TE).
Обнаружение галогенов в природе: Фтор-F 2 Флюорит -caf 2 фтор-F 2 Флюорит -caf 2 хлор-Cl 2 Каменный золь- NaCl Хлор-Cl 2 Каменный золь- NaCl Сильвинит -накл * KCL Сильвинит -накл * KCL йод- j 2 йод-J 2 Морская вода, водоросли, буровые установки Морская вода, водоросли, Бром-Br 2 бромные буровые воды в аналогичных соединениях, вместе с хлором в аналогичных соединениях, вместе с кристаллами хлорида хлорида — минерал Галит
Allhotropiy Allhotropia (от DR-греч.Αλλος «Другой», τροπος «поворот, свойство») Существование одного и того же химического элемента в виде двух и более простых веществ, различных по структуре и свойствам: так называемые аллотропные модификации или аллотропные формы. Аллотропия (от DR-греч. Αλλος «Другой», τροπος «Вращать, Свойство») Существование одного и того же химического элемента в виде двух и более простых веществ, различных по структуре и свойствам: так называемые аллотропные модификации или аллотропные формы. .
Перед тем как сфотографировать различные вещества, найдите среди них Неметаллу, попробуйте угадать, о каком неметалло идет речь, объясните свой выбор.
Задачи урока:
- Получите представление о простых веществах — неметаллах;
- Познакомьтесь с общими физическими свойствами неметаллов и явлением аллотропии;
- Научитесь определять принадлежность веществ к неметаллам;
Проверьте свою домашнюю работу.
1. Где в периодической системе находятся элементы, соответствующие этим металлам?
4. Какие из веществ, упомянутых в приведенном ниже стихотворении, не применимы к металлам?
Семь металлов создали свет
По количеству семи планет:
Медь, железо, серебро …
Дали нам место на добре.
Златто, Олово, Свинец …
Мой сын, сера — их отец.
И вы должны знать:
Все они ртуть родная мать.
Изучение новой темы.
«Простые вещества — неметаллы. Аллотропия»
- Неметаллы — Это химические элементы, образующие в свободном виде простые вещества, не обладающие физическими свойствами металлов.
Периодическая система химических элементов Д.И. Менделеев
Группы элементов
Кислород
Бериллий
Алюминий
Марганец
Германий
Технеций
Стронций
Палладий
0003000300030003000200030002000300030003000300030002000300030002 Сибрид000 Сибрид000 Сибирский
00030002
Nemetalla
Газообразное
Жидкое
Твердое
Газообразные вещества Неметалла:
- О КОМПАНИИ 2 —
- Н. 2 —
- Высота 2 —
- Кл. 2 —
- F. 2 —
благородные газы:
- Инертные газы
- Каждая молекула инертного газа состоит из одного атома.
- Покажите, как распределены электроны в атомах гелия и неона.
He. —
Ne —
AR —
Кр. —
Xe. —
РН. —
- He. — Ne — AR — Кр. — Хе. — РН. —
- He. — Ne — AR — Кр. — Хе. — РН. —
- He. — Ne — AR — Кр. — Хе. — РН. —
- He. — Ne — AR — Кр. — Хе. — РН. —
Структура внешнего электронного слоя из атомов гелия и неона
Твердые тела:
Аллотропия — способность атомов одного химического элемента образовывать несколько простых веществ.
Причины аллотропии:
- Различное количество атомов в молекуле;
- Образование различных кристаллических форм.
Модификации кислородные.
- O 2 — кислород;
- бесцветный газ;
- не пахнет;
- плохо растворим в воде;
- точка кипения — 182,9 с;
- стабильная молекула.
- О 3 — озон;
- голубой газ;
- имеет резкий запах;
- растворяется в 10 раз лучше, чем кислород;
- точка кипения -111.9 с;
- нестабильная молекула.
Всеготропия фосфора. Красный и белый фосфор
R 4
(красный фосфор)
Аллотропия углерода.
Положение границы между металлами и неметаллами.
Выполните задачу.
- 1 опция
- О КОМПАНИИ 2 — кислород, газ;
- P 4 —
- I 2 —
- betta SN —
- H 2 —
- F 2 —
- Вариант 2
- О КОМПАНИИ 3 -Один газовый;
- альфа SN —
- N 2 —
- Cl 2 —
- Br 2 —
Проверьте ответы.
- 1 опция
- О КОМПАНИИ 2 — кислород, газ;
- П 4 — фосфор белый твердый;
- I 2 — твердый йод
- SI — твердый кремний
- betta SN — Белое олово, металл, скольжение;
- He — гелий, благородный газ;
- H 2 — водород, газ;
- F 2 — фтор, газ.
- Вариант 2
- О КОМПАНИИ 3 -Один газовый;
- П — фосфор красный твердый;
- C — углерод, цельный;
- alpha SN — олово серое, неметалл, порошок;
- Ne — неон, благородный газ;
- N 2 — азот, газ;
- Cl 2 — хлор, газ;
- Br 2 — бром жидкий.
Критерии оценки
- 8 правильных ответов — «5»;
- 7,6 откликов — «4»;
- 5,4 правильных ответов — «3»;
- Менее 4 правильных ответов — «2»;
Слайд 1.
Презентация ученика 9б класса химии гимназии №24. И.А. Крылова Сергеева Ирина на тему «Неметалла. Мышьяк»Clade 2.
Мышьяк Характеристики мышьякового элемента (ARSENICUM) — химического элемента с атомным номером 33 в периодической системе D.И. РЕМЕЕЛЕЕВ, обозначается символом AS. Порядковый номер — 33 заряда ядра = +33 Количество электронов = 33 относительный атомный вес = 74,92 (≈ 75) Номер периода — IV Количество электронных уровней = 4 Номер группы — V, основная подгруппа Количество электронов на последний уровень = 5 электронный паспорт 1с²2S²2P63S²3P63D104S²4P³ Электроэнергия — 2,18 (по шкале Полинга) Возможные степени окисления = -3, 0, +3, +5Слайд 3.
Исторические факты, как известно, являются мышьяком с глубокой древности: 1.В трудах Диоскара (I в. Н.э.) упоминается о прокаливании вещества, которое сейчас называется серой мышьяк; 2. В III-IV вв. В отрывочных записях, приписываемых Зозиму (египетскому или греческому алхимику), есть упоминание о металлическом мышьяке; 3. Греческий писатель Олимпиодора (V в. Н.э.) описывает производство белого сульфида мышьяка обжигом; 4. В VIII в. Арабский алхимик Гебере получил триоксид мышьяка; 5. В средние века люди начали сталкиваться с трехокись мышьяка при переработке мышьякосодержащих руд, и белый дым газообразный AS2O3 был назван рудным дымом; Диоскрид ГеберСлайд 4.
6. Получение свободного металлического мышьяка приписывается немецкому алхимику Альбертону БольштоТе и относится примерно к 1250 году, хотя греческие и арабские алхимики несомненно получили мышьяк (нагревая его трок с органическими веществами) раньше, чем самый крупный; 7. В 1733 году было доказано, что белый мышьяк — это «земля», металлический оксид мышьяка; 8. В 1760 году француз Луи Клод Гадо получил первую органическую миссию мышьяка, известную как жидкость када или оксида «подобного»; Формула этого вещества [(Ch4) 2AS] 2O; 9.В 1775 году Карл Вильгельм Шелеле получил мышьяковую кислоту и мышьяковый водород; 10. В 1789 году Антуан Лоран Лавозье признал мышьяк независимым химическим элементом. Альберт Фон Большестт К.В. Шелеле А.Л. ЛавуазьеСлайд 5.
Мышьяк — это вещество серебристо-серого или оловянно-белого цвета, в свежем виде с металлическим блеском. Но в воздухе он быстро тускнеет. Это хрупкая полуметаллическая сталь из стали (находится в периодической системе на границе между металлами и неметаллами, поэтому называется «полуметаллом»).Для мышьяка, как и для других полуметаллов, характерно образование ковалентной кристаллической решетки и наличие металлической проводимости. Но все же мышьяк-неметалл. Физические свойства: 1. При нагревании выше 600 ° C мышьяк нарушается без плавления и под давлением 37 атм. Плавится при 818 ° С. 2. Плотность (с п. У.) — 5,73 г / см³ (серый мышьяк) 3. Температура кипения = 876 К (Кельвин) внешний вид простого вещества.Слайд 6.
Аллотропные модификации мышьяка Несмотря на то, что мышьяк относится к неметаллам, он имеет 4 аллотропные модификации, белый, желтый, черный и металлический (или серый) мышьяк.Последние 2 обладают свойствами металлов. 1. Серый мышьяк представляет собой хрупкую кристаллическую массу серо-стального цвета с металлическим блеском, который на воздухе быстро исчезает из-за окисления поверхностного слоя. 2. Черный мышьяк — самая стойкая форма — черный порошок, как и большинство металлов, в тонком (очень маленьком, который может проходить через сито) состоянии (вспомните подвижное серебро). В отличие от серого вида устойчив на воздухе, но при 2859 ° C переходит в серую форму. Черный мышьяк серый мышьяк (металлик)Слайд 7.
Находящийся в природе мышьяк — это рассеянный элемент. Содержание в земной коре 1,7 × 10-4% по массе. В морской воде 0,003 мг / л. Это вещество может находиться в нативном состоянии, иметь форму металлических блестящих серых оболочек или плотных масс, состоящих из мелких зерен. Известно около 200 арсенинговых минералов. В небольших количествах он часто содержится в свинцовых, медных и серебряных рудах. Нередко встречаются два природных соединения мышьяка с серой: оранжево-красный прозрачный настоящий карт ASS и лимонно-желтый Auripigmentation AS2S3.Минерал, имеющий промышленное значение — Arsenopyritis (Arsenic Cherdan) Feass или Fes2 Feas2 (46% AS), также дает мышьяковый кедан — луллингит (Feas2) (72,8% AS), побеги FEASO4 (27 — 36% AS). Большая часть мышьяка добывается путем переработки мышьякосодержащих золотых, свинцово-цинковых, медицинских и других руд. Hells LöllingitСлайд 8.
Арсенопирит Realgar Auripigment представляет собой тонкую (толщиной 2 мм) кристаллическую корку самородного мышьяка на контакте размещения Доломитовых Альп с вмещающим гнейсом (камнем).Родной мышьяк. Воронцовское месторождение золота. Северный Урал. Почка самородного мышьяка на стене карбонатной резиденции в рудной бране.Слайд 9.
Получение мышьяка мышьяк получают в промышленности при нагревании мышьякового кчедана: FeasS = Fes + AS или (реже) при восстановлении угля AS2O3. Оба процесса ведутся в ретортах из огнеупорной глины, подключенных к ресиверу для конденсации паров мышьяка. Ангидрид мышьяка получают путем окислительного обжига мышьяковистой руды или как побочный продукт обжига полиметаллических руд, почти всегда содержащих мышьяк.При окислительном обжиге образуются пары AS2O3, которые конденсируются в камерах улавливания. Сырой AS2O3 очищается сублимацией при 500-600 ° C. Очищенный AS2O3 служит для производства мышьяка и входящих в него лекарств. В настоящее время для получения металлического мышьяка арсенопирит в муфельных печах чаще всего нагревают без доступа воздуха. При этом освобождается мышьяк, пары которого конденсируются и превращаются в твердый мышьяк в железных трубах, выходящих из печей, и в специальных керамических приемниках. Остаток в печах затем нагревается при доступе воздуха, после чего мышьяк превращается в AS2O3.Металлический мышьяк получается в относительно небольших количествах, а основная часть мышьяковой руды перерабатывается в белый мышьяк, то есть триоксид мышьяка — ангидрид мышьяка AS2O3. Схема муфельной печи реторты из огнеупорной глиныClade 10.
Химические свойства мышьяка с галогенами мышьяка напрямую связаны; в нормальных условиях ASF5 — газ; ASF3, ASCL3, ASB3 — бесцветные легколетучие жидкости; ASI3 и AS2I4 — красные кристаллы. При нагревании мышьяка с серым получают сульфиды: оранжево-красный AS4S4 и лимонно-желтый AS2S3.Бледно-желтый сульфид AS2S5 осаждается при переходе h3S в охлаждаемый льдом раствор мышьяковой кислоты (или ее солей) в дымящейся соляной кислоте: 2h4Aso4 + 5h3S = AS2S5 + 8h3O; Примерно 500 ° C разлагается на AS2S3 и серу. Все сульфиды мышьяка нерастворимы в воде и разбавленных кислотах. Сильные окислители (смеси HNO3 + HCl, HCl + KCLO3) переводят их в смесь h4Aso4 и h3SO4. Сульфид AS2S3 легко растворяется в аммонии и щелочных металлах и щелочных полисульфидах, образуя кислоты — тиомишамист h4Ass3 и Tiomyshiac h4Ass4.Сера (порошок)Clade 11.
Мышьяк-яд в сознании многих слов «яд» и «мышьяк» тождественен. Так уже было исторически. Известны истории о ядах Клеопатры. В Риме славились саранчовые луга. Обычный инструмент для устранения яда политических и других противников был также в средневековых итальянских республиках. В Венеции, например, на дворе держали государственные специалисты. А основным компонентом практически всех ядов был мышьяк. В России закон, запрещающий беспроцентное и янтарное масло, крепкую водку, мышьяк и цибух, был опубликован еще при Анне Иоанновне — в январе 1733 года закон был предельно строгим и гласил: «Кто дальше будет мышьяк и проч. Материалы будут торговать и пока поймали или кому будет сообщено, торговля будет жестоким наказанием и будет ссылка на ссылку без всякой пощады, личность будет выполнена и те, кто в аптеках и мэрии куплю.И если кто-то, ныряя в воду с такими ядовитыми материалами, устранит ущерб, причиненный людям, такой поиск не будет осуществлен, но смерть будет казнена, в зависимости от важности дела нет необходимости. «Мышьяковый яд (Яд» АРЗЕНИЧНЫЙ) Императрица Анна Иоанновна.Слайд 12.
На протяжении веков соединение мышьяка привлекало (и продолжает привлекать) внимание фармацевтов, токсикологов и судебных экспертов. Признать отравление мышьяком безошибочно узнали криминологи.Если в желудке отравленного обнаруживаются белые порфорамические зерна, то в первую очередь с подозрением относятся к ангидриду мышьяка AS2O3. Эти крупинки вместе с кусочками угля помещают в стеклянную трубку, герметизируют ее и нагревают. Если в трубке есть AS2O3, то на холодных частях трубки появляется серо-черное блестящее кольцо металлического мышьяка. После охлаждения конец трубки закрывают, уголь удаляют, а серо-черное кольцо нагревают. В то же время кольцо перегоняется до свободного конца трубки, давая загадочный белый ангидрид.Реакции здесь: AS2O3 + 3C → AS2 + 3CO или 2AS2O3 + 3C → 2AS2 + 3CO2; 2AS2 + 3O2 → 2AS2O3. Получившаяся белая вспышка помещается под микроскоп: при небольшом увеличении видны характерные блестящие кристаллы в виде октаэдров (многогранный кристалл). Октахэдра видСлайд 13.
Симптомы отравления Симптомы отравления мышьяком — металлический привкус во рту, рвота, сильные боли в животе. Позже судороги, паралич, смерть. Самым известным и общедоступным противоядием при отравлении мышьяком является молоко, а точнее основной белок молока казеин, образующий с мышьяком нерастворимое соединение, не всасывающееся в кровь.Мышьяк в виде неорганических препаратов смертелен в дозах 0,05-0,1 г., и тем не менее мышьяк присутствует во всех растительных и животных организмах. (Это доказано французскими учеными-орфологами в 1838 году). Морские растительные и животные организмы содержат в среднем сотни, а пресноводные и наземные — миллионы процентов мышьяка. Микрочастицы мышьяка поглощаются клетками человеческого тела, элемент № 33 содержится в крови, тканях и органах; Особенно много его в печени — от 2 до 12 мг на 1 кг веса.Ученые предполагают, что микроиндозы мышьяка повышают устойчивость организма к действию вредоносных микробов. Мать Джозефа Орфила Молоко — один из антифлов при отравлении мышьяком (!)Слайд 14.
Мышьяк мышьяка используется в стоматологии для лечения пульпы (ткани, содержащей нервы, кровеносные и лимфатические сосуды). Мировую известность приобрел Сальварсан, 606-й препарат Пауля Эрлиха — немецкого врача, открытого в начале XX века. Первое эффективное средство борьбы с ЛУЭС (сифилис-венерическим инфекционным заболеванием).Это действительно был 606-й из протестированных препаратами Эрлиха мышьяка. Лишь в 50-е годы, когда Салварсан уже перестал применяться как средство против ЛУЭС, малярии, возвратного тифа, советский ученый М.Я. Крафт установил свою истинную формулу (доказал, что она имеет полимерную структуру). Другие препараты мышьяка, в частности более эффективные и менее токсичные, и другие также используются для замены сальварсана: новарсенол, маирсенол и др. Применяются в медицинской практике и некоторые неорганические соединения мышьяка. Ангидрид мышьяка AS2O3, арсенит калия KASO2, гидроахенат натрия Na2HA4 · 7h3O (в минимальных дозах) — окислительные процессы в организме, усиливают кроветворение.Те же вещества — что и на открытом воздухе — назначают при определенных кожных заболеваниях. Это мышьяк и его соединения приписывают лечебное действие некоторым минеральным водам. Формула Сальварсана Пауля ЭрлихаСлайд 15.
Другое применение мышьяка Самой перспективной областью применения мышьяка, несомненно, является полупроводниковая техника. Особое значение в нем имеют арсениды Галлии Гааса и Индии INAS. Арсенид галлий также важен для нового направления электронной техники — электроники, которое возникло в 1963-1965 годах на стыке физики твердого тела, оптики и электроники.Этот материал помог создать новые полупроводниковые лазеры. Мышьяк используется как легирующая добавка, которая придает «классическим» полупроводникам — Si, GE — проводимость определенного типа. В этом полупроводнике так называемый «переходный слой» создается в полупроводнике, и, в зависимости от назначения кристалла, он легируется таким образом, чтобы получить этот слой на разной глубине. (Например, для изготовления диодов его «заглубляют»; а если из полупроводниковых кристаллов будут делать солнечные панели, то глубина «переходного слоя» будет не более одного микрона.) Мышьяк как ценная добавка используется в цветной металлургии. Таким образом, добавление 0,15-0,45% мышьяка в медь увеличивает ее прочность на разрыв, твердость и коррозионную стойкость при работе в тяжелых условиях. Кроме того, мышьяк увеличивает текучесть меди при разливке, облегчает волочение проволоки. Добавляют мышьяк и свинец, в некоторые разновидности бронзы, латуни, типографских сплавов. При этом мышьяк очень часто вредит металлургу — его присутствие в руде наносит вред производству.Вредны вдвойне: во-первых, для здоровья людей, во-вторых, для металла — значительные примеси мышьяка ухудшают свойства почти всех металлов и сплавов. Сульфидные соединения мышьяка — аурапигимент и реальгар — используются в покраске в покраске и в кожевенной промышленности. как средство для удаления волос с кожи. Пиротехнический реальгар используется для получения «греческого» или «индийского» огня, возникающего при сжигании смеси реальгара с серым и селутира (яркое белое пламя). Многие соединения мышьяка в очень малых дозах используются в качестве лекарств для борьбы с анемией и рядом серьезных заболеваний, поскольку они оказывают клинически значимое стимулирующее действие на ряд функций организма, в частности, на кровотечение.Краска для пиротехники с лазерным диодомСлайд 16.
Мышьяк в организме как микроэлерантный мышьяк широко распространен в дикой природе. Среднее содержание мышьяка в почвах 4 · 10-4%, в золе растений — 3 · 10-5%. Содержание мышьяка в морских организмах выше, чем в почве (у рыб 0,6-4,7 мг в 1 кг сырого вещества, накапливается в печени). Среднее содержание мышьяка в организме человека составляет 0,08-0,2 мг / кг. В крови мышьяк концентрируется в красных кровяных тельцах, где он связывается с молекулой гемоглобина.Наибольшее его количество (на 1 г ткани) находится в почках и печени. Много мышьяка содержится в легких и селезенке, коже и волосах; Сравнительно немного — в спинномозговой жидкости, головном мозге (в основном гипофизе), зародышах и др. Мышьяк участвует в окислительно-восстановительных реакциях: окислительном распаде сложных углеводов, ферментации, гликолизе и т. Д. Соединения мышьяка используются в биохимии в качестве специфических ингибиторов ферментов для изучения метаболических реакций. Поражение ладона (1), руки и ноги (2) мышьяк, фотографии людей, пораженных мышьякомСлайд 17.
Интересные факты о мышьяке и знаете ли вы, что … 1. В западных странах мышьяк был известен в основном как сильный яд, в то же время в традиционной китайской медицине его использовали почти две тысячи лет для лечения сифилиса и псориаза. Теперь врачи доказали, что мышьяк положительно влияет и на борьбу с лейкемией. Китайские ученые обнаружили, что мышьяк атакует белки, ответственные за рост раковых клеток. 2. Древние стеклянные черви также знают, что триоксид мышьяка делает стекло «глухим», т.е.е. непрозрачный. Однако небольшие добавки этого вещества, наоборот, осветляют стекло. Мышьяк и сейчас входит в рецепты некоторых стаканов, например, «Венского» стакана для термометров и твиста. 3. Удивительные цианобактерии обитают на востоке американского озера Моно на востоке американского штата Калифорния. При фотосинтезе они используют не кислород, а мышьяк, ядовитый почти для всех других форм жизни. Возможно, именно с них начался процесс фотосинтеза на нашей планете, а позже появился тот фотосинтез, который снабжает всех нас кислородом и энергией.Arsenic Lake Mono Сбор образца в одной из луж, на дне которой используются фотосинтезирующие мышьяк цианобактерии.Слайд 18.
Википедия Ссылки Популярная библиотека химических элементов Газета «Фармацевтический бюллетень»Неметаллы в природе. В природе самородные неметаллы N2 и O2 (в воздухе), сера (в земной коре) встречаются в природе, но чаще неметаллы в природе находятся в химически связанной форме. В первую очередь это вода и растворенные в ней соли, затем минералы и горные породы (например, различные силикаты, алюмосиликаты, фосфаты, бораты, сульфаты и карбонаты).По преобладанию в земной коре неметаллы занимают самые разные места: от трех самых распространенных элементов (O, Si, H) до очень редких (AS, SE, I, TE).
Слайд 3. Из презентации «Химия неметаллов» . Размер архива с презентацией 1449 КБ.Химический класс 9.
Резюме других презентаций«Химия неметаллов» — это химическая структура и свойства металлов и неметаллов. Аллотропия углерода. Положение металлов в периодической системе химических элементов.Презентация урока химии для 9 класса. Неметаллы в природе. Неметаллы. Красный фосфор. Тема: Неметалла. Кислород. М. Аллхотропия. Физические свойства неметаллов. Бриллиант. Almothlands также включает водород n и инертные газы. Общие характеристики и свойства неметаллов.
«Немметалла» — ряд электроотрицательных неметаллов. Твердый углеродный кремний. Чем объясняется разнообразие агрегатного состояния неметаллов. Сетка) Красный фосфор — белый фосфор (строение молекул P2 и P4).Как вы думаете, в таблице больше металлов или неметаллов? Контрольная работа. Неметаллы. Примеры: Алмаз — Графит (КРИСТ. Учитель 9 класса химии Кулешова С.Е. жидкий бром. Аллотропия. Какие наиболее активные и сильные неметаллы. O2 O2 и Озон O3. Агрегатное состояние. Газообразный кислород, водород. Физические свойства.
Галогены. Химия — биологическая роль хлора. Результаты исследований. Ферменты становятся активными в кислой среде при 37-38 ° C. Результаты исследования распространяются в природе. Участвует в образовании соляной кислоты, метаболизме, построении тканей.Заключение и рекомендации. МЕТЛА БИОЛОГИЧЕСКАЯ РОЛЬ. Растворение бромида натрия в водно-желтом осадке AgrBr ?. Цели и задачи. Результаты исследования Открывающий галоген. Перспективы проекта. 2011, С.Петропавловское.
«Химия алкадиенов» — алкадиены с изолированными двойными связями. Гибридизация центрального атома C-SP3. Урок химии в 9 классе Учитель: Л.В. Док. Актуализация ранее полученных знаний. Схема строения Аллена. Алькадиен: Строительство, Номенклатура, Гомологи, Изомериус.Игра. Экстремальная гибридизация атома C-SP2. Алкадианы с кумулятивными двойными связями. Номенклатура алкадиенов. Конъюгированные алкадианы.
«Химическое равновесие» — Задача 2: Напишите кинетические уравнения для химических реакций. Необратимо. Изменение скорости прямой и обратной реакции в процессе установления химического равновесия. Химическое равновесие. ВР = Воб. Задача 1: Отправьте факторы, влияющие на скорость химических реакций. I Вариант реализации HCl + O2? h3O + CL2. Химические реакции.II версия h3S + SO2? S + h3O. Реверсивный.
«Характеристики металла» — использование металлов в жизни человека. Свойства металлов. Общие характеристики. Хорошая электропроводность. Общие характеристики металлов. Поиск металлов в природе. Металлическая разновидность. Другие металлы вызывают коррозию, но не ржавеют. Металлы составляют одну из основ цивилизации на планете Земля. Ржавчина и коррозия металлов. Металлы. Содержание работы: из медицинских препаратов, содержащих благородные металлы, лаппис чаще всего, протаргол и др.
.
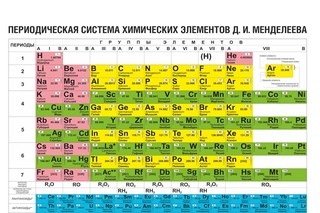
 О 2 +1 Факс 2 -1 ).
О 2 +1 Факс 2 -1 ).