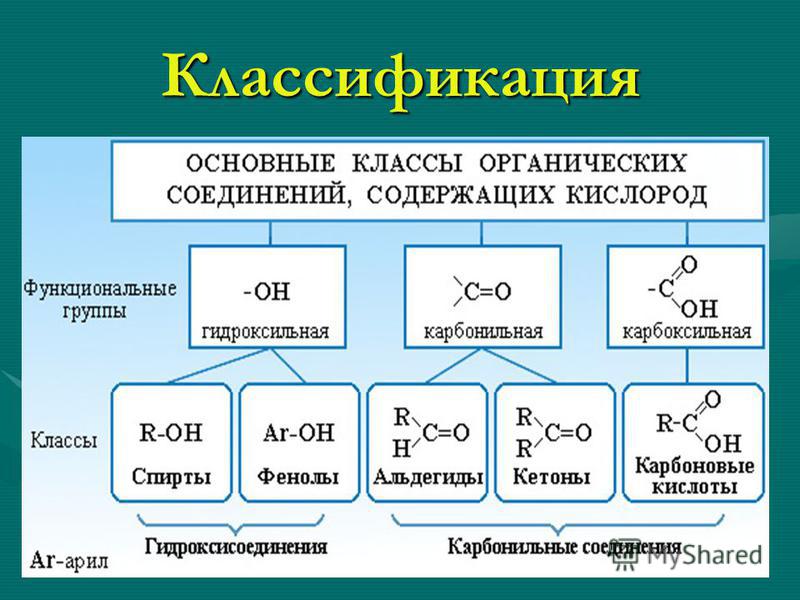
Внеклассный урок — Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ
Генетическая связь – это связь между веществами, которые относятся к разным классам.
Основные признаки генетических рядов:
1. Все вещества одного ряда должны быть образованы одним химическим элементом.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам химических веществ.
3. Вещества, образующие генетический ряд элемента, должны быть связаны между собой взаимопревращениями.
Таким образом, генетическим называют ряд веществ, которые представляют разные классы неорганических соединений, являются соединениями одного и того же химического элемента, связаны взаимопревращениями и отражают общность происхождения этих веществ.
Для металлов выделяют три ряда генетически связанных веществ, для неметаллов — один ряд.
1. Генетический ряд металлов, гидроксиды которых являются основаниями (щелочами):
металл → основный оксид → основание (щелочь) → соль.
Например, генетический ряд кальция:
Ca → CaO → Ca(OH)2 → CaCl2
2. Генетический ряд металлов, которые образуют амфотерные гидроксиды:
соль
↑
металл → амфотерный оксид → (соль) → амфотерный гидроксид
↓
cоль
Например: ZnCl2
↑
Zn → ZnO → ZnSO4 → Zn(OH)2
(H2ZnO2) ↓
Na2ZnO2
Оксид цинка с водой не взаимодействует, поэтому из него сначала получают соль, а затем гидроксид цинка.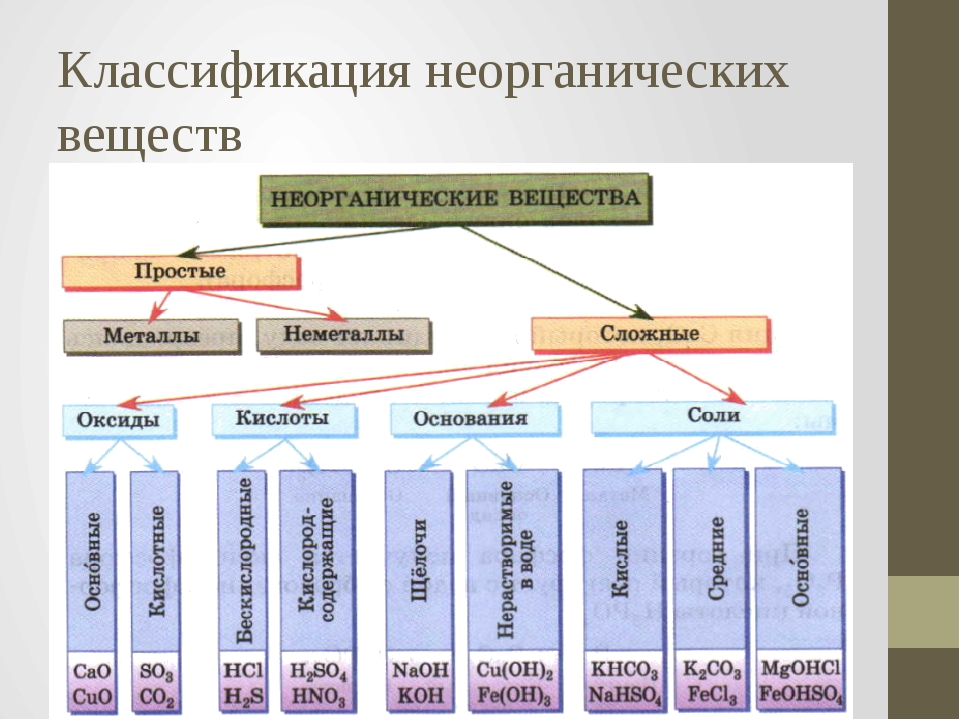 Так же поступают, если металлу соответствует нерастворимое основание.
Так же поступают, если металлу соответствует нерастворимое основание.
3. Генетический ряд неметаллов (неметаллы образуют только кислотные оксиды):
неметалл → кислотный оксид → кислота → соль
Например, генетический ряд фосфора:
P → P2O5 → H3PO4 → K3PO4
Переход от одного вещества к другому осуществляется с помощью химических реакций.
Урок химии по теме «Основные классы неорганических соединений». 8-й класс
Цель урока:
- формирование познавательных, коммуникативных, регулятивных универсальных учебных действий;
- обобщение и систематизация знаний обучающихся об основных классах неорганических веществ, их классификации, составе и номенклатуре.
Результаты обучения:
Предметные:
- Критический уровень:формулировать определения основных классов неорганических соединений, распознавать химические вещества по классам, давать названия веществам.

- Достаточный уровень: владеть критическим уровнем; знать классификацию веществ внутри класса, объяснять принадлежность веществ к определённому классу, уметь самостоятельно составлять простейшие химические формулы веществ.
- Творческий уровень: владеть достаточным уровнем, уметь самостоятельно решать экспериментальные задачи на идентификацию неорганических соединений.
Познавательные УУД.
- Критический уровень: ученик из указанного источника зафиксировал информацию и воспроизвёл её.
- Достаточный уровень: ученик из нескольких источников зафиксировал информацию, сделал вывод и привёл хотя бы один аргумент для его подтверждения.
- Творческий уровень: ученик самостоятельно организовал поиск информации, охарактеризовал основные источники, сделал вывод на основе анализа нескольких аргументов.
Коммуникативные УУД
- Критический уровень: ученик отвечает на вопросы с помощью товарищей или учителя по заданному алгоритму.
- Достаточный уровень: ученик самостоятельно дает односложные ответы по заданному алгоритму, взаимодействует с членами группы, договорившись о процедуре.
- Творческий уровень: ученик самостоятельно дает развернутый аргументированный ответ, обобщает результаты обсуждения в группе.
Регулятивные УУД
- Критический уровень: ученик понял цели и задачи деятельности, организовал свои действия с помощью товарищей или учителя, высказал своё мнение о проделанной работе.
- Достаточный уровень: ученик сформировал цели и задачи с помощью учителя, спланировал и организовал свою деятельность по готовому алгоритму, оценил результат и процесс деятельности.
- Творческий уровень: ученик самостоятельно сформировал цели и задачи деятельности, спланировал и организовал свою деятельность, сделал анализ результата и процесса деятельности.
Способы обучения: индивидуально-групповой способ, фронтальный способ.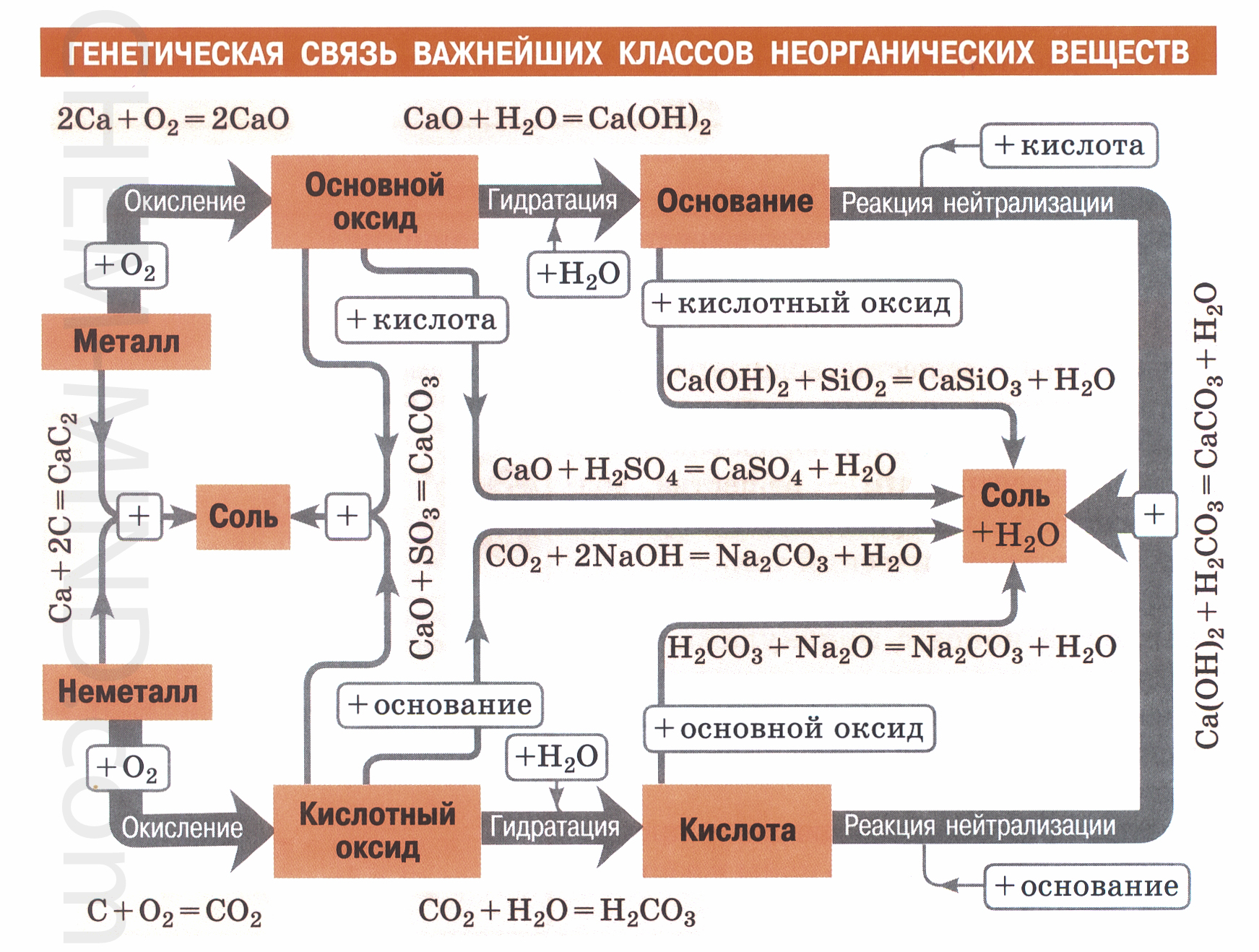
Средства обучения:
Ход урока
I. Исходная мотивация. Погружение в проблемуУчитель: Посмотрите, ребята, у меня на демонстрационном столе стоит много разных склянок. Что находится внутри каждой склянки?
Ученики: Химическое вещество.
Учитель: Мы с вами знаем, что по правилам техники безопасности каждая склянка должна быть подписана. Обратите внимание на этикетки склянок. Какой вывод мы можем сделать? Можно ли эти вещества каким-то образом рассортировать?
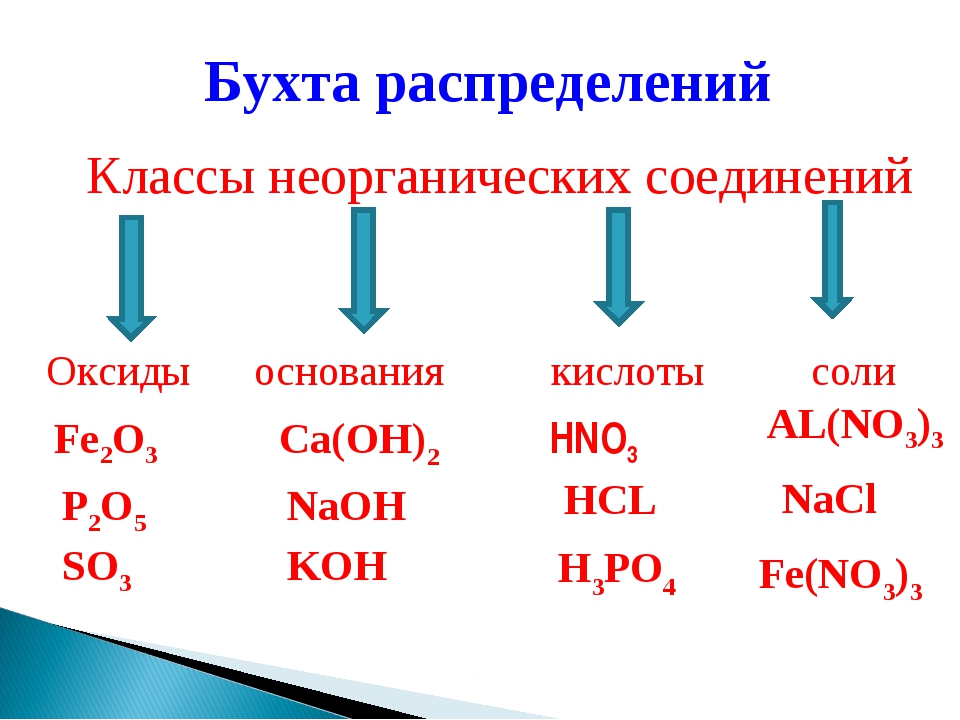
Ученики: Вещества относятся к разным классам неорганических веществ, мы можем, глядя на химическую формулу на этикетках распределить их на классы.
Учитель: Сколько классов веществ мы должны получить? Какие?
Ученики: 4; оксиды, основания, кислоты, соли.
Учитель: Следовательно, какая будет тема сегодняшнего урока?
Ученики: «Основные классы неорганических веществ».
Учитель: Мы уже изучили каждый класс веществ по отдельности. Что мы должны сделать на уроке сегодня?
Ученики: Обобщить знания обо всех четырёх классах неорганических веществ.
Учитель: Какие вопросы мы должны рассмотреть, чтобы достичь поставленной цели?
Ученики:
- Что такое оксиды, основания, кислоты, соли?
- Какие они бывают?
- Как правильно давать названия веществам разных классов?
- Как составлять химические формулы веществ?
Учитель: Ребята, вначале урока, каждый из вас взял карточку с названием одного класса неорганических веществ (оксиды, основания, кислоты, соли), таким образом, у нас образовалось 4 группы, в которых вам сегодня предстоит поработать.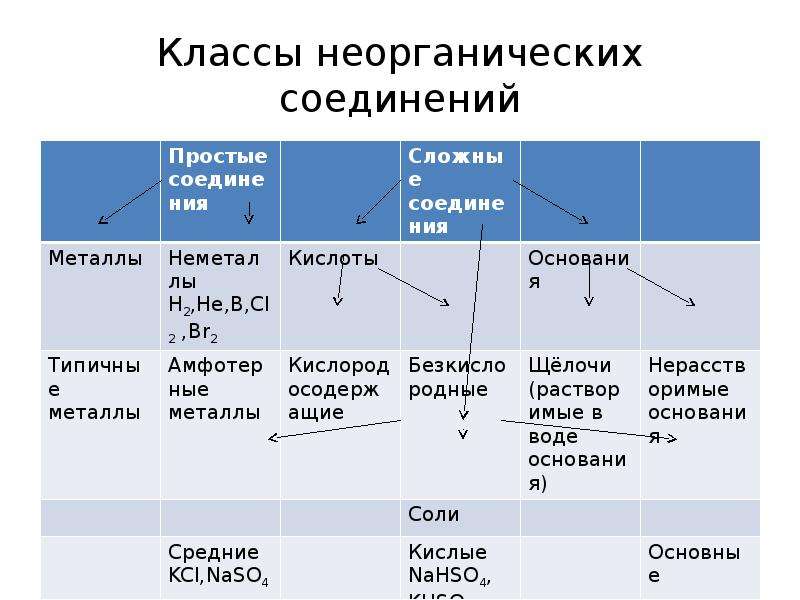 У каждой группы на столах лежит лист с заданиями и различные источники информации (учебники, справочники, схемы, таблицы, ваши рабочие тетради). Также, я вам предлагаю алгоритм работы. Если у вас возникнут вопросы, вы всегда можете получить консультацию у меня.
У каждой группы на столах лежит лист с заданиями и различные источники информации (учебники, справочники, схемы, таблицы, ваши рабочие тетради). Также, я вам предлагаю алгоритм работы. Если у вас возникнут вопросы, вы всегда можете получить консультацию у меня.
Алгоритм работы для обучающихся.
- Прочитайте внимательно предложенные вам задания.
- Обсудите ход выполнение заданий, составьте план работы вашей группы.
- Выполните задания, оформите результат работы.
- Представьте свою работу (подумайте, кто из вас будет отвечать по каждому заданию).
- Дайте оценку своей работе в группе и работе группы в целом.
Обучающиеся самостоятельно выполняют задания, предложенные учителем, используя по своему усмотрению различные источники информации, а также, опираясь на ранее полученные знания. Оформляют результаты деятельности.
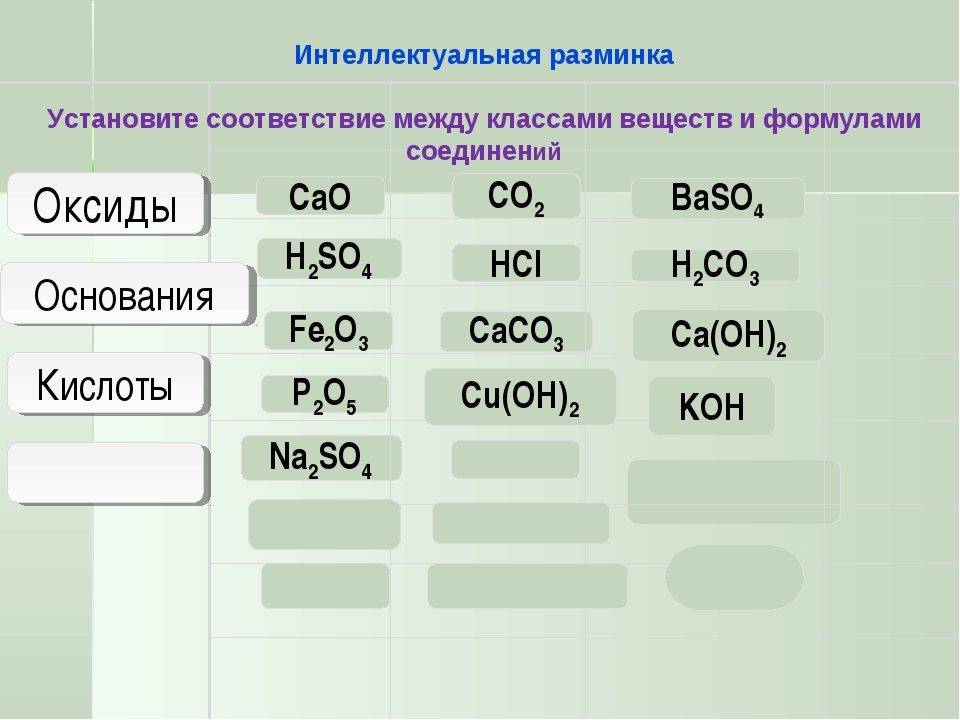
Задания для группы №1. Оксиды.
1. Проанализируйте предложенные вам формулы веществ и допишите определение, вставив пропущенные слова.
Оксиды – это _____ вещества, состоящие из _____ химических элементов, один из которых _____ , в степени окисления _____ .
Формулы: Na2O, CaO, SO2, P2O5, Al2O3.
2. Заполните схему, используя следующие понятия: «оксиды», «несолеобразующие оксиды», «кислотные оксиды», «основные оксиды», «солеобразующие оксиды». Приведите по три примера. Обоснуйте свой ответ.
3. Установите соответствие между формулами оксидов и их названиями.
Формулы оксидов | Названия оксидов |
1. P2O5 | А. Оксид серы (VI) |
Как даются названия веществам данного класса?
4. Составьте формулы:
1) оксидов железа, в которых металл проявляет степени окисления +2 и +3;
2) оксидов серы, в которых неметалл проявляет степени окисления +4 и +6.
5. В двух пронумерованных пробирках находятся оксид меди (II) и сажа. Как определить, в какой из пробирок находится оксид?
Задания для группы №2. Основания.
1. Даны формулы веществ, относящихся к классу оснований. Проанализируйте их, и допишите определения, вставив пропущенные слова.
Основания – это _____ вещества, состоящие из атомов _____ , связанных с одной или несколькими _____ .
Формулы: NaOH, Fe(OH)2, Ca(OH)2, KOH, Al(OH)3, Fe(OH)3
2. Записаны три ряда формул:
А. NaOH, Ba(OH)2, Cu(OH)2, KOH (таблица растворимости)
Б. Fe(OH)2, Pb(OH)2, LiOH, Ba(OH)2
В. LiOH, KOH, Al(OH)3, NaOH
LiOH, KOH, Al(OH)3, NaOH
В каждом ряду находиться одно лишнее основание. Определите его формулу, ответ обоснуйте.
3. Распределите формулы оснований, предложенных в первом задании, по соответствующим их названиям:
А. гидроксид кальция — …
В. гидроксид натрия — …
Г. гидроксид алюминия — …
Д. гидроксид железа (II) — …
Е. гидроксид калия — …
4. Пользуясь таблицей растворимости, составьте формулы трёх нерастворимых оснований и назовите их.
5. В трёх пробирках без этикеток находятся бесцветные растворы: №1 – соляная кислота, №2 – гидроксид натрия, №3 – вода. Как определить, в какой из них находится раствор щелочи?
Задания для группы №3. Кислоты.
1. Формулы: HCl, h3SO4, HNO3, h3CO3, h4PO4. Проанализируйте предложенные вам формулы веществ и допишите определение, вставив пропущенные слова:
Кислоты – это _____ вещества, молекулы которых состоят из атомов _____ и _____
2. Даны формулы кислот: H2S, HCl, HNO3, H2SO4, H3PO4, H2CO3, H2SO3, HClO 4. Распределите их по двум признакам на 2 и 3 группы соответственно. Ответ обоснуйте.
Даны формулы кислот: H2S, HCl, HNO3, H2SO4, H3PO4, H2CO3, H2SO3, HClO 4. Распределите их по двум признакам на 2 и 3 группы соответственно. Ответ обоснуйте.
3. Верны ли утверждения?
А. Азотная кислота имеет формулу HNO3.
Б. Формула соляной кислоты H2S.
В. H3PO4 – это фосфорная кислота.
Г. Вещество H2SO3 называется серная кислота.
Д. H2CO3 – это угольная кислота.
Е. Кремниевая кислота имеет формулу H2SiO3.
Ж. Хлороводородная кислота имеет формулу HCl.
З. Соединение H2SO4 называется сероводородная кислота.
4. Установите соответствие между формулами кислот и их названиями:
Формулы кислот | Названия кислот |
1. 2. h3SO4 3. HCl 4. h4PO4 5. h3SiO3 6. h3CO3 | А. Фосфорная кислота |
5. В трех пробирках без этикеток находятся бесцветные растворы: №1 – серная кислота, №2 – гидроксид калия, №3 – вода. Как определить, в какой из них находится кислота?
Задания для группы №4. Соли.
1. Даны формулы веществ: NaCl, K2CO3, BaSO4, Li3PO4. Проанализируйте их и допишите определение, вставив пропущенные слова.
Соли – это _____ вещества, состоящие из атомов _____ и _____ .
2. А. Даны формулы солей: K2SO4, KHSO4, CuCl2, NaHCO3, CuOHCl, FeS, Al(NO3)3, Fe(OH)2CL, BaSO4. Распределите их на три классификационные группы.
Б. Приведите по два примера растворимых и нерастворимых солей.
Приведите по два примера растворимых и нерастворимых солей.
3. Составьте формулы солей, которые можно получить при взаимодействии кислот и металлов, обозначенных в таблице (в скобках указаны степени окисления металлов).
Кислоты | Металлы | Названия солей, содержащих атомы алюминия | ||
К (+1) | Mg(+2) | Al (+3) | ||
HNO3 |
|
|
|
|
H2SO4 |
|
|
|
|
H3PO4 |
|
|
|
|
4. В трех пробирках без этикеток находятся бесцветные растворы: №1 – соляная кислота, №2 – гидроксид натрия, №3 – сульфат натрия. Как определить, в какой из них находится соль?
В трех пробирках без этикеток находятся бесцветные растворы: №1 – соляная кислота, №2 – гидроксид натрия, №3 – сульфат натрия. Как определить, в какой из них находится соль?
По истечении времени, отведенного на данную работу, каждая группа представляет свои результаты. Учащиеся других групп слушают ответы, задают уточняющие вопросы.
Учитель строит беседу, опираясь на проблемные вопросы, которые ученики поставили перед собой вначале урока. Каждая группа поочереди отвечает на каждый вопрос.
Модельные ответы.
Что такое оксиды, основания, кислоты, соли?
Задание 1. I группа.
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород, в степени окисления -2 .
Задание 1. II группа.
Основания – это сложные вещества, состоящие из атомов металлов, связанных с одной или несколькими гидроксильными группами OH.
Задание 1. III группа.
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Задание 1. IV группа.
Соли – это сложные вещества, состоящие из атомов металлов и кислотного остатка.
Какие они бывают? (классификация)
Задание 2. I группа.
Задание 2. II группа.
А. Cu(OH)2 – нерастворимое основание, остальные все растворимые (щелочи)
Б. LiOH – однокислотное основание, остальные – двухкислотные основания
В. Al(OH)3 – трехкислотное нерастворимое основание, остальные — однокислотные растворимые основания
Задание 2. III группа.
Бескислородные — H2S, HCl; кислородсодержащие — HNO3, H2SO4, h4PO4, H2CO3, H2SO3, HClO4.
Одноосновные — HCl, HNO3, HClO4; двухосновные — H2S, H2SO4, H2CO3, H2SO3; трехосновная — H3PO4 (по количеству атомов водорода).
Задание 2. IV группа.
А. Средние — K2SO4, CuCl2, FeS, Al(NO3)3, BaSO4; кислые — KHSO4, NaHCO3; основные – CuOHCl, Fe(OH)2CL.
Б. Растворимые соли — K2SO4, Al(NO3)3; нерастворимые соли — BaSO4, AgCl.
- Как правильно давать названия веществам разных классов?
- Как составлять химические формулы веществ?
Задание 3. I группа.
1. В
2. Г
3. Д
4. А
5. Б
Задание 3. II группа.
А. Ca(OH)2
Б. Fe(OH)3
В. NaOH
Г. Al(OH)3
Д. Fe(OH)2
Е. KOH
KOH
Задание 3. III группа.
А. Да
Б. Нет
В. Да
Г. Нет
Д. Да
Е. Да
Ж. Да
З. Нет
Задание 3. IV группа.
| Кислоты | Металлы | Названия солей, содержащих атомы алюминия | ||
К (+1) | Mg(+2) | Al (+3) | ||
HNO3 | KNO3 | Mg(NO3)2 | Al(NO3)3 | Нитрат алюминия |
H2SO4 | K2SO4 | MgSO4 | Al2(SO4)3 | Сульфат алюминия |
H3PO4 | K3PO4 | Mg3(PO4)2 | AlPO4 | Фосфат алюминия |
Задание 4. I группа.
I группа.
- FeO, Fe2O3
- SO4, SO3
Задание 4. II группа. (возможны другие варианты ответов)
- Al(OH)3 – гидроксид алюминия
- Cu(OH)2 – гидроксид меди (II)
- Fe(OH)2 – гидроксид железа (II)
Задание 4. III группа.
1. Г
2. В
3. Е
4. А
5. Б
6. Д
Как можно распознать вещества разных классов?
Задание 5. I группа.
В обе пробирки прилить раствор серной кислоты. С сажей кислота не взаимодействует, а в пробирке с оксидом меди (II) образуется голубой раствор.
CuO + H2SO4 → CuSO4 + H2O
Задание 5. II группа. (возможны другие варианты ответов)
Можно использовать универсальный индикатор: в кислоте он станет малинового цвета, в щелочи – синего, а в воде останется без изменений.
Задание 5. III группа. (возможны другие варианты ответов)
Можно использовать универсальный индикатор: в кислоте он станет малинового цвета, в щелочи – синего, а в воде останется без изменений.
Задание 4. IV группа.
Можно использовать универсальный индикатор: в кислоте он станет малинового цвета, в щелочи – синего, а в данной соли останется без изменений. Также можно использовать раствор хлорида бария: в пробирке, где находится соль выпадет белый порошкообразный осадок, в двух других ничего не произойдет.
Учитель: Теперь, ребята, давайте посмотрим, внимательно ли вы слушали друг друга. Задание для всех четырех групп: из перечисленных формул: H2S, K2SO4, NaOH, CO2, Fe(OH)3, Al2O3, Mg3(PO4)2, HNO3, CuCl2, Ba(OH)2, Na2O, H2CO3 выпишите последовательно формулы:
оксиды | основания | кислоты | соли |
|
|
|
|
Ответ:
| оксиды | основания | кислоты | соли |
CO2 | NaOH | H2S | K2SO4 |
Приложения
V.Учитель: Ребята, вы сегодня хорошо поработали, всем большое спасибо! В конце нашего урока, я предлагаю вам оценить свою работу и работу своих одноклассников. Для этого заполните, пожалуйста, таблицу, которая лежит у вас на столах и сдайте ее, а я посмотрю на результат.
Заполните только колонку 2, поставив х, там где вы считаете это нужно сделать.
1 | 2 | 3 |
я из указанного источника зафиксировал информацию и воспроизвёл её. |
|
|
я из нескольких источников зафиксировал информацию, сделал вывод и привёл хотя бы один аргумент для его подтверждения. |
|
|
я самостоятельно организовал поиск информации, охарактеризовал основные источники, сделал вывод на основе анализа нескольких аргументов. |
|
|
я ответил на вопросы с помощью товарищей или учителя по заданному алгоритму. |
|
|
я самостоятельно давал односложные ответы по заданному алгоритму, сотрудничал с членами группы, договорившись о процедуре. |
|
|
я самостоятельно дал развернутый аргументированный ответ, обобщил результаты обсуждения в группе. |
|
|
я понял цели и задачи деятельности, организовал свои действия с помощью товарищей или учителя, высказал своё мнение о проделанной работе. |
|
|
я сформировал цели и задачи с помощью учителя, спланировал и организовал свою деятельность по готовому алгоритму, оценил результат и процесс деятельности. |
|
|
я самостоятельно сформировал цели и задачи деятельности, спланировал и организовал свою деятельность, сделал анализ результата и процесса деятельности. |
|
|
Домашнее задание: повторить §18–21.
Список используемых ресурсов
- Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учреждений / О.С.Габриелян. – 12-е изд., стереотип. – М.: Дрофа, 2011.
- Габриелян О.С. Химия. 8 кл.: рабочая тетрадь к учебнику О.С.Габриеляна «Химия. 8 класс» / О.С.Габриелян, А.В.Яшукова. – 13-е изд., стереотип. – М. : Дрофа, 2011. – 192 с.: ил.
- Рябов М.А. Тесты по химии. Введение. Атомы химических элементов. Простые вещества. Соединения химических элементов: 8 класс: к учебнику О.С.Габриеляна «Химия. 8 класс» / М.А. Рябов, Е.
 Ю. Невская. – 2-е изд., перераб. и доп. – М.: Издательство «Экзамен», 2011. – 125 с. (Серия «Учебно-методический комплект»).
Ю. Невская. – 2-е изд., перераб. и доп. – М.: Издательство «Экзамен», 2011. – 125 с. (Серия «Учебно-методический комплект»). - Химия 8, 9 класс. Мультимедийное приложение к учебнику О.С.Габриеляна. Электронное учебное издание. ООО «Дрофа», 2011.
- http://school-collection.edu.ru/
- http://nsportal.ru/shkola/obshchepedagogicheskie-tekhnologii/
- https://urok.1sept.ru/
Урок 24. генетическая связь между основными классаминеорганических соединений. обобщение знаний по теме«основные классы неорганических соединений» — Химия — 8 класс
Урок Конспект Дополнительные материалы КонспектГенетическая связь между основными классами неорганических соединений. Обобщение знаний по теме «Основные классы неорганических соединений»
Обобщение знаний по теме «Основные классы неорганических соединений»
Изучая разные классы неорганических веществ, мы узнали, что каждый класс со-единений обладает характерными химическими свойствами. Также можно проследить взаимосвязи между веществами разных классов неорганических соединений.
Неметалл фосфор горит в кислороде ослепительным пламенем, в результате обра-зуется окисид фосфора (V): 4P + O2 = 2P2O5.
Растворим оксид фосфора (V) в воде и добавим несколько капель индикатора лак-муса. Оксид фосфора (V) взаимодействует с водой с образованием кислоты: P2O5 + 3h3O = 2h4PO4.
Оксид фосфора (V) – кислотный оксид. К получившемуся раствору кислоты по ка-плям будем приливать раствор гидроксида натрия. Щёлочь нейтрализует получившуюся кислоту. В результате образуются соль и вода: h4PO4 + 3NaOH = Na3PO4 + 3h3O.
У нас получилась цепочка превращений, в которой все вещества относятся к раз-ным классам неорганических соединений, но связаны общим химическим элементом:
P P2O5 h4PO4 Na3PO4
Неметалл кислотный оксид кислота соль
Такую же цепочку можно составить и для типичного металла, например для кальция.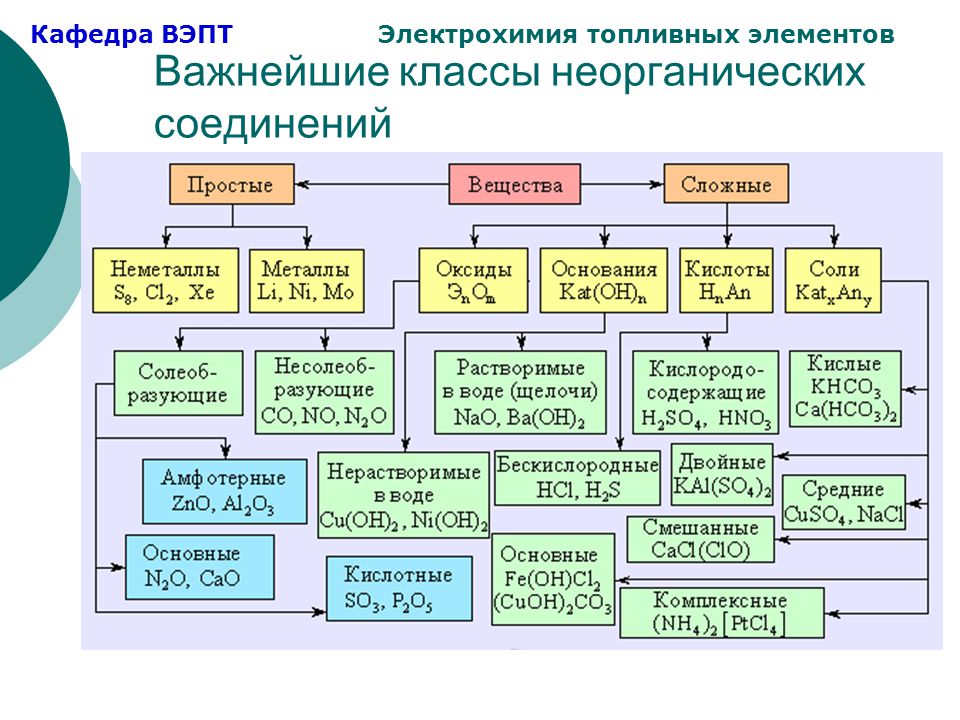
На воздухе кальций горит ослепительным пламенем. В результате образуется оксид кальция: 2Ca + O2 = 2CaO.
Растворим оксид кальция в воде. Прильём несколько капель фенолфталеина. Оксид кальция взаимодействует с водой с образованием щёлочи: CaO + h3O = Ca(OH)2.
Оксид кальция – основный оксид. Прильём к получившемуся раствору несколько капель соляной кислоты. Кислота нейтрализует щёлочь. В результате образуются соль и вода: Ca(OH)2 + 2HCl = CaCl2 + 2h3O
В получившейся цепочке превращений все вещества относятся к разным классам неорганических соединений, но связаны общим химическим элементом – металлом:
Ca CaO Ca(OH)2 CaCl2
металл основный оксид основание (щёлочь) соль
Такую цепочку превращений нельзя составить для металлов, которые образуют не-растворимые основания. Генетический ряд в этом случае будет другим.
Генетический ряд называют рядом превращений. Он характеризует взаимопревра-щения веществ разных классов.
§ 25.
 Генетическая связь между классами неорганических и органических веществ
Генетическая связь между классами неорганических и органических веществ1
Условие:
Что такое генетический ряд? Чем он характеризуется в неорганической и органической химии?
Решение:
Генетическим называют ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ, т. е. их генезис.
В неорганической химии в генетический ряд входят соединения одного химического элемента, которые относятся к разным классам соединений и связаны взаимными превращениями.
В органической химии в генетический ряд входят соединения с одинаковым числом атомов углерода, которые относятся к разным классам соединений и связаны взаимными превращениями.
Советы:
Информация содержится в тексте параграфа
2
Условие:
Что такое генетическая связь? Какие философские идеи она иллюстрирует?
Решение:
Генетическая связь — это связь между веществами разных классов, образованных одним химическим элементом, связанных взаимными превращениями, отражающая общность происхождения веществ этого элемента.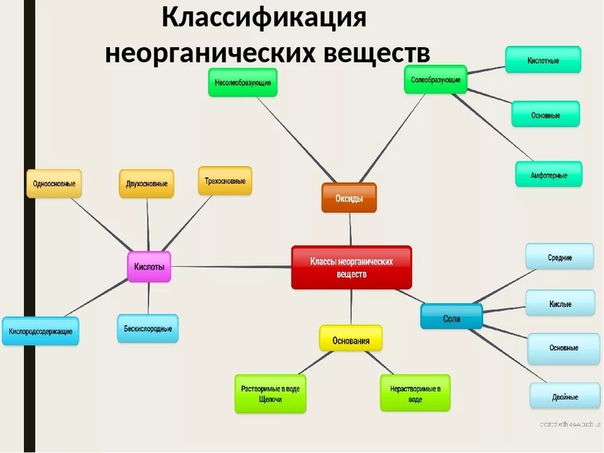
Генетическая связь иллюстрирует такую философскую идею как идею о детерминизме. Детерминизм – это философская идея о причинности, закономерности, генетической связи, взаимодействии и обусловленности всех явлений и процессов, которые происходят во всём мире.
Советы:
В качестве источника информации используйте Интернет и энциклопедические справочники.
3
Условие:
Составьте генетические ряды натрия и железа. Запишите уравнения реакций, с помощью которых можно осуществить предложенные вами переходы.
Решение:
Советы:
Используйте ранее полученные знания из курса неорганической химии.
4
Условие:
Составьте генетические ряды кремния и серы. Запишите уравнения реакций, с помощью которых можно осуществить предложенные вами переходы.
Решение:
Советы:
Используйте ранее полученные знания из курса неорганической химии.
5
Условие:
Составьте генетический ряд органических соединений, в состав молекул которых входит один атом углерода. Запишите уравнения реакций, с помощью которых можно осуществить предложенные вами переходы.
Запишите уравнения реакций, с помощью которых можно осуществить предложенные вами переходы.
Решение:
Советы:
Используйте ранее полученные знания из курса органической химии.
6
Условие:
При взаимодействии 12 г предельного одноатомного спирта с натрием выделилось 2,24 л водорода (н. у.). Найдите молекулярную формулу спирта, напишите формулы возможных изомеров и назовите их.
Решение:
Советы:
см. видеообзор.
7
Условие:
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение:
Советы:
Используйте ранее полученные знания из курса химии.
Урок химии в 8 классе
Урок химии в 8 классе
Автор: edu1
Методическая копилка — Химия
Разработка урока по теме: «Типы химических реакций. Реакции обмена.» 8 класс
Цели урока:
Образовательная— актуализация знаний обучающихся о типах химических реакций, классификации веществ, номенклатуре основных классов неорганических соединений, введение понятия о реакциях обмена, их значимости в повседневной жизни человека.
Развивающая – развитие научного мышления обучающихся через установление причинно-следственных связей, эксперимент и анализ эмпирических данных, умений анализировать результаты наблюдаемых опытов.
Воспитательные-формирование исследовательской компетенции обучающихся при изучении типов химических реакций.
Задачи:
1) обобщить и систематизировать знания о типах химических реакций, закрепить умения составлять уравнения химических реакций и расставлять коэффициенты в уравнениях химических реакций.
2) сформировать комплекс общеучебных познавательных умений — логически мыслить, анализировать, сравнивать, обобщать, делать выводы, аргументировать и отстаивать свою точку зрения.
3)совершенствовать коммуникативные и организационные умения (правильное использование химической терминологии и символики, потребности вести диалог, выслушивать оппонента, способности открыто выражать и аргументированно отстаивать свою точку зрения).
Место урока в школьном курсе: урок изучается в разделе «Изменения, происходящие с веществами», является последним из типов химических реакций, изучаемых в этом разделе.
Планируемые результаты:
урок должен помочь обучающимся 8 класса сформировать следующие универсальные учебные действия:
1)Личностные УУД: определиться в выборе индивидуальных образовательных потребностей; научиться общаться со сверстниками, отстаивать свою точку зрения в процессе беседы, показывать свою убежденность в вопросах значения химических знаний в повседневной жизни; оценивать жизненные ситуации и поступки с точки зрения общечеловеческих норм.
2)Регулятивные УУД: организовывать свое рабочее место под руководством учителя; определять цель и составлять план выполнения задания; развивать практические навыки и умения при решении повседневных проблем связанных с химией.
3)Познавательные УУД: научиться выполнять творческие задания для самостоятельного получения и применения знаний; устанавливать причинно-следственные связи; выдвигать гипотезы и обосновывать их; формулировать проблемы.
4)Коммуникативные УУД: участвовать в диалоге на уроке и в жизненных ситуациях; сотрудничать с одноклассниками в поиске и сборе информации; принимать решения и реализовывать их; точно выражать свои мысли.
Форма учебного процесса: классный урок.
Тип урока: комбинированный.
Оборудование: мультимедийный проектор, электронная презентация, экран, карточки с заданиями, оценочные карты, рефлексивные карты, демонстрационное оборудование (штатив с порбирками, пробиркодержатель, растворы соляной кислоты, серной кислоты, гидроксида натрия, хлорида бария, карбонат натрия, индикатор), чёрный и белый экраны, фишки)
Хронометраж урока:
- Организационный момент ……………………………… 1 мин.
- Актуализация опорных знаний ………………………… 3 мин.
- Мотивация знаний ………………………………………..2 мин.
- Изучение нового материала …………………………….. 15 мин. (физкультминутка)
- Первичное закрепление знаний ………………………… 4 мин.
- Рефлексия ………………………………………………….3 мин.
- Подведение итогов урока.
Информация о домашнем задании …………………….. 2 мин.
Ход урока.
I. Организационный момент.(1 мин)
Приветствие.
Мы – умные, мы – дружные,
Мы – внимательные, мы – старательные,
Мы отлично учимся, всё у нас получится!
II.Актуализация опорных знаний (3 мин)
Учитель:
— Эти явления знаете вы
В жизни нашей встречаются они,
А отличают эти явления – взаимные превращения,
И образуются всегда – новые вещества.
— Что же это за явления?
Обучающиеся:
— Химические реакции (слайд)
На предыдущих уроках вы познакомились с тремя типами химических реакций. По числу вступивших в реакцию веществ и, образовавшихся продуктов реакции, вспомним. «СЛАЙД 3,4»
III.Мотивация знаний
- Сравним уравнения химических реакций.
 «СЛАЙД 5»
«СЛАЙД 5»
- Fe + H2SO4 → FeSO4 + H2↑
- FeO + H2SO4 → FeSO4 + H2O
- Как вы думаете, в чём проявляется сходство и различие этих уравнений химических реакций? (Сходства: одинаковое количество исходных веществ и продуктов реакции, продуктом является соль,
Различия: исходными веществами одной из реакций являются сложные вещества-2, а другой — простое и сложное вещество (1), реакции относятся к разным типам.)
Обратили вы внимание на состав веществ?
Что происходит во втором случае? (обмен составными частями)
Совершенно верно происходит обмен.
Сформулируйте тему урока?
Записать тему урока в тетради. «СЛАЙД 6»
IV. Сообщение нового материала.
Попробуйте сформулировать определение реакций обмена? Если вы испытываете затруднения, обратитесь к тексту параграфа 32 на с. 165.
165.
«СЛАЙД 7» (записать в тетрадь)
Проведём с вами небольшой эксперимент. Я называю вещества, а вы записывайте в тетрадь формулы веществ и составляете уравнения химических реакций, которые я буду демонстрировать!
Демонстрационный опыт №1 «Взаимодействие соляной кислоты с карбонатом натрия».
К какому классу соединений относится кабонат натрия?
«СЛАЙД 9» Вспомним правила техники безопасности при работе с кислотами.
Назвать признак химической реакции? (выделение пузырьков газа). Какой это газ?
Записать уравнение химической реакции (1 обучающийся у доски, остальные в тетради). «СЛАЙД 10»
Как мы обозначим выделение газа?
Демонстрационный опыт №2 «Взаимодействие раствора гидроксида натрия с сульфатом меди».
«СЛАЙД 11»
Каким был раствор сульфата меди? Что произошло после того, как я добавила раствор гидроксида натрия
Расставьте коэффициенты в уравнении химической реакции, назовите образовавшиеся соединения:
CuSO4 + NaOH → Cu(OH)2↓+ Na2SO4
Cu(OH)2 + HCl → CuCl2 + H2O
По какому признаку вы определили, что протекает химическая реакция?(образовался осадок голубого цвета)
Записать уравнение химической реакции на доске.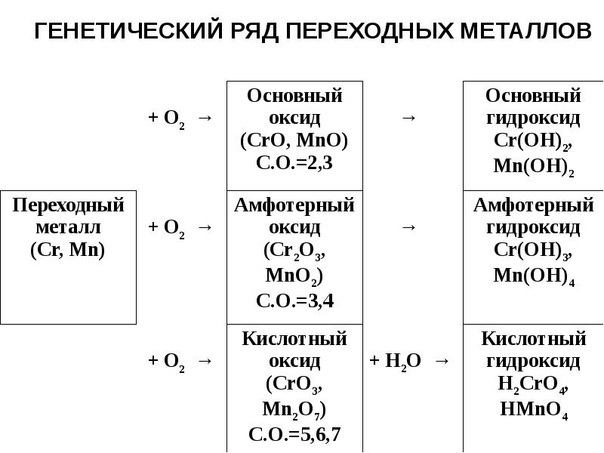
Демонстрационный опыт №3 Взаимодействие серной кислоты с раствором хлорида бария.
«СЛАЙД 13»Назовите признак, по которому вы определили, что химическая реакция произошла? (Выпадение осадка белого цвета).
Как узнать, выпадет осадок или нет в результате реакции обмена?
Работа с таблицей растворимости на форзаце учебника. !!!
-Необходимо вспомнить определение такого класса неорганических соединений, как СОЛИ?
Демонстрационный опыт №4 Взаимодействие соляной кислоты с раствором гидроксида натрия в присутствии индикатора – фенолфталеина.
ИНДИКАТОРЫ (от лат. indicator – указатель) – вещества, позволяющие следить за составом среды или за протеканием химической реакции
Физкультминутка
Если выделится газ-
Это раз;
И получится вода —
Это два;
А еще — нерастворимый
Осаждается продукт…
«Есть осадок», — говорим мы.
Это третий важный пункт.
Химик «правила обмена»
Не забудет никогда:
В результате — непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
Давайте подумаем!!! Где в быту мы встречаемся с реакциями обмена?
«СЛАЙД 13»
- Разрыхлители теста.
- Определение качества воды.
- Устранение жесткости воды.
- Определение качества продуктов питания.
- Определение массовой доли уксусной кислоты в ее растворе.
И это далеко не полный перечень областей применения реакций обмена. Т.Е сделайте вывод: жизнь современного человека немыслима без реакций обмена!!!
|
№ |
Реагенты |
Продукты реакции |
Признак протекания химической реакции |
|
1 |
HCl + Na2СO3→ |
NaCl + H2СO3 (СО2↑+ Н2О) |
выделение газа |
|
2 |
HCl+ Сu(OH)2 → |
CuCl2 + H2O |
образование воды |
|
3 |
H2SO4 + BaCl2 → |
HCl + BaSO4 ↓ |
выпадение осадка |
|
4 |
NaCl+ H2SO4→ |
→ ? + ? |
Будет идти реакция? |
V.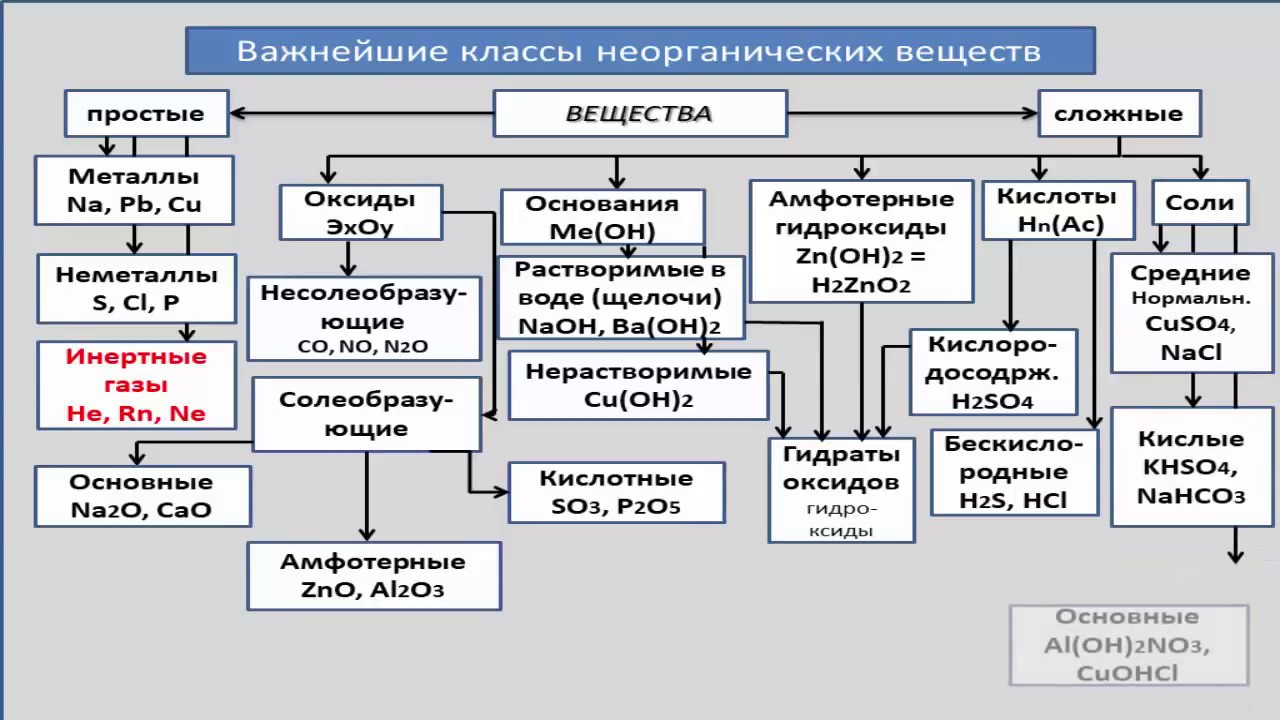 Закрепление изученного материала.
Закрепление изученного материала.
«СЛАЙД 14» Работа в парах с последующей взаимопроверкой. «СЛАЙД 15»
Кто может нам объяснить?
Кто справился с заданием без ошибок? (поднимите руку.)
Кто из вас испытал затруднения при выполнении? Почему?
Молодцы ребята!
VI. .Подведение итогов. Рефлексия
- Написано на доске:
- «Суди себя сам. Это самое трудное. Себя судить куда труднее, чем других. Если ты сумеешь правильно судить себя, значит ты поистине мудр.»
Релаксация. Закройте глаза и вспомните приятные моменты нашего урока. Я рада, что на протяжении всего урока вы были внимательны. Я хочу, чтобы все, кто работал хорошо – улыбнулись мне, а кто чувствует в себе потенциал работать ещё лучше – поаплодировали себе.
- У вас на столе лежат карты, для анализа нашего с вами урока. Предлагаю вам заполнить карту, для того, чтобы………………..для этого вы можете воспользоваться выражениями, указанными на слайде презентации «СЛАЙД 18»
|
Плюс (что понравилось на уроке) |
|
|
Минус (что не понравилось, непонятно) |
|
|
Интересно (любопытно, что ещё хотелось бы узнать) |
VI. Домашнее задание. (инструктаж по его выполнению).
Домашнее задание. (инструктаж по его выполнению).
§32, № 2-5 с.168
«Исследовательская работа»
1.Запишите формулы химических веществ, которые применяются в быту:
- Уксус-
- Пищевая сода-
- Кальцинированная сода-
- Медный купорос-
- Марганцовка-
- Хлористый кальций-
- Магнезия жжёная-
- Аккумуляторная кислота-
2.Проведите реакции между веществами:
|
Нужно взять |
Наблюдение |
Идет ли реакция? |
Уравнение реакции |
|
1. Железный гвоздь и раствор медного купороса |
|||
|
2. |
|||
|
3. Сода + уксус |
|||
|
4. Сода + хлористый кальций (апт.) |
|||
|
5.Монетка + р-р поваренной соли |
Информационные ресурсы
- Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М.: Дрофа, 2009.
- Габриелян О.С. Учебник для общеобразовательных учреждений. Химия. 8 класс. М.: Дрофа, 2009.
- Габриелян О.С., Воскобойникова Н.П., Яшукова А.
 В. Настольная книга учителя. 8 класс. М.: Дрофа, 2007.
В. Настольная книга учителя. 8 класс. М.: Дрофа, 2007. - Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. Методическое пособие к учебнику О.С.Габриеляна «Химия-8» для учащихся и учителей. М.: Блик и Ко, 2001.
Физкультминутка «Реакции обмена»
Слоганы
Упражнения
Реакции обмена
Правое плечо вверх — вниз;
Вы словно перемена.
Левое плечо вверх – вниз.
Их признаки запомним навсегда!
Руки к плечам согнутые в локтевом суставе и повороты в плечевом суставе вперед – назад;
Нам газа запах сладок,
Руки вверх – 2 раза;
И выпавший осадок,
Руки вниз – 2 раза;
И абсолютно новая вода!
Руки согнуты в локтях впереди, вращение в локтевом суставе вперед и назад.
Физкультминутка « Периодическая система»
Слоганы
Упражнения
Раз – два – руки в горизонтали,
Обе руки в горизонтальной плоскости одновременно вправо – влево;
Три – четыре – руки по вертикали.
Обе руки одновременно резким движением поднимаются вверх и опускаются вниз.
Помни, период – это горизонталь,
Руки на пояс, наклоны туловища вправо и влево;
Ну а группа – это вертикаль!
Руки на пояс, прыжки на месте.
Домашнее задание
«Исследовательская работа»
1.Запишите формулы химических веществ, которые применяются в быту:
- Уксус-
- Пищевая сода-
- Кальцинированная сода-
- Медный купорос-
- Марганцовка-
- Хлористый кальций-
- Магнезия-
- Аккумуляторная кислота-
2.Проведите реакции между веществами:
|
Нужно взять |
Наблюдение |
Идет ли реакция? |
Уравнение реакции |
|
1. |
|||
|
2. Заварить крахмал + йод |
|||
|
3. Сода + уксус |
|||
|
4. Сода + хлористый кальций (апт.) |
|||
|
5.Монетка + р-р поваренной соли |
Признаки протекания химических реакций
|
Реагенты |
Продукты реакции |
Признак протекания химической реакции |
|
|
1 |
|||
|
2 |
|||
|
3 |
|
реакции соединения |
реакции разложения |
реакции замещения |
реакции обмена |
Рефлексия
|
Плюс (что понравилось на уроке) |
|
|
Минус (что не понравилось, непонятно) |
|
|
Интересно (любопытно, что ещё хотелось бы узнать) |
__Фамилия Имя___________________________________________________
Бланк ответов
Задание 1
Задание 2
Задание 3
Задание для самостоятельного выполнения
|
Оценка |
Назовите вещества, которые относятся к разным классам неорганических соединений,но образуют при диссоциации в водных растворах одинаковые катионы? 1)KOH и LiOH 2)Ba(OH)2 и Ba(NO3)2 3)BaSO4 и Ba(OH)2 4)CaCO3 и Ca(OH)2 И почему?
2. даноm(p-pa)=29.2 gW(HCL)=5%MgSO3———————V(SO2)-?m(HCL)=29.2*5%/100%=1.46 g 1.46 X2HCL+MgSO3—>MgCL2+h3O+SO2 M(HCL)=36.5 g/mol Vm=22.4 L/mol2*36.5 22.4X=1.46*22.4 / 73X=0.448 Lответ 448 мл
даноm(p-pa)=29.2 gW(HCL)=5%MgSO3———————V(SO2)-?m(HCL)=29.2*5%/100%=1.46 g 1.46 X2HCL+MgSO3—>MgCL2+h3O+SO2 M(HCL)=36.5 g/mol Vm=22.4 L/mol2*36.5 22.4X=1.46*22.4 / 73X=0.448 Lответ 448 млГидроксид железа(|||)
Углекислый газ (оксид углерода (||) )
Кремниевая кислота
Сперва находим состав кислородно-озоновой смеси
М(см)=4·9=36.Обозначим объемную долю О3 через х,тогда объемная доля О2 будет (100-х) 36=((48х+32(100-х))/100,Оттуда х=25% -это озон,и 75% кислород.Теперь определим сколько литров кислорода даст данная смесь: 2О3→3О2 в 100 литре данной смеси имеется 25 литров озона,из него получиться 3·25÷2=37,5 литров О2,Всего из 100 литров такой смеси получается 75+37,5=112,5 литров кислорода.
Теперь найдем состав данной смеси углеводородов.
М(ср)=1,661·22,4=37,2,массу этана обозначим через х а общую массу циклобутена и бутина-2 через у.Тогда
37,2=56/(х/30+у/54) и х+у=56 решив это систему уравнению получаем
х=31,6 г этан и 24,4г циклобутена и бутина-2
С2Н6⇒3,5О2 и С4Н6⇒5,5О2 30——3,5·22,4, 31,6——х х=82,58л
54——5,5·22,4 24,4——у у=55,67 всего кислорода нужен 138,25л
Вычислили,что 100 л смеси кислорода и озона дает 112,5 литров кислорода Составим пропорцию 112,5——100,138,25——х х=123л
Алкены способны присоединять галогены с образованием дигалогеналканов, поэтому пропускание этилена через бромную воду приводит к её обесцвечиванию.
Ch3=Ch3 + Br2 → Ch3Br-Ch3Br
Уменьшается в этом ряду,у серебра самая большая электропроводность
Страница не найдена — Саянский медицинский колледж
Я, субъект персональных данных, в соответствии с Федеральным законом от 27 июля 2006 года № 152 «О персональных данных» предоставляю ОГБПОУ «Саянский медицинский колледж» (далее — Оператор), расположенному по адресу Иркутская обл. , г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
, г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
- Состав предоставляемых мной персональных данных является следующим: Имя, адрес электронной почты.
- Целями обработки моих персональных данных являются: обеспечение обмена короткими текстовыми сообщениями в режиме онлайн-диалога или обмена текстовыми сообщениями через электронную почту.
- Согласие предоставляется на совершение следующих действий (операций) с указанными в настоящем согласии персональными данными: сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение), использование, передачу (предоставление, доступ), блокирование, удаление, уничтожение, осуществляемых как с использованием средств автоматизации (автоматизированная обработка), так и без использования таких средств (неавтоматизированная обработка).
- Я понимаю и соглашаюсь с тем, что предоставление Оператору какой-либо информации о себе, не являющейся контактной и не относящейся к целям настоящего согласия, а равно предоставление информации, относящейся к государственной, банковской и/или коммерческой тайне, информации о расовой и/или национальной принадлежности, политических взглядах, религиозных или философских убеждениях, состоянии здоровья, интимной жизни запрещено.
- В случае принятия мной решения о предоставлении Оператору какой-либо информации (каких-либо данных), я обязуюсь предоставлять исключительно достоверную и актуальную информацию и не вправе вводить Оператора в заблуждение в отношении своей личности, сообщать ложную или недостоверную информацию о себе.
- Я понимаю и соглашаюсь с тем, что Оператор не проверяет достоверность персональных данных, предоставляемых мной, и не имеет возможности оценивать мою дееспособность и исходит из того, что я предоставляю достоверные персональные данные и поддерживаю такие данные в актуальном состоянии.
- Согласие действует по достижении целей обработки или в случае утраты необходимости в достижении этих целей, если иное не предусмотрено федеральным законом.
- Согласие может быть отозвано мною в любое время на основании моего письменного заявления.
химическое соединение | Определение, примеры и типы
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
Метан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения. На структуру химических соединений влияют сложные факторы, такие как валентные углы и длина связи.
Британская энциклопедия, Inc.Британская викторина
Подводки к химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Вся материя Вселенной состоит из атомов более чем 100 различных химических элементов, которые встречаются как в чистом виде, так и в сочетании в химических соединениях. Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно.Символ железа — Fe, от оригинального латинского названия ferrum . Фундаментальный принцип химической науки состоит в том, что атомы различных элементов могут объединяться друг с другом, образуя химические соединения. Например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит отдельные молекулы CH 4 . Формула соединения, например CH 4 , указывает типы присутствующих атомов, с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно.Символ железа — Fe, от оригинального латинского названия ferrum . Фундаментальный принцип химической науки состоит в том, что атомы различных элементов могут объединяться друг с другом, образуя химические соединения. Например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит отдельные молекулы CH 4 . Формула соединения, например CH 4 , указывает типы присутствующих атомов, с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Одиночный атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc.Исследуйте магнитоподобную ионную связь, образующуюся при передаче электронов от одного атома к другому
Ионы — атомы с положительным или отрицательным суммарным зарядом — связываются вместе, образуя ионные соединения.
Encyclopædia Britannica, Inc. См. Все видео для этой статьиПосмотрите, как работают молекулярные связи, когда два атома водорода соединяются с атомом серы, образуя сероводород
Молекулярные соединения образуются при образовании молекул, таких как молекулы метана или воды , соединяйтесь вместе, деля электроны.
Encyclopædia Britannica, Inc. Посмотреть все видео по этой статье
Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O.Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионов хлора с отрицательным зарядом (Cl — ). ( См. Ниже Тенденции в химических свойствах элементов, где обсуждается процесс превращения незаряженных атомов в ионы [i.е., виды с положительным или отрицательным суммарным зарядом].) Упомянутые выше вещества представляют два основных типа химических соединений: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются в тысячи слов, атомы элементов могут объединяться различными способами, образуя бесчисленное множество соединений. .На самом деле известны миллионы химических соединений, и еще многие миллионы возможны, но еще не открыты и не синтезированы. Большинство веществ, встречающихся в природе, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не меняют способ агрегирования атомов в соединениях. Соединения можно разбить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) — это изменение, при котором изменяется организация атомов. Пример химической реакции — горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасХимические соединения обладают поразительным набором характеристик. При обычных температурах и давлениях некоторые из них являются твердыми телами, некоторые — жидкостями, а некоторые — газами. Цвета различных составных частей совпадают с цветами радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
ртуть (Hg)Ртуть (химический символ: Hg) — единственный металлический элемент, который находится в жидком состоянии при комнатной температуре.
© marcel / FotoliaВ рамках широкой классификации органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат ионы O 2- или атомы кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и т. Д.Подклассы органических соединений включают спирты (содержащие группу OH), карбоновые кислоты (характеризующиеся группой COOH), амины (содержащие группу NH 2 ) и так далее.
Различные способности различных атомов объединяться с образованием соединений лучше всего можно понять с помощью периодической таблицы. Периодическая таблица Менделеева была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития химии было обнаружено, что элементы можно сгруппировать в соответствии с их химической реакционной способностью.Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей атомной структуры стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. Атом ). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
Таблица МенделееваПериодическая таблица элементов.
Encyclopædia Britannica, Inc.Например, атомы элементов в группе 1 периодической таблицы все имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона, и так далее, до группы 18 , элементы которого содержат восемь валентных электронов. Самое простое и самое важное правило для предсказания того, как атомы образуют соединения, заключается в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т.е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части таблицы Менделеева имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет его с 10 отрицательными зарядами и 11 положительными зарядами, что дает суммарный заряд +1: Na → Na + + e —.Калий, расположенный непосредственно под натрием в группе 1, также образует +1 ион (K + ) в своих реакциях, как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы завершить свою валентную оболочку. Например, кислород в группе 16 имеет шесть валентных электронов и, следовательно, нуждается в двух дополнительных электронах, чтобы завершить его внешнюю оболочку. Кислород достигает этой договоренности, реагируя с элементами, которые могут терять или делиться электронами.Например, атом кислорода может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2-. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) Получающиеся в результате Mg 2+ и O 2− затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, у него нет чистого заряда, потому что он содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное разделение элементов — на металлы, которые составляют большинство элементов, и неметаллы.Типичными физическими свойствами металлов являются блестящий внешний вид, пластичность (способность растираться в тонкий лист), пластичность (способность вытягиваться в проволоку), а также эффективная тепло- и электропроводность. Самым важным химическим свойством металлов является тенденция отдавать электроны с образованием положительных ионов. Например, медь (Cu) — типичный металл. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко превращаться в изделия различной формы, такие как трубы для систем водоснабжения.Медь содержится во многих ионных соединениях в форме иона Cu + или Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно мало, находятся в верхнем правом углу таблицы Менделеева, за исключением водорода, единственного неметаллического члена Группы 1.У неметаллов отсутствуют физические свойства, характерные для металлов. В химических реакциях с металлами неметаллы приобретают электроны с образованием отрицательных ионов. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — это типичный неметалл. При обычных температурах элементарный хлор содержит молекулы Cl 2 и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl — .
Разделение элементов на металлы и неметаллы является приблизительным. Некоторые элементы вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
2.11: Номенклатура неорганических соединений
Как правило, существует два типа неорганических соединений, которые могут образовываться: ионные соединения и молекулярные соединения. Номенклатура — это процесс присвоения химическим соединениям разных названий, чтобы их можно было легко идентифицировать как отдельные химические вещества.Неорганические соединения — это соединения, которые не имеют отношения к образованию углеводов, или просто все другие соединения, которые не подходят под описание органического соединения. Например, органические соединения включают молекулы с углеродными кольцами и / или цепями с атомами водорода (см. Рисунок ниже). Неорганические соединения, тема этого раздела, — это любая другая молекула, которая не включает эти отличительные углеродные и водородные структуры.
Соединения металлов и неметаллов (катионы и анионы)
Соединения, состоящие из металла и неметалла, обычно известны как Ionic Compounds , , где название соединения имеет окончание –ide . Катионы имеют положительный заряд, а анионы — отрицательный. Чистый заряд любого ионного соединения должен быть нулевым, что также означает, что оно должно быть электрически нейтральным. Например, один Na + сочетается с одним Cl —; один Ca 2 + сопряжен с двумя Br — . Необходимо соблюдать два правила:
- Катион (металл) всегда называется первым, его имя не меняется
- Анион (неметалл) пишется после катиона, модифицированный так, чтобы оканчиваться на –ide
Таблица катионов и анионов:
| +1 заряд | +2 Заряд | -1 Заряд | -2 Заряд | -3 Заряд | -4 Заряд |
|---|---|---|---|---|---|
| Водород: H + | Бериллий: Be 2 + | Гидрид: H — | Оксид: O 2- | Нитрид: N 3 — | Карбид: C 4 — |
| Литий: Li + | Магний: Mg 2 + | Фторид: F — | Сульфид: S 2 — | Фосфид: P 3 — | |
| Содуим: Na + | Кальций: Ca 2 + | Хлорид: Cl — | |||
| Калий: K + | Стронций: Sr 2 + | Бромид: Br — | |||
| Рубидий: Rb + | Барий: Ba 2 + | Йодид: I — | |||
| Цезий: Cs + | |||||
| Элементы группы 1А | Элементы группы 2А | Элементы группы 7А | Элементы группы 6А | Элементы группы 5А | Элементы группы 4А |
Пример 1
Na + + Cl — = NaCl Ca 2 + + 2Br — = CaBr 2
Натрий + Хлор = Натрий Хлор ide Кальций + Бром = Бром кальция ide
Переходные металлы могут образовывать более одного иона, поэтому необходимо указать, о каком именно ионе идет речь.На это указывает римская цифра после металла. Римская цифра обозначает заряд и степень окисления иона переходного металла. Например, железо может образовывать два общих иона: Fe 2 + и Fe 3 + . Чтобы различить разницу, Fe 2 + будет называться железом (II), а Fe 3 + будет называться железом (III).
| +1 Заряд | +2 Плата | +3 Заряд | +4 Плата |
|---|---|---|---|
| Медь (I): Cu + | Медь (II): Cu 2 + | Алюминий: Al 3 + | Свинец (IV): Pb 4 + |
| Серебро: Ag + | Железо (II): Fe 2 + | Железо (III): Fe 3 + | Олово (IV): Sn 4 + |
| Кобальт (II): Co 2 + | Кобальт (III): Co 3 + | ||
| Олово (II): Sn 2 + | |||
| Свинец (II): Pb 2 + | |||
| Никель: Ni 2 + | |||
| Цинк: Zn 2 + |
Пример 2
| Ионы: | Fe 2 + + 2Cl — | Fe 3 + + 3Cl — |
| Соединение: | FeCl 2 | FeCl 3 |
| Номенклатура | Хлорид железа (II) | Хлорид железа (III) |
Однако некоторые заряды переходных металлов имеют специфические латинские названия.Как и другие правила номенклатуры, ион переходного металла с более низким зарядом имеет латинское имя, оканчивающееся на -ous , а ион с более высоким зарядом имеет латинское имя, заканчивающееся на -ic . Наиболее распространенные из них представлены в таблице ниже:
| Ион переходного металла с римской цифрой | Латинское название |
|---|---|
| Медь (I): Cu + | Медь |
| Медь (II): Cu 2 + | Куприк |
| Железо (II): Fe 2 + | Черные металлы |
| Железо (III): Fe 3 + | Феррик |
| Свинец (II): Pb 2 + | Сливные |
| Свинец (IV): Pb 4 + | Сантехника |
| Ртуть (I): Hg 2 2 + | Mercurous |
| Ртуть (II): Hg 2 + | Mercuric |
| Олово (II): Sn 2 + | Олово |
| Олово (IV): Sn 4 + | Станник |
Для присвоения римских цифр применяется несколько исключений: алюминий, цинк и серебро.Хотя они относятся к категории переходных металлов, эти металлы не имеют римских цифр, написанных после их имен, потому что эти металлы существуют только в одном ионе. Вместо римских цифр различные ионы также могут быть представлены простыми словами. Металл заменяется на конец –ous или –ic .
- -ous Окончание используется для более низкой степени окисления
- -ic окончание используется для более высокой степени окисления
Пример 3
| Соединение | Cu 2 O | CuO | FeCl 2 | FeCl 3 |
| Заряд | Заряд меди +1 | Заряд меди +2 | Заряд железа +2 | Заряд железа +3 |
| Номенклатура | Медь ous Оксид | Cupr ic Оксид | Ferr ous Хлорид | Ferr ic Хлорид |
Однако эта система -ous / -ic в некоторых случаях неадекватна, поэтому предпочтительна римская система счисления.Эта система обычно используется для обозначения кислот, где H 2 SO 4 широко известна как серная кислота, а H 2 SO 3 известна как серная кислота.
Соединения неметаллов и неметаллов
Соединения, которые состоят из неметалла, связанного с неметаллом, обычно известны как Molecular Compound s , где первым указывается элемент с положительной степенью окисления. Во многих случаях неметаллы образуют более одного бинарного соединения, поэтому префиксы используются для их различения.
| Кол-во атомов | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Префиксы | Моно- | Di- | Три- | Тетра- | Пента- | Шестнадцатеричный | Гепта- | окта- | Нона- | дека- |
Пример 4
CO = углерод mon оксид BCl 3 = бор tri хлорид
CO 2 = углерод di оксид N 2 O 5 = di азот пент оксид
Префикс mono- не используется для первого элемента.Если перед первым элементом нет префикса, предполагается, что имеется только один атом этого элемента.
Бинарные кислоты
Хотя HF можно назвать фтористым водородом, ему дали другое название, чтобы подчеркнуть, что это кислота. Кислота — это вещество, которое диссоциирует на ионы водорода (H + ) и анионы в воде . Быстрый способ идентифицировать кислоты — увидеть, есть ли перед молекулярной формулой соединения буквой H (обозначающей водород). Для обозначения кислот префикс hydro- ставится перед неметаллом, модифицированным до –ic .Состояние кислот — водное (водн.), Потому что кислоты содержатся в воде.
Некоторые распространенные бинарные кислоты включают:
HF (г) = фтористый водород ide -> HF (водный) = hydro фтор ic кислота
HBr (г) = водород бром ide -> HBr (водн.) = гидро бром ic кислота
HCl (г) = водород, хлор иди -> HCl (водн.) = гидро хлор ic кислота
H 2 S (г) = сероводород ide -> H 2 S (водн.) = hydro сера ic кислота
Очень важно включить (aq) после кислот, потому что те же соединения могут быть записаны в газовой фазе с водородом, названным первым, за которым следует анион, оканчивающийся на –ide .
Многоатомные ионы
В многоатомных ионах многоатомные (то есть два или более атома) соединены вместе ковалентными связями . Хотя может существовать элемент с положительным зарядом, например H + , он не связан с другим элементом ионной связью. Это происходит потому, что если бы атомы образовали ионную связь, то она уже стала бы соединением, поэтому не нужно было бы получать или терять какие-либо электроны. Многоатомные анионы встречаются чаще, чем многоатомные катионы, как показано в таблице ниже.Многоатомные анионы имеют отрицательный заряд, в то время как многоатомные катионы имеют положительный заряд. Чтобы указать разные многоатомные ионы, состоящие из одних и тех же элементов, имя иона изменяется в соответствии с приведенным ниже примером:
Пример 5
hypo ____ ite ____ ite ____ съел per____ate
ClO — ClO 2 — ClO 3 — ClO 4 —
гипо хлор ите хлор ите хлор съедено на хлор съело
—————->
Как показано стрелкой при движении вправо, наблюдаются следующие тенденции:
Увеличение числа атомов кислорода
Повышение степени окисления неметалла
(Использование этого примера видно из набора соединений, содержащих Cl и O)
Это происходит потому, что количество атомов кислорода увеличивается от гипохлорита к перхлорату, но общий заряд многоатомного иона все еще равен -1.Чтобы правильно указать, сколько атомов кислорода в ионе, снова используются префиксы и суффиксы.
Таблица : Общие многоатомные ионы
Название: Катион-анион | Формула |
Ион аммония | NH 4 + |
Ион гидроксония | H 3 O + |
Ацетат-ион | C 2 H 3 O 2 — |
Арсенат-ион | AsO 4 3 — |
Карбонат-ион | CO 3 2 — |
Гипохлорит-ион | ClO — |
Хлорит-ион | ClO 2 — |
Хлорат-ион | ClO 3 — |
Перхлорат-ион | ClO 4 — |
Хромат-ион | CrO 4 2- |
Дихромат-ион | Cr 2 O 7 2 — |
Цианид-ион | CN — |
Ион гидроксида | ОН — |
Нитрит-ион | НЕТ 2 — |
Нитрат-ион | НЕТ 3 — |
Оксалат-ион | С 2 О 4 2 — |
Перманганат-ион | MnO 4 — |
Фосфат-ион | PO 4 3- |
Сульфит-ион | СО 3 2 — |
Сульфат-ион | СО 4 2 — |
Тиоцианат-ион | SCN — |
Тиосульфат-ион | S 2 O 3 2- |
Чтобы объединить тему кислот и многоатомных ионов, существует номенклатура водных кислот.К таким кислотам относятся серная кислота (H 2 SO 4 ) или угольная кислота (H 2 CO 3 ). Чтобы назвать их, следуйте этим простым простым правилам:
- Если ион оканчивается на -ат и к нему добавляется кислота, название кислоты будет иметь окончание -ic . Примеры: нитрат-ион (NO 3 — ) + H + (обозначает образование кислоты) = нитрат ic кислота (HNO 3 )
- Если ион оканчивается на -ite и к нему добавляется кислота, то название кислоты будет иметь окончание -ous .Пример: нитит-ион (NO 2 — ) + H + (означает образование кислоты) = нитрат ous кислоты (HNO 2 )
Проблемы
1. Какова правильная формула карбоната кальция?
а. Ca + + CO 2 —
г. CaCO 2 —
г. CaCO 3
г. 2CaCO 3
2. Как правильно назвать FeO?
а.Оксид железа
г. Двуокись железа
г. Оксид железа (III)
г. Оксид железа (II)
3. Как правильно назвать Al (NO 3 ) 3 ?
а. Нитрат алюминия
г. Нитрат алюминия (III)
г. Нитрит алюминия
г. Алюминий триоксид азота
4. Какова правильная формула треххлористого фосфора?
а. P 2 Класс 2
г.PCl 3
г. PCl 4
г. P 4 Класс 2
5. Какова правильная формула перхлората лития?
а. Li 2 ClO 4
г. LiClO 2
г. LiClO
г. Ни один из этих
6. Напишите правильное название для этих соединений.
а. BeC 2 O 4 :
г.NH 4 MnO 4 :
г. CoS 2 O 3 :
7. Что такое W (HSO 4 ) 5 ?
8. Как написать триоксид дифосфора?
9. Что такое H 3 P?
10. Добавив атомы кислорода к молекуле под номером 9, мы получим H 3 PO 4 ? Как называется эта молекула?
Ответ1.C; Кальций + карбонат -> Ca 2 + + CO 3 2 — -> CaCO 3
2.D; FeO -> Fe + O 2- -> Железо должно иметь заряд +2, чтобы образовалось нейтральное соединение -> Fe 2+ + O 2- -> Оксид железа (II)
3.А; Al (NO 3 ) 3 -> Al 3 + + (NO 3 — ) 3 -> Нитрат алюминия
4.B; Треххлористый фосфор -> P + 3Cl -> PCl 3
5.D, LiClO 4 ; Перхлорат лития -> Li + + ClO 4 — -> LiClO 4
6.а. Оксалат бериллия; BeC 2 O 4 -> Be 2+ + C 2 O 4 2 — -> Оксалат бериллия
г. Перманганат аммония; NH 4 MnO 4 -> NH 4 + + MnO 4 — -> Перманганат аммония
г. Тиосульфат кобальта (II); CoS 2 O 3 -> Co + S 2 O 3 2 — -> Кобальт должен иметь заряд +2, чтобы образовалось нейтральное соединение -> Co 2+ + S 2 O 3 2 — -> Тиосульфат кобальта (II)
7.Гидросульфат вольфрама (V)
8. P 2 O 3
9. Фосфорная кислота
10. Фосфорная кислота
Авторы
- Пуй Ян Хо (UCD), Алекс Москалук (UCD), Эмили Нгуен (UCD)
Неорганические соединения — обзор
15.1.1 Фитормедиация и создание биопродуктов с добавленной стоимостью
Органические и неорганические соединения накапливаются в окружающей среде в результате сельскохозяйственной, промышленной и бытовой деятельности.Неконтролируемое распространение необработанных отходов жизнедеятельности человека и сельскохозяйственных стоков являются наиболее распространенными источниками загрязнения воды и почвы. Накопились экологические и экологические последствия загрязнения человека и необработанных отходов, которые необходимо устранить, чтобы избежать дальнейших негативных последствий. Чтобы смягчить последствия промышленного и муниципального загрязнения, практика очистки сточных вод должна значительно расшириться и в глобальном масштабе. Из-за недостатков во многих наших современных методах очистки воды качество пресной воды становится столь же серьезной проблемой, как и ее дефицит.Практика очистки отходов помогает уменьшить загрязнение воды и почвы из-за перегрузки питательными веществами и других токсичных загрязнителей. Неочищенные сточные воды содержат в растворе питательные вещества, которые вызывают эвтрофикацию экосистемы или доставляют токсичные соединения в окружающую среду. Эвтрофные условия стимулируют дисбаланс экосистем, который, если его не устранить, может обостриться и создать условия, угрожающие здоровью человека. Помимо потенциальных негативных последствий перегрузки биогенными веществами, трудно устранить последствия загрязнения воды и почвы тяжелыми металлами и химическими веществами.
Потребность в рентабельных средствах удаления или нейтрализации опасных соединений растет с каждым днем. База данных известных соединений в Химической реферативной службе (CAS) в настоящее время пополняется из известных 66 миллионов зарегистрированных соединений с добавлением около 12 000 новых соединений каждый день (CAS, 2012). Сброс этих соединений в водоемы или их распыление на почву сильно повлиял на окружающую среду и будет продолжаться. Промышленность и человеческое развитие уже повлияли на качество почвы и воды во всем мире.Рост урбанизации и индустриализации, в частности, привел к возникновению экологических проблем, связанных с городскими отходами. Городские сточные воды являются значительным источником ухудшения состояния окружающей среды из-за бытовых продуктов и фармацевтических препаратов, а также эвтрофикации из-за перегрузки биогенными веществами.
Микроводоросли и цианобактерии положительно реагируют на широкий спектр органических и неорганических загрязнителей. Эти организмы способны удалять соединения из раствора за счет биоаккумуляции соединений в теле клетки, а также на поверхности клетки, в дополнение к активности минерализации, связанной с метаболизмом клетки.Водоросли и цианобактерии могут расти в воде с низкой или высокой питательной ценностью, а также в более суровых экосистемах, таких как высокая или гипер-соленость или экстремальный pH. В дополнение к универсальным механизмам выживания каждого организма, некоторые виды микроводорослей обладают способностью использовать как автотрофию, так и гетеротрофию, что делает их миксотрофными в правильных условиях. В присутствии высоких уровней загрязнителей водоросли и цианобактерии испытывают физиологические изменения (Fogg, 2001), а также генетические реакции (Gonzalez et al., 2012), которые позволяют водорослям быстро размножаться или цвести. Эта адаптация делает микроводоросли и цианобактерии идеальными для устранения загрязнителей окружающей среды, а также для связывания CO 2 . Phycoremediation — это использование определенных видов микроводорослей или макроводорослей для удаления или биоразложения дополнительных соединений окружающей среды. Phycoremediation — важный инструмент для обработки загрязненной почвы и воды, и он охватывает множество применений, которые включают, помимо прочего, стабилизацию кислотного загрязнения, удаление металлов в загрязненных водах, удаление избыточных питательных веществ из воды и разложение. или связывание токсичных соединений из воды и почвы.
Для того, чтобы фоновая медиация могла эффективно контролировать загрязняющие вещества, необходимо выбрать использование определенных видов или комбинации видов, которые способны лечить загрязнение или благоприятно взаимодействовать с ним. Такие качества, как устойчивость к экстремальным температурам, потенциал для продуктов с добавленной стоимостью (таких как липиды, углеводы и / или белки), миксотрофия и седиментация, являются ключевыми элементами для исследования. Исследователи изучили восстановление сточных вод, загрязненных рядом источников, чтобы изучить задачи, выполняемые различными видами водорослей на каждой стадии процесса восстановления (Abdel-Raouf et al., 2012). В таблице 15.1 представлены эти исследования с указанием типа сточных вод, которые исследовались в каждом исследовании. Эти исследования демонстрируют, что для каждой задачи, связанной с переработкой определенных отходов, может быть несколько видов, способных выполнить эту задачу.
Таблица 15.1. Диапазон Phycoremediation
| Сектор | Организм | Ссылка |
|---|---|---|
| Муниципальные сточные воды | ||
| Удаление N / P | Gloeocapsa Gloeocapsa Gloeocapsa Gloeocapsa gelatinosa Sengar et al.(2011) | |
| Разрушители эндокринной системы | Anabaena cylindrica , Chlorococcus , S. platensis , Chlorella , S. quadricauda , Anabaena Vax | Shi (2010) |
| Моча | Spirulina Plantensis | Ying et al., (2011) |
| Сельское хозяйство | ||
| Отходы птицы | C. Vulgaris | Murugesan(2010a, b) |
| Органические пестициды | Обширный каталог | Subashchandrabose et al. (2013) |
| Свиной навоз | Scendesmus intermediateus , Nannochloris sp. | Jimenez-Perez et al. (2004) |
| Промышленность | ||
| Тяжелые металлы | Anabaena variabilis | Parameswari et al. (2010) |
| Spirogya | Gupta et al.(2001) | |
| Кожевенное растение | C. Vulgaris | Rao et al. (2011) |
| Альгинат | Chroococcus turgidus | Sivasubramanian et al. (2009) |
| Пищевая промышленность | ||
| Olive Mill | Scenedesmus obliqus | Hodaifa et al. (2013) |
Следует отметить, что успешное культивирование водорослей и цианобактерий зависит не только от питательных веществ, присутствующих в данной экосистеме.Комбинация сложных факторов окружающей среды и их взаимодействия влияют на развитие клеток водорослей и цианобактерий. Такие факторы, как pH воды или почвы (Азов и Шелеф, 1987), доступность и интенсивность света, температура и множество биотических факторов, действующих в воде и почве, влияют на развитие клеток водорослей.
Использование фитомедиации для очистки сточных вод предлагает решения некоторых проблем, связанных с традиционными методами очистки. Некоторые из недостатков традиционных методов обработки связаны с изменчивостью химической эффективности в зависимости от удаляемого соединения или питательного вещества.Другой недостаток традиционных методов очистки, включающих химическое восстановление, состоит в том, что химические вещества, используемые для обработки воды, попадают в окружающую среду. Некоторые из этих химикатов остаются активными, что приводит к разной степени экологического ущерба от воздействия «очищенных» сточных вод. Кроме того, De la Noue et al. (1992) указали, что при утилизации богатой питательными веществами воды (обработанной или неочищенной) возникают экономические потери, совпадающие с потерей ценных питательных веществ, которые можно было бы восстановить, переработать и использовать повторно.Тела клеток водорослей удерживают питательные вещества в процессе фитомедиации, а полученная биомасса делает питательные вещества доступными для сбора и повторного использования (Pizarro et al., 2006). Собранные питательные вещества в виде биомассы водорослей можно использовать для множества экономически ценных целей, включая, помимо прочего, восстановление почвы, органические удобрения, ферментативные процессы и другие сельскохозяйственные / промышленные процессы.
Неорганическая химия — Американское химическое общество
Наука об окружающей средеХимия окружающей среды использует неорганическую химию, чтобы понять, как работает незагрязненная среда, какие химические вещества в каких концентрациях присутствуют в природе и с какими эффектами.Они также определяют влияние добавок, таких как удобрения, на естественные процессы. Агентство по охране окружающей среды США и другие агентства обнаруживают и идентифицируют природу и источник загрязнителей.
Компании, занимающиеся экологическими науками, включают Ch3M Hill, Bechtel, Veolia, URS Corporation, Black & Veatch, Tetra Tech, Energy Solutions, а также правительственные учреждения, такие как Агентство по охране окружающей среды США (EPA). Эти компании изучают химические и биохимические явления, происходящие в природных местах.Они используют химию атмосферы, воды и почвы, а также аналитическую химию.
Волокна и пластмассыВолокна — это материалы, которые представляют собой непрерывные волокна или отдельные удлиненные куски, похожие на отрезки нити. Они важны для множества применений, включая удержание тканей вместе как у растений, так и у животных. Существует множество различных видов волокон, включая текстильные волокна, натуральные волокна и синтетические или искусственные волокна, такие как целлюлоза, минеральные, полимерные и микроволокна.Волокна могут быть скручены в нити, нить или веревку; используется как компонент композитного материала; или свернутые в листы для изготовления таких продуктов, как бумага. Волокна часто используются при производстве других материалов. Самые прочные инженерные материалы обычно производятся в виде волокон, например углеродного волокна и сверхвысокомолекулярного полиэтилена. Синтетические волокна часто можно производить дешевле и в больших количествах по сравнению с натуральными волокнами, но натуральные волокна имеют преимущества в некоторых областях применения, особенно в одежде.
Пластиковые материалы — это любые синтетические или полусинтетические органические твердые вещества, используемые в производстве промышленных продуктов. Пластмассы обычно представляют собой полимеры с высокой молекулярной массой и могут содержать другие вещества для улучшения характеристик и / или снижения производственных затрат. Мономеры пластика представляют собой природные или синтетические органические соединения.
Термопласты — это пластмассы, которые не претерпевают химического изменения своего состава при нагревании и, следовательно, могут формоваться снова и снова; примерами являются полиэтилен, полипропилен, полистирол, поливинилхлорид и политетрафторэтилен.Сырье, необходимое для производства большей части этих пластиков, поступает из нефти и природного газа.
Из-за относительно низкой стоимости, простоты изготовления, универсальности и водонепроницаемости пластмассы используются в широком спектре продуктов, от скрепок для бумаг до космических кораблей. Однако эти же свойства заставляют их сохраняться за пределами их полезности, поэтому большая часть текущей работы сосредоточена на создании фоторазлагаемых или других более экологически чистых версий.
Примерами компаний, специализирующихся на волокнах и пластмассах, являются Albemarle, Bayer, Celanese, The Dow Chemical Company, Eastman Chemical Company и DuPont,
МикрочипХимия и материаловедение позволяют производить неорганическую электронику с высокоупорядоченными слоями и интерфейсами, которые не могут обеспечить органические и полимерные материалы.Точный контроль состава поверхности позволяет создавать микрочипы с конкретными желаемыми свойствами.
Интегральная схема или монолитная интегральная схема (также называемая ИС, микросхемой или микрочипом) — это электронная схема, изготовленная путем структурированного осаждения (или диффузии) микроэлементов на поверхность тонкой подложки из полупроводникового материала. Дополнительные материалы осаждаются и формируются рисунки для образования межсоединений между полупроводниковыми приборами.
Интегральные схемы используются сегодня практически во всем электронном оборудовании и произвели революцию в обществе.Компьютеры, сотовые телефоны и другие цифровые устройства теперь являются неотъемлемой частью структуры современного общества, что стало возможным благодаря низкой стоимости производства интегральных схем.
Интегральные схемы также разрабатываются для сенсорных приложений в медицинских имплантатах и других биоэлектронных устройствах. В таких средах требуются специальные методы герметизации, чтобы избежать коррозии или биоразложения открытых полупроводниковых материалов.
Примерами компаний, специализирующихся на микрочипах, являются Intel, Hitachi, AMD, Agilent, Alcatel-Lucent, STMicroelectronics, IBM, Texas Instruments, Rohm Semiconductor и Samsung Semiconductor,
Горная промышленность включает добычу ценных минералов или других геологических материалов из земли или из рудного тела, жилы или пласта.Материалы, извлекаемые при добыче полезных ископаемых, могут включать в себя цветные металлы, драгоценные металлы, железо, уран, уголь, алмазы, известняк, горючие сланцы, каменную соль и калий. Любой материал, который нельзя вырастить с помощью сельскохозяйственных процессов или создать в лаборатории или на фабрике, поступает из горнодобывающей промышленности. В более широком смысле горная промышленность включает добычу любого невозобновляемого ресурса (например, нефти, природного газа или даже воды) для использования человеком.
Примерами компаний, специализирующихся на добыче, руде и металлах, являются BHP Billiton, Vale, RioTinto, Shenhua Group, Suncor, Glencore и Barrick.
Краски, пигменты и покрытияПигмент — это материал, который изменяет цвет отраженного или проходящего света в результате избирательного поглощения по длине волны. Пигменты подразделяются на органические (полученные из растительных или животных источников) или неорганические (полученные из солей или оксидов металлов).
Пигменты используются для окрашивания красок, чернил, пластика, тканей, косметики, продуктов питания и других материалов. Большинство пигментов, используемых в производстве и изобразительном искусстве, представляют собой сухие неорганические красители, обычно измельченные в мелкий порошок.Этот порошок добавляется к носителю (или связующему), который представляет собой относительно нейтральный или бесцветный материал, который задерживает пигмент и придает краске адгезию.
Примерами компаний, специализирующихся на производстве красок, пигментов и покрытий, являются Continental Chemical, Lintech International, Shepherd Chemical Company, DuPont, The Valspar Corporation и Glidden Paints (подразделение PPG Industries).
Различные виды химии — химия и биохимия
По сути, химия — это изучение материи и изменений.Способы, которыми химики изучают материю и изменения, а также типы изучаемых систем сильно различаются. Традиционно химия подразделяется на пять основных дисциплин: органическая, аналитическая, физическая, неорганическая, и биохимия. За последние несколько лет начали появляться дополнительные концентрации, включая ядерную химию, химию полимеров, биофизическую химию, биоорганическую химию, химию окружающей среды и т. Д. Все эти области химии в некоторой степени рассматриваются в наших классах здесь, в UWL, а также в рамках исследовательских интересов нашего факультета на химическом факультете.Следующие ниже описания пяти основных субдисциплин были написаны несколькими преподавателями в их области знаний. Все наши преподаватели будут рады подробно рассказать и / или обсудить другие аспекты химии, которые не описаны ниже!
Органическая Органическая химия — это раздел химии, который включает изучение молекул жизни. В основном это касается изучения структуры и поведения этих молекул, которые состоят только из нескольких различных типов атомов: углерода, водорода, кислорода, азота и некоторых других.Эти атомы используются для создания молекул, необходимых всем растениям и животным для их выживания. Традиционные химики-органики озабочены синтезом новых молекул и разработкой новых реакций, которые могут сделать эти синтезы более эффективными. Типы молекул, которые синтезируют химики-органики, включают полезные вещества, такие как лекарства, ароматизаторы, консерванты, ароматизаторы, пластмассы (полимеры) и сельскохозяйственные химикаты (удобрения и пестициды), и иногда включают необычные молекулы, встречающиеся в природе, или молекулы, которые могут просто создать проблему для делать.Кроме того, понимание органической химии необходимо для изучения биохимии и молекулярной биологии, потому что биомолекулы, такие как белки, сахара, жиры и нуклеиновые кислоты (ДНК и РНК), являются органическими молекулами, хотя и очень большими. Студенты, специализирующиеся на органической химии, обычно продолжают работать в фармацевтических, пищевых или полимерных компаниях, проводят исследования или преподают в области органической химии, продолжают медицинскую карьеру или могут искать другие связанные с этим рабочие места.
Вернуться к началу
Аналитическая Аналитическая химия — это наука об идентификации и количественном определении материалов в смеси.Химики-аналитики могут изобретать процедуры анализа, а также использовать или изменять существующие. Они также контролируют, проводят и интерпретируют анализ. Студенты, специализирующиеся на аналитической химии, часто продолжают работать в лабораториях судебной экспертизы, экологических или фармацевтических компаниях, работают, управляют и / или разрабатывают процедуры обеспечения качества, проводят исследования или преподают в колледжах и университетах.
Вернуться к началу
Физика Физическая химия — это изучение фундаментальных физических принципов, которые определяют поведение атомов, молекул и других химических систем.Физические химики изучают широкий круг вопросов, таких как скорость реакций (кинетика), способ взаимодействия света и вещества (спектроскопия), расположение электронов в атомах и молекулах (квантовая механика), а также стабильность и реакционная способность различных соединений. и процессы (термодинамика). Во всех этих случаях физико-химики пытаются понять, что происходит на атомном уровне и почему. Студенты, специализирующиеся на физической химии, могут продолжить карьеру в промышленности, исследованиях или преподавании.Многие современные исследования в области физической химии в промышленности и академических кругах сочетают в себе методы и идеи из нескольких областей. Например, некоторые химики применяют методы физической химии для исследования механизмов органических реакций (какие столкновения и перегруппировки связей происходят, насколько они быстры, сколько этапов и т. Д.) — этот тип исследования называется физической органической химией. Другие применяют физические методы для изучения биологических систем (почему белки складываются в те формы, которые они имеют, как структура связана с функцией, что заставляет нерв работать и т. Д.)) — это биофизическая химия. Третьи могут использовать физические методы для характеристики полимеров или изучения систем окружающей среды.
Вернуться к началу
Неорганическая Неорганическая химия обычно считается областью в химии, не имеющей отношения к углероду. Однако углерод играет очень важную роль во многих неорганических соединениях, и существует целая область исследований, известная как металлоорганическая химия, которая действительно представляет собой гибрид традиционных дисциплин органической и неорганической химии.Некоторые области неорганической химии, которые особенно важны, — это катализ, химия материалов и биоинорганическая химия. Катализаторы — это химические соединения, которые увеличивают скорость реакции, но не расходуются, и обычно основаны на переходных металлах (обычно) металлоорганических комплексах переходных металлов). Это чрезвычайно важная область для промышленности, и многие из химиков, которые будут идентифицированы. как неорганические или металлоорганические химики работают в этой области. Химия материалов — это область, связанная с разработкой и синтезом материалов, которые позволяют продвигать технологии практически во всех сферах жизни общества.Часто химики-неорганики, работающие в этой области, занимаются синтезом и характеристикой соединений в твердом состоянии или неорганических полимеров, таких как силиконы. Химики-биоинорганики изучают функцию металлосодержащих соединений в живых организмах. Студенты, специализирующиеся на неорганической химии, часто продолжают работать в промышленности в области полимеров или материаловедения, проводят исследования или преподают в области неорганической химии или ищут другие связанные с этим рабочие места.
Вернуться к началу
Биохимия Биохимия — это исследование химических принципов, лежащих в основе основных биологических систем.По сути, биохимические исследования направлены на определение связи между структурой и функцией биологических макромолекул. В частности, биохимические исследования обеспечили более полное понимание регенеративной медицины, инфекционных заболеваний, трансплантации органов / тканей, клинической диагностики и генетических заболеваний. Студенты, специализирующиеся на биохимии, продолжают делать чрезвычайно успешную карьеру в медицине, исследованиях и бизнесе. Некоторые студенты могут поступать в профессиональные школы сразу после получения степени бакалавра, в то время как другие могут поступать в академические или правительственные исследовательские учреждения.Некоторые студенты также объединяют свои знания в области биохимии в рамках степени магистра делового администрирования (MBA). Совместное изучение биохимии и бизнеса дает этим студентам уникальную возможность лучше сопоставить затраты и размер прибыли при производстве биохимических продуктов. Для получения информации о специальности «Биохимия» щелкните здесь.
Вернуться к началу
Графика Легенда:
Органическая химия : Восстановление камфоры боргидридом натрия.
Аналитическая химия : Масс-спектр диэтиламина.
Физическая химия : Иллюстрация момента инерции молекулы, такой как этан.
Неорганическая химия : Рентгеновская кристаллическая структура нового твердого неорганического соединения, синтезированного исследовательской группой доктора Роба Макгаффа.
Биохимия : схематический рисунок, показывающий структурные элементы домена I лактатдегидрогеназы
Понимание разницы между органическими и неорганическими
Слово «органический» в химии означает нечто совершенно иное, чем когда вы говорите о продуктах и продуктах питания.Органические соединения и неорганические соединения составляют основу химии.
Основное различие между органическими и неорганическими соединениями заключается в том, что органические соединения всегда содержат углерод, в то время как большинство неорганических соединений не содержат углерода.
Кроме того, почти все органические соединения содержат связи углерод-водород или C-H. Обратите внимание, что , содержащее углерод, недостаточно для того, чтобы соединение считалось органическим. Ищите и углерод, и водород.
Вы знали?
Органическая и неорганическая химия — две основные дисциплины химии.Химик-органик изучает органические молекулы и реакции, а неорганическая химия занимается неорганическими реакциями.
Примеры органических соединений или молекул
Молекулы, связанные с живыми организмами, являются органическими. К ним относятся нуклеиновые кислоты, жиры, сахара, белки, ферменты и углеводородное топливо. Все органические молекулы содержат углерод, почти все содержат водород, а многие также содержат кислород.
- ДНК
- столовый сахар или сахароза, C 12 H 22 O 11
- бензол, C 6 H 6
- метан, CH 4
- этанол или зерновой спирт, C 2 H 6 O
Примеры неорганических соединений
Неорганические вещества включают соли, металлы, вещества, состоящие из отдельных элементов, и любые другие соединения, не содержащие углерод, связанный с водородом.Некоторые неорганические молекулы действительно содержат углерод.
- поваренная соль или хлорид натрия, NaCl
- диоксид углерода, CO 2
- алмаз (чистый углерод)
- серебро
- сера
Органические соединения без связей C-H
Некоторые органические соединения не содержат углерод-водородных связей. Примеры этих исключений включают
- четыреххлористый углерод (CCl 4 )
- мочевина [CO (NH 2 ) 2 ]
Органические соединения и жизнь
В то время как большинство органических соединений, встречающихся в химии, производятся живыми организмами, молекулы могут образовываться с помощью других процессов.
Например, когда ученые говорят об органических молекулах, обнаруженных на Плутоне, это не означает, что в мире есть инопланетяне. Солнечное излучение может обеспечить энергию для производства органических соединений из неорганических углеродных соединений.
Пероксиды органические | CAMEO Chemicals
Как правило, материалы этой группы легко воспламеняются. Они ведут себя как сильные окислители и поэтому ускоряют горение других материалов, обеспечивая молекулярный кислород к месту горения.Многие пероксиды нестабильны и подвержены взрывному разложению при ударе, нагревании или трении. Взрывы пероксидов стали причиной многих несчастных случаев со смертельным исходом.
Перекиси — хорошие окислители. Некоторые органические соединения могут воспламениться при контакте с концентрированными пероксидами. Полностью восстановленные материалы, такие как неорганические сульфиды, нитриды и гидриды, могут взрывоопасно реагировать с пероксидами. Есть несколько химических классов, которые, по крайней мере, не выделяют тепла при смешивании с пероксидами. Многие из них производят взрывы или выделяют газы (токсичные и нетоксичные).Обычно разбавленные растворы пероксидов (пероксида бензоила подвергается термическому разложению до CO2, BzOH, C6H6 (и других углеводородов) и дифенилового эфира. (Uetake, et. Al. Chem. Abs. 1974. 81 5175) Газообразный O2 также может быть высвобождается при разложении органических пероксидов (Davies, AG Organic Peroxides. London: Butterworths, 1961. pp. 171). Кроме того, некоторые из них могут также выделять альдегиды при разложении, например диметилпероксид, который при разложении дает формальдегид (Rodd, E.H, Ed. Химия органических соединений. Нью-Йорк: издательство Elsevier Publishing Company, 1951. Vol. Ia с. 327).
Часто очень токсичен и раздражает кожу, глаза и слизистые оболочки.
Пероксиды характеризуются наличием одинарной связи O-O (пероксидной связи). Структура простейшего пероксида, перекиси водорода (h3O2), представляет собой H-O-O-H. Как неорганический пероксид, пероксид водорода входит в категорию неорганических окислителей (группа реакционной способности 44). Органические пероксиды получают путем замены одного или обоих атомов H в этом соединении органическими группами.Гидропероксиды образуются в результате замены только одного из атомов H органической группой. Таким образом, этилгидропероксид имеет формулу C2H5-O-O-H. Некоторые органические соединения образуют опасные уровни взрывоопасных пероксидов за счет самоокисления при контакте с воздухом во время хранения. Эти пероксиды обычно образуются медленно и становятся взрывоопасными при сушке. Многие растворы перекиси ингибируются, чтобы предотвратить разложение с образованием кислорода и других продуктов. Такие реакции часто катализируются примесями в отсутствие ингибирования.Когда это происходит, такое разложение высвобождает очень реактивные свободные радикалы, которые могут инициировать другие реакции: пероксиды широко используются в качестве инициаторов полимеризации. Пероксиды используются в бумажной промышленности (для отбеливания), в производстве текстиля (для отбеливания), в качестве окислителей в реакциях органического синтеза, в качестве вспенивающих агентов и в составах пропеллентов.
Пероксид бензоила, пероксибензойная кислота, пероксид ацетила, гидропероксид кумола, пероксид циклогексанона, пероксид октанила, пероксид диацетонового спирта.

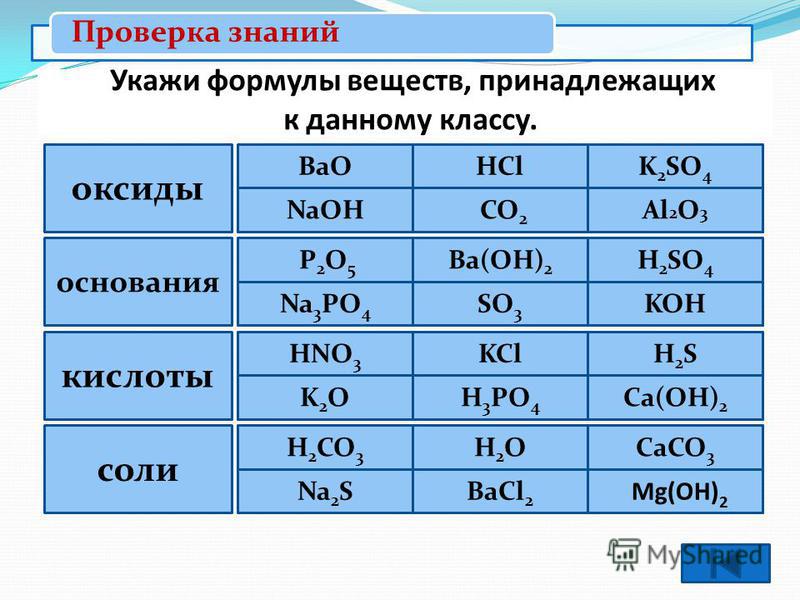 Оксид фосфора (V)
Оксид фосфора (V)

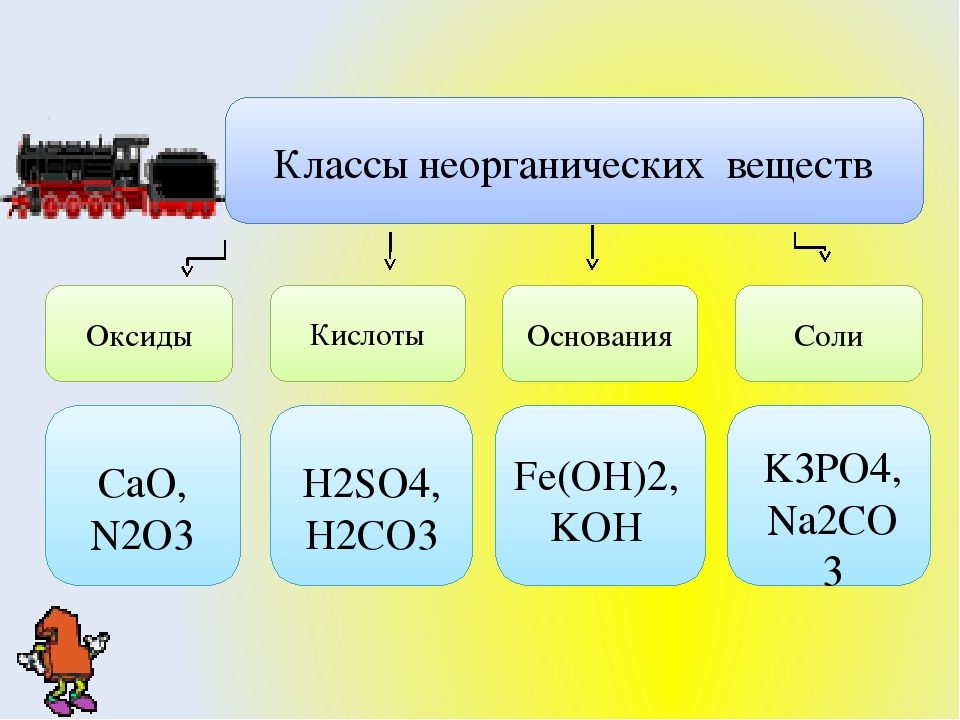
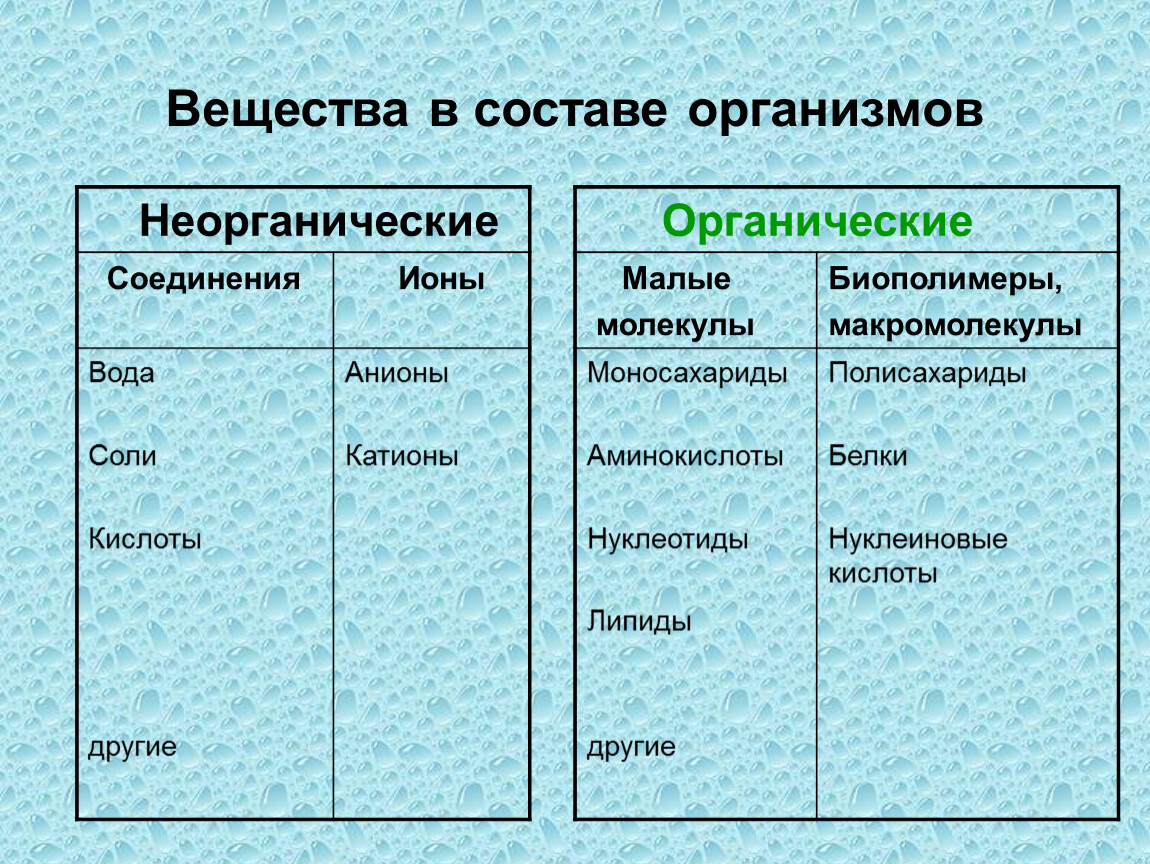 Заварить крахмал + йод
Заварить крахмал + йод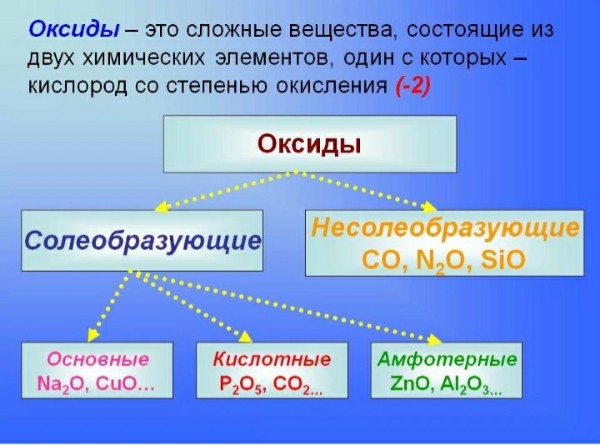 Железный гвоздь и раствор медного купороса
Железный гвоздь и раствор медного купороса