Таблица Менделеева, химические элементы
Таблица Менделеева — общепринятое графическое выражение Периодического закона, открытого Д.И. Менделеевым в 1869 г. Первоначальный вариант таблицы был разработан Менделеевым в 1869—1871 годах. За время существования было предложено более сотни вариантов её изображения, однако наиболее общепринятый вариант представляет собой двумерную таблицу в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Мы постарались описать основные химические элементы Таблицы Менделеева, для подробной информации о них переходите по соответствующей ссылке в таблице. Обращаем ваше внимание, что целью нашего сайта Занимательная химия не является описание химических элементов с научной точки зрения, мы больше сконцентрировались на интересных фактах, которые будут интересны даже детям, не углубляясь в непонятные термины и цифры. Однако, для каждого элемента приводится краткое описание химических свойств в простой и доступной форме.
| ГРУППЫ ЭЛЕМЕНТОВ | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||
| 1 H водород | 2 He гелий | ||||||||
| 3 Li литий | 4 Be бериллий | 5 B бор | 6 С углерод | 7 N азот | 8 O кислород | 9 F фтор | 10 Ne неон | ||
| 11 Na натрий | 12 Mg магний | 13 Al алюминий | 14 Si кремний | 15 P фосфор | 16 S сера | 17 Cl хлор | 18 Ar аргон | ||
| 19 K калий | 20 кальций | 21 Sc скандий | 22 Ti титан | 23 V ванадий | 24 Cr хром | 25 Mn марганец | 26 Fe железо | 27 Co кобальт | 28 Ni никель |
| 29 Cu медь | 30 Zn цинк | 31 Ga галлий | 32 Ge германий | 33 As мышьяк | 34 Se селен | 35 Br бром | 36 Kr криптон | ||
| 37 Rb рубидий | 38 Sr стронций | 39 Y иттрий | 40 Zr цирконий | 41 Nb ниобий | 42 Mo молибден | 43 Tc технеций | 44 Ru рутений | 45 Rh родий | 46 Pd палладий |
| 47 Ag серебро | Cd кадмий | 49 In индий | 50 Sn олово | 51 Sb сурьма | 52 Te теллур | 53 I иод | 54 Xe ксенон | ||
| 55 Cs цезий | 56 Ba барий | 57 La лантан × | 72 Hf гафний | 73 Ta тантал | 74 W вольфрам | 75 Re рений | 76 Os осмий | 77 Ir иридий | 78 Pt платина |
| 79 Au золото | 80 Hg ртуть | 81 Tl таллий | 82 Pb свинец | 83 Bi висмут | 84 Po полоний | 85 At астат | 86 Rn радон | ||
| 87 Fr франций | 88 Ra радий | 89 Ac актиний ×× | Rf резерфордий | 105 Db дубний | 106 Sg сиборгий | 107 Bh борий | 108 Hs хассий | 109 Mt мейтнерий | 110 Ds дармштадтий |
| 111 Rg рентгений | 112 Сn коперниций | 113 Nh нихоний | 114 Fl флеровий | 115 Mc московий | 116 Lv ливерморий | 117 Tn теннесин | 118 Og оганессон | ||
| 57 La лантан | 58 Ce церий | 59 Pr празеодим | 60 Nd неодим | 61 Pm прометий | 62 Sm самарий | 63 Eu европий | 64 Gd гадолиний | 65 Tb тербий | 66 Dy диспрозий | 67 Ho гольмий | 68 Er эрбий | 69 Tm тулий | 70 Yb иттербий | 71 Lu лютеций |
| 89 Ac актиний | 90 Th торий | 91 Pa протактиний | 92 U уран | 93 Np нептуний | 94 Pu плутоний | 95 Am америций | 96 Cm кюрий | 97 Bk берклий | 98 Cf калифорний | 99 Es эйнштейний | 100 Fm фермий | 101 Md менделевий | 102 No нобелий | 103 Lr лоуренсий |
Таблица Менделеева и её значение
Открытие Периодического закона стало важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях была создана стройная таблица Менделеева, на основе которой стало возможным обобщать, делать выводы и предвидеть открытие новых химических элементов.

Список химических элементов Таблицы Менделеева
Список химических элементов упорядочен в порядке возрастания атомных номеров, приводятся обозначения элемента в Таблице Менделеева, латинское и русское названия.
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннесин |
| 118 | Og | Oganesson | Оганессон |
Таблица Менделеева в хорошем качестве
Предлагаем вам скачать несколько вариантов таблицы Менделеева в хорошем качестве, которые можно распечатать на принтере большого формата, как в черно-белом так и в цветном вариантах.
www.alto-lab.ru
ТАБЛИЦА МЕНДЕЛЕЕВА | CHEM-MIND.com
- НОВОСТИ
- КУРС ХИМИИ
- Дополнительные уроки
- Курс химии
- Разбор заданий ЕГЭ
- ТЕСТЫ
- Вариаты ЕГЭ
- Тесты по заданиям
- Тесты по темам
- СТАТЬИ
- ОПЫТЫ
- ТАБЛИЦА МЕНДЕЛЕЕВА
Поиск
- НОВОСТИ
- Новости
Алгоритм обучения для подготовки к ЕГЭ по химии
НовостиОтветы в тестах вновь правильно отображаются!
НовостиТехнические проблемы
НовостиНовый раздел на сайте
НовостиС 8 марта
- Новости
- КУРС ХИМИИ
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
Разбор задания №11 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №10 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №9 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №8 ЕГЭ по химии
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
- ТЕСТЫ
www.chem-mind.com
Справочный материал для ЕГЭ и ОГЭ
Для сдающих ЕГЭ и ОГЭ, отдельной темой выкладываем справочный материал приближенный к тому, что выдают на экзамене:
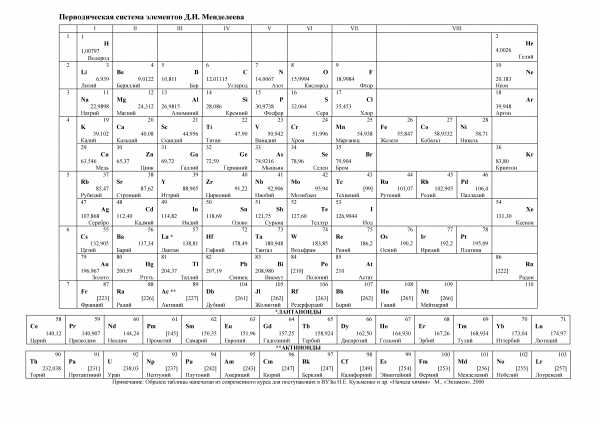 Таблица Менделеева для ЕГЭ и ОГЭ
Таблица Менделеева для ЕГЭ и ОГЭ Таблица растворимости для ЕГЭ и ОГЭ
Таблица растворимости для ЕГЭ и ОГЭwww.chem-mind.com
Описание элемента по положению в Периодической системе элементов Д.И. Менделеева
Тема: Периодический закон и Периодическая система химических элементов Д. И. Менделеева
Урок: Описание элемента по положению в Периодической системе элементов Д. И. Менделеева
В 1869 году Д.И.Менделеев на основе данных накопленных о химических элементах сформулировал свой периодический закон. Тогда он звучал так: « Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов». Очень долго физический смысл закона Д.И.Менделеева был непонятен. Всё встало на свои места после открытия в XX веке строения атома.
Современная формулировка периодического закона: « Свойства простых веществ, также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома».
Заряд ядра атома равен числу протонов в ядре. Число протонов уравновешивается числом электронов в атоме. Таким образом, атом электронейтрален.
Заряд ядра атома в Периодической таблице – это порядковый номер элемента.
Номер периода показывает число энергетических уровней, на которых вращаются электроны.
Номер группы показывает число валентных электронов. Для элементов главных подгрупп число валентных электронов равно числу электронов на внешнем энергетическом уровне. Именно валентные электроны отвечают за образование химических связей элемента.
Химические элементы 8 группы – инертные газы имеют на внешней электронной оболочке 8 электронов. Такая электронная оболочка энергетически выгодна. Все атомы стремятся заполнить свою внешнюю электронную оболочку до 8 электронов.
Какие же характеристики атома меняются в Периодической системе периодически?
— Повторяется строение внешнего электронного уровня.
— Периодически меняется радиус атома. В группе радиус увеличивается с увеличением номера периода, так как увеличивается число энергетических уровней. В периоде слева направо будет происходить рост атомного ядра, но притяжение к ядру будет больше и поэтому радиус атома уменьшается.
— Каждый атом стремится завершить последний энергетический уровень У элементов 1 группы на последнем слое 1 электрон. Поэтому им легче его отдать. А элементам 7 группы легче притянуть 1 недостающий до октета электрон. В группе способность отдавать электроны будет увеличиваться сверху вниз, так ка увеличивается радиус атома и притяжение к ядру меньше. В периоде слева направо способность отдавать электроны уменьшается, потому что уменьшается радиус атома.
— Чем легче элемент отдает электроны с внешнего уровня, тем большими металлическими свойствами он обладает, а его оксиды и гидроксиды обладают большими основными свойствами. Значит, металлические свойства в группах увеличиваются сверху вниз, а в периодах справа налево. С неметаллическими свойствами все наоборот.
Рис. 1. Положение магния в таблице
В группе магний соседствует с бериллием и кальцием. Рис.1. Магний стоит ниже, чем бериллий, но выше кальция в группе. У магния больше металлические свойства, чем у бериллия, но меньше чем у кальция. Основные свойства его оксидов и гидроксидов изменяются также. В периоде натрий стоит левее, а алюминий правее магния. Натрий будет проявлять больше металлические свойства, чем магний, а магний больше, чес алюминий. Таким образом, можно сравнить любой элемент с соседями его по группе и периоду.
Кислотные и неметаллические свойства изменяются противоположно основным и металлическим свойствам.
Характеристика хлора по его положению в периодической системе Д.И.Менделеева.
Рис. 4. Положение хлора в таблице
. Значение порядкового номера 17 показывает число протонов17 и электронов17 в атоме. Рис.4. Атомная масса 35 поможет вычислить число нейтронов (35-17 = 18). Хлор находится в третьем периоде, значит число энергетических уровней в атоме равно 3. Стоит в 7 –А группе, относится к р- элементам. Это неметалл. Сравниваем хлор с его соседями по группе и по периоду. Неметаллические свойства хлора больше чем у серы, но меньше, чем у аргона. Хлор обладает меньшими неметаллическими свойствами, чем фтор и большими чем бром. Распределим электроны по энергетическим уровням и напишем электронную формулу. Общее распределение электронов будет иметь такой вид. См.Рис. 5
|
|
Рис. 5. Распределение электронов атома хлора по энергетическим уровням
Определяем высшую и низшую степень окисления хлора. Высшая степень окисления равна +7, так как он может отдать с последнего электронного слоя 7 электронов. Низшая степень окисления равна -1, потому что хлору до завершения необходим 1 электрон. Формула высшего оксида Cl2O7 (кислотный оксид), водородного соединения HCl.
В процессе отдачи или присоединения электронов атом приобретает условный заряд. Этот условный заряд называется степенью окисления.
— Простые вещества обладают степенью окисления равной нулю.
— Элементы могут проявлять максимальную степень окисления и минимальную. Максимальную степень окисления элемент проявляет тогда, когда отдает все свои валентные электроны с внешнего электронного уровня. Если число валентных электронов равно номеру группы, то и максимальная степень окисления равна номеру группы.
Рис. 2. Положение мышьяка в таблице
Минимальную степень окисления элемент будет проявлять тогда, когда он примет все возможные электроны для завершения электронного слоя.
Рассмотрим на примере элемента №33 значения степеней окисления.
Это мышьяк As.Он находится в пятой главной подгруппе.Рис.2. На последнем электронном уровне у него пять электронов. Значит, отдавая их, он будет иметь степень окисления +5. До завершения электронного слоя атому As не хватает 3 электрона. Притягивая их, он будет иметь степень окисления -3.
Положение элементов металлов и неметаллов в Периодической системе Д.И. Менделеева.
Рис. 3. Положение металлов и неметаллов в таблице
В побочных подгруппах находятся все металлы. Если мысленно провести диагональ от бора к астату, то выше этой диагонали в главных подгруппах будут все неметаллы, а ниже этой диагонали — все металлы. Рис.3.
Используя Периодическую систему можно очень много сказать об элементе. Можно сравнить его с другими элементами, определить строение его атома, электронной оболочки атома.
1. Символ элемента
2. Порядковый номер элемента
3. Значение относительной атомной массы элемента.
4. Число протонов, электронов, нейтронов.
5. Номер периода.
6. Номер и тип группы (тип элемента s -, p -,d -,f — элемент)
7. Металл или неметалл
8. Сравнение свойств элемента (металлических и неметаллических) с соседними элементами по периоду и группе.
9. Написать распределение электронов по атомным орбиталям – квантовую диаграмму.
10. Написать электронную формулу.
11. Зарисовать распределение электронов по энергетическим уровням
12. Определить высшую степень окисления атома и формулу его высшего оксида. Определить характер оксида (основной, кислотный, амфотерный).
13. Определить низшую степень окисления элемента и формулу его водородного соединения (если такое есть).
Подведение итога урока
На этом уроке вы узнали о Периодическом законе Менделеева, который описывает изменение свойств простых тел, а также формы и свойства соединений элементов в зависимости от величины их атомных масс. Рассмотрели, как по положению в Периодической системе можно описать химический элемент.
Список рекомендованной литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с .
Рекомендованные ссылки на ресурсы интернет
1. Chemport.ru (Источник).
2. Химик (Источник).
Рекомендованное домашнее задание
1. №№ 1-4 (с.125) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Какие характеристики атома изменяются периодичности ?
3. Дайте характеристику химического элемента кислорода по его положению в Периодической системе Д.И.Менделеева.
interneturok.ru
Таблица Менделеева
Выбор статьи по меткам03 (1)9 класс (3)10 класс (1)11 класс (2)12 (1)13 (С1) (3)14 ноября (2)14 февраля (1)15 задание ЕГЭ (2)16 задача профиль (1)18 (С5) (2)18 задача ЕГЭ (2)23 марта (1)31 января (1)2016 (2)140319 (1)14032019 (1)C5 (1)RC-цепь (1)А9 (1)Александрова (2)Ампера (1)Архимед (1)Бернулли (1)Бойля-Мариотта (1)В8 (1)В12 (1)В13 (1)В15 (1)ВК (1)ВШЭ (2)ГИА физика задания 5 (1)Герона (1)Герцшпрунга-Рассела (1)Гринвич (1)ДВИ (1)ДПТ (1)Десятичные приставки (1)Дж (1)Диэлектрические проницаемости веществ (1)ЕГЭ 11 (2)ЕГЭ 14 (1)ЕГЭ 15 (2)ЕГЭ 18 (1)ЕГЭ С1 (1)ЕГЭ по математике (25)ЕГЭ по физике (49)ЕГЭ профиль (6)Европа (1)Задача 17 ЕГЭ (6)Задачи на движение (1)Закон Архимеда (2)Законы Ньютона (1)Земля (1)Ио (1)КПД (9)Каллисто (1)Кельвин (1)Кирхгоф (1)Кирхгофа (1)Койпера (1)Колебания (1)Коши (1)Коэффициенты поверхностного натяжения жидкостей (1)Кулона-Амонтона (1)Ломоносов (2)Лоренца (1)Луна (1)МГУ (1)МКТ (7)Максвелл (2)Максвелла (1)Максимальное удаление тела от точки бросания (1)Менделеева-Клапейрона (3)Менелая (3)Метод наложения (2)Метод узловых потенциалов (1)Метод эквивалентных преобразований (1)НОД (1)Нансен (1)НеИСО (1)ОГЭ (11)ОГЭ (ГИА) по математике (27)ОГЭ 3 (ГИА В1) (1)ОГЭ 21 (3)ОГЭ 21 (ГИА С1) (4)ОГЭ 22 (2)ОГЭ 25 (3)ОГЭ 26 (1)ОГЭ 26 (ГИА С6) (1)ОГЭ по физике 5 (1)ОДЗ (12)Обыкновенная дробь (1)Оорта (1)Основные физические константы (1)Отношение объемов (1)Плюк (1)Показатели преломления (1)Показательные неравенства (1)Противо-эдс (1)Работа выхода электронов (1)Радиус кривизны траектории (1)Релятивистское замедление времени (1)Релятивистское изменение массы (1)С1 (1)С1 ЕГЭ (1)С2 (2)С3 (1)С4 (3)С6 (5)СУНЦ МГУ (2)Сиена (1)Синхронная машина (1)Снеллиуса (2)Солнечной системы (1)Солнце (2)СпБ ГУ вступительный (1)Средняя кинетическая энергия молекул (1)Статград физика (3)Таблица Менделеева (1)Текстовые задачи (8)Тьерри Даксу (1)ФИПИ (1)Фазовые переходы (1)Фаренгейт (1)Фобос (1)Френеля (1)Цельсий (1)ЭДС (6)ЭДС индукции (1)Эйлера (1)Электрохимические эквиваленты (1)Эрастофен (1)абсолютная (1)абсолютная влажность (2)абсолютная звездная величина (3)абсолютная температура (1)абсолютный ноль (1)адиабаты (1)аксиомы (1)алгоритм Евклида (1)алгоритм Робертса (1)аморфное (1)амплитуда (3)аналитическое решение (1)анекдоты (1)апериодический переходной процесс (2)аргумент (1)арифметическая прогрессия (5)арифметической прогрессии (1)арки (1)арккосинус (1)арккотангенс (1)арксинус (1)арктангенс (1)архимеда (3)асинхронный (1)атмосферное (2)атомная масса (2)афелий (2)база (1)балка (1)банк (1)без калькулятора (1)белого карлика (1)бензин (1)бесконечная периодическая дробь (1)бесконечный предел (1)биквадратные уравнения (1)бипризма (1)биссектриса (3)биссектрисы (2)благоприятный исход (1)блеск (4)блок (2)боковой поверхности (1)большая полуось (1)большем давлении (1)бревно (1)бригада (2)бросили вертикально (1)бросили под углом (3)бросили со скоростью (2)броуновское движение (1)брошенного горизонтально (2)бруски (1)брусок (2)брусок распилили (1)быстрый способ извлечения (1)вариант (3)вариант ЕГЭ (12)вариант ЕГЭ по физике (18)варианты ЕГЭ (6)вариент по физике (1)введение дополнительного угла (1)вектор (5)векторное произведение (2)велосипедисты (1)вероятность (1)вертикальная составляющая (1)вертикально вверх (1)вертикальные углы (1)вес (3)весов (1)вес тела (1)ветви (1)ветвь (2)ветер (1)взаимодействие зарядов (1)видеоразбор (2)видеоразбор варианта (1)видимая звездная величина (2)виртуальный банк (1)виртуальных перемещений (1)витка (1)витков (1)виток (1)вклад (1)влажность (3)влажность воздуха (1)влетает (2)вневписанная окружность (2)внутреннее сопротивление (1)внутреннее сопротивление источника (1)внутреннюю энергию (1)внутренняя энергия (8)вода течет (1)воды (1)возведение в квадрат (1)возвратное уравнение (1)возвратность (1)возвратные уравнения (2)воздушный шар (1)возрастающая (1)возрастет (1)волны (1)вписанная окружность (3)вписанной окружности (1)вписанный угол (4)в правильной пирамиде (1)вращение (1)времени (2)время (24)время в минутах (1)время выполнения (1)время движения (2)время падения (1)всесибирская олимпиада (1)в стоячей воде (1)встретились (1)встретятся (1)вступительный (1)вступительный экзамен (1)вторая половина пути (1)вторичная (1)вторичная обмотка (1)вторичные изображения (1)второй закон Ньютона (4)выбор двигателя (1)выборка корней (4)выколотая точка (1)выплаты (2)выразить вектор (1)высота (5)высота Солнца (1)высота столба (1)высота столба жидкости (1)высота столбика (1)высоте (3)высоту (1)высоты (3)выталкивающая сила (2)вычисления (1)газ (3)газа (1)газов (1)газовая атмосфера (1)галочка (1)гамма-лучей (1)гармоника (2)гвоздя (1)геометрическая вероятность (1)геометрическая прогрессия (4)геометрические высказывания (1)геометрический смысл (2)геометрическую прогрессию (1)геометрия (6)гигрометр (1)гидродинамика (1)гидростатика (3)гимназия при ВШЭ (1)гипербола (2)гипотенуза (3)гистерезисный двигатель (1)главный период (1)глубина (1)глухозаземленная нейтраль (1)гомотетия (2)гонщик (1)горизонтальная сила (1)горизонтальной спицы (1)горизонтальную силу (1)гравитационная постоянная (1)градус (1)грани (2)график (2)графики функций (5)графически (1)графический способ (1)графическое решение (2)груз (2)грузик (2)группа (1)давление (28)давление жидкости (3)давление пара (1)дальность полета (1)двигатель с активным ротором (1)движение под углом (1)движение под углом к горизонту (4)движение по кругу (1)движение по течению (1)движение с постоянной скоростью (2)двойное неравенство (1)двойной фокус (1)двугранный угол при вершине (1)девальвация (1)действительная часть (1)действующее значение (2)деление (1)деление многочленов (2)деление уголком (1)делимость (2)делимость чисел (1)делитель (1)демонстрационный варант (1)деталей в час (1)диаграмма (1)диаметр (2)диаметру (1)динамика (4)диод (1)диск (1)дискриминант (4)дифракционная решетка (2)дифференцированный платеж (1)диффузия (1)диэлектрик (1)диэлектрическая проницаемость (1)длина (4)длина вектора (1)длина волны (7)длина отрезка (2)длина пружины (1)длина тени (1)длиной волны (2)длину нити (1)длительность разгона (1)длительный режим (1)добротность (1)догнал (1)догоняет (1)докажите (1)долг (1)доля (1)дополнительный угол (1)досок (1)досрочный (2)досрочный вариант (1)дптр (1)дуга (1)единицы продукции (1)единичный источник (1)единичных кубов (1)единственный корень (1)ежесекундно (1)емкость (7)емкость заряженного шара (1)естественная область определения (1)желоб (1)жесткость (6)жеткость (1)живая математика (2)жидкости (1)жидкость (1)завод (1)загадка (2)задание 13 (2)задание 15 (3)задание 23 (1)задания 1-14 ЕГЭ (1)задача 13 профиль (1)задача 14 профиль (3)задача 16 (1)задача 16 ЕГЭ (1)задача 16 профиль (3)задача 17 (1)задача 18 (1)задача 26 ОГЭ (2)задача с параметром (6)задачи (1)задачи на доказательство (4)задачи на разрезание (4)задачи на совместную работу (3)задачи про часы (1)задачи с фантазией (1)задерживающее напряжение (1)заземление (1)заказ (1)закон Бернулли (1)закон Гука (1)закон Ома (3)закон Снеллиуса (1)закона сохранения (1)закон движения (1)закон кулона (7)закон сложения классических скоростей (1)закон сохранения импульса (6)закон сохранения энергии (4)законы Кирхгофа (6)законы коммутации (1)законы сохранения (1)закрытым концом (1)замена переменной (2)замкнутая система (2)зануление (1)запаянная (2)заряд (9)заряда (1)заряд конденсатора (1)защитная характеристика (1)звездочка (1)звезды (1)зенит (1)зенитное расстояние (1)зеркало (2)знак неравенства (1)знаменатель (1)знаменатель прогрессии (4)значение выражения (1)идеальный блок (1)идеальный газ (5)извлечение в столбик (1)излом (1)излучение (2)изменение длины (2)изобара (1)изобаричесикй (1)изобарический (2)изобарный (1)изобарный процесс (1)изображение (3)изолированная нейтраль (1)изопроцессы (1)изотерма (2)изотермический (2)изотермический процесс (1)изотоп (1)изохора (1)изохорический (1)изохорный процесс (1)импульс (9)импульса (1)импульс силы (1)импульс системы (1)импульс системы тел (4)импульс тела (4)импульс частицы (1)инвариантность (1)индуктивно-связанные цепи (1)индуктивное сопротивление (1)индуктивность (1)индукцией (1)индукция (7)интеграл Дюамеля (1)интервал (1)интересное (3)интерференционных полос (1)иррациональность (2)испарение (2)исследование функции (4)источник (1)источник света (1)исход (1)камень (1)камешек (1)капилляр (1)карлик (2)касательная (4)касательного (1)касательные (1)касаются (1)катер (2)катет (3)катушка (4)качаний (2)квадлратичная зависимость (1)квадрант (1)квадрат (3)квадратичная функция (3)квадратное уравнение (4)квадратную рамку (1)квазар (1)квант (1)квантов (1)кинематика (2)кинематическая связь (1)кинематические связи (1)кинетическая (12)кинетическая энергия (4)кинетической (1)кинетической энергии (1)кинетическую энегрию (1)классический метод (3)классический метод расчета (1)клин (1)ключ (1)кодификатор (1)колебаний (1)колене (1)количество вещества (1)количество теплоты (9)коллектор (1)кольцо (2)комбинаторика (1)коммутация (1)комплексное сопротивление (1)комплексное число (1)комплексные числа (1)компонент (1)конвекция (3)конденсатор (10)конденсаторы (1)конечная скорость (1)конечная температура (1)конечная температура смеси (1)конечный предел (1)консоль (1)контрольная (1)контрольные (1)контур (5)конус (4)концентрация (7)концентрическим (1)координата (5)координаты (3)координаты вектора (2)координаты середины отрезка (1)координаты точки (1)корабля (1)корень (2)корень квадратный (1)корень кубический (1)корни (2)корни иррациональные (1)корни квадратного уравнения (3)корни уравнения (1)корпоративных (1)косинус (2)косинусы (1)котангенс (1)коэффициент (1)коэффициент жесткости (1)коэффициент наклона (3)коэффициент поверхностного натяжения (3)коэффициент подобия (5)коэффициент трансформации (1)коэффициент трения (5)коэффициенты (1)красное смещение (1)красной границы (1)красный (1)кратковременный режим (1)кратные звезды (1)кредит (11)кредитная ставка (4)кредиты (1)криволинейная трапеция (2)кристаллизация (1)критерии оценки (1)круговая частота (1)круговой контур (1)кружок (1)кубическая парабола (1)кулонова сила (1)кульминация (1)кусочная функция (1)левом колене (1)лед (1)лет (1)линейная скорость (2)линейное напряжение (1)линейное уравнение (2)линейный размер (1)линза (2)линзы (2)линии излома (1)линиями поля (1)линия отвеса (1)литров (1)лифт (1)лифта (1)лифте (1)логарифм (8)логарифмические неравенства (3)логарифмические уравнения (1)логарифмическое неравенство (3)логарифмы (1)лучевая (1)льда (1)магнитное поле (2)магнитном поле (2)магнитные цепи (1)максимальная высота (1)максимальная скорость (1)малых колебаний (1)масса (23)массе (1)массивная звезда (1)массовое содержание (1)массой (1)массу (1)математика (4)математический маятник (1)математического маятника (1)маятник (4)мгновенный центр вращения (1)медиана (1)меридиан (1)мертвая вода (1)мертвая петля (1)метод внутреннего проецирования (1)метод замены переменной (4)метод интервалов (3)метод комплексных амплитуд (3)метод контурных токов (1)метод координат (1)метод линий (1)методом внутреннего проецирования (1)метод переменных состояния (1)метод подстановки (4)метод рационализации (4)метод решетки (1)метод следов (5)метод сложения (4)метод телескопирования (1)метод узловых напряжений (1)методы расчета цепей (2)методы расчета цепей постоянного тока (1)метод эквивалентного генератора (2)механика (1)механическая характеристика (1)механическое напряжение (1)миля (1)минимальная скорость (1)минимальной высоты (1)минимальной скоростью (1)минимум (1)мишени (1)мнимая единица (1)мнимая часть (1)многоугольник (1)многочлены (1)мода (2)модули (1)модуль (13)модуль Юнга (1)модуль средней скорости (1)молекулярно-кинетическая теория (2)моль (2)молярная масса (5)момент (7)момент инерции (1)момент инерции двигателя (1)момент нагрузки (1)момент сил (1)монотонная (1)монотонность функции (1)монохроматического (1)мощности силы тяжести (1)мощность (8)мощностью (1)мяч (1)наблюдатель (1)нагревание (1)нагреватель (1)нагревателя (1)нагрели (1)наибольшее (1)наивысшая точка (1)наименьшее (1)наименьшее общее кратное (1)наклон (1)наклонная плоскость (2)налог (1)на подумать (2)направление (1)направление обхода (3)направлении (1)направляющий вектор (1)напряжение (9)напряжение на зажимах (1)напряжение смещения нейтрали (2)напряженность (4)напряженность поля (6)насос (1)насоса (1)насыщенный пар (4)натяжение нити (5)натяжения (1)находился в полете (2)начальная температура (1)начальной скоростью (1)недовозбуждение (1)незамкнутая система (2)нелинейное сопротивление (1)неопределенность типа бесконечность на бесконечность (1)неопределенность типа ноль на ноль (1)непериодическая дробь (1)неравенства (8)неравенство (21)неразрывности струи (1)нерастяжимой (1)нерастяжимой нити (1)нерастянутой резинки (1)несимметричная нагрузка (1)несинусоидальный ток (3)нестандартные задачи (1)нестрогое (1)неупругим (1)нецентральный (1)нечетная функция (2)нечетное (1)нечетность (1)неявнополюсный (1)нити (2)нити паутины (1)нить (2)нить нерастяжима (1)новости (1)нормаль (1)нормальное ускорение (11)нулевой ток (2)обкладками (1)обкладках (1)обкладки (1)область допустимых значений (9)область значений (1)область определения (8)область определения функции (4)оборот (1)обратные тригонометрические функции (1)обратные функции (1)общая хорда (1)общее сопротивление (1)общее сопротивление цепи (1)объем (36)объемный расход (1)объемом (1)объем пара (1)объем параллелепипеда (1)объем пирамиды (1)одинаковые части (1)одновременно из одной точки (1)окружность (13)окружность описанная (1)олимпиада (2)олимпиады по физике (2)они встретятся (1)операторный метод (4)оптика (1)оптимизация (1)оптическая разность хода (1)оптический центр (1)орбитам (1)орбитой (1)оригинал (1)осевое сечение (1)оси (1)основание (2)основание логарифма (2)основания трапеции (1)основное тригонометрическое тождество (1)основное уравнение МКТ (2)основной газовый закон (1)основной период (1)основной уровень (1)основные углы (1)остаток (1)ось (1)отбор корней (5)ответ (1)отданное (1)относительная (1)относительная влажность (3)относительно (2)относительность движениия (1)относительность движения (2)отношение (5)отношение времен (1)отношение длин (1)отношение площадей (3)отношение скоростей (2)отрезок (1)отсечение невидимых граней (1)очки (1)падает (1)падает луч (1)падает под углом (1)падение (3)падение напряжения (2)пар (3)парабола (5)параболы (1)параллакс (5)параллелепепед (2)параллелепипед (3)параллелограмм (4)параллелограмм Виньера (1)параллельно (2)параллельно двум векторам (1)параллельное соединение (3)параллельные прямые (1)параллельными граням (1)параметр (29)параметры (1)парообразование (1)парсек (1)парциальное (1)парциальное давление (1)паскаль (1)первая треть (1)первичная (1)перевозбуждение (1)перегородка (1)перегрузок (1)переливания (1)переменное магнитное поле (1)переменное основание (2)перемещение (6)перемычка (4)перемычку (1)переносная скорость (1)пересекает (1)пересечение (1)пересечения (1)переходная проводимость (1)переходное сопротивление (1)переходной процесс (1)переходные процессы (9)перигелий (2)периметр (3)период (15)периодическая дробь (1)период колебаний (2)период малых колебаний (1)период обращения (2)период функции (1)периоды (1)перпендикулярно (1)песок (1)пион (1)пипетка (1)пирамида (7)пирамида шестиугольная (1)пирамиды (2)пирсона (1)плавание (1)плавкие предохранители (1)плавление (1)план (1)планете (1)планеты (3)планиметрия (12)планиметрия профиль (1)пластинами (1)пластинка (1)платеж (8)плечо (2)плоского зеркала (1)плоскопараллельная (1)плоскость (4)плоскость сечения (1)плотности веществ (1)плотность (22)плотность пара (3)плотность сосуда (1)плотность энергии (1)площади (2)площади фигур на клетчатой бумаге (1)площадь (29)площадь круга (1)площадь пластин (1)площадь поверхности (1)площадь под кривой (2)площадь проекции (1)площадь проекции сечения (1)площадь сектора (1)площадь сечения (5)площадь треугольника (1)поверхностная плотность заряда (1)поворот (1)повторно-кратковременный режим (1)погрешность (1)погружено (1)подготовка к контрольным (3)под каким углом (1)подмодульное (1)подмодульных выражений (1)подобен (1)подобие (7)подобия треугольников (1)подобны (1)подпереть (1)под углом (2)под углом к горизонту (2)показателем преломления (1)показатель преломления (4)поле (1)полезной работы (1)полезную мощность (1)полигон частот (1)по линиям сетки (1)полное ускорение (1)половина времени (1)половинный угол (1)положительный знаменатель (1)полония (1)полость (1)полуокружность (1)полупроводник (1)полученное (1)понижение горизонта (1)по окружности (1)по переменному основанию (1)поправка часов (1)по прямой (1)поршень (4)порядок решетки (2)последовательно (1)последовательное соединение (3)последовательность (1)по сторонам клеток (1)посторонние корни (4)постоянная Авогадро (1)постоянная Хаббла (1)постоянная времени (1)постоянная скорость (1)постоянная составляющая (2)постоянный ток (5)построение (2)построение графика функции (1)потенциал (5)потенциал шара (1)потенциальная (13)потенциальная энергия (3)потенциальной (1)потери в стали (2)потеря корней (4)поток (5)по физике (1)правило левой (1)правило моментов (3)правильную пирамиду (1)правильный многоугольник (1)правом колене (1)предел функции (1)преломляющий угол (1)преобразование графиков функций (1)преобразования (1)преподаватели (2)пресс (2)призма (6)призмы (3)признаки подобия (4)признаки равенства треугольников (3)пробн (1)пробник (122)пробниук (1)пробный ЕГЭ (2)пробный ЕГЭ по физике (3)пробный вариант (25)пробный вариант ЕГЭ (17)пробный вариант ЕГЭ по физике (51)пробный вариант по физике (1)провода (1)проводник (1)проводник с током (1)проводящего шара (1)проволока (1)проволоки (1)прогрессия (2)проекции ускорения (2)проекция (6)проекция перемещения (1)проекция скорости (4)проекция ускорения (2)производительность (2)производная (2)промежуток (1)промежуток знакопостоянства (1)пропорциональны (1)проскальзывает (1)проскальзывания (1)противоположное событие (1)противостояние (1)протона (1)прототипы (1)профиль (2)профильный ЕГЭ (1)процент (5)процентная ставка (6)процентное отношение (1)процентное содержание (2)проценты (3)пружин (1)пружина (6)пружинный маятник (1)пружины (1)прямая (6)прямое восхождение (2)прямой (1)прямой АВ (1)прямоугольник (1)пузырек (1)пульсар (1)пуля (1)пути (1)путь (26)пять корней (1)работа (14)работа газа (5)работа тока (1)работу выхода (2)рабочее тело (1)рабочие (1)равнобедренный (1)равновесие (4)равновесия (1)равновесное (1)равнодействующая (1)равноускоренно (2)равноускоренное (3)равные (1)равные фигуры (1)радиальную ось (1)радикал (1)радиус (10)радиус колеса (1)радиус кривизны (2)радиус описанной сферы (1)радиус темного кольца в отраженном свете (1)разбор (1)разложение на множители (2)размах (1)разности температур (1)разность (1)разность потенциалов (2)разность прогрессии (3)разность хода (1)разрежьте (2)разрезание (5)разрешающая сила (1)разрыв функции (1)рамка (8)рамка с током (1)раскрытие модуля (1)расписание (1)расположение корней квадратного трехчлена (1)распределение частот (1)рассеивающая (1)расстояние (21)расстояние между зарядами (1)расстояние на карте (1)расстояние от точки (1)расстояния (2)раствор (2)растяжение (2)расходуется (1)расцепители (1)расчеты по формулам (1)рационализация (4)рациональные неравенства (1)реактивные элементы (1)реактивный двигатель (1)реакция опоры (4)реакция якоря (1)ребра (1)ребус (2)резервуар (1)резистор (1)рейки (1)рельса (1)рентгеновскую трубку (1)репетитор (1)решебник (1)решение тригонометрических уравнений (1)решение уравнений (2)решение уравнений больших степеней (1)розетка (1)ромб (1)ряд Фурье (1)сарай с покатой крышей (1)сближаются (1)сближения (1)сбрасывают с высоты (1)сверхгигант (2)сверхновая (1)светимость (3)свободно (1)свободного падения (1)свободно падает (2)свойства (2)свойства отрезков (1)свойства степени (1)свойства функции (1)свойства функций (2)свойства чисел (1)свойство биссектрисы (2)свойству биссектрисы (1)сдвинуть (1)сектор (1)секущая (2)серия решений (1)сертификация (6)сессия (1)сечение (14)сечение наклонной плоскостью (1)сидерический (1)сила (7)сила Архимеда (5)сила Лоренца (4)сила ампера (9)сила взаимодействия (4)сила давления (1)сила на дно (1)сила натяжения (7)сила натяжения нити (4)сила поверхностного натяжения (3)сила реакции опоры (1)сила трения (3)сила тяготения (1)сила тяжести (5)сила упругости (2)силой (2)силу (1)силу натяжения (1)силы трения (2)символический метод (3)симметричная нагрузка (1)симметрия (3)синодический (1)синус (3)синусоида (1)синусоидальный закон (1)синусоидальный ток (5)синусы (1)синхронный компенсатор (1)система (3)система неравенств (7)система отсчета (2)система счисления (1)система уравнений (3)системы уравнений (3)скалярное произведение (3)склонение (1)скольжение (2)скользит равномерно (1)скоросмть (1)скоростей (1)скорости (3)скорости течения (1)скорость (41)скорость реки (1)скорость сближения (3)скорость света (1)скорость теплохода (1)скорость удаления (1)скорость частицы (1)скоростью (1)с лестницы (1)сложение векторов (1)сложная функция (1)смежные углы (1)смекалка (2)смеси (1)смешанное число (1)смещение (2)снаряд (1)собирающая (2)событие (1)соединение звездой (1)соединение треугольником (1)сокращение (1)сокращение дробей (1)соленоид (1)солнечная постоянная (3)солнечная система (1)сообразительность (1)сообщающиеся сосуды (2)соприкосновения (1)сопротивление (13)сопротивления (1)сопряженное (3)составить квадрат (1)составляет с направлением (1)составляющая скорости (2)составляющие (1)составляющие скорости (3)сосуд (1)сосудах (1)сосуде (1)сохранение энергии (1)спектра (2)спектральный класс (2)спецификация (1)спирт (1)сплава (1)сплавы (1)справочные данные (3)справочные материалы (12)спрос (1)сравнение чисел (2)среднее (1)среднее значение (1)среднеквадратичная скорость (1)среднюю линию (1)средняя квадратичная скорость (1)средняя скорость (6)срок (1)срок кредитования (1)стадии (1)стакан (2)статград (12)статика (2)стенка (1)степенная функция (1)степенные уравнения (1)степень (2)стереометрия (4)стержень (3)стержня (1)столб жидкости (3)столбик (3)столбик жидкости (2)столбик ртути (1)столбчатая диаграмма (1)стрелки поравняются (1)строгое (1)струю (1)студенты (2)ступеньку (1)сумма прогрессии (1)суммарный импульс (1)сумма ряда (1)сумма углов (2)суммирование (2)сумму (1)суперпозиция (1)сутки (1)сфера (5)сферы (2)таблица (1)таблица частот (1)тангенс (3)тангенс разности (1)тангенс суммы (1)тангенциальная (1)тангенциальное ускорение (1)твердое тело (1)тела вращения (1)тележка (1)телескоп (1)телескопирование (1)тело (1)температура (21)температурный коэффициент сопротивления (1)температуры (1)тени (1)тень (1)теорема Пифагора (3)теорема Штейнера (1)теорема виета (5)теорема косинусов (4)теорема синусов (2)теореме косинусов (1)теоремы (1)теоретическое разрешение (1)теория вероятности (1)теплового двигателя (1)тепловое действие (1)тепловое равновесие (2)тепловой баланс (1)тепловой двигатель (1)теплоемкость (1)теплообмен (1)теплопередача (4)теплопроводность (2)теплота (1)теплота сгорания (1)теплоты (4)техника быстрого счета (1)товар (1)ток (11)ток насыщения (1)топливо (1)точечный источник (1)точка касания (1)точка росы (1)точки перемены знака (1)траектории (1)траекторию (1)траектория (1)транзистор (1)трансформатор (1)трапеция (4)трение (1)тренировочная работа (1)тренировочная статград (1)тренировочные работы (1)тренировочный вариант (21)тренировочный вариант ЕГЭ (54)тренировочный вариант ЕГЭ по физике (4)трения (2)трения покоя (1)трения скольжения (1)треугольная пирамида (1)треугольник (3)треугольник Паскаля (1)треугольника (1)треугольники (2)треугольник перемещений (1)трехфазные цепи (2)тригонометрические выражения (2)тригонометрические уравнения (1)тригонометрия (9)троса (1)трубка (5)трубы (1)увеличение (1)угловая скорость (2)угловая частота (2)угловой скоростью (3)углом (1)углы (3)угол между боковыми ребрами (1)угол между векторами (1)угол между плоскостями (2)угол между прямой и плоскостью (1)угол между прямыми (1)угол наклона (1)уголь (12)удар (1)удельная (1)удельная теплоемкость (2)удельная теплота (1)удельная теплота парообразования (2)удельное сопротивление (1)удержать (1)удлинение (3)узел (2)узкую трубку (1)умножение (1)умножение вектора на число (1)умножение на пальцах (1)упростить (1)упрощение (3)упрощение выражений (1)упругий удар (1)уравнение (5)уравнение Менделеева-Клапейрона (8)уравнение окружности (2)уравнение плоскости (3)уравнение теплового баланса (1)уравнению (1)уравнения (2)уравнения высоких степеней (1)уравнения высших степеней (1)урана (1)усеченный конус (1)ускорение (27)ускорением (1)ускорение свободного падения (4)ускорений (1)ускоряющая разность потенциалов (1)условие плавания (2)условие равновесия (1)условия возврата (1)фазное напряжение (1)фигуры (2)физика (29)физика статград (1)фиолетовый (1)фирмы (1)фокальная плоскость (1)фокус (5)фокусное расстояние (1)формула (1)формула Герона (1)формула Пика (1)формулы сокращенного умножения (2)фотон (4)фотонов (1)функции (1)функция (1)холодильник (1)холодильнику (1)хорда (3)целые числа (1)цель (1)центральный угол (4)центр вращения (1)центр масс (1)центр масс системы (1)центробежная сила (1)центростремительное ускорение (1)центр тяжести (1)центр тяжести системы (1)цепи постоянного тока (13)цепь второго порядка (1)цепь первого порядка (4)цикл Карно (1)циклическая частота (3)цилиндр (2)часовой угол (1)части (4)частица (2)частных клиентов (1)частота (10)частота излучения (1)часть объема (1)человека (1)черная дыра (1)четная функция (3)четность (1)
easy-physic.ru
Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона
Тема: Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
Урок: Структура Периодической системы химических элементов. Объяснительная и предсказательная функции периодического закона
В начале XX века было открыто строение атома и стало ясно, что свойства химических элементов находятся в периодической зависимости не от атомных масс, а от заряда ядра атома, т. е. числа протонов в ядре.

Рис. 1. «Длинная» форма таблицы
Дальнейшее развитие Периодической системы заключалось в том, что ученые заполняли пустые клетки в таблице Менделеева: открыли семейство благородных газов. Открывались естественно и искусственно полученные радиоактивные элементы. В 2010 году был открыт последний 117 химический элемент, 7 периода Периодической системы.
Таким образом, перед учеными встал вопрос о нижней границе Периодической системы, который остается открытым до сих пор.
Чаще всего можно увидеть три формы выражения Периодической системы: короткая или короткопериодная, длинная или длиннопериодная или сверхдлинная.
В короткой форме таблица изображена на Рис. 2.
1-3 периоды занимают по 1 строке, 4-ый и последующие периоды занимают по 2 строчки. Символы элементов главных и побочных подгрупп выравниваются относительно разных краев клеток. Лантаноиды и актиноиды вынесены из общей таблицы.
В длинном варианте лантаноиды и актиноиды вынесены из общей таблицы, соответственно, так же как и в короткой, делая её более компактной. Нет главных и побочных подгрупп. Каждый период занимает ровно одну строчку. Рис. 1.

Рис. 2. «Короткая форма»
Рис. 3. Клеточка таблицы
Каждая клеточка Периодической системы содержит символ одного химического элемента, у которого указан порядковый номер и значения относительной атомной массы элемента. Рис. 3.
Период начинается щелочным металлом и заканчивается инертным газом.
Всего периодов семь. Исключением является 1-ый период. В его состав входит только 2 химических элемента: водород, который не считается щелочным металлом, и гелий.
1-ый, 2-ой , 3-ий периоды называются малыми. Они содержат 2 и 8 химических элементов и состоят из одного ряда.
4-7 периоды называются большими. 4-ый и 5-ый периоды включают в себя 18 элементов. 6-ой и 7-й состоят из 32 элементов. В 6-ом и 7-ом периодах есть группы, состоящие из 14 элементов. В 6-ом периоде эти элементы схожи по свойствам с лантаном, а в 7-ом – с актинием. Эти элементы вынесены за основную таблицу и называются лантаноиды и актиноиды. Они обладают одинаковыми свойствами.
Совокупность переходных металлов в каждом периоде называется вставной декадой, потому что этих металлов в каждом периоде 10.
Рис. 4. Вторая группа
Группой называется вертикальный ряд химических элементов. Все элементы группы имеют одинаковое число валентных электронов.
Группы в короткой форме таблицы делятся на главную «А» и побочную «Б» подгруппы.
В каждой главной подгруппе с ростом порядкового номера элемента химические свойства меняются от неметаллических на металлические.
В побочную подгруппу включаются только металлы, называемые переходными элементами.
Если подгруппа начинается элементами малого периода – это главная подгруппа. Подгруппа, которая начинается элементами большого периода, – это побочная подгруппа. Например, рассмотрим II группу периодической системы. Рис. 4.
Бериллий Be – элемент 2-го периода.
Он начинает столбик элементов главной подгруппы. В её состав входят: Be. Mg, Ca, Sr, Ba, Ra.
Цинк Zn начинает побочную подгруппу, так как он входит в состав 4-го периода. В побочную подгруппу входит Zn, Cd, Hg.
Рис. 5. Химический элемент бром
Рассмотрим элемент Br. Рис. 5. Его порядковый номер – 35, относительная атомная масса – 80. Находится в 4-ом периоде, в 7-ой главной подгруппе.
Рис. 6. Химический элемент платина
Рассмотрим элемент платину. Рис. 6.
Символ – Pt, порядковый номер – 78, относительная атомная масса – 195. Находится в 6-м периоде, в 8-й побочной подгруппе.
В состав каждой группы входит элементы с одинаковым числом валентных электронов. Следовательно, они будут обладать схожими химическими свойствами.
Это отражается в названии некоторых групп элементов.
— Например, элементы главной подгруппы 1-ой группы – Li, Na, K, Rb, Cs, Fr – называются щелочные металлы.
— Элементы главной подгруппы 2-ой группы – Ca, Sr, Ba, Ra – называются щелочноземельные металлы.
— Халькогены O, S, Se, Te, Po – элементы 6-й группы главной подгруппы.
— Галогены: F, Cl, Br, J, At – элементы 7-й группы главной подгруппы.
— 8-ю главную подгруппу называют подгруппой инертных или благородных газов. Это He, Ne, Ar, Kr, Xe, Ra.
Химические свойства в периодах меняются с металлических через амфотерные на неметаллические. Таким образом, зная химические свойства элемента, можно предположить, где конкретно он находится в Периодической системе. И наоборот, если знать положение элемента в Периодической системе, можно предположить его химические свойства.
С момента открытия Периодического закона и Периодической системы химических элементов Д.И. Менделеева, химия перестала быть описательной наукой. Теперь при помощи его таблицы можно предсказывать свойства любого химического элемента. Дальнейшее развитие физики и химии полностью подтвердило правоту Д.И. Менделеева, так были открыты семейства инертных газов. Для радиоактивных элементов были сначала описаны свойства, а затем они были получены. Периодический закон и Периодическая система химических элементов Д.И. Менделеева носят фундаментальный характер, являются основным законом природы.
Подведение итога урока
На уроке вы изучили тему «Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона». Вы узнали о значении Периодической таблицы Менделеева, ее функциях и возможностях.
Список литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. 2011. – 176 с.: ил.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. – Дрофа, 2001. – 224 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Chemport.ru (Источник).
2. Химик (Источник).
3. Hemi.nsu.ru (Источник).
Домашнее задание
1. №№ 193, 194 (с. 143) Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
2. Какие названия имеют некоторые группы химических элементов?
3. Сформулируйте Периодический закон. Чем отличается современная формулировка закона от данной Д.И. Менделеевым?
interneturok.ru
Методическая разработка по химии (9 класс) по теме: Методическая разработка урока по химии в 9 классе по теме: «Периодический закон и периодическая таблица химических элементов Д.И. Менделеева»
Методическая разработка урока по химии в 9 классе по теме:
«Периодический закон и периодическая таблица химических элементов Д.И. Менделеева»
Составила: Нечаева Валентина Николаевна,
учитель химии ГБОУ «Школа №2084» г. Москва
Тип урока: урок изучения нового материала.
Цель: раскрыть сущность периодического закона и строение периодической таблицы химических элементов Д.И. Менделеева.
Задачи:
- Образовательные: познакомить с историей открытия периодического закона Д.И. Менделеева; закрепить знания о взаимосвязи между положением элемента в периодической системе и строением атома; дать понятие периодичности; раскрыть сущность, структуру, значение периодического закона и периодической таблицы химических элементов.
- Развивающие: стимулировать познавательную активность учащихся; способствовать формированию научного мировоззрения; развивать логическое мышление, умение выделить главное, сравнивать, обобщать.
- Воспитательные: интерес к предмету, к истории развития науки, патриотизм, умение работать в группе, чувство сопричастности к общему делу.
- Методические: развитие познавательной деятельности и познавательной активности на уроке химии, путем применения наглядных средств обучения с элементами дидактических игр.
Методы: словесный; словесно-наглядный; поисково-исследовательский; метод проектов. Информационно-коммуникационные технологии.
Форма организации познавательной деятельности: групповая.
Оборудование: периодическая система химических элементов Д.И. Менделеева; творческие проекты учеников; проектор, магнитофон.
Подготовка урока: За 2 недели до урока формируются группы, в которую входят 5-6 учеников. Каждый группе сообщаются темы, по которым должны подготовить презентации. Необходимо не позже за два дня до проведения урока проверить презентации, чтобы материал не выходил за рамки программы и был сформулирован корректно.
Эпиграф: «Периодическому закону будущее не грозит разрушением, а лишь надстройки и развитие обещает».
Ход урока
Учитель: Хочу раскрыть вам один секрет: экзамен по химии очень сложный, но его сдать легко и просто, так как учитель сам раздает шпаргалки…периодическую таблицу химических элементов Д.И. Менделеева. Ведь из периодической таблицы мы можем почерпнуть всю интересующую нас информацию. А для этого нам необходимо изучить и раскрыть сущность периодического закона и периодической таблицы химических элементов Менделеева.
Начать нашу работу я бы хотела с музыки. Послушайте….
Д.И. Менделеев очень любил музыку, особенно произведения композитора Л. Бетховена…
Нам с вами предстоит пройти тернистый путь исследований, чтобы доказать правоту нашего великого соотечественника. Надеюсь, эта музыка вдохновит и вас на плодотворную работу.
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине 19 века знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации (63 элемента).
Актуализация опорных знаний. (См. слайд №6).
Презентация 1. Первые попытки классификации химических элементов.
(выступление группы 1)
Вопросы о том, из каких элементов состоит наш мир, конечно или бесконечно их число задавали еще в глубокой древности. Так, древнегреческий философ Фалес Милетский полагал, что первоисточником всей материи является вода (вода произвела все живые вещи, из воды выходит все). Анаксимен первоначалом всех веществ считал воздух. От уплотнения воздуха происходят облака, из них идет вода, а из воды все остальное. От разряжении воздуха возникает огонь. Философ Гераклит, основатель античной диалектики, первопричину всех вещей видел в огне (… Мир, единый… был, есть и будет вечно живым огнем, закономерно воспламеняющимся и закономерно угасающим…). Философ Ксенофан первоматерией считал землю — из нее все возникает, в нее все возвращается.
Учение Эмпидокла о четырех первоэлементах (вода, земля, огонь и воздух) в значительной мере было переработано Аристотелем. Аристотель считал за первоэлементы основные качества (принципы) материи: тепло, холод, сухость, влажность. Все элементы — сочетания основных принципов. Учение Аристотеля породило новое направление в химии — алхимию (превращение одних элементов в другие за счет их смешения и придачи недостающих качеств). Основное занятие алхимиков, поиск философского камня, превращающего неблагородные металлы в золото, продолжалось на протяжении 12 веков. (См. слайд №7,8,9).
Первого марта 1869 года Д. И. Менделеев обнародовал периодический закон и его следствие — таблицу элементов. В 1870 году он назвал систему «естественной», а спустя год — «периодической». Таблица (далекий прообраз современной), демонстрирующая закон, была представлена Менделеевым под названием «Опыт системы элементов, основанный на их атомном весе и химическом сходстве». Им же была дана формулировка закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от их атомного веса». Таблица состояла из шести вертикальных групп, предшественниц будущих периодов. По горизонтали прослеживались еще не полные ряды элементов, прообразов будущих подгрупп (сегодня — групп) элементов. Она содержала 67 элементов (сейчас их около 120), в том числе три предсказанных, впоследствии открытых: зкаалюминий-галлий, экабор-скандий, экасилициум-германий плюс гафний. (Слайд №10,11,12).
Вопросы к классу:
- сколько химических элементов было известно к моменту открытия периодического закона?
- почему другие учёные (Ньюлендс, Мейер) много сделали для подготовки открытия периодического закона, но не могли постичь истину?
Учитель: Работая в Петербургском университете Д.И. Менделеев не нашел ничего, что можно было бы рекомендовать студентам в качестве учебного пособия. И решил написать новую книгу «Основы химии». Работа над учебником привело к открытию периодического закона.
Мир сложен. Он полон событий, сомнений,
И тайн бесконечных, и смелых догадок.
Как чудо природы
Является гений,
И в хаосе этом
Находит порядок…
Весь мир большой:
Жара и стужа,
Планет круженье, свет зари –
Все то, что видим мы снаружи,
Законом связано внутри.
Найдется ль правило простое,
Что целый мир объединит?
Таблицу Менделеев строит,
Природы ищет алфавит.
Презентация 2. Сущность открытия периодического закона.
(выступление группы 2 ).
Величайшим вкладом, изменившим весь ход науки, была идея гениального русского ученого Дмитрия Ивановича Менделеева, поставившего перед собой цель разобраться во всем многообразии химических элементов и свести их в единую систему.
Менделеевым был открыт закон, который по периодической повторяемости свойств элементов, расположенный в порядке возрастания атомных весов, был назван им периодическим. В знак признания великой заслуги Менделеева открытый им закон стали называть периодическим законом Менделеева.
Сам Менделеев сновидения не отрицал, однако рассказывал, что увидел эту таблицу после того, как не спал несколько ночей подряд, пытаясь изложить на бумаге уже сформировавшиеся представления. «Все в голове сложилось, а выразить таблицей не могу», – так говорил Менделеев своему другу философу Лапшину, посетившему его незадолго перед открытием в 1869 году. По воспоминаниям очевидцев, в эти дни Менделеев три дня и три ночи, не ложась спать, проработал, пробуя сформулировать результаты своей мыслительной конструкции. Дойдя до крайней степени нервного истощения, Менделеев лег спать и тотчас заснул. «Вижу во сне таблицу, где элементы расставлены, как нужно. Проснулся, тотчас записал на клочке бумаги. И только впоследствии оказалась нужной в одном месте поправка».
В таблице Менделеева каждый химический элемент занимает определенное место, отмечающееся оответствующим числом, — порядковым номером элемента. Некоторые места в таблице, созданной Менделеевым, оказались незаполненными, так как элементы, которые должны были занимать эти места, еще не были открыты. Таким образом, пустые места в периодической таблице указывали на наличие в природе еще не открытых химических элементов, а по числу свободных мест в таблице можно было установить и число не открытых элементов. Изучая свойства известных элементов, окружающих свободное место в таблице, можно заранее предсказать свойства еще не открытых элементов.
В марте 1869 г. Менделеев сообщил Русскому химическому обществу об открытом им законе в статье «Соотношение свойств с атомным весом элементов» и тогда же сформулировал основные положения открытого закона. (См. слайд №13).
Вопросы к классу:
- На что обратил внимание Д.И. Менделеев при расположении элементов в таблице?
- Что такое периодичность?
Учитель: К сожалению, сторонников периодического закона сначала было очень мало, даже среди русских ученых. Противников – иного, особенно в Германии и Англии. Возникало много вопросов.
Презентация 3. Современная формулировка периодического закона.
(выступление группы 3)
Первого марта 1869 года Д. И. Менделеев обнародовал периодический закон и его следствие — таблицу элементов. В 1870 году он назвал систему «естественной», а спустя год — «периодической». Таблица (далекий прообраз современной), демонстрирующая закон, была представлена Менделеевым под названием «Опыт системы элементов, основанный на их атомном весе и химическом сходстве». Им же была дана формулировка закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от их атомного веса». Таблица состояла из шести вертикальных групп, предшественниц будущих периодов. По горизонтали прослеживались еще не полные ряды элементов, прообразов будущих подгрупп (сегодня — групп) элементов. Она содержала 67 элементов (сейчас их около 120), в том числе три предсказанных, впоследствии открытых и названных «укрепителями периодического закона».
Естественно, первая таблица была несовершенной, и в последующие годы Менделеев многократно дополнял ее и вносил в ее структуру изменения. В момент представления первого варианта таблицы (март 1869 года) не были еще известны благородные («инертные») газы (Не, Ne, Ar, Kr, Xe, Rn – они содержатся в воздухе, не активны, молекулы их одноатомны) и отсутствовали сведения о внутреннем строении атомов. Лишь в двадцатых годах прошлого столетия, после революционных открытий в физике, применения рентгеновских лучей и обнаружения благородных газов, стало возможным дать современное определение закона о периодической зависимости свойств элементов от порядкового номера элемента, а не от атомного веса, как было вначале отмечено Д. Менделеевым. Иными словами, в трактовке закона понятие «атомный вес» элемента было заменено словами «порядковый (или атомный) номер», что отвечает числу протонов в ядре атома и, соответствен но, числу электронов у нейтрального атома. Определение стало отвечать данным об электронном строении атома, диктующим периодическую повторяемость свойств атомов через 2 (s-элементы), 6 (р-элементы), 10 (d-элементы) и 14 (f-элементы) элементов. Эти цифры отвечают максимально возможному числу электронов на определенном энергетическом уровне атома. Они же соответствуют и числу возможных элементов в соответствующем периоде.
(Слайд № 14)
Вопросы к классу:
- В чем различия современной формулировки периодического закона от формулировки данной Д.И. Менделеевым?
- От чего зависит свойства элементов?
Учитель: Графическим изображением периодического закона является периодическая таблица химических элементов.
Презентация 4. Структура периодической системы химических элементов Д.И. Менделеева.
(выступление группы 4, см. слайд № 15,16 ).
Вопросы к классу:
- Какую информацию в себе несет порядковый номер элемента?
- Какую информацию в себе несет порядковый номер группы?
- Какую информацию в себе несет порядковый номер периоды ?
- Какие именно электроны отвечают за свойства атомов?
- Почему свойства элементов периодически повторяются?
- В чем же физический смысл периодического закона?
Презентация 5. Значение периодического закона. (Выступление группы 5), Слайд №17,18.
- Периодическая система и периодический закон дают возможность сформировать представление о единстве и целостности мира, более глубоко изучить химические элементы и их свойства;
- Периодическая система была первой естественной классификацией химических элементов и явилась могучим орудием для дальнейших исследований;
- периодическая система дала толчок к исправлению атомных масс некоторых элементов.
- Предсказательное значение: учёные могли открыть элементы с заданными свойствами, ранее не известные и синтезировать новые химические элементы.
- Периодический закон открыл путь к изучению строения атома;
И, действительно, периодическая система и периодический закон дают возможность сформировать представление о единстве и целостности мира, более глубоко изучить химические элементы и их свойства, (обратить внимание на высказывание Менделеева: «Посев научный взойдет для жатвы народной!»).
Периодическая система элементов оказала большое влияние на последующее развитие химии. Она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований.
Менделеев был не только убежден, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы. Были даны этим элементам и названия экабор( так как свойства его должны были напоминать бор), экаалюминий, экасилициум. Первым , в 1875 году французским химиком был открыт новый элемент – галлий (от древнего названия Франции), Д.И.Менделеев сразу по описанию его свойств узнал предсказанный им экаалюминий. В 1879г. появились сообщения шведского химика об открытия скандия, по свойствам схожим с экабором. В 1886г. немецкий химик открыл германий, предсказанного элемента экасилициума.
Большое значение имела периодическая система также при установлении валентности и атомных масс некоторых элементов. Точно так же периодическая система дала толчок к исправлению атомных масс некоторых элементов. Например, у бериллия относительная атомная масса была определена 13,5 вместо 9, а это значило, что бериллий следовало поместить не на 4, а на 6-ом месте. Однако, Д.И.Менделеев был твёрдо убеждён, что относительная атомная масса бериллия определена неверно, впоследствии это подтвердили. И в настоящее время периодический закон остается путеводной звездой химии. Именно на его основе были искусственно созданы трансурановые элементы. Один из них- элемент №101, впервые полученный в 1955 г., — в честь великого русского ученого был назван менделеевием.
Последующее развитие науки позволило, опираясь на периодический закон, гораздо глубже познать строение вещества, чем это было возможно при жизни Менделеева.
Учитель: Закон, открытый Д.И. Менделеевым объективно и верно отражает явления и процессы, протекающие в природе.
Д.И.Менделеев работал над созданием таблицы 15 лет. Он был великим ученным.
Презентация 6. Д.И. Менделеев. Жизнь и деятельность.
(выступление группы 6, см. Слайд №19.
Дмитрий Иванович Менделеев (1834 — 1907)
Русский ученый, открыл периодический закон химических элементов.
В 1955 г. американские физики во главе с Г. Сиборгом синтезировали химический элемент с порядковым номером 101. Они дали ему название менделевий — в знак признания заслуг великого русского ученого. Периодическая система Менделеева уже более 100 лет служит ключом к открытию новых элементов.
Периодический закон и периодическая система стали важнейшим вкладом Д. И. Менделеева в развитие естествознания. Но они составляют лишь часть огромного творческого наследия ученого. Полное собрание его сочинений —25 объемистых томов, настоящая энциклопедия знаний.
Менделеев привел в систему разрозненные сведения об изоморфизме, и это сыграло роль в развитии геохимии. Он открыл критическую температуру кипения, выше которой вещество не может находиться в жидком состоянии, разработал гидратную теорию растворов и тем самым по праву считается выдающимся физико-химиком. Он провел глубокие исследования свойств разреженных газов, показав себя выдающимся физиком-экспериментатором. Менделеев предложил теорию неорганического происхождения нефти, до сих пор имеющую приверженцев; разработал процесс приготовления бездымного пороха; изучал воздухоплавание, метеорологию, совершенствовал технику измерений. Будучи управляющим Главной палаты мер и весов, много сделал для развития метрологии. За свои научные заслуги Менделеев был избран членом более 50 академий и научных обществ разных стран мира. В научной деятельности ученый видел, по его словам, свою «первую службу Родине».
Вторая служба — педагогическая деятельность. Менделеев был автором учебника «Основы химии», который при его жизни выдержал 8 изданий и не раз переводился на иностранные языки. Менделеев преподавал во многих учебных заведениях Петербурга. «Из тысяч моих учеников много теперь повсюду видных деятелей, и, встречая их, всегда слышал, что доброе в них семя полагал, а не простую отбывал повинность»,— писал ученый на склоне лет.
Многогранной и полезной была «третья служба Родине» — на ниве промышленности и сельского хозяйства. Здесь Менделеев проявил себя подлинным патриотом. заботившимся о развитии и будущем России. В своем имении Боблово он ставил «опыты по разведению хлебов». Детально изучал способы добычи нефти и дал много ценных рекомендаций по их усовершенствованию. Он постоянно вникал в насущные нужды промышленности, посещал фабрики и заводы, рудники и шахты. Авторитет Менделеева был настолько высок, что его постоянно приглашали экспертом для решения сложных экономических проблем. Незадолго до смерти он опубликовал книгу «К познанию России», в которой наметил обширную программу развития производительных сил страны.
«Посев научный взойдет для жатвы народной»-таков был девиз всей деятельности ученого.
Менделеев был одним из культурнейших людей своего времени. Он глубоко интересовался литературой и искусством, собрал огромную коллекцию репродукций картин художников разных стран и народов. На его квартире часто происходили встречи выдающихся деятелей культуры.
В этом году исполняется 177 лет со дня рождения выдающегося российского химика Дмитрия Ивановича Менделеева и 142 года со дня создания им периодической системы элементов. За истекшее время таблица, наглядно демонстрирующая периодический закон, неоднократно дополнялась и расширялась. До последнего времени в научной и учебной литературе приводилась так называемая короткая форма таблицы. Современный, расширенный вариант таблицы Менделеева составлен авторами статьи на основании последних решений ИЮПАК — Междунаpодного союза теоpетической и пpикладной химии. Эта оpганизация, созданная в 1919 году, кооpдиниpует исследования, тpебующие междунаpодного согласования, контpоля и стандаpтизации, pекомендует и утверждает химическую теpминологию, включая названия элементов. Россия, будучи полноправным членом союза, выполняет его решения и рекомендации. Новая форма таблицы была одобрена XVII Менделеевским съездом в сентябре 2003 года. В таблицу внесены самые последние характеристики всех известных на сегодняшний день элементов. Она будет полезна всем, кто изучает химию и физику или просто интересуется современной наукой.
Итак, мы познакомились с историей открытия периодического закона и еще раз убедились, что по периодической системе можно очень много узнать о каждом химическом элементе, что, бесспорно, доказывает гениальность этого открытия.
В 1905 году Менделеев писал: « Будущие не грозит периодическому закону разрушением, а только надстройки и развитие обещает».
И это будущее наступило.
Химическая викторина. (См. слайд №20).
- 1. Какой химический элемент сначала обнаружили на Солнце потом на Земле
- 2. Какой элемент может быть легким, как сажа, а твердый как алмаз.
- 3. Какой цвет имеет иод.
- 4. Название элемента похоже на планету
- 5. Назвать химический элемент, состоящий из двух млекопитающих
- 6. Химический элемент названный в честь нашей страны
- 7. Химические элементы названные в честь городов
- 8. Элементы названные в честь стран
- 9. Самый распространенный элемент на планете
- 10. Назвать благородные металлы
- 11. Назвать металл, который обладает наивысшей электропроводностью
- 12. Назвать самый твердый металл.
- 13. Назвать самый легкий металл
- 14. Назвать самый тяжелый металл
- 15. Назвать аллотропную модификацию кислорода
- 16. Назвать второй по распространенности химический элемент
- 17. Назвать третий по распространенности химический элемент
- 18. Назвать газ необходимый для дыхания.
- 19. Назвать самый сильный окислитель
- 20. Назвать жидкий металл
- 21. Назвать химический элемент №101
Химический кроссворд. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. (Слайд №21).
Тесты. (См. слайд №22).
- Ко времени открытия периодического закона было известно:
а) 27 химических элементов;
б) 63 химических элемента;
в) 52 химических элемента;
г) 109 химических элементов. - Д.И. Менделеев в своём открытии опирался на:
а) количество молекул;
б) названия элементов;
в) атомную массу;
г) спираль Шанкуртуа. - Свойства элементов в группах и периодах повторяются:
а) периодически;
б) линейно;
в) волнообразно;
г) прерывисто. - Периодическая система одержала триумф после открытия:
а) галлия;
б) скандия;
в) таллия;
г) германия. - В периодической системе:
а) пять периодов;
б) семь периодов;
в) десять периодов;
г) восемь периодов. - Номер группы соответствует:
а) высшей степени окисления;
б) низшей степени окисления;
в) числу электронов;
г) числу протонов
Завет детям Д.И. Менделеева: (Слайд №23).
«Главный секрет вот какой: один человек — нуль, вместе — только люди. Поэтому, живите для других, начиная с мамы, друг с друга, брата или сестры, затем для всех других… Сами трудитесь, трудясь, вы сделаете всё и для близких и для себя, а если при труде успеха не будет, будет неудача, не беда – попробуйте ещё, сохраните спокойствие, то внутреннее обладание, которое делает людей с волей, ясных и нужных другим. Иного завета, лучшего, дать не могу. С ним и живите. С ним завещайте».
«Труд, работа не всякая, а осмысленная, сознательная, нужная людям».
Задание на дом: §3, с.19 № 4-6
Используемая литература.
1. Габриелян О.С. «Химия 9 класс»- М. «Дрофа»,2010г
2. Габриелян О. С., Остроумов И. Г. Настольная книга учителя. Химия. 9 кл.: Методическое пособие. — М.: Дрофа, 2003.
3. Химия. 9 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия. 9» / О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. — М.: Дрофа, 2003—2005.
4. Габриелян О. С., Остроумов И. Г. Изучаем химию в 9 кл.: Дидактические материалы. — М.: Блик плюс, 2004.
5. Габриелян О. С., Воскобойникова Н. П. Химия в тестах, задачах, упражнениях. 8 — 9 кл. — М.: Дрофа, 2005.
nsportal.ru
