Задания на тему химическая связь
Распределить данные вещества в таблицу. Согласно их типу химической связи.
Ионная связь
Ковалентная полярная
Ковалентная неполярная
Металлическая
MgCl2, H2, CO2, NaI2, HF, Al, ZnO, Fe, Br2, Ca3N2, O2, SO3, HBr, Al2S3, CuSn (сплав)
2. На ваш выбор, изобразите схему образования химической связи, выбрав соединение из каждого столбика.
3. * Укажите вещества с водородной связью.
1. Распределить данные вещества в таблицу. Согласно их типу химической связи.
Ионная связь
Ковалентная полярная
Ковалентная неполярная
Металлическая
MgCl2, H2, CO2, NaI2, HF, Al, ZnO, Fe, Br2, Ca3N2, O
2. На ваш выбор, изобразите схему образования химической связи, выбрав соединение из каждого столбика.
На ваш выбор, изобразите схему образования химической связи, выбрав соединение из каждого столбика.
3* Укажите вещества с водородной связью.
Распределить данные вещества в таблицу. Согласно их типу химической связи.
Ионная связь
Ковалентная полярная
Ковалентная неполярная
Металлическая
MgCl2, H2, CO2, NaI2, HF, Al, ZnO, Fe, Br2, Ca3N2, O2, SO3, HBr, Al2S3, CuSn (сплав)
2. На ваш выбор, изобразите схему образования химической связи, выбрав соединение из каждого столбика.
3. * Укажите вещества с водородной связью.
1. Распределить данные вещества в таблицу. Согласно их типу химической связи.
Ионная связь
Ковалентная полярная
Ковалентная неполярная
Металлическая
MgCl2, H2, CO2, NaI2, HF, Al, ZnO, Fe, Br2, Ca3N2, O2, SO3, HBr, Al2S3, CuSn (сплав)
2. На ваш выбор, изобразите схему образования химической связи, выбрав соединение из каждого столбика.
На ваш выбор, изобразите схему образования химической связи, выбрав соединение из каждого столбика.
3.* Укажите вещества с водородной связью.
| 1. |
Типы химической связи
Сложность: лёгкое |
1 |
2.
|
σ- и π-связи
Сложность: лёгкое |
1 |
| 3. |
Атомные орбитали
Сложность: лёгкое |
1 |
4.
|
Свойства ковалентной связи
Сложность: среднее |
2 |
| 5. |
Полярность ковалентной связи
Сложность: среднее |
2 |
6.
|
Гибридизация орбиталей
Сложность: среднее |
2 |
| 7. |
Число связей
Сложность: сложное |
3 |
8.
|
Типы гибридизации орбиталей Сложность: сложное | 3 |
| 9. |
Валентные углы
Сложность: сложное |
3 |
Тестовые задания по теме «Химическая связь.
 Строение вещества»
Строение вещества»ВАРИАНТ 1
1. Электроотрицательность атомов элементов IVA- группы (сверху вниз)
1) убывает
2. Химический элемент, обладающий наибольшим значением электроотрицательности, — это
4) фтор F
3. Вещество, химическая формула которого HCl, образовано химической связью
2) ковалентной полярной
4. Вещество, образованной ионной химической связью, — это
1) KF
5. Наиболее полярная ковалентная связь в молекуле
2) HF
6. Степень окисления +6 сера имеет в соединении
4) H₂SO₄
7. Электронная плотность смещена от кислорода в сторону другого элемента в оксиде
3) OF₂
8. В узлах кристаллической решетки хлорида натрия находятся
2) ионы
9. Низкие температуры плавления у веществ, имеющих кристаллическую решетку
Низкие температуры плавления у веществ, имеющих кристаллическую решетку
3) молекулярную
10. Атомную кристаллическую решетку имеет вещество
4) С
11. Структурная формула В –А – В соответствует веществу
3) H₂S
12. Степень окисления азота в азотной кислоте
1) +5
ВАРИАНТ 2
1. Электроотрицательность атомов элементов 2-го периода (слева направо)
2) возрастает
2. Химический элемент, обладающий наибольшим значением электроотрицательности, — это
1) натрий Na
3. Вещество, химическая формула которого H₂, образовано химической связью
1) ковалентной неполярной
4. Вещество, образованное металлической связью, — это
1) Fe
5. Наиболее полярная ковалентная связь в молекуле
3) HF
6. Степень окисления -2 кислород имеет в соединении
Степень окисления -2 кислород имеет в соединении
1) CaO 2) SO₂ 3) NO (+2)
7. Электронная плотность смещена в сторону серы в молекуле
1) H₂S
8. В узлах кристаллической решетки алмаза находятся
2) атомы
9. Наиболее высокую температуру плавления имеет вещество
1) графит
10. Ионную кристаллическую решетку имеет вещество
2) NaCl
11. Структурная формула В=А=В соответствует веществу
4) SO₂
12. Степень окисления фосфора в ортофосфорной кислоте
1) +5
А химическая связь. А химическая связь Химическая связь в молекулах метана хлорида
На выполнение экзаменационной работы по химии отводится 3 часа (180 минут). Работа состоит из 3 частей и включает 43 задания.
- Часть 1 включает 28 заданий (А1-А28).
 К каждому заданию даётся 4 варианта ответа, из которых только один правильный. Внимательно прочитайте каждое задание и проанализируйте все варианты предложенных ответов.
К каждому заданию даётся 4 варианта ответа, из которых только один правильный. Внимательно прочитайте каждое задание и проанализируйте все варианты предложенных ответов. - Часть 2 состоит из 10 заданий (В1-В10), на которые надо дать краткий ответ в виде числа или последовательности цифр.
- Часть 3 содержит 5 наиболее сложных заданий по общей, неорганической и органической химии. Задания C1-C5 требуют полного (развёрнутого) ответа.
Все бланки ЕГЭ заполняются яркими чёрными чернилами. Допускается использование гелевой, капиллярной или перьевой ручек. При выполнении заданий Вы можете пользоваться черновиком. Обращаем Ваше внимание, что записи в черновике не будут учитываться при оценке работы.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
При выполнении работы Вы можете пользоваться периодической системой химических элементов Д. И. Менделеева; таблицей растворимости солей, кислот и оснований в воде; электрохимическим рядом напряжений металлов (они прилагаются к тексту работы), а также непрограммируемым калькулятором, который выдается на экзамене.
И. Менделеева; таблицей растворимости солей, кислот и оснований в воде; электрохимическим рядом напряжений металлов (они прилагаются к тексту работы), а также непрограммируемым калькулятором, который выдается на экзамене.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (A1-A28) поставьте знак «×» в клеточке, номер которой соответствует номеру выбранного вами ответа.
А1 Одинаковое число электронов содержат частицы
1) Al 3+ и N 3-
2) Ca 2+ и Cl +5
3) S 0 и Cl —
4) N 3- и Р 3-
А2 В ряду элементов Na → Mg → Al → Si
1) уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
А3 Верны ли следующие суждения о соединениях металлов?
А. Степень окисления бериллия в высшем оксиде равна +2.
Степень окисления бериллия в высшем оксиде равна +2.
Б. Оснóвные свойства оксида магния выражены сильнее, чем у оксида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А4 Химическая связь в молекулах метана и хлорида кальция соответственно
1) ковалентная полярная и металлическая
2) ионная и ковалентная полярная
3) ковалентная неполярная и ионная
4) ковалентная полярная и ионная
А5 Степень окисления хлора равна +7 в соединении
1) Ca(ClO 2) 2
2) HClO 3
3) NH 4 Cl
4) HClO 4
А6 Молекулярное строение имеет
1) оксид кремния(IV)
2) нитрат бария
3) хлорид натрия
4) оксид углерода(II)
А7 Среди перечисленных веществ:
А) NaHCO 3
Б) HCOOK
В) (NH 4) 2 SO 4
Г) KHSO 3
Д) Na 2 HPO 4
Е) Na 3 PO 4
кислыми солями являются
1) АГД
2) АВЕ
3) БДE
4) BДЕ
А8 Цинк взаимодействует с раствором
1) CuSO 4
2) MgCl 2
3) Na 2 SO 4
4) CaCl 2
А9 Какой оксид реагирует с раствором НСl, но не реагирует с раствором NaOH?
1) CO
2) SO 3
3) P 2 O 5
4) MgO
А10 Гидроксид алюминия реагирует с каждым из двух веществ:
1) KOH и Na 2 SO 4
2) HCl и NaOH
3) CuO и KNO 3
4) Fe 2 O 3 и HNO 3
А11 Карбонат бария реагирует с раствором каждого из двух веществ:
1) H 2 SO 4 и NaOH
2) NaCl и CuSO 4
3) HCl и CH 3 COOH
4) NaHCO 3 и HNO 3
А12 В схеме превращений
веществами «X» и «Y» являются соответственно
1) Cl 2 и Cu(OH) 2
2) CuCl 2 (р-р) и NaOH
3) Cl 2 и NaOH
4) HCl и H 2 O
А13 Бутен-1 является структурным изомером
1) бутана
2) циклобутана
3) бутина
4) бутадиена
А14 В отличие от пропана, циклопропан вступает в реакцию
1) дегидрирования
2) гидрирования
3) горения в кислороде
4) этерификации
А15 Свежеосаждённый гидроксид меди(II) реагирует с
1) пропанолом
2) глицерином
3) этиловым спиртом
4) диэтиловым эфиром
А16 Формальдегид не реагирует с
1) Ag 2 O(NH 3 р-р)
2) O 2
3) H 2
4) СН 3 ОСН 3
А17 Бутанол-1 образуется в результате взаимодействия
1) бутаналя с водой
2) бутена-1 с водным раствором щёлочи
3) 1-хлорбутана с одным раствором щёлочи
4) 1,2-дихлорбутана с водой
А18 В схеме превращений HC ≡ CH → X → CH 3 COOHвеществом «Х» является
1) CH 3 CHO
2) CH 3 − CO − CH 3
3) CH 3 − CH 2 OH
4) CH 3 − CH 3
А19 Взаимодействие оксида углерода(IV) с водой относится к реакциям
1) соединения, необратимым
2) обмена, обратимым
3) соединения, обратимым
4) обмена, необратимым
А20 Скорость реакции азота с водородом понизится при
1) уменьшении температуры
2) увеличении концентрации азота
3) использовании катализатора
4) увеличении давления
А21 Химическое равновесие в системе
сместится в сторону продуктов реакции при
1) повышении давления
2) повышении температуры
3) понижении давления
4) использовании катализатора
А22 Наибольшее количество сульфат-ионов образуется в растворе при диссоциации 1 моль
1) сульфата натрия
2) сульфата меди(II)
3) сульфата алюминия
4) сульфата кальция
А23 Сокращённому ионному уравнению Н + + ОН — = Н 2 О соответствует взаимодействие
1) H 2 SO 4 с NaOH
2) Cu(OH) 2 с HCl
3) H 2 SiO 3 с KOH
4) HCl с HNO 3
А24 Одинаковую реакцию среды имеют растворы хлорида меди(II) и
1) хлорида кальция
2) нитрата натрия
3) сульфата алюминия
4) ацетата натрия
А25 Окислительные свойства серная кислота проявляет в реакции, схема которой:
1) H 2 SO 4 + NH 3 → NH 4 HSO 4
2) H 2 SO 4 + KOH → K 2 SO 4 + H 2 O
3) H 2 SO 4 + P → H 3 PO 4 + SO 2
4) H 2 SO 4 + P 2 O 5 → HPO 3 + SO 3
А26 Верны ли следующие суждения о правилах обращения с веществами?
А. Вещества в лаборатории запрещается пробовать на вкус.
Вещества в лаборатории запрещается пробовать на вкус.
Б. С солями ртути следует обращаться особо осторожно ввиду их ядовитости.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А27 Полимер, имеющий формулу
получают из
1) толуола
2) фенола
3) пропилбензола
4) стирола
А28 Согласно термохимическому уравнению реакции
СаО (тв) + Н 2 О (ж) = Са(ОН) 2(тв) + 70 кДж
для получения 15 кДж теплоты потребуется оксид кальция массой
1) 3 г
2) 6 г
3) 12 г
4) 56 г
Часть 2
Ответом к заданиям этой части (В1-В10) является последовательность цифр или число, которые следует записать в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждую цифру и запятую в записи десятичной дроби пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами.
В заданиях B1-B5 к каждому элементу первого столбца подберите соответствующий элемент второго и запишите в таблицу выбранные цифры под соответствующими буквами, а затем получившуюся последовательность цифр перенесите в бланк ответов № 1 без пробелов, запятых и других дополнительных символов. (Цифры в ответе могут повторяться.)
(Цифры в ответе могут повторяться.)
В1 Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит.
Ответом к заданиям B6-B8 является последовательность из трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания сначала в текст работы, а затем перенесите их в бланк ответов № 1 без пробелов, запятых и других дополнительных символов.
В6 Взаимодействие 2-метилпропана и брома при комнатной температуре на свету
1) относится к реакциям замещения
2) протекает по радикальному механизму
3) приводит к преимущественному образованию 1-бром-2-метилпропана
4) приводит к преимущественному образованию 2-бром-2-метилпропана
5) протекает с разрывом связи C — C
6) является каталитическим процессом
В7 Фенол реагирует с
1) кислородом
2) бензолом
3) гидроксидом натрия
4) хлороводородом
5) натрием
6) оксидом углерода(IV)
Ответ:___________________________
В8 Метиламин может взаимодействовать с
1) пропаном
2) хлорметаном
3) кислородом
4) гидроксидом натрия
5) хлоридом калия
6) серной кислотой
Ответ:___________________________
Ответом к заданиям B9-B10 является число. Запишите это число в текст работы, а затем перенесите его в бланк ответов № 1 без указания единиц измерения.
Запишите это число в текст работы, а затем перенесите его в бланк ответов № 1 без указания единиц измерения.
В9 Определите массу воды, которую надо добавить к 20 г раствора уксусной кислоты с массовой долей 70% для получения раствора уксусной кислоты с массовой долей 5%. (Запишите число с точностью до целых.)
Ответ: ___________ г.
В10 Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO 2 , равна __________ г. (Запишите число с точностью до целых.)
Не забудьте перенести все ответы в бланк ответов № 1.
Часть 3
Для записи ответов к заданиям этой части (С1-С5) используйте бланк ответов № 2. Запишите сначала номер задания (С1, С2 и т. д.), а затем его полное решение. Ответы записывайте чётко и разборчиво.
С1 Используя метод электронного баланса, составьте уравнение реакции
С2 Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
С3 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С4 К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na 2 CO 3 ⋅10H 2 O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
С5 При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Система оценивания экзаменационной работы по химии
ЧАСТЬ 1
За правильный ответ на каждое задание части 1 ставится 1 балл. Если указаны два и более ответов (в их числе правильный), неверный ответ или ответ отсутствует — 0 баллов.
| № задания | Ответ | № задания | Ответ | № задания | Ответ |
| А1 | 1 | А11 | 3 | А21 | 2 |
| А2 | 1 | А12 | 3 | А22 | 3 |
| А3 | 3 | А13 | 2 | А23 | 1 |
| А4 | 4 | А14 | 2 | А24 | 3 |
| А5 | 4 | А15 | 2 | А25 | 3 |
| А6 | 4 | А16 | 4 | А26 | 3 |
| А7 | 1 | А17 | 3 | А27 | 4 |
| А8 | 1 | А18 | 1 | А28 | 3 |
| А9 | 4 | А19 | 3 | ||
| А10 | 2 | А20 | 1 |
ЧАСТЬ 2
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр (число).
За полный правильный ответ в заданиях В1-В8 ставится 2 балла, если допущена одна ошибка — 1 балл, за неверный ответ (более одной ошибки) или его отсутствие — 0 баллов.
За правильный ответ в заданиях В9 и В10 ставится 1 балл, за неверный ответ или его отсутствие — 0 баллов.
№ задания | Ответ |
ЧАСТЬ 3
КРИТЕРИИ ПРОВЕРКИ И ОЦЕНКИ ВЫПОЛНЕНИЯ ЗАДАНИЙ С РАЗВЁРНУТЫМ ОТВЕТОМ
За выполнение заданий ставится: С1, С5 — от 0 до 3 баллов; С2, С4 — от 0 до 4 баллов; С3 — от 0 до 5 баллов.
С1 Используя метод электронного баланса, составьте уравнение реакции
Na 2 SO 3 + … + KOH → K 2 MnO 4 + … + H 2 O
Определите окислитель и восстановитель.
Баллы | |
Элементы ответа: 2) указано, что сера в степени окисления +4 является восстановителем, а марганец в степени окисления +7 (или перманганат калия за счёт марганца в степени окисления +7) — окислителем; | |
В ответе допущена ошибка только в одном из элементов | |
В ответе допущены ошибки в двух элементах | |
Максимальный балл |
C2 Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия.
Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
Баллы | |
Элементы ответа: | |
Правильно записаны 4 уравнения реакций | |
Правильно записаны 3 уравнения реакций | |
Правильно записаны 2 уравнения реакций | |
| Правильно записано 1 уравнение реакций | 1 |
Все элементы ответа записаны неверно | |
Максимальный балл |
C3 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Баллы | |
Элементы ответа: | |
Ответ правильный и полный, включает все названные выше элементы | 5 |
| Правильно записаны 4 уравнения реакций | 4 |
| Правильно записаны 3 уравнения реакций | 3 |
| Правильно записаны 2 уравнения реакций | 2 |
| Правильно записано одно уравнение реакций | 1 |
| 0 | |
| Максимальный балл |
С4 К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na 2 CO 3 ⋅10H 2 O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na 2 CO 3 ⋅10H 2 O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
Баллы | |
Элементы ответа: Возможен также расчёт на основании уравнений реакций образования NaHSO 4 и последующего его взаимодействия с Na 2 CO 3 . Конечный ответ не изменится; 2) рассчитано общее количество серной кислоты, а также количество 3) рассчитано количество серной кислоты, вступившей в реакцию с гидроксидом натрия и масса гидроксида натрия в исходном растворе: n(H 2 SO 4) = 2 − 0,5 =1,5 моль 4) рассчитана массовая доля гидроксида натрия в исходном растворе: | |
Ответ правильный и полный, включает все названные выше элементы | 4 |
| В ответе допущена ошибка в одном из названных выше элементов | 3 |
| В ответе допущены ошибки в двух из названных выше элементов | 2 |
| В ответе допущены ошибки в трёх из названных выше элементов | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
* Примечание.
С5 При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
| Баллы | |
Элементы ответа. С n H 2n+1 COOH + NaHCO 3 = СnH 2n+1 COONa + H 2 O + CO 2 2) Рассчитана молярная масса кислоты: 3) Установлена молекулярная формула кислоты: Молекулярная формула — C 4 H 9 COOH | |
| Ответ правильный и полный, включает все названные выше элементы | 3 |
| Правильно записаны первый и второй элементы ответа | 2 |
| Правильно записан первый или второй элементы ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
* Примечание. В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
1) ковалентная неполярная, ионная и ковалентная полярная
2) ионная, ковалентная неполярная и ковалентная полярная
3) ковалентная полярная, ионная и ковалентная неполярная
4) ионная, ковалентная полярная и ковалентная неполярная
Неметаллические свойства элементов в периоде с увеличением заряда ядра атомов
1) усиливаются; 2) изменяются периодически; 3) ослабевают;4) не изменяются
Карбоксильная группа имеется в молекулах
1) одноатомных спиртов; 2) альдегидов; 3) многоатомных спиртов
4) карбоновых кислот
5. Взаимодействие гидроксида бария с серной кислотой является реакцией
1) присоединения; 2)обмена; 3) замещения;4) гидратации
Коэффициент перед формулой восстановителя в уравнении реакции, схема которой
S + HNO 3 ® H 2 SО 4 + NO 2 + H 2 O, равен
1) 1 2) 2 3) 3 4) 4
7. Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в
Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в
1) водный раствор сахарозы; 2) водный раствор хлорида натрия
3) муравьиную кислоту (водв. Р-р) ;4) расплав гидроксида натрия
8. Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между азотной кислотой и гидроксидом бария равна
1 ) 10 и 3 2) 12 и 3 3) 10 и 4 4) 12 и 4
Сокращенное ионное уравнение реакции
Zn 2+ + 2ОН — = Zn(OH) 2 ¯ соответствует взаимодействию веществ
1) ZnSO 4 (р-р) и Fе(ОН)з; 2) ZnSO 4 (р-р) и Ва(ОН) 2 (р-р)
3) ZnCl 2 (р-р) и NaOH (р-р) ; 4) ZnO и H 2 O
10. Азотная кислота не реагирует с
l)FeO 2)СаСОз 3) SiO 2 4) Сu
11.При нагревании спиртов в присутствии концентрированной серной кислоты можно получить
1) алкоголяты; 2) простые эфиры; 3) альдегиды; 4) карбоновые кислоты
Гидролизу не подвергаются
1) сульфат железа (III) ; 2)спирты; 3) хлорид аммония; 4) сложные эфиры
Формула органического вещества А в схеме превращений
+Cl 2 +NaOH
С 2 H 6 ® X ® A
1) C 2 H 5 OH ; 2) C 2 H 5 Ona ; 3) C 2 H 5 Cl ; 4) С 2 Н 6
14. Качественной реакцией на соли аммония является
Качественной реакцией на соли аммония является
1) действие щелочи; 2) действие другой соли
3) действие кислоты; 4) разложение нитратов
15. Реакция «серебряного зеркала» характерна для обоих веществ
1) уксусная кислота и ацетальдегид; 2) муравьиная кислота и формальдегид
3) глюкоза и глицерин; 4) сахароза и глицерин
16. С наибольшей скоростью при комнатной температуре протекает реакция
1) цинка с разбавленной серной кислотой; 2) магния с соляной кислотой
3) железа с кислородом; 4) карбоната натрия (р-р) с соляной кислотой
Химическое равновесие в системе
2NO (г) + О 2 (г) Û 2NO 2 (г) + Q можно сместить в сторону продукта реакции при
1) понижении температуры; 2) повышении температуры;
3) понижении давления; 4) использовании катализатора
Ацетилен в лаборатории получают из
1) карбида кальция; 2) карбоната кальция; 3) углерода; 4) гидроксида кальция
В промышленности уксусную кислоту получают
1) каталитическим окислением бутана
2) взаимодействием ацетата натрия с серной кислотой
3) гидролизом сложных эфиров
4) гидролизом простых эфиров
20. Гомологом СНз-СН 2 -СН 2 -СН = СН 2 является
Гомологом СНз-СН 2 -СН 2 -СН = СН 2 является
1) пентен-2 2) метилбутен-1 3) бутен-1 4) метилбутан
Формула изомера пропанола-1
1) СНз-СН 2 -СН = О
2) СНз-СН 2 -О-СНз
3) СНз-СН 2 -СН 2 ОН
22. Масса щелочи, которую необходимо растворить в 50г воды для приготовления 10%-ного раствора, равна
1) 5,6г 2) 6,25г 3) 10,0г 4) 12,5г
23. Количество вещества нитрата бария, образовавшегося при сливании растворов, содержащих 3 моль азотной кислоты и 4 моль гидроксида бария, равно
1) 3 2) 7 3) 2,5 4) 4
24. В присутствии водоотнимающего средства из 92г этанола получили 33,6л (н.у.) этилена. Выход продукта в процентах от теоретически возможного составил
Транскрипт1
Задания А4 по химии 1. Химическая связь в молекулах метана и хлорида кальция соответственно ковалентная полярная и металлическая ионная и ковалентная полярная ковалентная неполярная и ионная ковалентная полярная и ионная Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная между атомами металлов и неметаллов. Определим состав веществ по формулам: в метане углерод и водород, поэтому связь ковалентная полярная, в хлориде кальция кальций и хлор, значит связь ионная. Ответ: Укажите вещество, в котором кислород образует ионные связи. озон оксид кальция углекислый газ вода Оксид кальция это ионное соединение, потому что ионная связь образуется между атомами металлов и неметаллов. Ответ: 2.
Определим состав веществ по формулам: в метане углерод и водород, поэтому связь ковалентная полярная, в хлориде кальция кальций и хлор, значит связь ионная. Ответ: Укажите вещество, в котором кислород образует ионные связи. озон оксид кальция углекислый газ вода Оксид кальция это ионное соединение, потому что ионная связь образуется между атомами металлов и неметаллов. Ответ: 2.
2
3. Соединения с ковалентной неполярной связью расположены в ряду: Ковалентная неполярная связь образуется в простых веществах между атомами неметаллов. 4. Водородная связь характерна для алканов аренов спиртов алкинов Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (F, O и N), одной молекулы и атомом элемента с высокой электроотрицательностью (F, O, N, Cl) другой молекулы. Например, между атомом водорода одной молекулы фтороводорода и атомом фтора другой молекулы фтороводорода образуется водородная связь (обозначена пунктиром) Cреди предложенных веществ кислород в составе группы -ОН присутствует только в молекулах спиртов, поэтому среди предложенных веществ водородная связь возможна между молекулами спиртов Остальные вещества относятся к углеводородам и не способны к образованию водородных связей. Ответ: 3.
Ответ: 3.
3 5. Только ковалентные связи имеет каждое из двух веществ: Молекулы веществ в 4 варианте состоят из атомов неметаллов. Атомы неметаллов соединяются посредством ковалентных связей. Поэтому это правильный ответ. Ответ: Неполярная ковалентная связь характерна для каждого из двух веществ: воды и алмаза водорода и хлора меди и азота брома и метана Ковалентная неполярная связь образуется в простых веществах между атомами неметаллов. Во втором варианте ответов даны простые вещества неметаллы, значит это и есть правильный ответ. Ответ: 2.
4
7. Ковалентная неполярная связь характерна для Ковалентная неполярная связь образуется в простых веществах между атомами неметаллов. Простое вещество неметалл йод, значит это правильный ответ. 8. Ковалентная неполярная связь характерна для каждого из двух веществ: азота и кислород воды и аммиака меди и азота брома и метана Ковалентная неполярная связь образуется в простых веществах между атомами неметаллов. Азот и кислород — это простые вещества неметаллы, значит это правильный ответ.
5 9. Вещества с ковалентной полярной связью находятся в ряду: Ковалентная связь это соединение атомов посредством общих электронных пар, образуется между атомами неметаллов. Ионная связь это связь между ионами, образуется при взаимодействии атомов металла и неметалла. В первом варианте молекулы состоят только из атомов неметаллов, поэтому это правильный ответ. Ковалентная связь бывает полярная и неполярная. Неполярная связь между одинаковыми атомами, полярная — между разными. (Точнее неполярная ковалентная связь между атомами с одинаковой электроотрицательностью, полярная — между атомами с разной электроотрицательностью) 10. Веществом с ионной связью является Ионная связь это связь между ионами, образуется при взаимодействии атомов металла и неметалла. Ионным соединением является фторид кальция.
6
11. Вещество с ковалентной неполярной связью имеет формулу Ковалентная неполярная связь это соединение атомов посредством общих электронных пар, образуется между атомами неметаллов с одинаковой электроотрицательностью. Веществом, где образуется ковалентная неполярная связь является бром. Ответ: Водородная связь образуется между молекулами этана бензола водорода этанола Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (F, O и N), одной молекулы и атомом элемента с высокой электроотрицательностью (F, O, N, Cl) другой молекулы. Например, между атомом водорода одной молекулы фтороводорода и атомом фтора другой молекулы фтороводорода образуется водородная связь (обозначена пунктиром) Среди предложенных веществ водородная связь возможна между молекулами этанола Ответ: 4.
Веществом, где образуется ковалентная неполярная связь является бром. Ответ: Водородная связь образуется между молекулами этана бензола водорода этанола Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (F, O и N), одной молекулы и атомом элемента с высокой электроотрицательностью (F, O, N, Cl) другой молекулы. Например, между атомом водорода одной молекулы фтороводорода и атомом фтора другой молекулы фтороводорода образуется водородная связь (обозначена пунктиром) Среди предложенных веществ водородная связь возможна между молекулами этанола Ответ: 4.
7
13. В молекулах хлороводорода и брома химическая связь соответственно ковалентная полярная и ковалентная неполярная ионная и ковалентная полярная ковалентная неполярная и ковалентная полярная ионная и ковалентная неполярная В молекуле хлороводорода атомы разных неметаллов связь ковалентная полярная. Бром это простое вещество неметалл связь ковалентная неполярная. 14. Как ионные, так и ковалентные связи участвуют в образовании хлорида натрия карбида кальция оксида кремния глюкозы Хлорид натрия — соединение с ионным типом связи, оксид кремния — ковалентным, глюкоза — ковалентным. Лишь в случае карбида кальция () в соединении присутствуют как ионные (между катионом и анионом), так и ковалентные (между атомами углерода в анионе) связи. Ответ: 2.
14. Как ионные, так и ковалентные связи участвуют в образовании хлорида натрия карбида кальция оксида кремния глюкозы Хлорид натрия — соединение с ионным типом связи, оксид кремния — ковалентным, глюкоза — ковалентным. Лишь в случае карбида кальция () в соединении присутствуют как ионные (между катионом и анионом), так и ковалентные (между атомами углерода в анионе) связи. Ответ: 2.
8 15. Вещество, в котором ковалентная связь образована по донорно-акцепторному механизму нитрат аммония хлорвинил этиленгликоль карбид кальция Ион аммония (в данном случае содержащийся в нитрате аммония) — типичный пример частицы в которой ковалентная связь образована по донорно-акцепторному механизму. 16. В какой молекуле есть ковалентная неполярная связь? H 2 O 2 H 2 O SF 2 CaF 2 В молекуле перекиси водорода есть связь между атомами кислорода, которая является ковалентной неполярной.
9
17. В какой молекуле есть ковалентная неполярная связь? C 2 H 6 CH 4 NO 2 HCl Только в молекуле этана (C 2 H 6) есть углерод-углеродная связь, которая является ковалентной неполярной. 18. Только ковалентными связями образованы оба вещества пары Ковалентные связи образуются между атомами неметаллов. Между металлами и неметаллами образуются ионные связи. Также ионная связь возникает между ионами аммония ионами (например,) (и им подобными) и отрицательными Таким образом, только ковалентными связями образованы оба вещества пары Ответ: 3.
18. Только ковалентными связями образованы оба вещества пары Ковалентные связи образуются между атомами неметаллов. Между металлами и неметаллами образуются ионные связи. Также ионная связь возникает между ионами аммония ионами (например,) (и им подобными) и отрицательными Таким образом, только ковалентными связями образованы оба вещества пары Ответ: 3.
10
19. Веществу с ионным типом связи отвечает формула Ионная связь это связь между ионами, образуется при взаимодействии атомов металла и неметалла, поэтому правильным ответом является фторид рубидия. Ответ: Водородные связи образуются между молекулами уксусной кислоты углекислого газа ацетилена сероводородной кислоты Водородная связь образуется между атомом водорода одной молекулы и атомом элемента с высокой электроотрицательностью другой молекулы, такими элементами могут быть: O, N, F, Сl. Для водородной связи необходимо наличие в молекуле полярных ковалентных связей, в образовании которой участвует атом водорода и электроотрицательный атом (кислород, азот, галоген). В молекуле уксусной кислоты есть группа атомов СOOH, где происходит смещение электронной плотности, поэтому правильный ответ уксусная кислота.
В молекуле уксусной кислоты есть группа атомов СOOH, где происходит смещение электронной плотности, поэтому правильный ответ уксусная кислота.
1. Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь. 2. Водородная связь образуется между молекулами водорода метанола толуола метаналя метановой кислоты
За да ния для подготовки 1. Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь. 2. Из предложенного перечня выберите два соединения, в которых между молекулами
Контрольная работа по химии 2 11 класс строение вещества ответы >>> Контрольная работа по химии 2 11 класс строение вещества ответы Контрольная работа по химии 2 11 класс строение вещества ответы Тестовые
1. Какой вид химической связи в оксиде бария? ковалентная неполярная металлическая ковалентная полярная ионная 2. Какой вид химической связи в оксиде хлора(vii)? ковалентная полярная ионная ковалентная
Отложенные задания (114) Ионный характер связи наиболее выражен в соединении 1) CCl 4 2) SiO 2 3) CaBr 2 4) NH 3 В веществах, образованных путем соединения одинаковых атомов, химическая связь 2) ковалентная
3. Химическая связь Ионная химическая связь это связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Ковалентная химическая связь это связь, возникающая между атомами за счет
Химическая связь Ионная химическая связь это связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Ковалентная химическая связь это связь, возникающая между атомами за счет
Тест «Классификация химических связей» 1. Ковалентная неполярная связь образуется между атомом хлора и атомом 1) калия 2) водорода 3) хлора 4) углерода 2. Ковалентная неполярная связь образуется между
Задания А6 по химии 1. Молекулярное строение имеет 1) оксид кремния(iv) 2) нитрат бария 3) хлорид натрия 4) оксид углерода(ii) Под строением вещества понимают, из каких частиц молекул, ионов, атомов построена
1. Какой из перечисленных элементов является наиболее типичным неметаллом? 1) Кислород 2) Сера 3) Селен 4) Теллур 2. Какой из перечисленных элементов имеет наибольшую электроотрицательность? 1) Натрий
Строение вещества химия 11 класс контрольная работа >>> Строение вещества химия 11 класс контрольная работа Строение вещества химия 11 класс контрольная работа Водородная связь не образуется между молекулами
1. 1. Укажи название типа связи, который описывает отрывок: «Связь возникает за счет образования общего двухэлектронного облака». Ответ: ковалентная 1.2. Укажи цифры (без знаков препинания и пробелов) под
1. Укажи название типа связи, который описывает отрывок: «Связь возникает за счет образования общего двухэлектронного облака». Ответ: ковалентная 1.2. Укажи цифры (без знаков препинания и пробелов) под
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ 1. Электронную конфигурацию инертного газа имеет ион 1) Fe 3+ 2) Fe 2+ 3) Co 2+ 4) Ca 2+ 2. Электронную конфигурацию инертного газа имеет ион 1) O 2-2) S 2+ 3) Si 2+ 4) Br +
Тесты Вариант 1 1. Пoнятие aтoм для oбoзнaчeния мельчaйшиx неделимых чaстиц вещeствa былo введенo в нayкy: a) в ХIХ в. иpлaндским физикoм Cтoни; б) в кoнце ХIХ в. aнглийским физикoм Дж.Toмсoнoм; в) в Aнтичнoсти;
1. Чему равен заряд ядра атома кислорода? 1) 2 2) +6 3) +7 4) +8 2. Что общего в атомах 1 1Н, 2 1Н, 3 1Н? 1) Массовое число 2) Число протонов 3) Число нейтронов 4) Радиоактивные свойства Входные тесты
Проверочная работа по химии Химическая связь 9 класс 1 вариант 1. Ковалентная связь между атомами образуется посредством: 1) общих электронных пар 2) электростатического притяжения ионов 3) «электронного
ЭКЗАМЕНАЦИОННЫЕ БИЛЕТЫ ГОСУДАРСТВЕННОЙ ИТОГОВОЙ АТТЕСТАЦИИ ПО ХИМИИ ПО ОСНОВНЫМ ОБРАЗОВАТЕЛЬНЫМ ПРОГРАММАМ ОСНОВНОГО ОБЩЕГО ОБРАЗОВАНИЯ в 2019 году 1. Периодический закон и периодическая система химических
Периодический закон и периодическая система химических
Оценочные материалы для элективного курса «Решение задач повышенной сложности» для 0 классов Номер задания Входной контроль Кодификатор элементов содержания и требований к уровню подготовки выпускников
11 класс контрольная работа по химии строение вещества >>> 11 класс контрольная работа по химии строение вещества 11 класс контрольная работа по химии строение вещества Только ковалентная связь наблюдается
Тест 1 Периодический закон и периодическая система химических элементов. Строение атома. 1. Чем отличаются атомы изотопов одного элемента? 1) числом протонов; 2) числом нейтронов; 3) числом электронов;
3. Молекулы. Химическая связь. Строение веществ Химические частицы, образованные из двух или нескольких атомов, называются молекулами (реальными или условными формульными единицами многоатомных веществ).
Фоксфорд.Учебник Бинарные соединения Улучшить знания уровень, 11 класс Бинарные соединения это собирательная группа веществ, которые имеют различное химическое строение, но состоят из двух видов атомов.
1.1. Укажите общее название элементов, обозначенных на рисунке желтым цветом. Ответ: неметаллы Правую часть ПС занимают элементы-неметаллы (p-элементы). 1.2. Укажи номер элемента, который резко отличается
1.ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОСВОЕНИЯ ПРЕДМЕТА. В результате изучения предмета в 9 классе учащийся должен знать/понимать: химическую символику: знаки химических элементов, формулы химических веществ и уравнения
1. Чему равен заряд ядра атома углерода? 1) 0 2) +6 3) +12 4) -1 2. Что общего в атомах 12 6С и 11 6С? 1) Массовое число 2) Число протонов 3) Число нейтронов 4) Радиоактивные свойства Входные тесты по
УТВЕРЖДЕНО Приказ Министра образования Республики Беларусь 03.12.2018 836 Билеты для проведения экзамена в порядке экстерната при освоении содержания образовательной программы среднего образования по учебному
1. ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОБУЧЕНИЯ Раздел 2. Многообразие химических реакций В результате изучения раздела учащиеся должны важнейшие химические понятия: классификация химических реакций различными способами,
Задания на тему: «Периодическая система Менделеева» Прочитать конспект и выполнить задания. На каждый вопрос один ответ. Для 5 задания сделать графическую конфигурацию элемента Периодически изменяются
На каждый вопрос один ответ. Для 5 задания сделать графическую конфигурацию элемента Периодически изменяются
II. Строение вещества Ионная химическая связь Ионная связь Ионы частицы с зарядом отличным от нуля Катионы имеют положительный заряд Анионы имеют отрицательный заряд Определение: Ионная связь это химическая
Химия 1. Первоначальные химические понятия. Предмет химии. Тела и вещества. Основные методы познания: наблюдение, измерение, описание, эксперимент. Физические и химические явления. Правила безопасности
УТВЕРЖДЕНО Приказ Министра образования Республики Беларусь 03.12.2018 836 Билеты для проведения экзамена в порядке экстерната при освоении содержания образовательной программы базового образования по учебному
Тематическое планирование по химии на 2017-2018 учебный год 9 класс Учебник: О.С. ГАБРИЕЛЯН. ХИМИЯ. 8 КЛАСС. М., «ДРОФА», 2007-2012 гг. Содержание учебного материала Сроки Обязательный минимум ВВЕДЕНИЕ.
ХИМИЯ, 11 класс Вариант 1, Ноябрь 2010 Краевая диагностическая работа по ХИМИИ ВАРИАНТ 1 При выполнении заданий А1 А8 в бланке ответов 1 под номером выполняемого задания поставьте знак «х» в клеточку,
ПРОГРАММА ВСТУПИТЕЛЬНОГО ЭКЗАМЕНА ПО ХИМИИ Поступающий в вуз должен показать знание основных теоретических положений химии как одной из важнейших естественных наук, которые лежат в основе научного понимания
I. Планируемые результаты освоения обучающимися основной образовательной программы основного общего образования по химии Выпускник научится: характеризовать основные методы познания: наблюдение, измерение,
Планируемые результаты освоения обучающимися основной образовательной программы основного общего образования по химии Выпускник научится: характеризовать основные методы познания: наблюдение, измерение,
Тематическое планирование по химии (экстернат) на 2016-2017 учебный год в 8 классе Учебник: О.С. ГАБРИЕЛЯН. ХИМИЯ. 8 КЛАСС. М., «ДРОФА», 2007-2015 гг. Четверти Содержание учебного материала Сроки Обязательный
МУНИЦИПАЛЬНОЕ КАЗЕННОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КЕЖЕМСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА» Рабочая программа учебного предмета «химия» для учащихся 9 класса п. Кежемский 208 г. Планируемые результаты
Банк заданий химия 9 класс 1. Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
Пояснительная записка Рабочая программа учебного предмета «химия» для 8-9 классов разработана в соответствии с Основной образовательной программой основного общего образования МБОУ г. Мурманска «Средняя
Мурманска «Средняя
ЭКЗАМЕНАЦИОННЫЕ БИЛЕТЫ ГОСУДАРСТВЕННОЙ ИТОГОВОЙ АТТЕСТАЦИИ ПО ХИМИИ ПО ПРОГРАММАМ ОСНОВНОГО ОБЩЕГО ОБРАЗОВАНИЯ Билет 1 1. Периодическая система химических элементов Д. И. Менделеева и строение атомов:
Зачет по теме «Химическая связь» 11класс 1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая
Задания 3. Строение молекул. Химическая связь 1. Какой вид химической связи в оксиде бария? ковалентная неполярная металлическая ковалентная полярная ионная 2. Какой вид химической связи в оксиде хлора(vii)?
Задания А3 по химии 1. Верны ли следующие суждения о соединениях металлов? А. Степень окисления алюминия в высшем оксиде равна +3. Б. Оснóвные свойства оксида натрия выражены сильнее, чем у оксида алюминия
Задания 3. Строение молекул. Химическая связь 1. Какой вид химической связи в оксиде бария? металлическая ковалентная полярная 2. Какой вид химической связи в оксиде хлора(vii)? ковалентная полярная ионная
Какой вид химической связи в оксиде хлора(vii)? ковалентная полярная ионная
Тематическое планирование по химии (экстернат) на 2016-2017 учебный год в 11 классе Учебник: О.С. ГАБРИЕЛЯН. ХИМИЯ. 11 КЛАСС. БАЗОВЫЙ УРОВЕНЬ. М., «ДРОФА», 2007-2015 гг. Полугодия Содержание учебного материала
Билеты для переводного экзамена по химии в 8 классе Билет 1 1. Предмет химии. Вещества. Вещества простые и сложные. Свойства веществ. 2. Кислоты. Их классификация и свойства. Билет 2 1. Превращения веществ.
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа 4 г. Балтийска Рабочая программа учебного предмета «Химия» 9 класс, ступень базовый уровень Балтийск 2017год 1.Пояснительная
ОБРАЗОВАТЕЛЬНЫЙ СТАНДАРТ ОСНОВНОГО ОБЩЕГО ОБРАЗОВАНИЯ ПО ХИМИИ Изучение химии в основной школе направлено на достижение следующих целей: освоение важнейших знаний о химической символике, химических понятиях,
Муниципальное автономное общеобразовательное учреждение «Средняя общеобразовательная школа 16» с изменениями от 16. 12.2016 г. РАБОЧАЯ ПРОГРАММА по предмету «химия» 8-9 класс (ФК ГОС) 1.Требования к уровню
12.2016 г. РАБОЧАЯ ПРОГРАММА по предмету «химия» 8-9 класс (ФК ГОС) 1.Требования к уровню
ЕСТЕСТВОЗНАНИЕ. ХИМИЯ. ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ. Основные понятия и законы химии. Строение вещества. Типы химических связей. Предмет химии. Её связь с другими науками. Познание свойств вещества, строения,
Химия Пояснительная записка Примерная программа учебного предмета «Химия» на уровне основного общего образования составлена в соответствии с требованиями к результатам основного общего образования, утвержденными
Муниципальное автономное общеобразовательное учреждение основная общеобразовательная школа села Зарубино Билеты по химии Учитель химии Сомова Н.Х. 2012 г. Экзаменационные билеты по химии Теоретическая
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ХИМИИ В САРАТОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ В 2009 ГОДУ 1. Предмет химии, ее задачи. Место химии среди естественных наук, взаимосвязь наук с химией.
Задания А1 по химии 1. Одинаковое число электронов содержат частицы Порядковый номер элемента определяет количество электронов в атоме. При образовании положительно заряженных ионов количество электронов
Одинаковое число электронов содержат частицы Порядковый номер элемента определяет количество электронов в атоме. При образовании положительно заряженных ионов количество электронов
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ КРАСНОДАРСКОГО КРАЯ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «НОВОРОССИЙСКИЙ КОЛЛЕДЖ РАДИОЭЛЕКТРОННОГО ПРИБОРОСТРОЕНИЯ»
Аннотация к рабочей программе по химии Рабочая программа по химии для основной школы составлена на основе: 1. Федеральный Закон «Об образовании в РФ» от 29 декабря 2012 года, 273. 2. Приказ Министерства
План-конспект урока химии в 11 классе общеобразовательной школы Тема: «Химическая. Виды химической связи». Цели: 1. Углубить, обобщить и систематизировать основные понятия темы. Совершенствовать навыки
Усть-Донецкий район х. Крымский муниципальное бюджетное общеобразовательное учреждение Крымская средняя общеобразовательная школа УТВЕРЖДЕНА Приказ от 2016г Директор школы И. Н. Калитвенцева Рабочая программа
Н. Калитвенцева Рабочая программа
I.Требования к уровню подготовки учащихся Учащиеся в результате усвоения раздела должны знать/понимать: химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических
РАБОЧАЯ ПРОГРАММА УЧЕБНОГО ПРЕДМЕТА «ХИМИЯ», 9 КЛАСС Рабочая программа учебного предмета «Химия», 9 класс составлена в соответствии федеральным компонентом государственного стандарта общего образования
I. Требования к уровню подготовки учащихся В результате изучения химии в 9 классе учащиеся должны знать: химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических
РАБОЧАЯ ПРОГРАММА ПО ХИМИИ АННОТАЦИЯ КЛАСС: 8-9 1. Нормативные документы: Федеральный закон от 29.12.2012 273-ФЗ «Об образовании в Российской Федерации» Приказ Министерства образования и науки Российской
Требования к уровню подготовки выпускников: Обучающийся должен знать: важнейшие химические понятия: вещество, химический элемент, атом, молекула, атомная и молекулярная масса, ион, аллотропия, изотопы,
А 3.
 Химическая связь.
Химическая связь. 1. Химическая связь в хлороводороде и хлориде бария соответственно
1)ковалентная полярная и ионная 2) ковалентная неполярная и ионная
3)ионная и ковалентная полярная 4) ионная и ковалентная неполярная
2. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1)сульфат бария и метанол 2)сероводород и метан
2)вода и ацетилен 4}азот и фторид кальция
3. Химическая связь в молекулах метана и хлорида кальция соответственно
1)водородная и ионная 2)ионная и ковалентная полярная
3)ковалентная неполярная и ионная 4)ковалентная полярная и ионная
4. Вещества только с ковалентной полярной связью указаны в ряду:
1)СаF 2 , Nа 2 S, N 2 2)Р 4 , FеС1 3 , NН 3 3)SiF 4 , НF, Н 2 S 4)Nа 3 Р, LiН, S0 2
5. Вещества с ионным типом связи — это
1)SF 6 , NН 4 F, ОF 2 , 2)NН 4 С1, РС1 3 , SiС1 4 3)КF, КС1, NН 4 F 4)СН 4 , К 2 С0 3 , С 2 Н 2
6. Полярность связи Э-Н увеличивается в ряду
1)Н 2 S, НС1 2) НF, Н 2 О 3)NН 3 , С 2 Н 6 4)Н 2 S, Н 2 Sе
7. Длина связи увеличивается в ряду
Длина связи увеличивается в ряду
1)РС1 3 , РВг 3 , РН 3 2)NН 3 , NF 3 , NС1 3 3)SО 2 , СО 2 , NО 2 4)ВгС1 3 , ВгF 3 , НВг
6. Прочность связи увеличивается в ряду
1) NН 3 , РН 3 2) Н 2 , Вг 2 3) СS 2 , СО 2 4) НВг, НI
9. Ионный характер связи наиболее выражен в соединении
1)ВеО 2) К 2 О 3) МgО 4)В 2 О 3
10. Число σ-связей одинаково в молекулах в ряду
1)Н 2 S, СО 2 , NН 3 2)Н 2 О, SO 2 , SО 3 3)РF 3 , NН 3 , НС1 4)С 2 Н 2 , SО 3 , NН 3
11 .Число π-связей в молекуле увеличивается в ряду
1)СО 2 , SО 2 , С 2 Н 2 2)С 2 Н 2 , NО 2 , NО 3)NО, N 2 , SО 3 4)НС1О 4 , Н 2 СО 3 , С 2 Н 2
12. Связь образована по донорно-акцепторному механизму
1) NН 3 2) Н 2 О 3) Н 3 О + 4) Н 2 О 2
А. Чем больше энергии выделяется при образовании связи, тем связь прочнее.
Б. Чем полярнее связь, тем легче она разрывается по ионному типу.
1}верно только А 2)верно только Б 3)верны оба суждения 4)оба неверны
А. При разрыве некоторых связей происходит выделение энергии.
При разрыве некоторых связей происходит выделение энергии.
Б. Пи-связь менее прочна, чем сигма-связь.
А. При образовании химической связи энергия всегда выделяется.
Б. Энергия двойной связи меньше, чем одинарной связи.
1)верно только А 2)верно только Б 3)верны оба суждения 4)оба неверны
16. Прочность связи увеличивается в молекулах в ряду
1)хлор-кислород-азот 2)кислород-азот-хлор
3)кислород-хлор-азот 4)хлор-азот-кислород
17. Водородные связи образуются между молекулами
1) водорода 2) формальдегида 3) уксусной кислоты 4) сероводорода
18 .Способность атомов принимать электроны увеличивается в ряду:
а) Br,S,Te б) C,Si,Pb в) Cl,Br,I г) N,O,F
19 .За счет ковалентной полярной связи образованы следующие вещества:
а) H 2 S,Cl 2 ,H 2 O б) CO,SO 2 ,N 2 O 5 в) NaCl, F 2 , NO г) HCl,NH 3 ,KI
20 .У ионов по сравнению с атомами:
а) разное количество электронов
б) разное количество протонов
в) разное количество нейтронов
г) нет различий
21 . В соединении KNO 3 химические связи:
В соединении KNO 3 химические связи:
а) все ковалентные б) все ионные
в) ковалентные и ионные
г) металлические и ковалентные
22 .В каком ряду записаны формулы веществ с ионной связью?
а) HBr, KOH, CaBr 2
б) CaCl 2 , NaOH, K 2 SO 4
в) H 2 SO 4 , K 2 SO 4 , Al(OH) 3
г) K 2 O, NaF, SO 3
23 .Наиболее электроотрицательный элемент – это:
а) бор б) сера в) кислород г) азот
24 .Вещество с ионной связью имеет формулу: а) F 2 б) HF в) CaF 2 г) OF 2
25 .Между атомами химических элементов с порядковыми номерами 11 и 7 образуется химическая связь:
а) ковалентная неполярная б) ковалентная полярная в) ионная г) металлическая
26 .Вещество с металлической связью имеет формулу:
а) BaCl 2 б) PCl 3 в) Cl 2 г) Ba
27 .Химическая связь в оксиде калия
а) ковалентная полярная б) ковалентная неполярная в) ионная г) металлическая.
А 5. Вещества молекулярного и немолекулярного строения.
1 .Все вещества молекулярного строения характеризуются
1) высокой температурой плавления 2) электропроводностью
3) постоянством состава 4) твердостью
2 .Кристаллическая решетка кремния
3 . Молекулярное строение имеет 1) хлорид бария 2) оксид калия 3) хлорид аммония 4) аммиак
4.Молекулярное строение имеет
1) СО 2 2) КВг 3) МgSО 4 4) SiО 2
5 .Молекулярную кристаллическую решетку имеют вещества
1) графит и алмаз 2) кремний и йод
3) хлор и оксид углерода(4) 4) хлорид калия и оксид бария
6 .Аллотропными модификациями являются
1) сера и селен 2) графит и алмаз
3) кислород-17 и кислород-18 4) азот и аммиак
7 .Атомную кристаллическую решетку имеют
1) оксид кремния (4) и оксид углерода (4) 2) хлор и йод 3) графит и кремний 4) хлорид калия и фторид натрия
8 .Вещество немолекулярного строения
1)СО 2) МgО 3)СО 2 4) SО 3
9 .Наибольшую температуру плавления имеет
1)хлорид лития 2)хлорид натрия 3)хлорид калия 4)хлорид рубидия
10 . Бром — летучая жидкость с неприятным запахом. Кристаллическая решетка брома
Бром — летучая жидкость с неприятным запахом. Кристаллическая решетка брома
1) атомная 2) молекулярная 3) ионная 4) металлическая
11 .Оксид кремния тугоплавок, нерастворим. Его кристаллическая решетка 1) атомная 2) молекулярная 3) ионная 4) металлическая
12 .Из молекул состоят кристаллы
1) сахара 2) соли 3) алмаза 4) серебра
13 . Из разноименно заряженных ионов состоят кристаллы 1)сахара 2) гидроксида натрия 3) графита 4) меди
14 .Тугоплавким и нелетучим веществом является
1) С 6 Н 6 2) ВаСО 3 3) СО 2 4) О 3
15 . Оцените правильность суждений А. Если между частицами в кристалле прочная связь, то вещество тугоплавко
Б. Все твердые вещества имеют немолекулярное строение
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба неверны
16 .Оцените правильность суждений
А. Если между частицами в кристалле прочная связь, то вещество легко испаряется
Б. Все газы имеют молекулярное строение
1) верно только А 2) верно только Б 3) оба суждения верны 4) оба неверны
А. Среди веществ молекулярного строения есть газообразные, жидкие и твердые
Среди веществ молекулярного строения есть газообразные, жидкие и твердые
при обычных условиях
Б. Вещества с атомной кристаллической решеткой при обычных условиях твердые
1) верно только А 2) верно только Б 3)оба суждения верны 4) оба неверны
Химическая связь
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr,Na2O,KI
3) SO2. P4.CaF2
P4.CaF2
4) H2S,Br2,K2S
3. Соединение с ионной связью образуется при взаимодействии
1) СН4 и О2
2) SO3 и Н2О
3) С2Н6 и HNO3
4) NH3 и HCI
4. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl,NaCl.Cl2
2) O2.H2O.CO2
3) H2O.NH3.CH4
4) NaBr.HBr.CO
5. В каком ряду записаны формулы веществ только с ковалентной полярной
связью?
1) С12, NO2, НС1
2) HBr,NO,Br2
3) H2S.H2O.Se
4) HI,H2O,PH3
6. Ковалентная неполярная связь характерна для
1) С12 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью является
Веществом с ковалентной полярной связью является
1) С12 2) NaBr 3) H2S 4) MgCl2
8. Веществом с ковалентной связью является
1) СаС12 2) MgS 3) H2S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
1) NH3 2) Сu 3) H2S 4) I2
10. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
12. Ковалентная полярная связь характерна для
1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1)ковалентную полярную
2) ковалентную неполярную
3) ионную
4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1} ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота
2) сероводорода
3) метана
4) хлора
16. Водородные связи образуются между молекулами
1) диметилового эфира
2) метанола
3) этилена
4) этилацетата
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
19. Водородная связь не характерна для вещества
Водородная связь не характерна для вещества
1) Н2О 2) СН4 3) NH3 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) H2S и Na2S
4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3} брома 4} иода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4H10, NO2, NaCl
2) СО, CuO, CH3Cl
3) BaS,C6H6,H2
4) C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО,С3Н6, S8
2) Fe.NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5NO2, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) С3Н4, NO, Na2O
2) СО, СН3С1, PBr3
3) Р2Оз, NaHSO4, Сu
4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C3Ha,NO2, NaF
2) КС1, CH3Cl, C6H12О6
3) P2O5, NaHSO4, Ba
4) C2H5NH2, P4, CH3OH
27. Полярность связи наиболее выражена в молекулах
Полярность связи наиболее выражена в молекулах
1) сероводорода
2) хлора
3) фосфина
4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1)СF4
2)CCl4
3)CBr4
4)CI4
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
30. Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
Урок химии на тему «Химическая связь», 11-й класс
Цель урока и задачи:
Образовательная: выявление и оценка степени овладения системой знаний и комплексом навыков и умений о химической связи, готовности учащихся успешно применять полученные знания на практике, позволяющие обеспечить обратную связь и оперативную корректировку учебного процесса;
Развивающая: развитие критического мышления , самостоятельности и способности к рефлексии, обеспечение системности учения;
Воспитательная: воспитание положительной мотивации учения, правильной самооценки и чувства ответственности.
Тип урока: — применение знаний по теме.
Оборудование: ПК, медиапроектор, STAR BOARD, у учителя- макеты кристаллических решеток, модели биополимеров: белков, ДНК, скотч, на каждом столе у учащихся – мини-лекция, фломастеры, листки чистой бумаги.
СХЕМА УРОКА
1. Стадия вызова — СОСТАВЛЕНИЕ КЛАСТЕРА ( ПУЧОК)
Задачи этой стадии:
- самостоятельное определение учащимися направлений в изучении темы, тех ее аспектов, которые хотелось бы обсудить и осмыслить;
- самостоятельная актуализация по теме и пробуждение познавательной активности;
на этой фазе работы заслушивается коллективное мнение, знание об этом понятии и выявляются остаточные знания.
На этом этапе не дается оценка знаний. Но кластер пока с доски не стирается.
Учитель ставит перед ребятами вопрос: « А соответствуют ли ваши представления научным понятиям?» и ставит учебную задачу.
2. СТАДИЯ ОСМЫСЛЕНИЯ
Учащимся предлагается новая информация, которую они должны отработать.
Задачи этой стадии:
- организация активной работы с информацией, увязать их уже с имеющимися знаниями
- активно отслеживать свое понимание (каждому)
Эта технология связана с текстом и письмом. Требования к тексту: 7-10 минут прочтения. Текст-это последовательность осмысленных высказываний, передающих информацию, объединенных общей темой, обладающих свойствами связности и целостности. Текст должен быть адаптирован, Читая текст, делать пометки на полях:
V – я знал
+ -не знал
— — понимал не так (думал по-другому)
? — не понял, хочу узнать больше.
Прочитав текст один раз, нужно вернуться к своим первоначальным предположениям, вспомнить, что сам ученик знал или предполагал по данной теме раньше, возможно, количество значков увеличится.
Далее в тетради , или на листке сформулировать эти значки словами в таблицу «ИНСЕРТ»
Для заполнения таблицы необходимо снова вернутся к тексту, таким образом, обеспечивается вдумчивое, внимательное чтение.
V |
+ |
— |
? |
Я знал, что… |
|
|
|
На этом этапе реализуется личностно-ориентированный подход по поводу содержания урока. ЭТО НЕ ПРОВЕРЯЕМО. Технологический прием « ИНСЕРТ» сделают зримым процесс накопления информации, путь от «старого» знания к « новому». При этом графу ? необходимо довести до конца. Возвращаемся снова к КЛАСТЕРУ. Большой потенциал данный прием имеет на стадии рефлексии – это исправление неверных предложений в « предварительном КЛАСТЕРЕ», заполнение иго на основе новой информации, установление причинно-следственных связей между отдельными смысловыми блоками ( работа может вестись индивидуально в группах, по всей теме или по отдельным смысловым блокам). Учитель спрашивает:»Что изменилось?»,стирает жестко КЛАСТЕР. Очень важным моментом является презентация «новых» КЛАСТЕРОВ- это и есть осмысление. Ошибаться не стыдно, исправлять – нормальный процесс.
При этом графу ? необходимо довести до конца. Возвращаемся снова к КЛАСТЕРУ. Большой потенциал данный прием имеет на стадии рефлексии – это исправление неверных предложений в « предварительном КЛАСТЕРЕ», заполнение иго на основе новой информации, установление причинно-следственных связей между отдельными смысловыми блоками ( работа может вестись индивидуально в группах, по всей теме или по отдельным смысловым блокам). Учитель спрашивает:»Что изменилось?»,стирает жестко КЛАСТЕР. Очень важным моментом является презентация «новых» КЛАСТЕРОВ- это и есть осмысление. Ошибаться не стыдно, исправлять – нормальный процесс.
3. СТАДИЯ РЕФЛЕКСИИ – ОСМЫСЛЕНИЕ
Вопрос |
Вариант ответа |
|||||
1.соотнесите |
1)хлорид калия |
Тип связи: |
||||
2. |
а) N и О |
б)Si и Cl |
в)Na и O |
г)P и Br |
||
3.Неполярная ковалентная связь наблюдается в следующем веществе |
А) углекислый газ |
Б) алмаз |
В) аммиак |
Г) хлороформ |
||
4. Какие из перечисленных признаков хар-ы для веществ с металлическим типом связи: |
А) 1,2,4 |
Б) 2,3,4 |
В)1,2,5 |
Г) 3,4,5 |
||
5. |
I. кремний |
|
А)ионная |
|||
САМОПРОВЕРКА
Вопрос |
Ответ |
1. |
1а, 2б, 3в, 4г, 5а, 6г |
2. |
В |
3. |
Б |
4. |
А |
5. |
I.4.в; II.3.а; III.2.б; IV.1.г. |
ПОДВЕДЕНИЕ ИТОГОВ : выяснить отношение учащихся прошедшему к семинару. Время 5 минут, участвуют все. Материал: листы бумаги всем участникам, фломастеры, скотч.
ПРОВЕДЕНИЕ:
Вопросы для подведения итогов работы обозначаются с помощью пальцев:
— большой палец – над темой я хотел(а) бы еще поработать
— указательный палец – здесь мне необходимы конкретные указания
— средний палей – мне здесь совсем не понравилось
— безымянный палец – психологическая атмосфера
— мизинец – мне здесь не хватало …
Ребята рисуют свои руки, обводя их контур, записывают вопросы возле каждого пальца и вписывают внутри контура свои вопросы. Затем листки вывешиваются – как бы « на выставке», и всем учащимся до общего обсуждения предоставляется время для знакомства и следующий урок начинается с обсуждения.
Затем листки вывешиваются – как бы « на выставке», и всем учащимся до общего обсуждения предоставляется время для знакомства и следующий урок начинается с обсуждения.
ДОМАШНЕЕ ЗАДАНИЕ:
обязательная часть: по задачнику работа
индивидуальная часть: познакомиться с результатами предыдущего урока, на основе самоконтроля и самопроверки поработать над ошибками дома.
Приложение
ХИМИЧЕСКАЯ СВЯЗЬ 8 класс | |
Дидактическая карточка № 1/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: NCl3, K2O, h3S, O3, Mg Определите степень окисления каждого атома в веществах, формулы которых: LiOH, h3SO3, Cr2O3, AlBr3, KH, OF2 Нарисуйте структурную формулу для вещества, формула которого h3SO4 | Дидактическая карточка № 2/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: PF3, BaO, h3O, O2, Al Определите степень окисления каждого атома в веществах, формулы которых: Ba(OH)2, h3SO4, MnO2, CrO3, h3O2, F2 Нарисуйте структурную формулу для вещества, формула которого h3SiO3 |
Дидактическая карточка № 3/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: CO2, K2O2, Al2S3, N2, Be Определите степень окисления каждого атома в веществах, формулы которых: Al(OH)3, h3SiO3, Al2O3, AlN, Mgh3, N2 Нарисуйте структурную формулу для вещества, формула которого h3CO3 | Дидактическая карточка № 4/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: HF, KF, SO2, h3, Cs Определите степень окисления каждого атома в веществах, формулы которых: Be(OH)2, h3CO3, Cl2O3, Mg3P2, K3N, O2 Нарисуйте структурную формулу для вещества, формула которого HNO3 |
Дидактическая карточка № 5/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: AsCl3, MgO, K2S, CO2, Pb Определите степень окисления каждого атома в веществах, формулы которых: Fe(OH)3, HNO3, Crh4, HCl, HClO4, Cl2 Нарисуйте структурную формулу для вещества, формула которого h3S | Дидактическая карточка № 6/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: Ch5, SiO2, Cl2O, I2, K Определите степень окисления каждого атома в веществах, формулы которых: h3CO2, PCl5, Nh4, CrBr3, RbH, NO2 Нарисуйте структурную формулу для вещества, формула которого HClO4 |
Дидактическая карточка № 7/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: OF2, N2O, h3Se, CCl4, Mg3N2 Определите степень окисления каждого атома в веществах, формулы которых: La(OH)3, h4PO3, CrO3, AlF3, N2O3, Mg(NO3)2 Нарисуйте структурную формулу для вещества, формула которого h4PO4 | Дидактическая карточка № 8/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: Ph4, Mg2C, As2O3, CHCl3, Ba3P2 Определите степень окисления каждого атома в веществах, формулы которых: HNO2, P2O5, MgO, KClO4, NO, Fe(NO2)2 Нарисуйте структурную формулу для вещества, формула которого Al(OH)3 |
Дидактическая карточка № 9/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: N2O3, N2O, Nh4, CF4, Mg3N2 Определите степень окисления каждого атома в веществах, формулы которых: h4PO4, h4PO3, AlPO4, AlP, PCl5, Mg3P2 Нарисуйте структурную формулу для вещества, формула которого h3SeO4 | Дидактическая карточка № 10/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: NF3, SiCl4, h3Se, P2S3, Al2S3 Определите степень окисления каждого атома в веществах, формулы которых: HNO3, HNO2, KNO3, Li3N, NCl3, NO2 Нарисуйте структурную формулу для вещества, формула которого Ca3(PO4)2 |
Дидактическая карточка № 11/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: N2, KBr, Ph4, P2O3, Al2S3 Определите степень окисления каждого атома в веществах, формулы которых: CO2, CO, CaCO3, h3CO3, COCl2, NaHCO3 Нарисуйте структурную формулу для вещества, формула которого NaHCO3 | Дидактическая карточка № 12/8 ХС Химическая связь Определите тип связи в следующих молекулах и нарисуйте механизм ее образования: O2, Al2O3, h3O2, As2O3, K2S Определите степень окисления каждого атома в веществах, формулы которых: MnO2, MnO, MnCO3, Mn, KMnO4, K2MnO4 Нарисуйте структурную формулу для вещества, формула которого Na3PO4 |
Классные ресурсы | План установки химического склеивания
Резюме
В библиотеке материалов для занятий в средней школе AACT есть все, что вам нужно для составления учебного плана для вашего класса: уроки, занятия, лабораторные работы, проекты, видео, симуляции и анимации. Мы разработали модульный план, используя ресурсы AACT, который предназначен для обучения ваших студентов химическому связыванию.
Мы разработали модульный план, используя ресурсы AACT, который предназначен для обучения ваших студентов химическому связыванию.
Уровень
Средняя школа
Цели
К концу этого раздела учащиеся должны уметь
- Различие между расположением атомов металлов и атомов неметаллов в периодической таблице.
- Используйте значения электроотрицательности, чтобы предсказать, какая связь наиболее вероятна: ионная или ковалентная.
- Идентифицируйте соединения как ионные, ковалентные или металлические на основе их химической формулы.
- Предсказать количество атомов, необходимых в молекулярной формуле.
- Изучите соотношения атомов в соединениях.
- Перечислите некоторые свойства ионных, ковалентных и металлических связей.
- Сравните и сопоставьте основную структуру ионных и молекулярных соединений.
- Определить количество валентных электронов у атома.
- Создайте точечную структуру Льюиса для атома, ковалентного соединения и ионного соединения.

- Предсказать заряд иона.
- Предсказать молекулярную форму ковалентной молекулы на основе ее точечной структуры Льюиса.
- Объясните, почему из катионов и анионов образуются стабильные нейтральные ионные соединения.
- Объясните, почему различные количества ионов объединяются, образуя различные соединения.
- Объясните назначение верхних и нижних индексов в химических формулах.
- Назовите и напишите формулы бинарных и тройных ионных соединений.
- Визуализируйте «свободно движущиеся электроны» в металлической связи.
- Определите, что разные металлы имеют разные свойства.
- Осмыслить влияние одного домена электронной пары на другой и понять, как эти взаимодействия приводят к геометрии молекул, предсказанной теорией VSEPR.
- Опишите влияние отталкивания электронных пар на форму молекулы.
- Поймите, что названия молекулярных форм являются описаниями фактической формы.
- Установить корреляцию между геометрией, несвязывающими парами и молекулярной формой.

- Свяжите форму молекулы и значения относительной электроотрицательности составляющих ее атомов с полярностью молекулы.
- Объясните значение следующих слов: когезия, адгезия, поверхностное натяжение и капиллярное действие.
- Опишите уникальное поведение молекул воды и почему оно важно.
- Определить полярность молекул.
- Расположите молекулы в порядке возрастания силы Ван-дер-Ваальса, учитывая набор структурных формул для нескольких соединений.
- Манипулируйте моделями, чтобы продемонстрировать молекулярную ориентацию, порождающую лондоновские дисперсионные силы, диполь-дипольные силы и водородные связи.
- Определите межмолекулярные силы, присутствующие в химических веществах.
- Знать, что физические свойства связаны с межмолекулярными силами.
Темы химии
Этот модуль помогает учащимся понять
- Ионная связь
- Ковалентная связь
- Наименование соединений
- Молекулярные формулы
- Молекулярная структура
- Точечные структуры Льюиса
- Молекулярные формы
- Теория ВСЕПР
- Молекулярная геометрия
- Электроотрицательность
- Полярность
- Физические свойства
- Металлические связки
- Магнетизм
- Электрический ток
- Электроны
- Закон Ленца
- Резонанс
- Свойства воды
- Бисероплетение
- Межмолекулярные силы
- Лондонские дисперсионные силы
- Силы диполя-диполя
- Водородное соединение
Время
Подготовка учителя : см. отдельные ресурсы.
отдельные ресурсы.
Урок : 8-12 академических часов, в зависимости от уровня класса.
Материалы
- См. список материалов, прилагаемый к каждому отдельному виду деятельности.
Безопасность
- См. инструкции по технике безопасности, прилагаемые к каждому отдельному виду деятельности.
Заметки учителя
- Действия, показанные ниже, перечислены в том порядке, в котором они должны быть выполнены.
- Количество заданий, которые вы будете использовать, будет зависеть от уровня учащихся, которых вы обучаете.
- Заметки учителя, раздаточные материалы для учащихся и дополнительные материалы доступны на странице для каждого отдельного занятия.
- Обратите внимание, что большинство этих ресурсов предоставляются участникам AACT.
Классные ресурсы:
Основы склеивания
- Помогите учащимся представить, как образуются различные химические связи, используя анимацию связи, чтобы представить концепцию связи.
 Примеры ионных, ковалентных и полярных ковалентных связей анимированы, и учащимся предоставляется набор соединений для предсказания типов связи.
Примеры ионных, ковалентных и полярных ковалентных связей анимированы, и учащимся предоставляется набор соединений для предсказания типов связи. - Используйте Моделирование ионной и ковалентной связи с сентября выпуск 2016 г. Химия Решения для студентов изучить ионную и ковалентную связь. Учащиеся общаются с разными комбинации атомов и ставится задача определить тип связи и число атомов, необходимое для образования каждого. Моделирование визуально отличает между переносом электронов при образовании ионного соединения и совместное использование электронов при образовании ковалентного соединения.Студенты также становятся знакомы с молекулярной формулой и геометрической формой, а также с наименованием системы для каждого типа облигаций. Эта симуляция разблокирована и может использоваться ваши студенты. Он также включает в себя руководство для учителя и лист активности учащихся.
Ковалентная, ионная и металлическая связь и свойства
- В лаборатории You Light Up My Life студенты участвуют в управляемом исследовании, которое позволяет им проверить различные физические свойства заданных образцов.
 Эта лабораторная работа может быть использована для изучения ионных, ковалентных и металлических связей и их свойств. Это также поможет учащимся установить связи и различать типы связей, а также поможет им лучше понять номенклатуру ионных и ковалентных соединений.
Эта лабораторная работа может быть использована для изучения ионных, ковалентных и металлических связей и их свойств. Это также поможет учащимся установить связи и различать типы связей, а также поможет им лучше понять номенклатуру ионных и ковалентных соединений. - Учащиеся строят ионные соединения, уравновешивая заряды катионов и ионов в упражнении «Создание ионных соединений». Это задание показывает учащимся, как образовывать стабильные ионные соединения, объясняет, почему для образования этих соединений необходимо разное количество катионов и ионов, и использует верхние и нижние индексы в химических формулах.Другим вариантом является головоломка с ионными связями, которая содержит кусочки головоломки, которые учащиеся используют для создания нейтральных ионных соединений. После того, как они получили нейтральное ионное соединение, они могут использовать электронные точечные диаграммы, чтобы показать образование соединений. Наконец, они назовут ионные соединения.
- Учащиеся строят модели ионных и ковалентных соединений с помощью лаборатории Lego Modeling of Compounds.
 К концу этой лабораторной работы они смогут строить молекулярные модели, исследовать соотношение атомов в соединениях и сравнивать базовую структуру ионных и ковалентных веществ.
К концу этой лабораторной работы они смогут строить молекулярные модели, исследовать соотношение атомов в соединениях и сравнивать базовую структуру ионных и ковалентных веществ. - Используйте одно из наших заданий по ионной связи, чтобы помочь учащимся продемонстрировать свое понимание ионной связи и ионных свойств.
- Упражнение «Меня зовут Бонд, ионная связь» начинается с того, что пары учащихся играют в игру «Война ионных соединений», чтобы построить восемь соединений. Затем перенесите соединения в «скобку» и используйте свои знания об ионной связи вместе с диаграммой растворимости, чтобы предсказать самую сильную и самую слабую связь между четырьмя парами ионных веществ.
- С помощью аналогичного ресурса «скобки», Ionic Bonding Brackets, учащиеся применяют свои знания о силе ионной связи и ее связи с температурой плавления и растворимостью. После анализа ионного заряда и радиуса, чтобы предсказать самую сильную и самую слабую связь между четырьмя парами ионных веществ, они затем определят, какая из них будет наименее растворимой.

- Демонстрация «Соединение металлов и магнетизм» может быть использована для того, чтобы показать вашим учащимся, как электроны проходят через металл с использованием трубок, изготовленных из разных металлов.Эта демонстрация позволит вашим ученикам визуализировать «свободно движущиеся электроны» в металлических соединениях, понять магнитные поля и определить, что разные металлы имеют разные свойства из-за их электронной структуры.
- Упражнение «Разве не ионное» использует подсказки и вопросы, чтобы помочь учащимся научиться образовывать ионные и ковалентные соединения. К концу этого задания учащиеся должны уметь предсказывать заряды ионов, ионные связи и ковалентные связи. Это упражнение также можно использовать, чтобы помочь учащимся решить стехиометрические задачи для расчетов предельных и избыточных реагентов.
- Используйте лабораторную работу «Ионные и ковалентные соединения», чтобы позволить учащимся сравнить два визуально похожих вещества, соль и сахар .
 Расплавив образец каждого вещества и проанализировав их химический состав, учащиеся делают выводы о свойствах ионных и ковалентных соединений.
Расплавив образец каждого вещества и проанализировав их химический состав, учащиеся делают выводы о свойствах ионных и ковалентных соединений.
Структуры Льюиса, молекулярная геометрия (VSEPR) и полярность
- На уроке «Молекулярные соединения» учащиеся обучаются тому, как называть молекулярные соединения и создавать точечные структуры Льюиса с помощью одного игрального кубика и карточек элементов.Этот ресурс включает в себя набор карточек с элементами, которые ваши учащиеся могут использовать при выполнении задания.
- Познакомьте с молекулярной геометрией с помощью задания VSEPR Modeling, в ходе которого учащиеся строят физические модели молекул, а затем определяют расположение атомов. Эта управляемая исследовательская деятельность позволяет им концептуализировать влияние одного домена электронной пары на другой. Они также поймут, как эти взаимодействия приводят к молекулярной геометрии, предсказанной теорией VSEPR.Узнайте больше об этой деятельности по моделированию VSEPR в соответствующей статье из сентябрьского выпуска Chemistry Solutions за 2017 год.

- Альтернативным вариантом является задание VSEPR с воздушными шарами, которое позволяет учащимся изучить теорию отталкивания электронных пар валентной оболочки с использованием моделей воздушных шаров. Поскольку воздушные шары, как правило, занимают столько места, сколько могут, когда связаны вместе, они могут выглядеть как модели центральных атомов в теории VSEPR, что делает модель отличной метафорой. Это упражнение является расширением формы молекул, которое можно найти на веб-сайте AACT.
- Студенты могут
исследовать геометрию ковалентных соединений VSEPR в лаборатории,
Формы молекул. Они рисуют Льюиса
структуры, использовать молекулярные модели и определять геометрию ковалентных
соединения. В этой лабораторной работе рассматриваются следующие молекулярные формы: тетраэдрическая,
тригональные пирамидальные, тригональные плоские, изогнутые и линейные. Обратите внимание на это действие
включает в себя много повторений, чтобы студенты получали столько практики, сколько необходимо
чтобы освоить это понятие.

- Студенты могут продолжить изучить теорию отталкивания электронных пар валентной оболочки, используя упражнение, ВСЕПР с воздушными шарами .Воздушные шары, как правило, занимают как можно больше места когда они связаны вместе, поэтому они выглядят как модели центральных атомов в теории ВСЕПР, отличная метафора для модели. Этот ресурс является расширением Формы молекул деятельность.
- В упражнении «Установление связей между электроотрицательностью, молекулярной формой и полярностью» учащиеся находят значения электроотрицательности различных элементов, рисуют структуры Льюиса молекул, состоящих из этих элементов, и определяют молекулярную форму каждой молекулы.Затем учащиеся определяют, являются ли молекулы полярными или неполярными, основываясь на значениях электроотрицательности атомов и форме. Наконец, учащиеся используют Ptable.com, чтобы найти информацию об атомах и молекулах и связать то, что они находят, с наблюдаемыми свойствами.
- Учащиеся могут ознакомиться с особыми свойствами воды, исследуя когезию, адгезию, поверхностное натяжение и капиллярное действие с помощью задания «Что делает воду такой особенной?» Их наблюдения помогут определить исследуемые физические свойства, описать уникальное поведение воды и объяснить, почему они важны.
- План урока «Полярность» помогает учащимся получить несколько ценных советов по определению того, является ли молекула полярной или неполярной, на основе ее структуры Льюиса, структуры VSEPR и полярности. Учебное задание включает в себя «Дерево решений», помогающее учащимся проработать этапы определения того, является ли вещество полярным.
Межмолекулярные силы (МВФ)
- Познакомьте с взаимосвязью между молекулярной структурой и свойствами с помощью урока «Химия воды». Видео.Учащиеся смотрят видео, входящее в серию видео Основы химии Американского химического общества, и отвечают на вопросы во время воспроизведения.
 Это упражнение поможет им узнать, как форма молекулы определяет такие свойства, как температура плавления и кипения.
Это упражнение поможет им узнать, как форма молекулы определяет такие свойства, как температура плавления и кипения. - Учащиеся исследуют межмолекулярные силы притяжения в плане урока «Большая гонка: исследование сил Ван-дер-Ваальса», строя молекулы и определяя силы притяжения между ними: лондонская дисперсия, диполь-диполь и водородная связь.Имея набор структурных формул, они ранжируют молекулы в порядке возрастания силы ван-дер-ваальсовых сил.
- Демонстрация межмолекулярных сил и физических свойств позволяет учащимся наблюдать и сравнивать свойства поверхностного натяжения, образования гранул, испарения и смешиваемости воды и ацетона. Этот ресурс включает согласование как с AP Chemistry Curriculum Framework, так и с NGSS.
- Если вы предпочитаете лабораторную работу, используйте лабораторию физических свойств, чтобы провести их через исследование того, как межмолекулярные силы влияют на физические свойства.Эта лабораторная работа поможет им понять, что происходит в процессе замораживания и плавления и как работает растворимость.

- Если ваши ученики
учатся тактильно, используйте один или оба этих ресурса, чтобы помочь им смоделировать
ковалентная связь и полярность с использованием веревки и шариков из пенопласта.
- В упражнении Моделирование полярности связи , учащиеся моделируют притяжение электронов в связи между двумя элементами, демонстрируя ковалентную связь. В частности, различая полярные и неполярные связи.
- В аналогичном задании Моделирование молекулярной полярности учащихся используют значения электроотрицательности и их знание ковалентной связи для моделирования связей в молекуле. Они затем используйте эту информацию, чтобы помочь им определить общую полярность молекула.
- Студенты могут исследовать Лондонскую дисперсию и диполь-дипольные межмолекулярные силы с помощью моделирования «Сравнение сил притяжения». В анализе, который следует за исследованием, они связывают IMF (включая водородные связи) с физическими свойствами, такими как температура кипения и растворимость.
 Моделирование было создано Concord Consortium для AACT с использованием программного обеспечения Next-Generation Molecular Workbench.
Моделирование было создано Concord Consortium для AACT с использованием программного обеспечения Next-Generation Molecular Workbench.- Другим вариантом является моделирование межмолекулярных сил, которое позволяет учащимся рассмотреть три основных типа межмолекулярных сил — лондонские дисперсионные силы, диполь-дипольные взаимодействия и водородные связи — с помощью коротких видеоклипов и сопроводительного текста. Затем они отвечают на вопросы викторины, используя относительную силу этих взаимодействий, чтобы сравнить различные вещества, учитывая их название, формулу и структуру Льюиса, и упорядочить их в зависимости от силы их межмолекулярных сил, их точки кипения или их давления пара.Моделирование разработано как викторина из пяти вопросов, которую учащиеся могут использовать несколько раз.
- Завершите изучение межмолекулярных взаимодействий уроком «Обзор межмолекулярных сил», который поможет вашим учащимся ознакомиться с пятью типами взаимодействий (лондонская дисперсия, дипольные диполи, дипольные силы, водородная связь и ионная связь).
 Урок включает в себя презентацию PowerPoint и лист для заметок учащихся, которые можно использовать во время повторения.
Урок включает в себя презентацию PowerPoint и лист для заметок учащихся, которые можно использовать во время повторения.
Расширение деятельности
Свяжите химию с текущими событиями с помощью одного или обоих следующих действий:
- Лаборатория химии дезинфицирующего средства для рук и мыла также показывает учащимся связь между химией и текущими событиями.Они моделируют взаимодействие между частицами дезинфицирующего средства для рук и вирусными частицами, а также между частицами мыла и вирусными частицами. Затем они применяют свое понимание молекулярной структуры и межмолекулярных сил для анализа своих наблюдений и поведения частиц.
- Помимо связи химии с текущими событиями, дайте своим учащимся дополнительную практику преобразования единиц измерения с помощью задания «Разработка эффективной респираторной тканевой маски». Учащиеся используют преобразование единиц измерения, чтобы сравнить размеры молекул, вирусов и капель, а затем использовать их для интерпретации графических данных.
 Затем они используют свои выводы для разработки тканевой маски, которая помогает защитить своего владельца от заражения SARS-CoV-2, коронавирусом, вызывающим COVID-19 .
Затем они используют свои выводы для разработки тканевой маски, которая помогает защитить своего владельца от заражения SARS-CoV-2, коронавирусом, вызывающим COVID-19 .
Завершающие проекты
Нравится ли вам заканчивать свой блок кульминационным действием? У нас есть два проекта в нашей библиотеке ресурсов Molecules & Bonding.
- С помощью молекулярного моделирования учащиеся исследуют молекулу, выбранную из утвержденного учителем списка, строят трехмерную модель молекулы и представляют свои исследования классу в устной презентации продолжительностью 7-10 минут.
- Если вы не иметь время для студентов, чтобы завершить долгосрочный проект, использовать Свойства общего молекулярного вещества вместо проекта молекулярного моделирования. Этот ресурс позволяет учащимся применять свои знания о молекулярной полярности, форме и межмолекулярных силах объяснить различия в свойствах различных ковалентных веществ.
- Проект «Эволюция материаловедения в повседневных продуктах» соединяет
повседневных продуктов в химию и помогает учащимся понять прогресс
разработка общих предметов и отображение своих знаний через творческий
видео.

День | Тема |
|
сен 7 День 1 | Добро пожаловать в курс! гр 10 Химический обзор Периодическая таблица Диаграммы Льюиса Октет Правила и общие ионы | Учебник Секции (нажмите на название) 1. |
|
| |
8 сентября День 2 | гр 10 Химический обзор Изотопное изобилие Тенденции в Периодическая таблица | Учебник Секции (нажмите на название) 1. |
|
| |
9 сентября День 3 | Тенденции в Периодическая таблица | Учебник Секции (нажмите на название) 1. |
|
| |
10 сентября День 4 | Химическая связь (ионная) | Учебник Секции (нажмите на название) 2. |
|
| |
13 сентября День 5 | Химическое соединение ионный Номенклатура | 2. 2.1 Ионные соединения |
|
| |
14 сентября День 6 | Назначение трендов Молекулярный рисунок Соединения | 2. |
|
| |
15 сентября День 7 | Полярность Молекулы | 3.3 полярных молекулы и Соединения |
|
| |
16 сентября День 8
| Межмолекулярный Силы | 3. 3,5 Водородное соединение |
|
| |
17 сентября День 9 | Номенклатура Молекулярно-ионное соединение Обзор номенклатуры Многоатомные ионы и производные | Разделы учебника (нажмите на название) 2. 2.4 Химические формулы и Номенклатура (74-81) |
| ||
20 сентября День 9 | Номенклатура Кислоты и Производные | 2. 10.1 Свойства Кислоты и основания (466-468) |
|
| |
21 сентября День 10 | Склеивание и Назначение полярности Номенклатура Соли кислот | 2. 10.1 Свойства Кислоты и основания (466-468) |
|
| |
22 сентября День 11
| Свойства Лаборатория молекулярных и ионных соединений Введение к химическим реакциям | 4. |
|
| |
23 сентября День 12
| Балансировка Химические уравнения Свойства Лабораторный анализ молекулярных и ионных соединений | 4. |
|
| |
24 сентября День 11
| 4. | |
|
| |
27 сентября День 12
| Номенклатура Учебная записка к оплате Синтез Реакции | |
|
| |
28 сентября
| Номенклатура Тест | |
|
|
(PDF) Преподавание и изучение концепции химической связи
36
Херст, О. (2002). Как мы учим первокурсников молекулярной структуре, Journal of Chemical
(2002). Как мы учим первокурсников молекулярной структуре, Journal of Chemical
Education, 79(6), 763-764.
Джонстон, А. Х. (1991). Почему науке трудно учиться? Вещи редко бывают такими, какими
кажутся. Журнал компьютерного обучения, 7, 75-83.
Джойс, Б., и Шоуерс, Б. (1983). Сила и развитие персонала посредством исследований по обучению
. Александрия, Вирджиния: Ассоциация надзора и разработки учебных программ
.
Юсти, Р.и Гилберт, Дж. К. (2000). История и философия науки через модели:
некоторые проблемы в случае «атома». Международный научный журнал
Education, 22(9), 993-1009.
Юсти, Р., и Гилберт, Дж. (2002). Модели и моделирование в химическом образовании. В JK
Gilbert, O.D. Jong, R. Justy, DF, Treagust, & JH Van Driel (Eds.),
Химическое образование: на пути к исследовательской практике (стр. 47-68).
Дордрехт: Клювер.
Кинд, В. (2009). Знания педагогического содержания в естественнонаучном образовании: перспективы
и потенциал для прогресса, Исследования в области естественнонаучного образования, 45 (2), 169-204.
Козма, Р., и Рассел, Дж. (2005). Моделирование студентов, становящихся химиками: Развитие
репрезентативных компетенций. В: Дж.К. Гилберт (ред.), Визуализация в науке
образование. (стр. 121–145). Дордрехт: академические издательства.
Леви Нахум, Т., Хофштейн, А., Мамлок-Нааман, Р.и Бар-Дов, З. (2004). Могут ли итоговые
экзаменов усилить неверные представления учащихся о химии. Химия
Образование: исследования и практика, 5(3), 301-325.
Леви Наум, Т., Мамлок-Нааман, Р., Хофштейн, А. и Крайчик, Дж. (2007). Разработка
нового подхода к обучению концепции химической связи в соответствии с текущими научными и педагогическими знаниями
, Science Education, 91, 579-603.
Леви Наум, Т.(2007). Преподавание концепции химической связи в старших классах:
Разработка и внедрение новой системы, основанной на анализе
вводящих в заблуждение системных факторов. Неопубликованная докторская диссертация, Научный институт Вейцмана
, Реховот (на иврите).
Леви Наум, Т., Мамлок-Нааман, Р., Хофштейн, А., и Кроник, Л. (2008). Новая структура
«снизу вверх» для обучения химическому связыванию. Journal of Chemical
Education, 85, 1680-1685.
Линн, М.К., Кларк, Д., и Слотта, Д.Д. (2003). WISE дизайн для интеграции знаний.
Научное образование, 87, 517–538.
Лукс-Хорсли, С., и Мацумото, К. (1999). Исследования по повышению квалификации
для учителей математики и естественных наук: состояние сцены. Школа
Наука и математика, 99, 258-271.
Лунетта, В., Н., и Хофштейн, А. (1981). Моделирование в естественнонаучном образовании. Наука
Образование, 65, 252-273.
8.S: Основные концепции химической связи (краткое содержание)
8.1: ХИМИЧЕСКАЯ СВЯЗЬ, СИМВОЛЫ ЛЬЮИСА И ПРАВИЛО ОКТЕТОВ
Символы точек Льюиса можно использовать для предсказания числа связей, образованных большинством элементов в их соединениях. Символы электронных точек Льюиса, которые состоят из химического символа элемента, окруженного точками, представляющими его валентные электроны, сгруппированы в пары, часто расположенные выше, ниже, а также слева и справа от символа. Структуры отражают тот факт, что элементы в периоде 2 и выше имеют тенденцию приобретать, терять или делиться электронами, чтобы достичь в общей сложности 8 валентных электронов в своих соединениях.
Структуры отражают тот факт, что элементы в периоде 2 и выше имеют тенденцию приобретать, терять или делиться электронами, чтобы достичь в общей сложности 8 валентных электронов в своих соединениях.
- Ионная связь : связь, образованная на основе электростатических сил, существующих между противоположно заряженными ионами. Ионы образуются из атомов путем переноса одного или нескольких электронов
- Ковалентная связь : связь, образованная между двумя или более атомами путем совместного использования электронов
- Металлическая связь : связь, при которой связывающие электроны могут относительно свободно перемещаться по трехмерной структуре
- Символы электронных точек : также известные как символы Льюиса ; простой и удобный способ показать валентные электроны атомов и следить за ними в процессе образования связи
- Количество валентных электронов любого репрезентативного элемента совпадает с номером столбца элемента в периодической таблице
- Правило октета : атомы имеют тенденцию терять или приобретать электроны, пока они не будут окружены 8 валентными электронами
8.
 2: ИОННАЯ СВЯЗЬ
2: ИОННАЯ СВЯЗЬКоличество энергии, необходимое для разделения пары газообразных ионов, представляет собой энергию связи. Образование ионных соединений обычно чрезвычайно экзотермическое. Сила электростатического притяжения между ионами с противоположными зарядами прямо пропорциональна величине зарядов ионов и обратно пропорциональна межъядерному расстоянию.
Энергия образования ионной связи
Образование ионных соединений очень экзотермическое
Удаление электрона из атома, такого как Na, является эндотермическим, поскольку необходимо использовать энергию для преодоления сил притяжения внутри атома.Добавление электрона является противоположным процессом и высвобождает много энергии
Основной причиной устойчивости ионных соединений является притяжение между ионами с разным зарядом. Это притяжение сближает ионы, высвобождая энергию и заставляя ионы образовывать твердый массив (решетку)
Энергия решетки : энергия, необходимая для полного разделения моля твердого ионного соединения на его газообразные ионы
Большие значения энергии решетки означают, что ионы сильно притягиваются друг к другу
Энергия, высвобождаемая при притяжении между ионами разного заряда, более чем компенсирует эндотермический характер энергии ионизации, превращая образование ионных соединений в экзотермический процесс
\[E = k \dfrac{Q_1Q_2}{d} \номер\]
- E = потенциальная энергия двух взаимодействующих заряженных частиц
- Q 1 и Q 2 = заряды на частицах
- D= расстояние между частицами
- К = постоянная; 8.
 99 X 10 9 Jm/C 2
99 X 10 9 Jm/C 2
Для данного расположения ионов энергия решетки увеличивается по мере увеличения заряда ионов и уменьшения их радиусов. Величина энергии решетки зависит в первую очередь от зарядов ионов, поскольку ионные радиусы не изменяются в широких пределах.
Электронные конфигурации ионов
Многие ионы, как правило, имеют электронные конфигурации инертных газов. Вот почему На может иметь заряд +1, но не +2. Как только ион достигает конфигурации благородного газа, он хочет остаться там.
- Na: 1s 2 2s 2 2p 6 3s 1 = [Ne] 3s 1
- Na + : 1s 2 2s 2 2p 6 = [Ne]
- Na 2+ : 1s 2 2s 2 2p 5
Аналогичным образом, присоединение электронов к неметаллам является либо экзотермическим, либо слегка эндотермическим, пока электроны присоединяются к валентной оболочке. Дальнейшее добавление электронов требует огромного количества энергии; больше, чем доступно энергии решетки
Дальнейшее добавление электронов требует огромного количества энергии; больше, чем доступно энергии решетки
- Cl: 1s 2 2s 2 2p 6 3s 2 3p 5 = [Ne] 3s 2 907 6 9060 3p 92
- Cl: 1s 2 2s 2 2p 6 3s 2 3p 6 = [Ar]
- Cl 2 : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 0 = [1Ar] 670 = [1Ar]
Энергии решетки ионных соединений, как правило, достаточно велики, чтобы компенсировать потерю до 3 электронов атомами.Таким образом, мы находим катионы только с зарядами +1, +2 или +3.
Поскольку большинство переходных металлов имеют более 3 электронов за пределами ядра благородного газа, достижение конфигурации благородного газа для этих ионов обычно невозможно.
Когда из атома образуется положительный ион, первыми всегда теряются электроны с подоболочки с наибольшим значением n . Таким образом, переходный металл всегда теряет внешние электроны s до того, как он потеряет электроны нижележащей подоболочки d .
Таким образом, переходный металл всегда теряет внешние электроны s до того, как он потеряет электроны нижележащей подоболочки d .
8.3 Размеры ионов
Размеры ионов важны для определения как способа упаковки ионов в твердом теле, так и энергии решетки твердого тела. Это также основной фактор, определяющий свойства ионов в растворе
.Размер атома зависит от заряда его ядра, количества электронов, которыми он обладает, и орбиталей, на которых находятся электроны внешней оболочки
Положительные ионы образуются путем удаления 1 или более электронов из самой внешней области атома.Таким образом, образование катиона не только освобождает наиболее пространственно вытянутые орбитали, но и уменьшает полные электрон-электронные отталкивания. Следовательно, катионы меньше исходных атомов, из которых они произошли.
Обратное происходит, когда речь идет об отрицательных ионах. Добавленный электрон увеличивает электрон-электронное отталкивание и заставляет электроны больше распространяться в пространстве.
Для ионов с одинаковым зарядом размер увеличивается по мере продвижения вниз по группе
8.3: КОВАЛЕНТНАЯ СВЯЗЬ
Прочность ковалентной связи зависит от перекрывания валентных орбиталей связанных атомов.Порядок связи — это количество пар электронов, которые удерживают два атома вместе. Одинарные облигации имеют порядок связи один, а множественные облигации с порядками связи два (двойная связь) и три (тройная связь) довольно распространены. В близкородственных соединениях со связями между атомами одного типа связь с наивысшим порядком связи является и самой короткой, и самой прочной.
Ионные вещества обычно хрупкие с высокими температурами плавления. Обычно они кристаллические, то есть имеют плоские поверхности, образующие характерные углы друг с другом.
- Ковалентная связь : химическая связь, образованная общей парой электронов
- Структура Льюиса : структура, представляющая связи с использованием точек для неспаренных электронов и линий для связей
Для неметаллов число валентных электронов совпадает с номером группы
Зная это, мы можем предсказать, что элементу группы 7А потребуется одна ковалентная связь, чтобы получить октет, элементу группы 6А — две и так далее.
Множественные облигации
- Простая связь : общая пара электронов, одна ковалентная связь
- Двойная связь : два общих электрона
Расстояние между связанными атомами уменьшается по мере увеличения числа общих электронных пар
8.4: ПОЛЯРНОСТЬ СВЯЗИ И ЭЛЕКТРОТРИЦАТЕЛЬНОСТЬ
Полярность связи и ионный характер увеличиваются с увеличением разницы в электроотрицательности. Электроотрицательность (χ) элемента представляет собой относительную способность атома притягивать к себе электроны в химическом соединении и увеличивается по диагонали от левого нижнего угла периодической таблицы к правому верхнему.Шкала электроотрицательности Полинга основана на измерениях силы ковалентных связей между различными атомами, тогда как электроотрицательность элемента по Малликену представляет собой среднее значение
.- Полярность связи : мера того, насколько поровну электроны распределены между атомами в химической связи
- Неполярная связь : связь, в которой электроны поровну распределены между двумя атомами
- Ковалентная полярная связь : один из атомов оказывает большее притяжение к электрону, чем другой
Электроотрицательность
Используется для оценки того, будет ли связь неполярной, полярной ковалентной или ионной
Электроотрицательность : способность атома в молекуле притягивать к себе электроны
Атом с очень отрицательным сродством к электрону и высокой энергией ионизации будет одновременно притягивать электроны от других атомов и сопротивляться оттягиванию своих электронов; он будет сильно электроотрицательным
Самая высокая электроотрицательность = 4. 0 (фтор), самое низкое = 0,7 (цезий)
0 (фтор), самое низкое = 0,7 (цезий)
Электроотрицательность увеличивается слева направо и обычно уменьшается с увеличением атомного номера в любой группе
Электроотрицательность и полярность связи
Различия в электроотрицательности:
Неполярный = 0 – 0,4
Полярная ковалентная = 0,4 – 1,6
Ионный = > 1,6 (> 50% = ионный)
δ + и δ : «знак дельты»; представляют частичный положительный и отрицательный заряд.Атом с δ является более электроотрицательным
8.5: ЧЕРТЕЖ СТРУКТУР ЛЬЮИСА
Символы точек Льюиса обеспечивают простое объяснение того, почему элементы образуют соединения с наблюдаемой стехиометрией. График зависимости общей энергии ковалентной связи от межъядерного расстояния идентичен графику ионной пары, потому что оба являются результатом сил притяжения и отталкивания между заряженными объектами. Структуры Льюиса — это попытка рационализировать, почему для элементов определенных семейств обычно соблюдаются определенные стехиометрии.
- Суммируйте валентные электроны всех атомов. Для аниона добавьте электрон к общему отрицательному заряду. Для катиона вычтите электрон.
- Напишите символы для атомов, чтобы показать, какие атомы к каким присоединены, и соедините их одинарной связью.
- Завершите октеты атомов, связанных с центральным атомом.
- Поместите все оставшиеся электроны на центральный атом, даже если в результате получится более октета
- Если электронов недостаточно, чтобы дать центральному атому октет, попробуйте кратные связи
8.6: РЕЗОНАНСНЫЕ КОНСТРУКЦИИ
Некоторые молекулы имеют две или более химически эквивалентных электронных структуры Льюиса, называемых резонансными структурами. Резонанс — это умственное упражнение и метод в рамках теории связи валентных связей, который описывает делокализацию электронов внутри молекул. Эти структуры отмечены двунаправленной стрелкой между ними, что указывает на то, что ни одна из структур Льюиса точно не описывает связь, но фактическая структура представляет собой среднее значение отдельных резонансных структур.
Резонансные структуры ( резонансные формы) представляют собой отдельные структуры Льюиса в тех случаях, когда две или более структур Льюиса одинаково хорошо описывают одну молекулу. Если молекула (или ион) имеет две или более резонансные структуры, молекула представляет собой смесь этих структур. Молекула , а не быстро колеблется между двумя или более различными формами.
8.7: ИСКЛЮЧЕНИЯ ИЗ ПРАВИЛА ОКТЕТОВ
Следование правилу октетов для точечных структур Льюиса приводит к наиболее точному изображению стабильных молекулярных и атомных структур, поэтому мы всегда хотим использовать правило октетов при рисовании точечных структур Льюиса.Есть три исключения: (1) когда имеется нечетное число валентных электронов, (2) когда валентных электронов слишком мало и (3) когда валентных электронов слишком много
- Молекулы с нечетным числом электронов
- Молекулы, в которых атом имеет менее октета
- Молекулы, в которых атом имеет более октета
Нечетное число электронов
В некоторых молекулах, таких как ClO 2 , NO и NO 2 , число электронов нечетное. Например, в NO имеется 5 + 6 = 11 валентных электронов. Следовательно, полное спаривание этих электронов невозможно, и невозможно получить октет вокруг каждого атома.
Например, в NO имеется 5 + 6 = 11 валентных электронов. Следовательно, полное спаривание этих электронов невозможно, и невозможно получить октет вокруг каждого атома.
Меньше октета
Исключения второго типа возникают, когда вокруг атома в молекуле или ионе находится менее восьми электронов. Относительно редкая ситуация; чаще всего встречается в соединениях бора и бериллия. Например, рассмотрим трифторид бора, BF 3
.Вокруг атома бора находится 6 электронов.Мы можем образовать двойную связь между бором и любым из 3 атомов фтора (3 возможных резонансных структуры)
Однако тем самым мы заставили атом фтора разделить дополнительные электроны с бором. Это привело бы к тому, что атом F имел бы заряд +1, а атом бора – заряд –1, что крайне неблагоприятно.
Затем мы заключаем, что структуры, содержащие двойные связи, менее важны, чем структура, показанная справа. Поскольку в этом случае бор имеет только 6 валентных электронов, он будет бурно реагировать с молекулами, имеющими неподеленную пару электронов.
Больше, чем октет
Правило октета работает так же хорошо, как и сейчас, потому что репрезентативные элементы обычно используют только нс и три нп орбиталей валентной оболочки в связывании, и они содержат восемь электронов.
Поскольку элементы второго периода имеют только 2s- и 2p-орбитали, они не могут иметь более октета электронов в своих валентных оболочках. Однако, начиная с третьего периода, элементы имеют незаполненные орбитали 90 333 и 90 334, которые можно использовать для связывания.
Размер также играет важную роль в определении того, может ли атом вместить более восьми электронов. Чем больше центральный атом, тем большее число атомов может его окружать. Размер окружающих атомов также важен. Расширенные валентные оболочки чаще всего возникают, когда центральный атом связан с самыми маленькими и наиболее электроотрицательными атомами.
8.8: ПРОЧНОСТЬ КОВАЛЕНТНЫХ СВЯЗЕЙ
Порядок связи — это количество пар электронов, которые удерживают два атома вместе. Одинарные облигации имеют порядок связи один, а множественные облигации с порядками связи два (двойная связь) и три (тройная связь) довольно распространены. Связь с наивысшим порядком связи является и самой короткой, и самой прочной. В связях с одинаковым порядком связи между разными атомами наблюдаются тенденции, которые, за немногими исключениями, приводят к образованию наиболее прочных одинарных связей между самыми маленькими атомами.
Одинарные облигации имеют порядок связи один, а множественные облигации с порядками связи два (двойная связь) и три (тройная связь) довольно распространены. Связь с наивысшим порядком связи является и самой короткой, и самой прочной. В связях с одинаковым порядком связи между разными атомами наблюдаются тенденции, которые, за немногими исключениями, приводят к образованию наиболее прочных одинарных связей между самыми маленькими атомами.
Энергия диссоциации связи : она же энергия связи ; изменение энтальпии, ΔH, необходимое для разрыва конкретной связи в моле газообразного вещества.
Для многоатомных молекул мы часто должны использовать средние энергии связи.
Энергия связи всегда положительна, чем больше энергия связи, тем прочнее связь
Молекула с сильными связями обычно менее подвержена химическим изменениям, чем молекула со слабыми связями
Энергии связи и энтальпии реакций
ΔH = Σ (энергии разорванных связей) – Σ (энергии образовавшихся связей)
Если ΔH > 0, реакция эндотермическая
Если ΔH < 0, реакция экзотермическая
Cl – Cl (г) + H – CH 3 (г) → H – Cl (г) + Cl – CH 3 (г)
Связи разорваны: 1 моль Cl – Cl, 1 моль C – H
Образованные связи: 1 моль H – Cl, 1 моль C – Cl
\[∆H = [D (Cl – Cl) + D(C – H)] [D (H – Cl) + D (Cl – Cl)]\]
= (242 кДж + 413 кДж) – (431 кДж + 328 кДж)
= 104 кДж
Прочность и длина связи
По мере увеличения количества связей между данным элементом энергия связи увеличивается, а длина связи уменьшается. Следовательно, атомы удерживаются более плотно и близко друг к другу. В общем случае по мере увеличения числа связей между двумя атомами связь становится короче и прочнее.
Следовательно, атомы удерживаются более плотно и близко друг к другу. В общем случае по мере увеличения числа связей между двумя атомами связь становится короче и прочнее.
8.10 Число окисления
Номера окисления : также Степени окисления ; положительное или отрицательное целое число, присвоенное элементу в молекуле или ионе на основе набора обычных правил; в какой-то степени он отражает положительный или отрицательный характер атома
Числа окисления НЕ соответствуют реальным зарядам атомов, ЗА ИСКЛЮЧЕНИЕМ особого случая простых ионных веществ
- Форма окисления элемента в его элементарной форме равна нулю .
- Степень окисления одноатомного иона равна его заряду. Например, степень окисления натрия в Na + равна +1, а серы в S 2 равна –2
- В бинарных соединениях (состоящих из двух разных элементов) элементу с большей электроотрицательностью присваивается отрицательная степень окисления, равная его заряду в простых ионных соединениях элемента.
 Например, рассмотрим степень окисления Cl в PCl 3 .Cl более электроотрицательный, чем P. В своих простых ионных соединениях Cl появляется как ион Cl. Так, в PCl 3 Cl присвоена степень окисления –1.
Например, рассмотрим степень окисления Cl в PCl 3 .Cl более электроотрицательный, чем P. В своих простых ионных соединениях Cl появляется как ион Cl. Так, в PCl 3 Cl присвоена степень окисления –1. - Сумма степеней окисления равна нулю для электрически нейтрального соединения и равна общему заряду ионных частиц. Например, PCl 3 представляет собой нейтральную молекулу. Таким образом, сумма степеней окисления атомов P и Cl должна быть равна нулю. Поскольку степень окисления каждого Cl в этом соединении равна –1 (правило 3), степень окисления P должна быть +3.
Элементы группы 1A — +1, элементы группы 2A — +2, а алюминий — +3.
Наиболее электроотрицательный элемент F всегда находится в степени окисления –1. Кислород обычно находится в состоянии -2, однако в пероксидах может быть -1.
Водород имеет степень окисления +1, когда он связан с более электроотрицательным элементом (большинство неметаллов), и -1, когда он связан с менее электроотрицательными элементами (большинство металлов)
Номера окисления и номенклатура
Сначала дается название менее электроотрицательного элемента, за которым следует название более электроотрицательного элемента, измененное таким образом, чтобы оно имело –ide , заканчивающееся на
.
Соединения металлов в более высоких степенях окисления имеют тенденцию быть молекулярными, а не ионными
Ковалентная связь – объяснение, типы и важные часто задаваемые вопросы
В химии ковалентные связи образуются между двумя атомами или ионами, в которых электронные пары являются общими для них; они также известны как молекулярные связи.Силы притяжения или отталкивания между двумя атомами (когда они имеют общую электронную пару или пару связи) называются ковалентной связью. Для описания количества электронных пар, общих для соседних атомов, Ирвинг Ленгмюр ввел термин «ковалентность» в 1919 году, но он стал использоваться в 1939 году. Соединения, содержащие углерод, демонстрируют этот тип химической связи. Пара электронов, которые являются общими для двух атомов, теперь распространяется вокруг ядер атомов, что приводит к созданию молекулы.
(изображение будет загружено в ближайшее время)
Свойства ковалентной связи
Если валентность атома не удовлетворяется путем обмена одной электронной парой между атомами, атомы имеют более одной общей электронной пары между собой. Некоторые из свойств ковалентной связи:
Некоторые из свойств ковалентной связи:
Ковалентные связи образуются между неметаллическими элементами, такими как водород, кислород и т. д.
Ковалентная связь не приводит к образованию новых электронов. Связь только соединяет их.
Ковалентные связи включают одинарные, двойные или тройные связи, в которых 2, 4 или 6 общих электронов соответственно.
Между атомами существуют очень прочные химические связи.
Ковалентная связь обычно содержит энергию около ~80 килокалорий на моль (ккал/моль).
Ковалентные связи редко самопроизвольно разрываются после их образования.
Большинство соединений с ковалентными связями имеют относительно низкие температуры плавления и кипения.

Соединения с ковалентными связями обычно имеют более низкие энтальпии испарения и плавления.
Соединения, образованные ковалентной связью, не проводят электричество из-за отсутствия свободных электронов.
Ковалентные соединения не растворяются в воде.
Типы ковалентных связей
Ковалентную связь можно разделить на три типа в зависимости от количества общих электронных пар. Типы ковалентных связей:
Одиночная ковалентная связь
Двойная ковалентная связь
Тройная ковалентная связь
Одинарная ковалентная связь
то такие связи называются одинарными ковалентными связями.
 Он представлен одним тире (-). Эта форма ковалентной связи имеет меньшую плотность и слабее, чем двойная и тройная связь, хотя и является наиболее стабильной связью.
Он представлен одним тире (-). Эта форма ковалентной связи имеет меньшую плотность и слабее, чем двойная и тройная связь, хотя и является наиболее стабильной связью.Пример:
Молекула HCL имеет один атом водорода с одним валентным электроном и один атом хлора с семью валентными электронами. В этом случае между водородом и хлором образуется одинарная связь за счет совместного использования одного электрона, что завершает октет одной молекулы HCL.
(изображение будет загружено в ближайшее время)
Двойные связи
Когда две пары электронов делятся между двумя участвующими атомами, образуется двойная связь.Он представлен двумя черточками (=). Двойные ковалентные связи намного прочнее одинарных, но они менее стабильны.
Пример:
Молекула двуокиси углерода имеет один атом углерода с шестью валентными электронами и два атома кислорода с четырьмя валентными электронами.
Чтобы завершить свой октет, поскольку углерод имеет 6 валентных электронов, он делит два своих валентных электрона с одним атомом кислорода и два с другим атомом кислорода. Каждый атом кислорода имеет два общих электрона с углеродом, поэтому в молекуле СО2 имеются две двойные связи.
(изображение будет загружено в ближайшее время)
Тройная связь
Когда три пары электронов делятся между двумя участвующими атомами, образуется тройная связь. Тройные ковалентные связи представлены тремя черточками (≡). Это наименее стабильные типы ковалентных связей.
Пример:
При образовании молекулы азота каждый атом азота, имеющий пять валентных электронов, отдает друг другу три электрона, образуя три электронные пары для завершения октета.Следовательно, между двумя атомами азота образуется тройная связь.
(изображение скоро будет загружено)
В зависимости от сродства к электронам, которое имеет каждый атом, у нас есть три типа связей: полярные, неполярные и координированные.
Неполярная ковалентная связь
Этот союз устанавливается между атомами с одинаковой электроотрицательностью. Этот тип связи может поддерживаться и между атомами с разницей электроотрицательностей менее 0,4.
Пример:
Молекула хлора Cl2 состоит из двух атомов хлора с одинаковой электроотрицательностью, которые имеют общую электронную пару в неполярной ковалентной связи.То же самое происходит и в случае двух атомов кислорода, образующих молекулу кислорода O2.
Между атомами углерода в органических молекулах ковалентная связь неполярного типа.
Полярная ковалентная связь
Полярная ковалентная связь образуется между двумя атомами неметаллов, которые имеют разность электроотрицательностей от 0,4 до 1,7. Когда они взаимодействуют, общие электроны остаются ближе к этому более электроотрицательному атому.
Пример:
Молекула воды имеет две полярные ковалентные связи между кислородом и водородом.
В молекуле воды h3O электроны атомов водорода остаются ближе и дольше вокруг кислорода, который является более электроотрицательным.
Фтор F является наиболее электроотрицательным элементом (4.0) и имеет семь валентных электронов. При соединении с водородом через полярную ковалентную связь образуется фтороводород HF.
Молекула аммиака NH 3 имеет полярные ковалентные связи между азотом и водородом.
Координированная или дативная ковалентная связь
Этот тип связи возникает, когда один из атомов в связи обеспечивает совместное использование электронов.Мы достигаем этого в реакции между аммиаком Nh4 и трифторидом бора BF3. Азот имеет два свободных электрона, а бор электронодефицитный. Объединяя азот и бор, они завершают свою последнюю оболочку с восемью электронами.
рабочих листов и онлайн-упражнений по химическому связыванию
Расширенный поискСодержание:
Язык: AfarAbkhazAvestanAfrikaansAkanAmharicAragoneseArabicAssameseAsturianuAthabascanAvaricAymaraAzerbaijaniBashkirBelarusianBulgarianBihariBislamaBambaraBengali, BanglaTibetan стандарт, тибетский, CentralBretonBosnianCatalanChechenChamorroCorsicanCreeCzechOld церковнославянский, церковнославянский, Старый BulgarianChuvashWelshDanishGermanDivehi, Мальдивский, MaldivianDzongkhaEweGreek (современный) EnglishEsperantoSpanishEstonianBasquePersian (фарси) Фуле, фулах, пулар, PularFinnishFijianFaroeseFrenchWestern FrisianIrishScottish гэльский, GaelicGalicianGuaraníGujaratiManxHausaHebrew (современный) HindiHiri MotuCroatianHaitian, гаитянский CreoleHungarianArmenianHereroInterlinguaIndonesianInterlingueIgboNuosuInupiaqIdoIcelandicItalianInuktitutJapaneseJavaneseGeorgianKarakalpakKongoKikuyu, GikuyuKwanyama, KuanyamaKazakhKalaallisut , гренландский кхмерский каннада корейский канури кашмирский курдский коми корнуоллский кыргызский латинский люксембургский , летзебургский ганда лимбургский , лимбургский , лимбургский лингала лаосский литовский люба-катанга латышский малагасийский маршалльский мао riMacedonianMalayalamMongolianMarathi (маратхи) MalayMalteseBurmeseNauruanNorwegian BokmålNorthern NdebeleNepaliNdongaDutchNorwegian NynorskNorwegianSouthern NdebeleNavajo, NavahoChichewa, Chewa, NyanjaOccitanOjibwe, OjibwaOromoOriyaOssetian, OsseticEastern пенджаби, Восточная PanjabiPāliPolishPashto, PushtoPortugueseQuechuaRomanshKirundiRomanianRussianKinyarwandaSanskrit (санскрит) SardinianSindhiNorthern SamiSangoSinhalese, SinhalaSlovakSloveneSamoanShonaSomaliAlbanianSerbianSwatiSouthern SothoSundaneseSwedishSwahiliTamilTeluguTajikThaiTigrinyaTurkmenTagalogTswanaTonga (Остров Тонга) TurkishTsongaTatarTwiTahitianUyghurUkrainianUrduUzbekValencianVendaVietnameseVolapükWalloonWolofXhosaYiddishYorubaZhuang, ChuangChineseZulu Предмет:
Класс/уровень: Возраст: 345678
Поиск: Все рабочие листыТолько мои подписчикиТолько мои любимые рабочие листыТолько мои собственные рабочие листы
Химические связи: определение, типы и примеры
Определение: что такое химическая связь?
Химические связи — это силы, которые удерживают атомы вместе в молекуле. Они являются результатом сильных внутримолекулярных взаимодействий между атомами молекулы. Валентные (самые внешние) электроны атомов участвуют в химических связях. Когда два атома приближаются друг к другу, эти внешние электроны начинают взаимодействовать. Хотя электроны отталкиваются друг от друга, они притягиваются к протонам внутри атомов. Взаимодействие сил приводит к образованию связей между атомами. Основными типами химических связей являются ионная связь, ковалентная связь, водородная связь и металлическая связь [1,2] .
Они являются результатом сильных внутримолекулярных взаимодействий между атомами молекулы. Валентные (самые внешние) электроны атомов участвуют в химических связях. Когда два атома приближаются друг к другу, эти внешние электроны начинают взаимодействовать. Хотя электроны отталкиваются друг от друга, они притягиваются к протонам внутри атомов. Взаимодействие сил приводит к образованию связей между атомами. Основными типами химических связей являются ионная связь, ковалентная связь, водородная связь и металлическая связь [1,2] .
Связь между двумя атомами зависит от разности электроотрицательностей между атомами. Если разница электроотрицательностей значительно высока, атомы передают электроны, образуя ионы и тем самым образуя ионную связь. Если разность электроотрицательностей равна нулю или мала, то атомы объединяются, образуя ковалентные связи.
Различные типы химических связей с примерами
Типы химических связей1. Ионная связь
Как следует из названия, ионные связи возникают в результате притяжения между ионами. Ионы образуются, когда атом теряет или приобретает электрон. Эти типы связей обычно образуются между металлом и неметаллом [1-5] .
Ионы образуются, когда атом теряет или приобретает электрон. Эти типы связей обычно образуются между металлом и неметаллом [1-5] .
Примеры
- Натрий (Na) и хлор (Cl) объединяются, образуя устойчивые кристаллы хлорида натрия (NaCl), также известного как поваренная соль.
- Магний (Mg) и кислород (O) соединяются с образованием оксида магния (MgO).
- Калий (K) и хлор (Cl) объединяются с образованием хлорида калия (KCl)
- Кальций (Ca) и фтор (F) объединяются с образованием фторида кальция (CaF 2 )
2.Ковалентная связь
В случае ковалентной связи атом разделяет одну или несколько пар электронов с другим атомом и образует связь. Это совместное использование электронов происходит потому, что атомы должны удовлетворять правилу октета (конфигурации благородных газов) при соединении. Такой тип связи характерен для двух неметаллов. Ковалентная связь является самой прочной и наиболее распространенной формой химической связи в живых организмах. Вместе с ионной связью они образуют две важнейшие химические связи [1-7] .
Вместе с ионной связью они образуют две важнейшие химические связи [1-7] .
Ковалентную связь можно разделить на неполярную ковалентную связь и полярную ковалентную связь. В случае неполярной ковалентной связи электроны поровну распределяются между двумя атомами. Наоборот, в полярных ковалентных связях электроны распределены между атомами неравномерно.
Примеры
- Два атома йода (I) соединяются с образованием газообразного йода (I 2 ).
- Один атом углерода (C) соединяется с двумя атомами кислорода (O) с образованием двойной ковалентной связи в двуокиси углерода (CO 2 ).
- Два атома водорода (H) объединяются с одним атомом кислорода (O) с образованием полярной молекулы воды (H 2 O).
- Бор (B) и три атома водорода (H) объединяются, образуя полярный боран (BH 3 ).
3. Водородная связь
Водородная связь — это химическая связь между атомом водорода и электроотрицательным атомом. Однако это не ионная или ковалентная связь, а особый тип диполь-дипольного притяжения между молекулами. Во-первых, атом водорода ковалентно связан с очень электроотрицательным атомом, что приводит к положительному заряду, который затем притягивается к электроотрицательному атому, что приводит к водородной связи [1,4-6] .
Однако это не ионная или ковалентная связь, а особый тип диполь-дипольного притяжения между молекулами. Во-первых, атом водорода ковалентно связан с очень электроотрицательным атомом, что приводит к положительному заряду, который затем притягивается к электроотрицательному атому, что приводит к водородной связи [1,4-6] .
Примеры
- Атом водорода одной молекулы воды связывается с атомом кислорода другой молекулы. Эта связь весьма значительна во льду.
- В хлороформе (CH 3 Cl) и аммиаке (NH 3 ) водородная связь возникает между водородом одной молекулы и углеродом/азотом другой.
- Азотистые основания, присутствующие в ДНК, удерживаются вместе водородной связью.
4. Металлические связки
Металлическая связь — это сила, удерживающая атомы вместе в металлическом веществе.Такое твердое тело состоит из плотно упакованных атомов, где самая внешняя электронная оболочка каждого атома металла перекрывается с большим количеством соседних атомов. Вследствие этого валентные электроны свободно перемещаются от одного атома к другому. Они не связаны с какой-либо конкретной парой атомов. Такое поведение называется нелокализацией [1,2,4] .
Вследствие этого валентные электроны свободно перемещаются от одного атома к другому. Они не связаны с какой-либо конкретной парой атомов. Такое поведение называется нелокализацией [1,2,4] .
Примеры
Другие типы химических связей
Бонд Ван-дер-Ваальса
Нейтральные молекулы удерживаются вместе слабыми электрическими силами, известными как силы Ван-дер-Ваальса.Сила Ван-дер-Ваальса — это общий термин, используемый для определения притяжения межмолекулярных сил между молекулами. Этот тип химической связи является самым слабым из всех связей [4,5] .
Примеры включают водородную связь, лондонские дисперсионные силы и диполь-дипольные силы.
Пептидная связка
В белке несколько аминокислот соединены друг с другом пептидными связями, образуя таким образом длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, когда она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседних аминокислот. Помимо пептидных связей, в белках [8] также распространены водородные связи, ионные связи и дисульфидные связи.
Помимо пептидных связей, в белках [8] также распространены водородные связи, ионные связи и дисульфидные связи.
Примеры включают полипептиды, такие как инсулин и гормон роста.
Часто задаваемые вопросы
Q.1. Что происходит с химическими связями в ходе химических реакций?Ответ. Во время химических реакций связи, удерживающие молекулы вместе, разрываются и образуют новые связи, перестраивая атомы в разные вещества.
В.2. Почему атомы образуют химические связи?Ответ. Атомы образуют химические связи, чтобы сделать их внешние электронные оболочки более стабильными.
Q.3. Какие субатомные частицы участвуют в химической связи?Ответ. Среди субатомных частиц только электроны активно участвуют в химической связи.
Q.4. Какую роль играют химические связи в обмене веществ? Ответ . Наше тело использует энергию, хранящуюся в химических связях, чтобы выполнять работу и поддерживать свою активность и функциональность.
Наше тело использует энергию, хранящуюся в химических связях, чтобы выполнять работу и поддерживать свою активность и функциональность.
Ответ. Потенциальная энергия хранится в ковалентных связях, удерживающих атомы вместе в молекуле.
Q.6. Что вызывает разрыв химических связей во время реакции?Ответ. Для разрыва или формирования каждой связи требуется определенное количество энергии. Без этой энергии реакция не может произойти. Эта энергия известна как энергия связи.
В.7. Почему инертные газы не образуют химических связей? Ответ. Электронные конфигурации благородных газов таковы, что их внешние оболочки являются полными. Полностью валентные электронные оболочки этих атомов делают благородные газы необычайно стабильными и маловероятными для образования химических связей, поскольку они не склонны приобретать или терять электроны.
Ответ. Нет. Вещества, входящие в состав смеси, можно разделить физическими средствами, поскольку они обладают разными физическими свойствами и не связаны химически.
Каталожные номера
- Hyperphysics.phy-astr.gsu.edu
- Chem.libretexts.org
- Opentextbc.ca
- Insula.com.au
- Chem.ucla.edu
- Manoa.hawaii.edu
- Manoa.hawaii.edu
- Opentextbc.ca
- Insula.com.au edu
- Teaching.ncl.ac.uk


 Между атомами каких элементов химическая связь будет иметь ионный характер?
Между атомами каких элементов химическая связь будет иметь ионный характер? Соотнесите
Соотнесите
 2 Атомная структура
2 Атомная структура  3 Ионы и правило октета
3 Ионы и правило октета  37)
37)  7 Периодические тенденции в атомных свойствах
7 Периодические тенденции в атомных свойствах  3
Химическая связь
и электроотрицательность
3
Химическая связь
и электроотрицательность  3
Химическая связь
и электроотрицательность
3
Химическая связь
и электроотрицательность  2
молекулярный
Соединения
2
молекулярный
Соединения 
 4
Межмолекулярные силы
4
Межмолекулярные силы 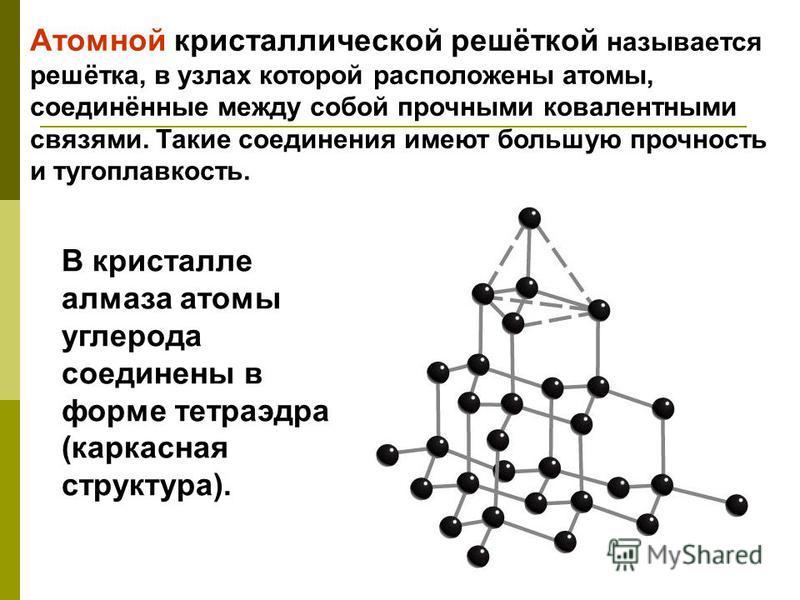 1
Ионные соединения
1
Ионные соединения  4 Химические формулы
и Номенклатура (74-81)
4 Химические формулы
и Номенклатура (74-81)  4 Химические формулы
и Номенклатура (74-81)
4 Химические формулы
и Номенклатура (74-81)  1 Введение в химические реакции
1 Введение в химические реакции  1 Введение в химические реакции
1 Введение в химические реакции  1 Введение в химические реакции
1 Введение в химические реакции