Растворы. Растворители. 9-й класс
Разделы: Химия
Цели:
- Организовать деятельность учащихся по восприятию, осмыслению таких понятий как: раствор, растворитель, полярный растворитель, неполярный растворитель. Усвоение закономерностей, которым подчиняются растворы.
- Развивать умения выделить главное, существенное в изучаемом материале.
- Обеспечить закрепление знаний и способов деятельности учащихся.
Ход урока
I. Организационный момент.
II. Подготовка учащихся к работе на основном этапе.
Четвёртый лишний. (Приложение. Слайд 1.)
- Морская вода.
- Клеточный сок.
- Минеральная вода “Аршан”.
- Дистиллированная вода.
Лишняя дистиллированная вода (т.к. всё остальное растворы).
Эпиграфом урока предлагаю взять слова академика Карпинского А.П (Cлайд 3):
““Растворы – это живая кровь, которая создает жизнь там, где ее не было”.
Рассмотрим биологическую роль растворов для живых организмов. (Cлайд 4 “видеофрагмент”.)
“Значение растворов в природе в возникновении и развитии жизни на земле трудно переоценить. Именно в первичном океане впервые развились живые организмы и из этого раствора они получили молекулы и ионы необходимые для их роста и жизни. С течением времени живые организмы развивались и изменялись, что позволило им покинуть водную среду, перейти на сушу и затем подняться в воздух. Они приобрели эту способность сохранив в своих организмах водный раствор в виде жидкости содержащих необходимый запас ионов и молекул. Внутри нас в каждой нашей клеточке воспоминание о первичном растворе в котором зародилась жизнь. Водные растворы обеспечивающие саму жизнь.” [1]
Вспоминаем понятие раствор (Слайд 5):
В трёх стаканах находятся (немаловажным, для детей видеть эти три стакана):
– песок и вода
– вода и медный купорос
– масло и вода
Где по вашему мнению находится раствор? Что такое раствор?
Растворы – однородная система, состоящая из двух и более компонентов (растворителя и растворённого вещества).
III. Усвоение новых знаний и способов действия.
Лабораторные опыты:
- В пробирку насыпать немного перманганата калия и добавить воды. Разделить пробирку на две пробирки. Во вторую пробирку добавить ещё воды. Одинаковы ли количества перманганата калия, содержащиеся в обоих растворах? А растворителя?
- Попытайтесь растворить очень небольшие количества серы, кристаллического
йода, поваренной соли и карбоната натрия в воде
| Вещество | Растворимость | |
| В воде | В бензине | |
| NaCl | ||
| Na2CO3 | ||
| S | ||
| I2 | ||
Можно ли найти универсальный растворитель – жидкость, в которой можно растворить любое вещество? (Слайд 8.)
Проанализируем результаты опыта и сделаем вывод:
Такого растворителя быть не может. Вещества с ионной связью, как и вещества с
ковалентной полярной связью, хорошо растворяются в полярных растворителях (например,
в воде), а вещества с неполярной связью – в неполярных растворителях (например,
в бензине).
Это правило было установлено ещё в средневековье, после длительных
поисков универсального растворителя, “алькагеста”, сформулировали правило
“Подобное растворяется в подобном”.
Проделанный нами эксперимент ещё раз показывает , что растворимость веществ
зависит от природы растворителя. От чего ещё зависит растворимость? (Слайд
9.)
Растворимость зависит от температуры. При увеличении температуры растворимость
веществ увеличивается. Но есть вещества, растворимость которых при нагревании
раствора уменьшается. Вы обращали когда-нибудь внимание на то, как ведет себя
вода в чайнике незадолго до того, как закипеть? Перед кипением, а иногда и
раньше, с самого начала нагревания, на внутренних стенках чайника или кастрюли
появляются пузырьки воздуха. Почему?
Проанализируйте рисунок со слайда 11 и сформулируйте вывод о физиологической потребности в кислороде у рыб.
IV. Закрепление.
Пополнилась ли ваша “копилка знаний” сегодня? Если да, то что вы узнали?
Какой растворитель можно использовать для растворения P, HCl, NaI, почему? (Слайд
12.)
V. Первичный контроль. (Cлайд 13.)
Совместите части:
Вариант 1.
| 1. Полярный растворитель | А. Вода |
| 2.Неполярный растворитель | Б. Сера |
| 3. Диполь | В. Соляная кислота |
Вариант 2.
| 1. Полярный растворитель | А. Йод |
| 2. Неполярный растворитель | Б. Вода |
| 3. Диполь | В. Поваренная соль |
VI. Рефлексия. (Слайд 14.)
– Выберите из ниже предложенных утверждений, соответствующее вашему мнению и настроению, и закончите фразу согласно вашему выбору.
Очередные 45 драгоценных минут моей не менее драгоценной жизни:
- потеряны безвозвратно, т.к…
- прошли с пользой, т.к…
VII . Домашнее задание. (Слайд 15.)
§6 Немного о растворителях.
“4” – с. 21 вопросы 1.
“5” – с. 21 вопрос 3.
Задание для учеников интересующихся химией: подготовить сообщение по теме: “Виды растворителей”
Творческий проект: “Какие растворы встречаются в организме человека и какова их роль?”
Литература.
- Диск Кирилла и Мефодия . Биология 10–11 класс.
- Кузнецова Н.Е. и др. Химия: Учебник для учащихся 9 класса общеобразовательных учреждений.– М.: Вентана-Граф, 2003. – 320 с.: ил.
- Кузнецова Н.Е., Шаталов М.А. Обучение химии на основе межпредметной интеграции: 8–9 классы: Учебно-методическое пособие.– М.: Вентана-Граф, 2004. – 352с.
- Зуева М.В., Гара Н.Н. Школьный практикум. Химия 8–9 кл. – М.: Дрофа, 1999.– 128 с.: ил.
22.02.2011
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai
Презентация к открытому уроку по химии в 9 классе «Железо».
Тема урока «Железо» 9 класс
Цель: Изучение свойств элементов побочных подгрупп Периодической системы химических элементов Д. И. Менделеева на примере железа.
Задачи:
1. Раскрыть особенности строения атомов элементов побочных подгрупп на примере железа. Показать роль окислителя на степень окисления атомов в соединениях.
2. Продолжить развитие логического мышления через умения сравнивать, анализировать, делать выводы.
3. Тип урока: изучение нового материала.
Технологии: технологии развивающего обучение, информационно – коммуникативные технологии, технология развития критического мышления
Оборудование: компьютер, мультимедийная установка, презентация, коллекция руд железа; S, Fe, растворы соляной, серной (разб) кислот, сульфата меди; пробирки, спиртовка, спички.
Ход урока:
Деятельность учителя
Деятельность ученика
I.Актуализация знаний. Проверка знаний по ранее изученному материалу
Вспомним особенности строения атомов элементов главных подгрупп I, II и III групп:
1. Какие свойства проявляют атомы металлов?
2. Как изменяются восстановительные свойства атомов элементов I – III групп главных подгрупп?
3. Как изменяются металлические свойства этих атомов?
4. Как называются электроны, которые участвуют в образовании химической связи между атомами? Где они располагаются в атомах элементов I – III групп главных подгрупп? (слайд 2)
Устно
1. Атомы металлов в реакциях проявляют восстановительные свойства, т.к. на внешних энергетических уровнях находится 1 — 3 электронов.
2. По мере увеличения зарядов ядер по подгруппе восстановительные свойства увеличиваются, по периоду — ослабевают.
3. По подгруппе металлические свойства возрастают, по периоду — ослабевают.
4. Электроны называются валентными. Располагаются они на внешних энергетических уровнях.
Стадия вызова
Что объединяет изображения?
(слайд3)
Обратимся к Периодической системе химических элементов. Каково положение железа в ней? В какой подгруппе ПСХЭ расположен химический элемент железо?
Проблемный вопрос:
По какой причине атом принадлежит к той или иной подгруппе ПСХЭ? Например, кальций — элемент главной подгруппы, а железо элемент побочной.
Сегодня на уроке мы рассмотрим особенности строения и свойств элементов побочных подгрупп на примере железа. (слайд 4)
Значение железа в жизни человека
В побочной.
Причина в электронном строении атомов химических элементов.
Железо – элемент побочной подгруппы.
Работа в печатных тетрадях
Стадия осмысления новой информации
А. СТРОЕНИТЕ АТОМА ЖЕЛЕЗА
1. Что можете сказать о положении химического элемента в ПСХЭ.
Самостоятельно в тетради запишите электронную и графическую формулы атома железа (слайд 5)
2. (слайд 6)
— В чем отличие в распределении электронов по энергетическим уровням в атомах железа и кальция?
— Сколько валентных электронов на внешнем уровне в атоме железа?
— схема отдачи 2 — х электронов. Обратите внимание на степень окисления атома железа.
— А не могут ли принять участие в образовании химических связей электроны с предпоследнего уровня? (сдайд 6). Оказывается еще один электрон с предпоследнего энергетического уровня может участвовать в образовании химической связи. Запишите схему. (слайд 7)
— Какой вывод можно сделать? Каковы особенности строения атомов элементов побочных подгрупп на примере железа?
(слайд 8)
Б Химические свойства
Дадим характеристику химическим свойствам простого вещества железа.
— По какому плану мы будем их изучать?
— Перечислите простые вещества, с которыми железо вступит в реакцию. Называемые вещества делит на две группы. Записывает схему:
Fe
+ O2, Cl2, F2 + S, I2
Проблемный вопрос:
— По какому признаку перечисленные вещества разделены на две группы? При этом надо, что железо — восстановитель.
— Дополните схему (слайд 9):
Fe
+ O2, Cl2, F2 + S, I2
Fe+? Fe+?
Демонстрирует слайд 10
и видеоопыты:
«Взаимодействие железа с кислородом, с серой». Виртуальная лаборатория
— Закончите уравнения реакций, используя текст учебника. Укажите условия их протекания. Обратите внимание на состав железной окалины.
1. Порядковый номер 26. Период 4 VIII группа побочная подгруппа.
Записывают заголовок «Строение атома»
1s22s22p63s23p63d64s2
В атоме железа электронами заполнен предпоследний энергетический уровень, а именно 3d – подуровень, 2 электрона.
Fe0 — 2e- = Fe+2
Да.
Fe0 — 3e- = Fe+3
Выводы в тетрадь:
1. В атоме железа электронами заполняется предпоследний энергетический уровень;
2. Валентными являются электроны внешнего и, частично, предпоследнего энергетических уровней;
3. Атомы железа проявляют переменную степень окисления (+2 и + 3).
План:
1.Взаимодействие с простыми веществами- неметаллами.
I. 2. Взаимодействие со сложными веществами: с водой, кислотами, солями.
в тетради: Химические свойства железа
I. Взаимодействие с простыми веществами- неметаллами.
По силе окислителя.
Fe
+ O2, Cl2, F2 + S, I2
сильные окислители слабые окислители
Fe+3 Fe+2
Записывают схему и вывод: степень окисления атома железа зависит от силы окислителя.
Записывают уравнения реакций:
1) 3Fe + 2O2 = Fe2O3·FeO или Fe3O4 (при нагревании)
2) 2Fe + 3Cl2 = 2FeCl3
3) Fe + S = FeS (при нагревании)
Cоставляют электронный баланс.
Рассмотрим свойства железа со сложными веществами.
Учитель создает проблемную ситуацию (слайд 11).
Предлагает ученикам вспомнить продукты взаимодействия с водой натрия, кальция и алюминия.
На стр. 64 учебника прочитайте условия течения реакции взаимодействия железа с водой.
Предлагает сделать вывод о химической активности железа, используя электрохимический ряд напряжений металлов.
-реакция железа с кислотами и растворами солей.
Записывает реакции:
Fe + HCl = ? + Н2↑
Fe + CuSO4 = ? + Cu
Какие частицы в данных реакциях являются окислителями?
Проблемный вопрос
Известно, что катионы водорода и катионы металлов являются слабыми окислителями. До какой степени окисления они окисляют атомы железа? По какой схеме (слайд 10)
Самостоятельно запишите формулу второго продукта реакции.
Проблемный вопрос
Возможна ли реакция и почему:
Fe + ZnCl2 = ?
Растворы кислот нельзя перевозить в железной таре. А концентрированные HNO3 и h3SO4 можно. Почему?
* Концентрированные кислоты HNO3 и h3SO4 пассивируют железо при обычной температуре.
II. II. Взаимодействие со сложными веществами: с водой, кислотами, солями
III.
С натрием:
а) выделяется большое количество тепла, при комнатной температуре;
б) образуется щелочь NaOH
С кальцием:
а) реакция протекает более спокойно, при комнатной температуре;
б) образуется малорастворимое основание Ca(OH)2
С алюминием:
а) реакция протекает только после удаления оксидной пленки при комнатной температуре
С железом:
а) реакция с парами воды, при высокой температуре;
б) образуется железная окалина Fe2O3·FeO
Записывают реакцию:
3Fe + 4h3O(пар) = Fe2O3·FeO + Н2
infourok.ru
Урок по химии в 9 классе
Общие сведения
Учитель: Л.А.Игумнова
9 класс
Химия
Автор УМК: О.С.Габриелян
Неметаллы
Задачи и планируемые результаты
Общеобразовательные задачи
— повторить названия, формулы, историю, свойства некоторых неметаллов
— научить применять полученные знания по теме: «Неметаллы» на практике
— научить чтению и анализу с использованием периодической системы химических элементов Д.И.Менделеева, таблицы растворимости
— закрепить умение работать с текстовыми заданиями
— научить отстаивать свою точку зрения
— закрепить умения вычленять проблемы
Воспитательные задачи
— вовлечь в активную практическую деятельность
— формировать культуру общения
— совершенствовать навыки общения
— создать условия для реальной самооценки обучающихся, реализация их как личностей
— воспитать культуру экономного расходования времени
Развивающие задачи
— продолжить развитие умения анализировать
— продолжить развитие умения сопоставлять
— продолжить развитие умения сравнивать
— формировать умения работать с таблицами
— формировать умение анализировать
— развивать логическое мышление
— развивать память
— развивать умение к анализу и синтезу
Предметные результаты
— смогут использовать химические термины, формулы, названия, технологическую схему
— смогут выбирать способ представления данных в зависимости от поставленной задачи
— смогут описывать свои наблюдения и опыты
— смогут выбрать из предложенного набора необходимое оборудование для опыта
Личностные результаты
— получат представление о целостном формировании мировоззрения, соответствующему современному уровню развития науки и общественной практики
— смогут показать свои знания по данной теме
— будут готовы к самообразованию на основе мотивации к обучению и познанию
Метапредметные результаты
— смогут самостоятельно определять цели своего обучения
— овладеют основами самоконтроля
— смогут ставить и формулировать для себя новые задачи в учебе и познавательной деятельности
— овладеют основами принятия решений и осуществления осознанного выбора в учебной и познавательной деятельности
— смогут устанавливать причинно-следственные связи
— смогут устанавливать аналогии
— продемонстрируют уверенное владение устной речью
— смогут строить логические рассуждения, умозаключения и делать выводы
— овладеют основами самооценки
Межпредметные связи
— экология
— биология
— история
— математика
— литература
— русский язык
— изобразительное искусство
Формы деятельности
— групповая
Формы обучения
-интеллектуально-ролевая игра
Ресурсы
— химическое оборудование
— раздаточный материал
Тип урока
— урок обобщающего контроля (по дидактическим целям)
— итоговый урок (по этапам формирования навыка)
— урок-игра (по используемым приемам активизации познавательного интереса и познавательной деятельности)
— урок работы в малых группах (по способу организации общения участников учебно-воспитательного процесса)
— проблемный урок (по приоритетно используемому методу обучения)
— проблемный урок (по типу межпредметных связей)
Цель урока
Закрепление изученного материала
Этапы урока
Класс делится на три группы: химики-технологи, медики, экологи. Каждая группа получает свое задание, состоящее из теоретической, практической, решение задачи. В результате каждая группа защищает свой проект. В качестве рефлексии каждая группа выбирает наиболее важные качества, необходимые экологу, химику-технологу, медику и аргументируют.
Задания для медиков
1.Массовая доля йода в щитовидной железе составляет 0,12%. Масса щитовидной железы 40г. Определить массу йода в щитовидной железе. Найдите ошибку в тексте условия.
2.Вычислите массу элемента фтора в крови человека со средней массой 80 кг, если в 10мл крови его содержится 0,07 мг, а массовая доля крови в теле составляет 8%.
3.Как известно, А.П.Чехов был врачом. В одном из его произведений встречаются такие слова: «Врач предложил больному выпить ложку брома». Какая химическая ошибка допущена в этих словах?
4.Какой несчастный случай может произойти при нарушении правил техники безопасности во время работы с концентрированной серной кислотой? Поясните с химической точки зрения. Как оказать первую медицинскую помощь в этом случае?
5.Поддерживаете ли вы рекламу зубной фторсодержащей пасты? Почему? Что не совсем достоверно?
Задания для химиков-технологов
1.в трех пробирках находятся растворы гидроксида натрия, нитрата серебра и соляной кислоты. Используя только их, определите, какое вещество находится в каждой из них. Ответ подтвердите уравнениями реакций.
2. В ходе первой мировой войны руководство германской армии пошло на чудовищное преступление – применение отравляющих веществ. Жидкий хлор немцы транспортировали в специальных цистернах и в подходящий момент, когда ветер дул в нужную сторону, разливали в баллоны. Тысячи таких баллонов они тайно устанавливали на передовых позициях. Вентили этих баллонов открывали одновременно. Хлор выходил наружу и устремлялся на позиции в виде гонимого попутным ветром облака, губительного для всего живого. Если газовая атака оказывалась внезапной, гибли тысячи людей. Узнать вовремя о намерении противника применить хлор – значило выиграть время для принятия защитных мер и сохранить человеческие жизни. Один русский офицер нашел способ решения этой задачи. Он изобрел прибор, предупреждающий о приготовлениях к хлорно-газовой атаке электрическим звонком. Какие химические процессы происходили в нем?
3.В технологическом процессе получения серной кислоты из серы было произведено 122,5 кг серной кислоты, что составляет 80% от теоретически возможного выхода. Предложите, за счет каких процессов в технологической цепочке данного производства возможны потери? Определите массу серы, необходимой для получения этой массы серной кислоты.
Задания для экологов
1.Получите сернистый газ, собрав прибор. Предложите, какие вещества находятся в ваших лотках. Какие правила защиты окружающей среды и безопасности вы должны соблюдать при выполнении опыта, как сделать этот процесс экологически чистым? Напишите уравнения реакций.
2.Если верить легенде, Черное море получило свое название из-за почернения опускаемых в его пучины серебряных предметов. Это связано с тем, что на глубине более 200м морская вода содержит сероводород (продукт жизнедеятельности некоторых микроорганизмов). Наличие сероводорода делает невозможной жизнь морских растений и животных на дне в этой зоне. В последние десятилетия по еще не вполне понятным причинам сероводород стал медленно подниматься к поверхности воды. Если этот процесс не прекратится, то черное море со временем станет безжизненным. Оцените и предложите способ борьбы с наступлением сероводорода с экономической и экологической стороны.
3.В одном из стихотворений К.И.Чуковского есть такие строки: «А лисички взяли спички,
К морю синему пошли
Море синее зажгли»
Реально ли сделать?
4.Для хлорирования питьевой воды расходуется хлор массой 0,002мг на 1 литр воды. Определите объем хлора, необходимого для обработки 120т воды. Оцените процесс с экологической стороны.
Важные качества, необходимые химику-технологу
— сосредоточенность
— соблюдение правил техники безопасности
— внимание
— смелость
— соблюдение правил работы с веществами и приборами
— находчивость
— владение теоретическими основами химического производства
Важные качества, необходимые в работе эколога
— беречь природу
— озеленять территорию
— предупреждать экологические катастрофы
— участвовать в экологических движениях
— своевременно ставить в известность соответствующие структуры об экологических нарушениях и опасностях
— выявлять наличие или отсутствии экологических нарушений
Важные качества, необходимые в работе
− чуткость
− исключительная добросовестность
− тактичность
− честность
− терпеливость и внимательность
− способность к самоотверженности
− любовь к людям и своей работе
infourok.ru
Презентация к уроку химии для 9 класса по теме: «Водород»
Просмотр содержимого документа
«Презентация к уроку химии для 9 класса по теме: «Водород»»

Презентация к уроку химии «ВОДОРОД» к учебнику О.С. Габриеляна 9 класс

Тема урока «ВОДОРОД»

Цель урока: систематизация и развитие знаний учащихся о водороде как химическом элементе и простом веществе, освойствах водорода, способах его получения.

В день, когда его запасы иссякнут, жизнь во Вселенной прекратится. Погаснут солнца, не станет воды… Вещество, без которого жизнь невозможна, «сидит» в самом центре нашей планеты — в ядре и вокруг него, и оттуда «мигрирует» наружу. Этот газ — начало всех начал. Его название — «водород».
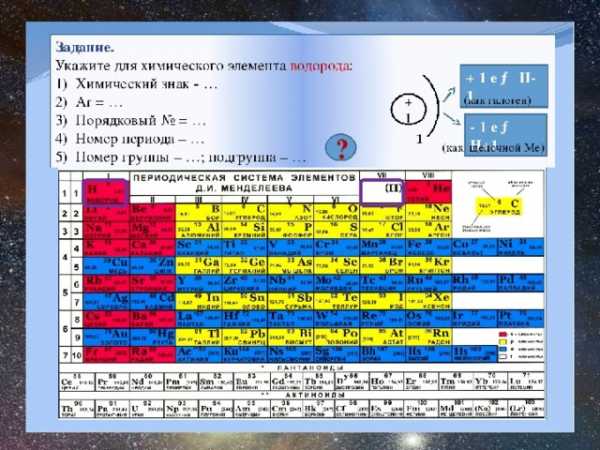

Химический элемент
- Порядковый номер
- Группа
- Период
- Электронная формула
- Степень окисления
?


Химические свойства Строение атома 1 1 Н) 1 1s Находится в первом периоде первой группе таблицы Д.И.Менделеева, так как на внешнем слое у него один электрон и он его отдает, проявляя степень окисления +1, и в седьмой группе, как галогены, до завершения уровня не хватает одного электрона и водород может взять его, проявляя при этом степень окисления -1.

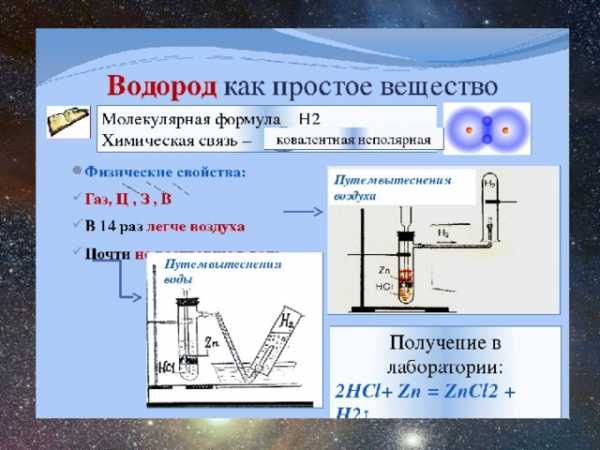
Водород как простое вещество
Химические свойства.
I. Восстановительные свойства водорода: Горение водорода
2Н2 + О2 = 2Н2О Взаимодействие с неметаллами
3h3 + N2 = 2Nh4 h3 + Cl2 = 2HCl Восстановление металлов из их оксидов h3 + CuO = Cu + h3O

Водород как простое вещество Химические свойства.
II. Окислительные свойства водорода:
Взаимодействие с металлами
h3 + 2Na = 2NaH
h3 + Ca = Cah3

Получение водорода
- В лаборатории:
Цинк и разбавленная серная кислота
Zn + 2HCl = ZnCl2 + h3
2) В промышленности:
Взаимодействием угля с водой
С + Н2О = СО + Н2
Метана с водой
СН4 + Н2О = СО + 3Н2
Электролизом воды
2Н2О = 2Н2 + О2

1


В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью «Водород».

Спасибо за внимание
multiurok.ru
